基于多腺嘌呤的DNA捕获探针、生物传感器及其检测方法与流程
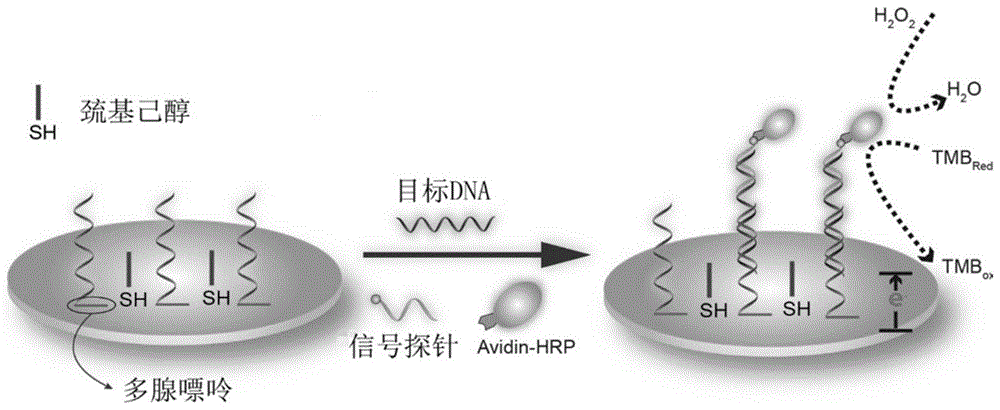
本发明属于电化学检测领域,具体地涉及一种基于多腺嘌呤的DNA捕获探针、生物传感器及其检测方法。
背景技术:
:电化学的发展历史悠久,与尖端科学技术和学科的发展紧密相关,电化学生物传感器具有特异性分子识别功能,在疾病基因诊断、抗癌药物筛选等方面显示了广阔的应用前景,是当今生物学、医学领域的前沿的研究手段。电化学生物传感器测定DNA的大致步骤包括:一、DNA捕获探针的固定,即将某一特定序列的单链DNA(ssDNA)固定在电极的表面;二、杂交,将固定有DNA捕获探针的电极放入到含有与之匹配的待测DNA的被测溶液中,使待测DNA与DNA捕获探针在电极表面发生杂交反应形成双链DNA(dsDNA);三、将杂交反应的信号转化为可测定的电化学信号;四、将电化学信号进行放大检测。DNA捕获探针的固定是DNA电化学传感器制作中的首要问题,固定的量和活性直接影响传感器的灵敏度。目前常见的DNA固定方法主要有共价键合法、自组装法和亲和素-生物素方法。共价键和法是通过形成共价键,如酰胺键、酯键、醚键等使DNA固定到电极表面,需要对电极表面进行活化预处理,引入所需的活性基团,通过双官能团试剂或偶联活化剂将衍生后的DNA分子与电极联结。但是该方法由于形成共价键的化学反应效率不大的问题,导致组装在电极表面的DNA捕获探针的密度不高。自组装法(SAM法)主要用于DNA捕获探针在金电极表面的固定,具体方法是将DNA捕获探针的末端巯基化,通过金硫键形成自组装层达到固定DNA的目的。但是该方法需要巯基修饰,成本较高,并且在实验操作中容易形成双硫键而影响检测结果的准确性。亲和素-生物素法是将亲和素(avidin)通过静电作用或共价偶联作用连接于电极表面,利用生物素和亲和素之间极强的生物识别亲和作用,将生物素修饰的DNA固定到电极上。以上三种方法均需要对DNA捕获探针进行修饰,合成成本较高,步骤繁琐。然而,目前本领域技术人员难以明确如何调控电化学生物传感器电极表面DNA捕获探针的组装密度,这直接制约了电化学生物传感器的进一步发展,因此亟待获得一种全新的DNA捕获探针固定方法及效果优异的电化学生物传感器。技术实现要素:本发明要解决的技术问题是解决了调控电化学生物传感器电极表面DNA捕获探针的组装密度的难题,从而提供了一种基于多腺嘌呤的DNA捕获探针、生物传感器及其检测方法。该DNA捕获探针和生物传感器能够灵敏度高、特异性佳地检测待测DNA,操作简便,应用前景广阔。本发明的发明人经过深入的研究和反复的试验,利用腺嘌呤与金电极的相互作用,设计了包含多个连续腺嘌呤(polyA)的DNA捕获探针,并且将这样的DNA捕获探针固定在金电极表面,通过“夹心式”的杂交方法,将待测DNA和信号探针引入金电极表面,再依据检测杂交前后催化氧化还原电流变化指示待测DNA的浓度,从而完成了本发明。本发明的技术方案之一是:一种基于多腺嘌呤的DNA捕获探针,其核苷酸序列如序列表中SEQIDNo.1、SEQIDNo.2、SEQIDNo.3、SEQIDNo.4或SEQIDNo.5所示。本发明中,所述的多腺嘌呤的DNA捕获探针含有不同个数(5个、10个、20个、30个和40个)的腺嘌呤,分别称为polyA5、polyA10、polyA20、polyA30和polyA40。本发明中,较佳地,所述DNA捕获探针为polyA30,其核苷酸序列如序列表中SEQIDNo.4所示。本发明的技术方案之二是:一种电化学生物传感器,其由包括以下步骤的方法制备而成:(1)制备基于多腺嘌呤的DNA捕获探针,所述DNA捕获探针的核苷酸序列如序列表中SEQIDNo.1、SEQIDNo.2、SEQIDNo.3、SEQIDNo.4或SEQIDNo.5所示;(2)将步骤(1)所得的基于多腺嘌呤的DNA捕获探针滴加到电极上,反应,得组装电极;(3)用巯基己醇(MCH)对步骤(2)所得的组装电极的空位封闭,得封闭的电极。本发明中,步骤(2)为:将步骤(1)所得的基于多腺嘌呤的DNA捕获探针滴加到电极上,反应,得组装电极。其中,所述DNA捕获探针滴加到电极上时的组装密度较佳地为0.01~3μM,更佳地为0.1μM。所述反应的温度为20~40℃,较佳地为25℃。所述组装的时间为本领域常规的时间,较佳地为过夜,即大于12小时。步骤(2)中,所述的电极为常规,较佳地,所述的电极为处理干净的电极;更佳地,所述处理干净的电极由包括以下步骤的方法制得:经物理打磨、硫酸电化学清洗,再用超纯水彻底冲洗电极表面,然后用N2吹干。所述的电极较佳的是金电极。本发明中,步骤(3)为:用巯基己醇(MCH)对步骤(2)所得的组装电极的空位封闭,得封闭的电极。其中,所述MCH的浓度较佳地为0.01~1mM,更佳地为0.1mM。所述封闭的时间为5~60分钟,较佳地为30分钟。所述封闭的温度为本领域常规的温度,较佳地为25℃。本发明中,经研究发现证实,最佳地,上述电化学生物传感器采用所述的polyA30作为DNA捕获探针;polyA30的组装密度为0.1μM;且步骤(3)中采用0.1mMMCH封闭30分钟。本发明的技术方案之三是:一种利用上述的电化学生物传感器检测待测DNA的方法,其包括以下的步骤:(Ⅰ)将待测DNA和核苷酸序列如序列表中SEQIDNo.7所示且在3’端连接生物素的信号探针预杂交,得预杂交物A;(Ⅱ)将步骤(Ⅰ)所得的预杂交物A与如权利要求2~5任一项所述的电化学生物传感器的电极上的DNA捕获探针杂交,得杂交的电极;(Ⅲ)向步骤(Ⅱ)所得的杂交的电极上滴加亲和素-辣根过氧化酶后孵化;加入底物TMB,进行检测分析。本发明中,步骤(Ⅰ)为:将待测DNA和核苷酸序列如序列表中SEQIDNo.7所示且在3’端连接生物素的信号探针预杂交,得预杂交物A。其中,较佳地,所述待测DNA的浓度为0~1000pM,所述信号探针的浓度为100nM。较佳地,所述预杂交在60~100℃保持1~10分钟,然后20~40℃放置5~60分钟。更佳地,所述预杂交的温度为80℃。更佳地,所述预杂交的时间为5分钟。较佳地,所述放置的时间为20分钟。较佳地,所述放置的温度为25℃。较佳地,所述预杂交在缓冲液下进行。所述缓冲液为本领域常规的缓冲液,较佳地,所述缓冲液为包含1MNaCl的10mMTE缓冲溶液,所述TE缓冲液包括10mMTris-HCl和1mMEDTA,pH7.0。本发明中,步骤(Ⅱ)为:将步骤(Ⅰ)所得的预杂交物A与所述的电化学生物传感器的电极上的DNA捕获探针杂交,得杂交的电极。其中,较佳地,步骤(Ⅱ)所述的杂交在25~45℃杂交30~120分钟;更佳地,所述杂交的温度为37℃。较佳地,所述杂交的时间为60分钟。较佳地,所述杂交完成后还包括清洗电极的步骤。所述清洗的清洗液是本领域常规的清洗液,较佳地,为含有1MNaCl的10mMTE缓冲溶液,所述TE缓冲液包括10mMTris-HCl和1mMEDTA,pH7.0。本发明中,步骤(Ⅲ)为:向步骤(Ⅱ)所得的杂交的电极上滴加亲和素-辣根过氧化酶(avidin-HRP酶)后孵化;加入底物TMB,进行检测分析。其中,较佳地,所述的亲和素-辣根过氧化酶为1000倍稀释的亲和素-辣根过氧化酶;较佳地,所述1000倍稀释的亲和素-辣根过氧化酶的添加量为1~5μL,更佳地为3μL。所述孵化的温度为本领域常规的温度,较佳地为室温,优选25℃。所述孵化的时间为本领域常规的时间,较佳地为15分钟。步骤(III)中加入底物TMB,进行检测分析的方法为本领域常规。本发明中,采用所述的方法进行电化学检测后,根据测得的电流的绝对值的大小,可以根据电流曲线图,拟合出曲线相应的待测DNA数量与电流绝对值之间的数学公式,一般而言,待测样品中待测DNA数量越大,相应的,测得的电流的绝对值越大。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明将包含多个连续腺嘌呤的DNA探针固定在金电极表面,首次构建了基于多腺嘌呤DNA的电化学生物传感器,可以达到基于巯基修饰DNA组装金电极同样的效果,将开创此类新型电化学生物传感器的新纪元。该固定方法不仅实现DNA探针无需巯基修饰步骤,降低成本的同时可以避免实验操作中双硫键的形成,而且可以通过改变DNA探针中连续腺嘌呤的个数就可以调控金电极表面DNA探针的组装密度。DNA捕获探针固定后,一方面其他碱基(G、C、T)也会非特异性地吸附在金电极表面,影响DNA捕获探针与待测DNA形成双链;另一方面,形成双链后在金电极表面又出现了空位,会吸附酶(如avidin-HRP酶(亲和素-辣根过氧化酶)),而使后续电化学检测产生很高背景信号,从而不利于获得最优的信噪比。然而本发明进一步地在将DNA捕获探针固定于金电极表面后,采用低浓度的巯基己醇对电极表面的空位点进行一段时间的封闭,有利于电极表面的DNA探针有序直立起来,利于后续的杂交反应,信噪比明显提高。本发明的检测方法能够广泛地应用于DNA检测中。本发明能够高灵敏度、高特异性地检测DNA,灵敏度可高至1pM,操作简便,应用前景广阔。附图说明图1为采用基于DNA捕获探针进行电化学检测的示意图。图2A~2C为不同组装方法的电化学检测的结果,其中A为使用0.1mM的MCH封闭;B为使用0.1μM的A5封闭;C为不进行封闭步骤。图3为不同组装方法进行电化学检测的信噪比的结果。图4为不同组装方法进行电化学检测的电极交流阻抗的结果。图5A~5D为不同组装方法进行电化学检测的电子转移速率系数的结果。其中,A为裸金电极;B为组装polyA30但是不进行封闭步骤的电极;C为组装polyA30并且用0.1mM的MCH封闭的电极;D为组装polyA30并且用0.1μM的A5封闭的电极。图6为基于多腺嘌呤的DNA捕获探针中腺嘌呤的数目对信噪比的影响的结果。图7A~7E为含有不同数目腺嘌呤的基于多腺嘌呤的DNA捕获探针对组装密度的影响的结果。其中,A为polyA5,B为polyA10,C为polyA20,D为polyA30,E为polyA40。图8为polyA30的浓度对信噪比的影响的结果。图9为0.1mM的MCH的封闭时间对信噪比的影响的结果。图10为不同浓度的待测DNA进行电化学检测的结果(i-t曲线)。图11为不同浓度的待测DNA进行电化学检测的结果(柱状图)。图12为采用单核苷酸错配序列、完全不互补的不互补DNA进行电化学检测的结果。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。如序列表中SEQIDNo.1~12所示的单链DNA均由lifetechnology生物有限公司合成。实施例中所述的室温为本领域常规的室温,一般指20~40℃。实施例1多腺嘌呤的DNA捕获探针的构建设计并合成含有不同个数(5个、10个、20个、30个和40个)的腺嘌呤的DNA捕获探针(分别称为polyA5、polyA10、polyA20、polyA30和polyA40),其核苷酸序列分别如序列表中SEQIDNo.1~5所示,人工合成(lifetechnology生物有限公司)后即获得多腺嘌呤的DNA捕获探针。同时合成有且仅有5个腺嘌呤的单链DNA(即A5,其核苷酸序列如序列表中SEQIDNo.6所示),以便作为后续试验的对照。实施例2含有多腺嘌呤的DNA捕获探针的生物传感器(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)将5μL0.1μM实施例1所得的多腺嘌呤的DNA捕获探针polyA30滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)使用150μL0.1mM的MCH(购自sigma)对步骤(2)所得的组装电极的空位封闭30分钟,得封闭的电极,即为可用于检测的生物传感器。(4)将1nM的待测DNA(其核苷酸序列如序列表中SEQIDNo.8所示)和100nM信号探针(其核苷酸序列如序列表中SEQIDNo.7所示,并且在3’端连接生物素)在含有1MNaCl的10mMTE缓冲溶液(包括10mMTris-HCl和1mMEDTA,pH7.0)中预杂交,80℃保持5分钟,然后25℃放置20分钟,得预杂交物A。(5)将步骤(4)所得的预杂交物A与步骤(3)所得的封闭的电极上的DNA捕获探针37℃杂交60分钟,再用含有1MNaCl的10mMTE缓冲溶液(包括10mMTris-HCl和1mMEDTA,pH7.0)彻底冲洗电极。(6)向步骤(5)所得的可检测的电极上滴加3μL能催化氧化还原反应的avidin-HRP酶(购自eBioscience,1000倍稀释),室温孵化15min,使其与该电极上的DNA捕获探针连接;然后加入能催化avidin-HRP酶的反应底物TMB(购自Neogen)进行电化学检测分析。进行电化学检测分析的详细原理参见图1,具体地,首先利用腺嘌呤与金电极之间的强相互作用,将一段富含多腺嘌呤(polyA)的DNA捕获探针连接到金电极表面,在待测DNA(其属于大肠杆菌基因组的一段核苷酸序列)存在的情况下,待测DNA和DNA捕获探针、生物素修饰的信号探针采用“夹心法”进行杂交。连接到电极表面的信号探针进而通过生物素-链霉素之间牢固的结合力将HRP酶连接到金电极表面,通过电极表面捕获的HRP酶与底物发生反应,从而灵敏地检测到催化反应所产生的催化电流。实施例3不同组装方法的电化学检测(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)将5μL0.1μM实施例1所得的polyA30滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)分别使用0.1mM的MCH、0.1μM的实施例1制备的A5对步骤(2)所得的组装电极的空位封闭30分钟,得封闭的电极A、B。此外,按步骤(2)操作后直接进行步骤(4)得滴加polyA30组装然而不经任何物质进行封闭的电极C。其余所有步骤与实施例2完全相同。结果如图2A~2C、图3和表1所示。结果说明,不使用物质进行封闭即不进行任何占位时(即电极C),电化学检测出的本底信号很高,且检测1nM的信号也不高,信噪比很小,因此不能检测到低浓度的待测DNA。当使用A5进行封闭金电极表面的空位后(即电极B),情况不能改善,本底信号依旧很高,而检测1nM的信号略有下降,CV峰的催化峰也更加不明显。原因可能是采用0.1μM捕获探针polyA30组装金电极后用0.1μMA5进行封闭,相当于0.2μMA30组装的金电极,更加阻碍电子传递,导致信号降低。而使用MCH进行封闭金电极表面的空位后(即电极A),本底信号明显降低,这可能因为用巯基己醇将金电极表面封闭,阻碍了对酶的吸附;检测1nM的信号明显提高,原因可能因为采用MCH占位后,组装在金电极表面的DNA变得有序,有利于杂交;信噪比也明显提高,CV峰也趋于正常的催化峰。因此,选择使用MCH封闭的多腺嘧啶捕获探针组装的金电极进行电化学生物传感器的实验。表1电化学检测实施例4不同组装方法的电极交联阻抗表征(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)将5μL0.1μM实施例1所得的polyA30滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)分别使用0.1mM的MCH、0.1μM的实施例1制备的A5对步骤(2)所得的组装电极的空位封闭30分钟,得封闭的电极A、B。此外,按步骤(2)操作后直接进行步骤(4)得滴加polyA30组装然而不经任何物质进行封闭的电极C。此外,将步骤(1)所得的电极称为裸金电极。(4)将上述得到的四种情况的电极(裸金电极、A、B和C)在含有0.1MKCl的10.0mMK3Fe(CN)6/K4Fe(CN)6溶液中进行交流阻抗表征。结果如图4和表2所示。结果说明,裸金电极的阻抗非常小,只有0.479kΩ,组装了polyA30捕获探针后,阻抗大大增加为9.20kΩ,说明polyA30捕获探针已经组装在金电极表面,从而阻碍了金电极表面的电子传递,引起阻抗增大;当使用0.1mM的MCH占位30分钟后,阻抗又变小为6.48kΩ,这是因为使用MCH占位后,电极表面的捕获探针变得有序了,有利于电子传递。对比组装polyA30捕获探针、polyA30组装后MCH处理、polyA30与polyA5共组装的金电极的阻抗可以看出来,使用polyA5占位,并不能达到MCH的效果,反而阻抗更大,这可能是因为:由于polyA5的存在,更多的腺嘌呤组装在电极表面,更加阻碍电子的传递。表2阻抗检测实施例5不同组装方法的电极表观电子转移速率系数(1)~(3)步骤同实施例4。(4)将上述得到的四种情况的电极(裸金电极、A、B和C)在含有0.1MKCl的10.0mMK3Fe(CN)6液中进行循环伏安检测,扫速分别设置为0.1V/s、0.2V/s、0.3V/s、0.4V/s、0.5V/s、0.6V/s。根据Laviron方程[参见E.Laviron,J.Electroanal.Chem.101(1979)19-28]可以估算出各电极的表观电子转移速率系数(Ks)。结果如图5A~5D和表3所示。结果说明,在(0.1-0.6)mV/s扫描速度范围内,可以看到明显的且几乎对称的氧化还原峰。随着扫速的增加,氧化和还原的峰电流同时增加并且在(0.1-0.6)mV/s扫描速度范围内呈线性增加,表明电极的氧化还原反应是扩散控制的电化学过程。裸金电极由于导电性好,有利于电子传递,Ks=0.65s-1;当金电极表面组装了多腺嘧啶捕获探针,Ks=0.01s-1,这是由于腺嘧啶固定在金电极表面,阻碍了电子传递,所以表观电子转移速率常数会变小很多;然而当用0.1mMMCH对金电极空位进行封闭后,使得非特异性吸附在金电极表面的DNA离开金电极表面,而且使得固定在金电极表面的捕获探针变得有序,所以表观电子转移速率常数较未用MCH封闭的大了6倍之多,即Ks达到0.07s-1;当使用捕获探针与polyA5共组装方法封闭金电极表面的位点时,表观电子转移速率常数仍是0.01s-1,未能改变多腺嘧啶捕获探针组装金电极的情况。所以,选择采用MCH封闭的多腺嘧啶捕获探针组装的金电极。表3电子转移速率系数检测综上,确定采用低浓度MCH对多腺嘧啶捕获探针组装的金电极进行封闭的效果最佳。实施例6多腺嘌呤的DNA捕获探针中腺嘌呤的数目对信噪比的影响(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)分别将5μL0.1μM实施例1所得的polyA5、polyA10、polyA20、polyA30和polyA40滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。其余步骤与实施例2相同。结果如图6和表4所示。结果说明,随着捕获探针中腺嘌呤(A)数目的增加,检测1nM待测DNA的信号逐渐增加,直到腺嘌呤数目为30时达到饱和,而且信号也越来越稳定,这是因为组装在金电极表面的捕获探针密度越小,越有利于杂交,致使信号逐渐增加;随着捕获探针中腺嘌呤(A)数目的增加,组装在金电极表面的捕获探针也越稳定,致使信号越来稳定。随着DNA捕获探针中A数目的增加,本底信号逐渐降低。这可能是因为,A的数目越多,组装在金电极表面的捕获探针也越稳定,吸附在电极表面的碱基A有一定阻碍酶吸附的作用。随着A数目的增加,信噪比逐渐增加,直到腺嘌呤数目为30时信噪比最大,所以选择polyA30作为最佳的DNA捕获探针进行后续实验。表4电化学检测实施例7不同多腺嘌呤的DNA捕获探针与组装密度(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)分别将5μL0.1μM实施例1所得的polyA5、polyA10、polyA20、polyA30和polyA40滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)使用150μL0.1mM的MCH(购自sigma),对步骤(2)所得的组装电极的空位封闭30分钟,得封闭的电极,即为可用于检测的生物传感器。(4)本实验用到的电解液为包含1MNaCl的10mMTE缓冲溶液(10mMTris-HCl,1mMEDTA,pH7.0),电解液需要使用时新鲜配制。实验前均向电解液中通入15分钟的N2以彻底除去氧气,将上述得到的电极分别首先放置在除氧后的电解液中进行计时电量法检测;然后在电解液中加入50μMRuHex(购自Sigma),吸附5分钟后再次进行计时电量法检测。通过计时电量法测定RuHex配合物的氧化还原电量推算出polyA捕获探针的表面密度,结果如图7A~7E和表5所示。结果说明,随着A的个数增加,组装在金电极表面的DNA的表面密度逐渐减小。这是因为金电极的表面积是一定的,而理论上组装在金电极表面上A的总数是不变的,因此随着A的个数增加,表面密度逐渐减小。因此根据上述结论,可以通过改变DNA探针中连续腺嘌呤的个数来调控金电极表面DNA探针的组装密度。表5表面密度基于多腺嘌呤的DNA捕获探针ΓDNA(pmol/cm2)PolyA52.1PolyA101.1PolyA200.9PolyA300.6PolyA400.4实施例8polyA30组装浓度对信噪比的影响(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)分别将实施例1所得的polyA30以0.02μM、0.1μM和0.5μM的浓度5μL的体积滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。其余步骤与实施例2相同。结果如图8和表6所示。结果说明,当组装0.02μM的polyA30捕获探针时,检测100pM目标时信号比较大,说明密度越小越有利于DNA的杂交,但是本底信号很大。当组装0.5μM的polyA30时,检测100pM目标时信号较小,可能是因为电极表面的组装密度大了,不利于DNA的杂交。从实验结果看,组装0.1μM的polyA30时,信噪比最大。表6电化学检测实施例9封闭时间的优化(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)将实施例1所得的polyA30以0.1μM浓度5μL的体积滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)使用150μL的1mMMCH(购自sigma)分别对步骤(2)所得的组装电极的空位封闭0、5、10、20、30和60分钟,得封闭的电极。其余步骤与实施例2相同。结果如图9和表7所示。结果说明,使用巯基己醇占位后,检测1nM目标的信号明显增加。随着封闭时间的延长,检测1nM目标的信号逐渐降低,背景信号也逐渐降低,但是信噪比是逐渐增大的,当封闭时间为30分钟时,电化学检测的信噪比最大。因此,选择控制封闭时间为30分钟。综上,通过以上条件的优化,采用本发明的生物传感器进行电化学检测的最优条件为:使用polyA30的捕获探针;并且使该捕获探针的组装浓度为0.1μM;用0.1mMMCH封闭30分钟。表7电化学检测效果实施例1灵敏度检测(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)将实施例1所得的polyA30以0.1μM浓度5μL的体积滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)使用150μL的1mMMCH(购自sigma)分别对步骤(2)所得的组装电极的空位封闭30分钟,得封闭的电极。(4)分别将1pM、10pM、100pM、200pM、500pM和1nM的待测DNA(其核苷酸序列如序列表中SEQIDNo.8所示)和100nM信号探针(其核苷酸序列如序列表中SEQIDNo.7所示,并且在3’端连接生物素)在含有1MNaCl的10mMTE缓冲溶液(包括10mMTris-HCl和1mMEDTA,pH7.0)中预杂交,80℃保持5分钟,然后25℃放置20分钟,得预杂交物A。其余步骤与实施例2相同。结果如图10~11和表8所示。结果说明,当没有待测DNA存在时,只能观察到很小的背景电流;当加入待测DNA,检测电流明显增大,且随着待测DNA浓度的增加而增加,因此采用本发明所述的含多腺嘌呤的DNA捕获探针及其自组装金电极进行电化学检测,所检测的待测DNA的检出限为1pM。表8电化学检测待测DNA浓度1pM10pM100pM200pM500pM1nM电流(nA)-44-114-250-401-584-900.7效果实施例2特异性检测(1)取经过物理打磨和硫酸电化学清洗的金电极(2mm直径,上海辰华仪器有限公司),用超纯水Milli-Q彻底冲洗电极表面,然后用N2吹干,得处理干净的电极。(2)将实施例1所得的polyA30以0.1μM浓度5μL的体积滴加到步骤(1)所得的处理干净的电极,25℃反应,过夜组装,得组装电极。(3)使用150μL的1mMMCH(购自sigma)分别对步骤(2)所得的组装电极的空位封闭30分钟,得封闭的电极。(4)分别将100pM的待测DNA(其核苷酸序列如序列表中SEQIDNo.8所示)、单核苷酸错配序列SNP(A)、SNP(C)和SNP(G)(其核苷酸序列依次如序列表中SEQIDNo.10~12所示)以及将充分过量的与上述待测DNA的核苷酸序列完全非互补DNA(NT)(其核苷酸序列如序列表中SEQIDNo.9所示)和100nM信号探针(其核苷酸序列如序列表中SEQIDNo.7所示,并且在3’端连接生物素)在含有1MNaCl的10mMTE缓冲溶液(包括10mMTris-HCl和1mMEDTA,pH7.0)中预杂交,80℃保持5分钟,然后25℃放置20分钟,得预杂交物A。相应地,有一个对应的不与任何待测DNA杂交的电极作为空白对照。其余步骤与实施例2相同。结果如图12和表9所示。结果说明,本发明所述的含有多腺嘌呤的DNA捕获探针及其自组装金电极进行的电化学检测的特异性非常高。众所周知,对单碱基错配的区分在单核苷多态性检测中具有很重要的应用。通过对仅仅与待测DNA存在单核苷酸差异的单碱基错配DNA链(SNP(A)、SNP(C)和SNP(G))探究特异性,其得到的信号强度大约是背景信号的2倍,而这仅仅是真正的待测DNA所检测得到的信号强度的五分之一左右,可见该自组装电极具有高度的序列特异性。表9电化学检测待测DNASNP(A)SNP(C)SNP(G)NT空白对照电流(nA)-250-57.14-68.36-46.86-32.78-21.2应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。<110>上海市计量测试技术研究院<120>基于多腺嘌呤的DNA捕获探针、生物传感器及其检测方法<130>P1610939C<160>12<170>PatentInversion3.5<210>1<211>18<212>DNA<213>人工序列<220><223>polyA5捕获探针<400>1aaaaacccaccaacgctg18<210>2<211>23<212>DNA<213>人工序列<220><223>polyA10捕获探针<400>2aaaaaaaaaacccaccaacgctg23<210>3<211>33<212>DNA<213>人工序列<220><223>poly20捕获探针<400>3aaaaaaaaaaaaaaaaaaaacccaccaacgctg33<210>4<211>43<212>DNA<213>人工序列<220><223>poly30捕获探针<400>4aaaaaaaaaaaaaaaaaaaaaaaaaaaaaacccaccaacgctg43<210>5<211>53<212>DNA<213>人工序列<220><223>poly40捕获探针<400>5aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaacccaccaacgctg53<210>6<211>5<212>DNA<213>人工序列<220><223>polyA5<400>6aaaaa5<210>7<211>20<212>DNA<213>人工序列<220><223>报告子(reporter)<400>7atcaattccacagttttcgc20<210>8<211>35<212>DNA<213>人工序列<220><223>待测DNA<400>8gcgaaaactgtggaattgatcagcgttggtgggaa35<210>9<211>36<212>DNA<213>人工序列<220><223>非互补DNA(NT)<400>9agactttgataccatactaaatagcaccatttccaa36<210>10<211>35<212>DNA<213>人工序列<220><223>SNP(A)<400>10gcgaaaactgtggaattgatcagcgtaggtgggaa35<210>11<211>35<212>DNA<213>人工序列<220><223>SNP(C)<400>11gcgaaaactgtggaattgatcagcgtcggtgggaa35<210>12<211>35<212>DNA<213>人工序列<220><223>SNP(G)<400>12gcgaaaactgtggaattgatcagcgtgggtgggaa35当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1