一种维生素B12与BtuF蛋白相互作用的分析方法与流程
本发明属于蛋白质结构生物学技术领域,具体涉及一种维生素B12与BtuF蛋白相互作用的分析方法。
背景技术:
蛋白质与配体的相互作用和识别是蛋白质发挥其生物功能的重要途径,在各种生命活动中扮演着非常重要的角色,因此,了解蛋白质和配体之间的相互作用机制对于理解生物体调控机制有着至关重要的意义。大肠杆菌中维生素B12吸收系统由BtuB、BtuF、BtuCD组成。BtuF在细胞周质中捕获VB12后与BtuCD对接形成稳定的BtuCDF复合物,并开始VB12由膜外向膜内的运输。
BtuF的两个球形结构域之间只有一个铰链状“连接器”,属于周质蛋白家族中第Ⅲ类。第Ⅲ类周质蛋白,如与锌结合的蛋白质TroA[100]、与镁离子结合的蛋白质PsaA、与维生素B12结合的蛋白质BtuF[Karpowich NK,et al.Crystal structures of the BtuF periplasmic-binding protein for vitamin B12suggest a functionally important reduction in protein mobility upon ligand binding.J Biol Chem[J].2003,278(10):8429-8434.]等,其空载状态的晶体结构和结合配体后的晶体结构之间并无较明显差异。然而近几年的研究对此结论提出了质疑。Kand[Kandt C,et al.Opening and Closing Motions in the Periplasmic Vitamin B12Binding Protein BtuF.Biochemistry[J].2006,45(44):13284-13292.]通过计算机模拟实验认为BtuF是一种非常灵活的蛋白质,它在空载和结合配体后构象会一直发生“打开”、“闭合”等运动,但BtuF与VB12结合之后构象更倾向于处于闭合状态。LM等[Liu M,et al.Study on the mechanism of the BtuF periplasmic-binding protein for vitamin B12.Biophys Chem[J].2008,135(1-3):19-24.]也通过构建BtuF、BtuCDF晶体结构模型等计算机模拟实验发现BtuF-VB12复合物释放VB12过程中,自由能变化非常大,意味着BtuF-VB12复合物处于一种很稳定的状态。而另一方面又发现BtuF-VB12复合物的构象也会由发生“扭曲”、“打开”等运动趋势。
目前用来表征蛋白质-配体的相互作用的分析方法和计算方法,如:量热仪、荧光、傅里叶变换红外光谱(FTIR)、表面等离子体共振(SPR)、酶联免疫吸附试验(ELISA)、核磁共振(NMR)和X射线晶体衍射等,很难提供蛋白质与配体结合其构象发生的变化,需要消耗大量的样品和时间。
技术实现要素:
针对传统蛋白质结构生物学研究方法中的灵敏度低、对蛋白质分子量有限制、所需样品量大、所需样品纯度较高和图谱解析耗时等缺点,本发明提供了一种维生素B12与BtuF蛋白相互作用的分析方法,能够实现蛋白质与配体相互作用的高效、准确检测分析。
本发明的技术方案如下:
一种维生素B12与BtuF蛋白相互作用的分析方法,将BtuF蛋白置换到pH8.0的醋酸铵缓冲液中,按摩尔比1:1加入维生素B12制备BtuF-VB溶液,在相同的质谱条件下,对BtuF蛋白、BtuF-VB、蛋白质标准品进行质谱分析,采集三者的离子淌度数据,并对离子淌度数据进行处理,得到各自的漂移时间分布,根据蛋白质标准品的漂移时间分布和理论碰撞横截面积,BtuF、BtuF-VB的漂移时间分布,得到BtuF、BtuF-VB的碰撞横截面积,根据漂移时间分布和碰撞横截面积,分析BtuF-VB的相互作用,具体步骤如下:
第一步,将BtuF蛋白和蛋白质标准品用超滤膜进行脱盐处理,将脱盐后的BtuF蛋白置换到pH8.0的醋酸铵缓冲液中,蛋白质标准品置换到pH7.4的醋酸铵缓冲液中;
第二步,在第一步得到的BtuF蛋白溶液中加入维生素B12的醋酸铵缓冲溶液,得到BtuF-VB复合物溶液;
第三步,在相同的质谱条件下,对BtuF蛋白、BtuF-VB和蛋白质标准品进行质谱分析,采集各自的离子淌度数据;
第四步,将得到的离子淌度数据处理,得到BtuF蛋白、BtuF-VB、蛋白质标准品的漂移时间分布;
第五步,根据蛋白质标准品的漂移时间分布和理论碰撞横截面积,以及BtuF蛋白、BtuF-VB的漂移时间分布,得到BtuF蛋白、BtuF-VB的碰撞横截面积,最后根据漂移时间分布和碰撞横截面积,分析BtuF-VB的相互作用。
第一步中,BtuF蛋白脱盐时,温度为4℃,离心转速为14000rcf,时间不低于30min,重复不少于5次。
第二步中,BtuF蛋白与维生素B12的摩尔比为1:1。
第三步中,离子淌度质谱仪条件为:针尖电压1.5kV,锥孔电压10V,源补偿电压10V,一级碰撞室电压2V,二级碰撞室电压2V,一级碰撞室和离子淌度分离室之间的反电压28V,碰撞室内氩气流速2mL/min,氦气室气体流速150mL/min,离子淌度分离室中用氮气做分离气体且流速为60mL/min,离子淌度分离室行波速度1100m/s,离子淌度分离室行波振幅37V。
第三步中,所述的蛋白质标准品为乙醇脱氢酶、刀豆蛋白、抗生物素蛋白、β-乳球蛋白、肌球蛋白、细胞色素c和血清淀粉样蛋白。
与现有技术相比,本发明具有如下显著优点:(1)操作方法简单;(2)所需样品量少;(3)对样品纯度要求不高;(4)实验重复性好;(5)图谱解析较为简单。
附图说明
图1是本发明实例1得到的BtuF和BtuF-VB的漂移时间分布图。
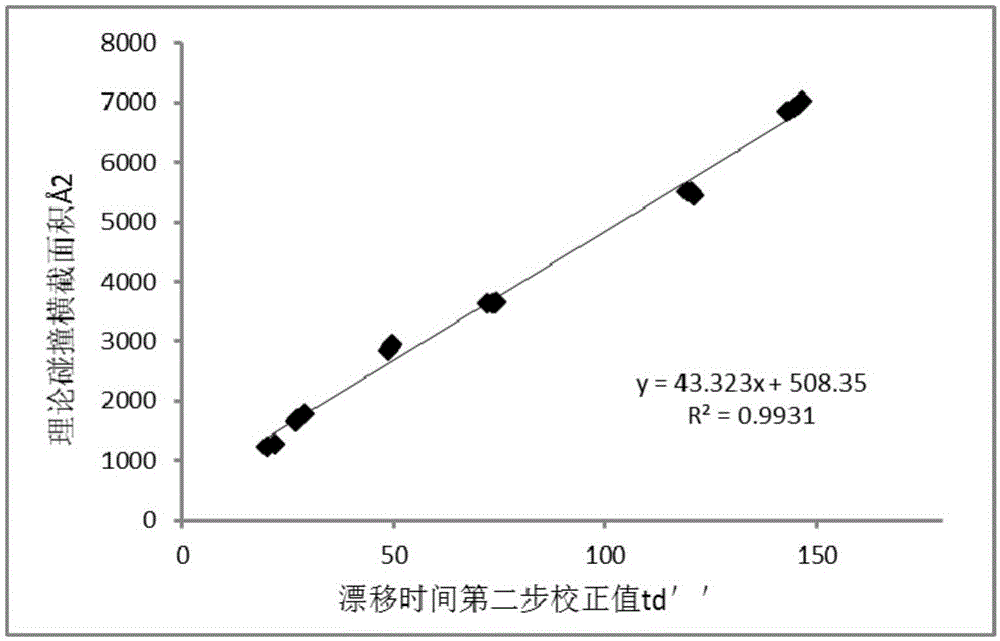
图2是本发明实例1中由蛋白质标准品的漂移时间和理论碰撞横截面积得到的校正曲线以及漂移时间第二步校正值与碰撞横截面积的关系式。
图3是本发明实例1中由蛋白质标准品的漂移时间和理论碰撞横截面积得到的校正曲线以及漂移时间第二步校正值与碰撞横截面积的关系式。
图4是本发明实例1中由蛋白质标准品的漂移时间和理论碰撞横截面积得到的校正曲线以及漂移时间第二步校正值与碰撞横截面积的关系式。
具体实施方式
下面结合实施例和附图对本发明作进一步详细说明。
实施例1
第一步,BtuF蛋白质和所有的蛋白质标准品(包括乙醇脱氢酶、刀豆蛋白、抗生物素蛋白、β-乳球蛋白、肌球蛋白、细胞色素c和血清淀粉样蛋白)都用10kD的超滤膜进行脱盐处理,离心温度为4℃,离心转速14000rcf,离心30min,重复5次,其中脱盐后的BtuF蛋白质置换到pH8.0的醋酸铵缓冲液中,脱盐后的蛋白质标准品置换到pH7.4的醋酸铵缓冲液中;
第二步,在第一步得到的BtuF蛋白溶液中加入等摩尔量的、用pH8.0的醋酸铵缓冲液配制的维生素B12溶液,得到BtuF-VB复合物溶液;
第三步,吸取2μL终浓度为10uM BtuF蛋白、BtuF-VB、终浓度为5uM蛋白质标准品上质谱,调节好仪器参数如:工作模式为离子淌度模式,电离模式为正离子模式,针尖电压1.5kV,锥孔电压10V,源补偿电压10V,一级碰撞室电压2V,二级碰撞室电压2V,一级碰撞室和离子淌度分离室之间的反电压28V,碰撞室内氩气流速2mL/min,氦气室气体流速150mL/min,离子淌度分离室中用氮气做分离气体且流速为60mL/min,离子淌度分离室行波速度11001100m/s,离子淌度分离室行波振幅37V,采集BtuF蛋白、BtuF-VB、各蛋白质标准品的离子淌度数据;
第四步,将第三步得到的离子淌度数据经Masslynx和Driftscope软件处理,得到BtuF蛋白、BtuF-VB、各蛋白质标准品的漂移时间分布;
第五步,根据蛋白质标准品的漂移时间分布和理论碰撞横截面积,以及BtuF蛋白、BtuF-VB的漂移时间分布,得到BtuF蛋白、BtuF-VB的碰撞横截面积,最后根据漂移时间分布和碰撞横截面积,分析BtuF-VB的相互作用。
表1三次独立重复实验的结果
结果如图1,可知BtuF和BtuF-VB的漂移时间为14.94ms、16.22ms,并计算得知其碰撞横截面积分别为与分别由BtuF、BtuF-VB晶体结构得到的碰撞横截面积一致,表明BtuF、BtuF-VB蛋白在质谱气相中仍然保留其在溶液环境中的天然构象,因此我们的实验设计具有生理意义。漂移时间分布一般会呈现高斯分布且含有多种构象状态的离子会导致较宽的漂移时间分布,可根据漂移时间分布来判断蛋白质结构的动力学变化以及结构异质性等。BtuF的漂移时间半峰宽分别为1.417ms,而当其与维生素B12结合后漂移时间半峰宽降为1.05ms,表明BtuF-VB复合物的结构均一性更好而且构象处于更加紧凑的状态。
图2为用蛋白质标准品的漂移时间分布,理论碰撞横截面积和BtuF、BtuF-VB的漂移时间分布,计算BtuF、BtuF-VB碰撞横截面积时的校正曲线。得到碰撞横截面积与漂移时间校正值的关系式为y=43.323x+508.35,得到BtuF、BtuF-VB的漂移时间分别为且线性相关系数为0.9931,表明此此趋势线具有很好的可靠性。
图3是实例1中在相同的实验条件下重复此实验,并用蛋白质标准品的漂移时间分布,理论碰撞横截面积和BtuF、BtuF-VB的漂移时间分布,计算BtuF、BtuF-VB碰撞横截面积时的校正曲线。得到碰撞横截面积与漂移时间校正值的关系式为y=43.431x+509.69,得到BtuF、BtuF-VB的漂移时间分别为且线性相关系数为0.9923,表明此趋势线具有很好的可靠性。图4是实例1中在相同的实验条件下重复此实验,并用蛋白质标准品的漂移时间分布,理论碰撞横截面积和BtuF、BtuF-VB的漂移时间分布,计算BtuF、BtuF-VB碰撞横截面积时的校正曲线。得到碰撞横截面积与漂移时间校正值的关系式为y=48.842x+466.82,得到BtuF、BtuF-VB的漂移时间分别为且线性相关系数为0.9935,表明此趋势线具有很好的可靠性。
表1是三次独立重复实验的结果汇总。BtuF、BtuF-VB12复合物的碰撞横截面积分别为BtuF、BtuF-VB12复合物的漂移时间分布分别为1.299±0.125ms、1.050±0.079ms。
- 还没有人留言评论。精彩留言会获得点赞!