一种提取分离装置的制作方法
本实用新型属于食品药品检测分析领域,具体涉及一种提取分离装置,用于从中药材中提取分离非法添加的合成酸性色素。
背景技术:
由于合成色素具有不同程度的致敏性甚至致癌性,根据中药材监管相关规定,中药材中不允许添加任何人工着色剂(合成色素),然而,目前市面上中药材的非法染色现象十分严重,不法分子通过对药材染色以达到掩盖掺伪、以次充好、以提取后的药材重新入药等不法目的。其中,市场上常见的染色中药有:红花、黄连、丹参、蒲黄、五味子等,而且所添加的色素种类越来越复杂,这对中药材的检验提出了新的要求。
中药材非法染色过程中常见的着色剂包括食用色素、工业染料、纺织品染料等几大类,如胭脂红、柠檬黄、亮蓝、苏丹红、金胺O、808猩红等。一般的中药材非法染色方式包括喷涂、浸泡等手段,并且,由于中药材多为植物组织,以水溶性合成酸性色素为主的各种合成色素会与植物组织的纤维素、木质素、半纤维素等物质发生紧密的结合从而发挥染色的作用。在进行中药材非法染色检测时,由于二者结合紧密,因此使用传统的方法较难将合成酸性色素等从中药材中充分提取,普通提取方法的回收率仅为30~70%,且方法准确性较差,无法进行后续定量分析。
另外,由于部分药厂对染色中药材的检查缺乏经验,生产过程中以非法染色中药材投料生产,导致部分成药中检出了合成色素。由于染色中药材在药品生产中一般只占有很少的比例,因此成药中的合成色素含量很低,使用传统提取方法较难检出,而且对检测仪器要求较高。经样品分析还发现,市场上存在以少量染色中药材掺入正品中药材中的现象,在这种情况下,由于掺入的量比较少,因此,使用传统的提取方法很有可能无法检出。针对上述存在的技术问题,中药材的现实检测中,亟需一种有效地从非法染色的中药材中提取合成色素、尤其是合成酸性色素的方法,以满足实际检测的需要。
现有技术中,如“聚酰胺固相萃取-HPLC法同时测定中药材中16种合成酸性色素”(《中成药》2015,37(5):1031-1036)所披露的方法能够同时进行16种合成酸性色素的测定。然而,该文献所记载的方法包括繁琐的提取分离过程,即反复加液、离心、移取、超声等步骤,耗时较长,因此,整体的提取分离与检测效率还有待进一步提高,以满足现实中各食品药品检验所或药企的快速检测需求。
因此,研发出一种全新设计的提取分离装置,用于中药材中非法添加的色素的高效提取分离及其后续的进一步定量检测,成为当今本领域研发人员的研究重点之一。
技术实现要素:
本实用新型旨在克服上述现有技术中存在的种种缺陷,尤其是针对现有方法提取分离耗时较长且效率较低、检测分析回收率不够高等技术问题。
因此,本实用新型的第一方面,提供了一种提取分离装置,用于从中药材中提取分离非法添加的合成酸性色素,所述提取分离装置包括:
提取器上盖1,提取器下盖2,WAX固相萃取柱3,固相萃取缸4,SPE转接头5,双公鲁尔接头6,鲁尔考克阀7与提取软管8,不锈钢筛网12和不锈钢滤片13;
所述提取器上盖1与所述提取器下盖2可拆卸地闭合围成一空腔;其中,所述提取器上盖1中心设有小通孔,并在所述提取器上盖1的外顶面中心设置有公鲁尔接口;所述提取器下盖2中心设有小通孔,并在所述提取器下盖2的外底面中心设置有母鲁尔接口;
其中,所述WAX固相萃取柱3借助于所述固相萃取缸4上盖的鲁尔口而插接于所述固相萃取缸4,在所述WAX固相萃取柱3的入口处插接有所述SPE转接头5;所述SPE转接头5的上端插接至所述双公鲁尔接头6,而所述双公鲁尔接头6的上端插接至所述提取器下盖2的母鲁尔接口内;所述提取器上盖1的顶面中心设置的所述公鲁尔接口插接至所述鲁尔考克阀7的母口内;并且,所述鲁尔考克阀7的公口插接入所述提取软管8的一端,而所述提取软管8的另一端为提取液的入口;
其中,通过设置在所述提取器上盖1内侧的外螺纹与设置在所述提取器下盖2内侧的相匹配的内螺纹,所述提取器上盖1与所述提取器下盖2实现可拆卸地闭合;并且,所述提取器上盖1的内顶面固定连接有一个空心的饼状体,所述外螺纹设置在所述饼状体的侧面上,所述饼状体的底面上具有若干个透孔,供提取液流出;
其中,所述不锈钢筛网12和所述不锈钢滤片13的材质均为304不锈钢或316不锈钢,并且,所述不锈钢筛网12的直径小于所述不锈钢滤片13的直径;所述不锈钢筛网12垫置于所述提取器下盖2的内底面上;所述不锈钢滤片13覆盖在所述空腔内填充的中药材细粉饼上;所述提取器上盖1旋紧后,其中所述饼状体的底面紧贴所述不锈钢滤片13。
使用上述提取分离装置,实施中药材中非法添加的合成酸性色素的提取分离方法,主要包括以下步骤:
首先,将一片不锈钢筛网12垫置于所述提取器下盖2的内底面上,精密称取中药材细粉,并将所述中药材细粉填充至提取器上盖1与提取器下盖2可拆卸地闭合围成的空腔内,然后整平中药材细粉饼,再于所述中药材细粉饼上覆盖一片不锈钢滤片13,旋紧所述提取器上盖1;;
接着,将WAX固相萃取柱3插入固相萃取缸4内,采用提取液预洗活化,并保持WAX固相萃取柱中的提取液充盈;在所述WAX固相萃取柱的入口处插接SPE转接头5,将所述SPE转接头5的上端插接至双公鲁尔接头6,最后将所述双公鲁尔接头6的上端插接至所述提取器下盖2的所述母鲁尔接口内;而WAX固相萃取柱3可借助于所述固相萃取缸4上盖的鲁尔口而插入;
将一端插接有鲁尔考克阀7的提取软管8的另一端插入提取液试剂瓶10,并浸没在提取液中;开启所述鲁尔考克阀7,再将注射器插入所述鲁尔考克阀7的母口,拉动注射器的活塞杆,抽吸提取液,直至提取液充满所述提取软管8和所述鲁尔考克阀7后,关闭所述鲁尔考克阀7并抽出该注射器;
然后,将所述鲁尔考克阀7的母口插接至所述提取器上盖1的顶面中心设置的所述公鲁尔接口;将所述提取液试剂瓶10放置于高处,使得所述提取液试剂瓶10的瓶底所处的水平面至少高于所述SPE转接头5的出液口;接着,开启所述鲁尔考克阀7,使得提取液流经所述中药材细粉并不断流入所述WAX固相萃取柱3内,进行固相萃取;在此过程中,所述中药材细粉中含有的合成酸性色素会被固相萃取柱中的混合型弱阴离子交换反相吸附剂所吸附;待滴下的液体呈无色后,关闭所述鲁尔考克阀7,取下所述双公鲁尔接头6及其以上的构件,然后使用洗脱剂对所述WAX固相萃取柱3进行洗脱,合并洗脱液,即提取分离得到所述合成酸性色素;当然,研发人员或操作人员可将洗脱液进一步调节pH至中性,定容,再经高速离心,取上清液进样至HPLC系统或HPLC-MS系统进行检测;由于以上检测方法中所使用的HPLC系统或HPLC-MS系统均可从现有的常规高效液相色谱设备、质谱设备中选择,因此高效液相分析和质谱分析的操作方法均为常规方法,在本实用新型说明书中将不再赘述。此外,值得一提的是,所述不锈钢筛网在阻挡中药材粉末的同时具有一定的过滤作用,而所述不锈钢滤片也起到过滤杂质的作用;说明书全文中所述的“滴下的液体呈无色”,是指研发人员或操作人员观察到所述SPE转接头5的出液口滴下的液体呈无色。
优选地,在上述提取分离装置中,所述不锈钢筛网12的筛孔为600目,所述不锈钢滤片13的筛孔为100目。
优选地,在上述提取分离装置中,所述提取器上盖1、所述提取器下盖2、所述SPE转接头5、所述双公鲁尔接头6与所述鲁尔考克阀7的材质均为聚丙烯;所述提取软管8的材质为硅胶。上述材质对色素均无吸附作用。
优选地,在上述提取分离装置中,所述空腔内进一步包括:一个橡胶环11;所述橡胶环11放置于所述提取器下盖2内,用于密封;此处所述的橡胶环即相当于水管接头中的密封圈,起到密封的作用。
此外,值得注意的是,精密称取中药材细粉后,填充所述空腔即可,但切勿填充过满,以免造成中药材细粉堵塞流路或影响上下盖的旋紧闭合。
更进一步优选地,上述提取分离装置还包括与所述固相萃取缸4连通的抽气泵14。在这种优选实施方式中,研发人员或操作人员能够使用与所述固相萃取缸4连通的抽气泵14进行加速提取,通过控制抽气泵14来调节固相萃取缸4的负压,使得提取液以2~3滴每秒的速度流出为宜;并且,待滴下的液体呈无色后,先关闭抽气泵14,再关闭所述鲁尔考克阀7,取下所述双公鲁尔接头6及其以上的构件,然后使用洗脱剂对所述WAX固相萃取柱3进行洗脱,合并洗脱液,即提取分离得到所述合成酸性色素。此外,值得说明的是,该抽气泵14优选为隔膜抽气泵,并且还可连接有废液瓶,供存储废液并抽出废气。
实际上,上述提取分离方法及其后续的定量检测方法均是采用了发明人所设计的全新的提取分离装置,才得以有效实施。
与现有技术相比,本实用新型具有以下优点:
①使用发明人所设计的全新的提取分离装置,实施提取分离方法,能够以比现有技术更短的耗时、高效地提取分离出合成酸性色素;②采用本实用新型所提供的提取分离装置实施提取分离,并进一步实施定量检测,测得各种合成酸性色素的回收率普遍地显著高于现有技术;③本实用新型所提供的提取分离装置能够大幅改进对于多种合成酸性色素的提取效率,并相应提高其检测能力,因此,具有广阔的应用前景与良好的市场潜力。
附图说明
图1为本实用新型的一个实施例中的所述提取器上盖1的俯视图、仰视图与侧视图;其中:1a-公鲁尔接口,1b-饼状体,1c-外螺纹,1d-透孔;
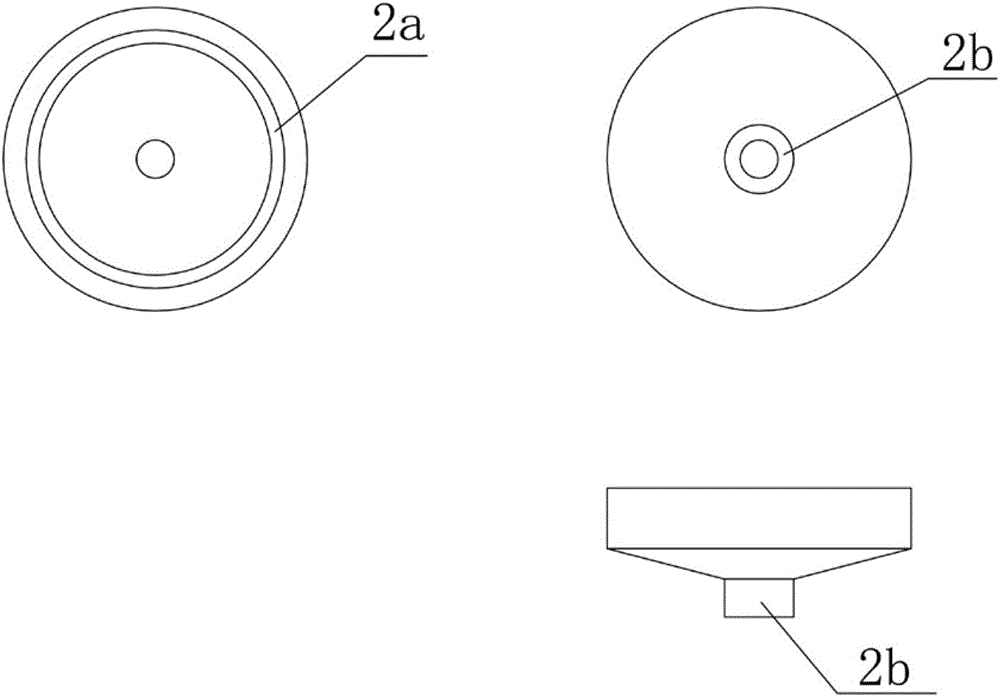
图2为本实用新型的一个实施例中的所述提取器下盖2的俯视图、仰视图与侧视图;其中:2a-内螺纹,2b-母鲁尔接口;
图3为本实用新型的一个实施例中的所述提取分离装置的结构简图;
其中:1-提取器上盖,2-提取器下盖,3-WAX固相萃取柱,4-固相萃取缸,5-SPE转接头,6-双公鲁尔接头,7-鲁尔考克阀,8-提取软管;
图4为11-橡胶环、12-不锈钢筛网和13-不锈钢滤片的散件图,它们被放置于提取器上盖1与提取器下盖2所闭合而成的所述空腔内;
图5为图3所示的提取分离装置的安装运行示意图;
其中:A-提取分离装置,10-提取液试剂瓶,14-抽气泵。
具体实施方式
下面结合具体实施方式对本实用新型作进一步阐述,但本实用新型并不限于以下实施方式。
本实用新型第一方面提供了一种提取分离装置,包括:
提取器上盖1,提取器下盖2,WAX固相萃取柱3,固相萃取缸4,SPE转接头5,双公鲁尔接头6,鲁尔考克阀7与提取软管8,不锈钢筛网12和不锈钢滤片13;
所述提取器上盖1与所述提取器下盖2可拆卸地闭合围成一空腔;其中,所述提取器上盖1中心设有小通孔,并在所述提取器上盖1的外顶面中心设置有公鲁尔接口;所述提取器下盖2中心设有小通孔,并在所述提取器下盖2的外底面中心设置有母鲁尔接口;
其中,所述WAX固相萃取柱3借助于所述固相萃取缸4上盖的鲁尔口而插接于所述固相萃取缸4,在所述WAX固相萃取柱3的入口处插接有所述SPE转接头5;所述SPE转接头5的上端插接至所述双公鲁尔接头6,而所述双公鲁尔接头6的上端插接至所述提取器下盖2的母鲁尔接口内;所述提取器上盖1的顶面中心设置的所述公鲁尔接口插接至所述鲁尔考克阀7的母口内;并且,所述鲁尔考克阀7的公口插接入所述提取软管8的一端,而所述提取软管8的另一端为提取液的入口;
其中,通过设置在所述提取器上盖1内侧的外螺纹与设置在所述提取器下盖2内侧的相匹配的内螺纹,所述提取器上盖1与所述提取器下盖2实现可拆卸地闭合;并且,所述提取器上盖1的内顶面固定连接有一个空心的饼状体,所述外螺纹设置在所述饼状体的侧面上,所述饼状体的底面上具有若干个透孔,供提取液流出;
其中,所述不锈钢筛网12和所述不锈钢滤片13的材质均为304不锈钢或316不锈钢,并且,所述不锈钢筛网12的直径小于所述不锈钢滤片13的直径;所述不锈钢筛网12垫置于所述提取器下盖2的内底面上;所述不锈钢滤片13覆盖在所述空腔内填充的中药材细粉饼上;所述提取器上盖1旋紧后,其中所述饼状体的底面紧贴所述不锈钢滤片13。
在一个优选实施例中,所述不锈钢筛网12的筛孔为600目,所述不锈钢滤片13的筛孔为100目。
在一个优选实施例中,所述提取器上盖1、所述提取器下盖2、所述SPE转接头5、所述双公鲁尔接头6与所述鲁尔考克阀7的材质均为聚丙烯;所述提取软管8的材质为硅胶。
在一个优选实施例中,所述空腔内进一步包括:一个橡胶环11;所述橡胶环11放置于所述提取器下盖2内,用于密封。
在一个更进一步优选的实施例中,所述提取分离装置还包括与所述固相萃取缸4连通的抽气泵14。
以下实施例1~4中,所使用的主要仪器、材料与试剂包括:
Agilent 1290 Infinity 超高效液相色谱仪(带DAD检测器),Agilent 6495三重四级杆质谱仪(AJS ESI离子源)美国安捷伦公司,数据分析软件(Agilent MassHunter 软件包包含数据采集、定性、定量分析、离子优化软件,版本B.07),Millipore Milli-Q Gradient A10 纯水仪(美国Millipore公司),Sartorius CP225D 分析天平(德国Sartorius公司),离心机;
色谱柱:Waters ACQUITY UPLC HSS T3 色谱柱(100mm*2.1mm,1.8μm),Waters ACQUITY UPLC HSS T3 VanGuard预柱(2.1mm*5mm)及Waters Guard Filter在线过滤器(配0.22μm滤片);SPE小柱(所述WAX固相萃取柱3,500mg/6cc,天津博纳艾杰尔公司);
乙腈为色谱纯试剂(德国Merck公司);甲酸(前处理用)、氨水、甲醇、异丙醇均为分析纯试剂(上海凌峰化学试剂有限公司),乙酸铵为质谱级纯度(上海阿拉丁公司);
实施例1
对某A厂生产的黄连饮片粉末中非法添加的合成酸性色素进行提取分离与检测:
在此实施例1中,使用如图3所示的提取分离装置,包括:提取器上盖1,提取器下盖2,WAX固相萃取柱3,固相萃取缸4,SPE转接头5,双公鲁尔接头6,鲁尔考克阀7与提取软管8;其中,所述提取器上盖1、所述提取器下盖2、所述SPE转接头5、所述双公鲁尔接头6与所述鲁尔考克阀7的材质均为聚丙烯;所述提取软管8的材质为硅胶,内径4mm,外径6mm。
所述提取器上盖1的结构如图1所示,所述提取器下盖2的结构如图2所示;其中,所述提取器上盖1中心设有小通孔,并在所述提取器上盖1的外顶面中心设置有公鲁尔接口1a;所述提取器下盖2中心设有小通孔,并在所述提取器下盖2的外底面中心设置有母鲁尔接口2b;通过设置在所述提取器上盖1内侧的外螺纹1c与设置在所述提取器下盖2内侧的相匹配的内螺纹2a,所述提取器上盖1与所述提取器下盖2实现可拆卸地闭合,旋紧闭合后可围成一个空腔;并且,所述提取器上盖1的内顶面固定连接有一个空心的饼状体1b,所述外螺纹1c设置在所述饼状体1b的侧面上,所述饼状体1b的底面上具有若干个透孔1d,供提取液流出。
步骤一:
先将提取器上盖1与提取器下盖2旋开,在提取器下盖2的内底面上垫置一片不锈钢筛网12(304不锈钢,直径10mm,600目),然后放入一个橡胶环11;接着,将该提取器下盖2放入天平,精密称取0.25g黄连饮片粉末填充于该提取器下盖2中,轻敲以整平黄连饮片粉末饼,再于所述黄连饮片粉末饼上覆盖一片不锈钢滤片13(304不锈钢,直径15mm,100目),之后旋紧所述提取器上盖1。
步骤二:
将WAX固相萃取柱3插入固相萃取缸4内,采用甲醇6ml,0.1%甲酸水6ml预洗活化该WAX固相萃取柱3,之后加水4 ml,以保持该WAX固相萃取柱中的提取液充盈且湿润;在所述WAX固相萃取柱3的入口处插接SPE转接头5,将所述SPE转接头5的上端插接至双公鲁尔接头6,最后将所述双公鲁尔接头6的上端插接至所述提取器下盖2的母鲁尔接口2b内;
步骤三:
将一端插接有鲁尔考克阀7的提取软管8的另一端插入提取液试剂瓶10,并浸没在提取液(70%甲醇水溶液)中;开启所述鲁尔考克阀7,再将注射器插入所述鲁尔考克阀7的母口,拉动注射器的活塞杆,抽吸提取液,直至提取液充满所述提取软管8和所述鲁尔考克阀7后,关闭所述鲁尔考克阀7并抽出该注射器;
步骤四:
将所述鲁尔考克阀7的母口插接至所述提取器上盖1的顶面中心设置的所述公鲁尔接口1a;将所述提取液试剂瓶10放置于高台上,使得所述提取液试剂瓶10的瓶底所处的水平面高于所述SPE转接头5的出液口;接着,开启所述鲁尔考克阀7,使得提取液流经所述黄连饮片粉末并不断流入所述WAX固相萃取柱3内,进行固相萃取;待滴下的液体呈无色后,关闭所述鲁尔考克阀7,取下所述双公鲁尔接头6及其以上的构件;然后使用6ml甲醇冲洗该WAX固相萃取柱3,排尽柱内液体,再以4ml的10%氨水甲醇溶液洗脱两次,合并洗脱液;
步骤五:
向上述合并的洗脱液中加入甲酸调pH至近中性,再定容至10ml,高速离心(14000rpm,10min),取上清液2ul进样至HPLC系统;通过HPLC系统,对黄连饮片中非法添加的若干种合成酸性色素完成检测。
其中,HPLC色谱条件为:
柱温:30℃,进样体积2μL;流速0.55ml/min。洗针时间20秒,洗针溶剂异丙醇:乙腈:甲醇:水=1:1:1:1
流动相:A相:10mmol乙酸铵,B相乙腈。流动相梯度洗脱程序如表1所示:
HPLC系统中线性关系确定:
选取了食品、药用辅料中允许添加的、国际禁用的、中药中常被报道的合成酸性色素,常见纺织品染料,及部分生物染料、显色剂,共50种。
分别精密称取50种色素对照品10mg置于20ml容量瓶中,根据色素的溶解性,水溶性色素使用水定容;脂溶性色素使用乙腈定容。定容后的溶液转移至储液瓶中,贴标签,保存于4℃冰箱中。使用前恢复至室温,根据需要进行稀释,配制成混合标准品溶液。
将上述混合标准品溶液等比稀释,分别取2μl进样,进行测定;以峰面积与对应的质量浓度进行线性回归分析,软件计算的出回归方程、线性范围和相关性系数,具体结果如表2所示:
实施例2
对某B厂生产的黄连饮片粉末中非法添加的合成酸性色素进行提取分离与检测:
在此实施例2中,使用如图3所示的提取分离装置,包括:提取器上盖1,提取器下盖2,WAX固相萃取柱3,固相萃取缸4,SPE转接头5,双公鲁尔接头6,鲁尔考克阀7与提取软管8;其中,所述提取器上盖1、所述提取器下盖2、所述SPE转接头5、所述双公鲁尔接头6与所述鲁尔考克阀7的材质均为聚丙烯;所述提取软管8的材质为硅胶,内径4mm,外径6mm。
所述提取器上盖1的结构如图1所示,所述提取器下盖2的结构如图2所示;其中,所述提取器上盖1中心设有小通孔,并在所述提取器上盖1的外顶面中心设置有公鲁尔接口1a;所述提取器下盖2中心设有小通孔,并在所述提取器下盖2的外底面中心设置有母鲁尔接口2b;通过设置在所述提取器上盖1内侧的外螺纹1c与设置在所述提取器下盖2内侧的相匹配的内螺纹2a,所述提取器上盖1与所述提取器下盖2实现可拆卸地闭合,旋紧闭合后可围成一个空腔;并且,所述提取器上盖1的内顶面固定连接有一个空心的饼状体1b,所述外螺纹1c设置在所述饼状体1b的侧面上,所述饼状体1b的底面上具有若干个透孔1d,供提取液流出。
步骤一:
先将提取器上盖1与提取器下盖2旋开,在提取器下盖2的内底面上垫置一片不锈钢筛网12(304不锈钢,直径10mm,600目),然后放入一个橡胶环11;接着,将该提取器下盖2放入天平,精密称取0.40g黄连饮片粉末填充于该提取器下盖2中,轻敲以整平黄连饮片粉末饼,再于所述黄连饮片粉末饼上覆盖一片不锈钢滤片13(304不锈钢,直径19mm,100目),之后旋紧所述提取器上盖1。
步骤二:
将WAX固相萃取柱3插入固相萃取缸4内,采用甲醇6ml,0.15%甲酸水6ml预洗活化该WAX固相萃取柱3,之后加水5 ml,以保持该WAX固相萃取柱中的提取液充盈且湿润;在所述WAX固相萃取柱3的入口处插接SPE转接头5,将所述SPE转接头5的上端插接至双公鲁尔接头6,最后将所述双公鲁尔接头6的上端插接至所述提取器下盖2的母鲁尔接口2b内;
步骤三:
将一端插接有鲁尔考克阀7的提取软管8的另一端插入提取液试剂瓶10,并浸没在提取液(70%甲醇水溶液)中;开启所述鲁尔考克阀7,再将注射器插入所述鲁尔考克阀7的母口,拉动注射器的活塞杆,抽吸提取液,直至提取液充满所述提取软管8和所述鲁尔考克阀7后,关闭所述鲁尔考克阀7并抽出该注射器;
步骤四:
将所述鲁尔考克阀7的母口插接至所述提取器上盖1的顶面中心设置的所述公鲁尔接口1a;将所述提取液试剂瓶10放置于高台上,使得所述提取液试剂瓶10的瓶底所处的水平面高于所述SPE转接头5的出液口;接着,开启所述鲁尔考克阀7,并启动抽气泵14进行抽气,使得提取液流经所述黄连饮片粉末并不断流入所述WAX固相萃取柱3内,进行固相萃取,如图5所示;待滴下的液体呈无色后,先关闭抽气泵14,再关闭所述鲁尔考克阀7,取下所述双公鲁尔接头6及其以上的构件;然后使用6ml甲醇冲洗该WAX固相萃取柱3,排尽柱内液体,再以3.5ml的10%氨水甲醇溶液洗脱两次,合并洗脱液;其中所使用的抽气泵14为Waters公司生产的隔膜抽气泵;
步骤五:
向上述合并的洗脱液中加入甲酸调pH至近中性,再定容至10ml,高速离心(14000rpm,10min),取上清液2ul进样至HPLC-MS系统;通过HPLC-MS系统,对黄连饮片中非法添加的若干种合成酸性色素完成检测。
在此实施例2中,HPLC色谱条件以及HPLC系统中线性关系的确定与实施例1相同,MS质谱仪及其所用调谐液由美国安捷伦公司提供,并按其操作手册设置合适的质谱条件。
实施例3
对某A厂生产的丹参饮片粉末中非法添加的合成酸性色素进行提取分离与检测:
在此实施例3中,使用如图3所示的提取分离装置,包括:提取器上盖1,提取器下盖2,WAX固相萃取柱3,固相萃取缸4,SPE转接头5,双公鲁尔接头6,鲁尔考克阀7与提取软管8;其中,所述提取器上盖1、所述提取器下盖2、所述SPE转接头5、所述双公鲁尔接头6与所述鲁尔考克阀7的材质均为聚丙烯;所述提取软管8的材质为硅胶,内径4mm,外径5mm。
所述提取器上盖1的结构如图1所示,所述提取器下盖2的结构如图2所示;其中,所述提取器上盖1中心设有小通孔,并在所述提取器上盖1的外顶面中心设置有公鲁尔接口1a;所述提取器下盖2中心设有小通孔,并在所述提取器下盖2的外底面中心设置有母鲁尔接口2b;通过设置在所述提取器上盖1内侧的外螺纹1c与设置在所述提取器下盖2内侧的相匹配的内螺纹2a,所述提取器上盖1与所述提取器下盖2实现可拆卸地闭合,旋紧闭合后可围成一个空腔;并且,所述提取器上盖1的内顶面固定连接有一个空心的饼状体1b,所述外螺纹1c设置在所述饼状体1b的侧面上,所述饼状体1b的底面上具有若干个透孔1d,供提取液流出。
步骤一:
先将提取器上盖1与提取器下盖2旋开,在提取器下盖2的内底面上垫置一片不锈钢筛网12(316不锈钢,直径10mm,400目),然后放入一个橡胶环11;接着,将该提取器下盖2放入天平,精密称取0.30g丹参饮片粉末填充于该提取器下盖2中,轻敲以整平丹参饮片粉末饼,再于所述丹参饮片粉末饼上覆盖一片不锈钢滤片13(316不锈钢,直径15mm,100目),之后旋紧所述提取器上盖1。
步骤二:
将WAX固相萃取柱3插入固相萃取缸4内,采用甲醇6ml,0.1%甲酸水6ml预洗活化该WAX固相萃取柱3,之后加水4 ml,以保持该WAX固相萃取柱中的提取液充盈且湿润;在所述WAX固相萃取柱3的入口处插接SPE转接头5,将所述SPE转接头5的上端插接至双公鲁尔接头6,最后将所述双公鲁尔接头6的上端插接至所述提取器下盖2的母鲁尔接口2b内;
步骤三:
将一端插接有鲁尔考克阀7的提取软管8的另一端插入提取液试剂瓶10,并浸没在提取液(70%甲醇水溶液)中;开启所述鲁尔考克阀7,再将注射器插入所述鲁尔考克阀7的母口,拉动注射器的活塞杆,抽吸提取液,直至提取液充满所述提取软管8和所述鲁尔考克阀7后,关闭所述鲁尔考克阀7并抽出该注射器;
步骤四:
将所述鲁尔考克阀7的母口插接至所述提取器上盖1的顶面中心设置的所述公鲁尔接口1a;将所述提取液试剂瓶10放置于高台上,使得所述提取液试剂瓶10的瓶底所处的水平面高于所述SPE转接头5的出液口;接着,开启所述鲁尔考克阀7,使得提取液流经所述丹参饮片粉末并不断流入所述WAX固相萃取柱3内,进行固相萃取;待滴下的液体呈无色后,关闭所述鲁尔考克阀7,取下所述双公鲁尔接头6及其以上的构件;然后使用6ml甲醇冲洗该WAX固相萃取柱3,排尽柱内液体,再以4ml的10%氨水甲醇溶液洗脱两次,合并洗脱液;
步骤五:
向上述合并的洗脱液中加入甲酸调pH至近中性,再定容至10ml,高速离心(14000rpm,10min),取上清液2ul进样至HPLC系统;通过HPLC系统,对丹参饮片中非法添加的若干种合成酸性色素完成检测。其中,HPLC色谱条件以及HPLC系统中线性关系的确定与实施例1相同。
实施例4
对某B厂生产的丹参饮片粉末中非法添加的合成酸性色素进行提取分离与检测:
在此实施例4中,使用如图3所示的提取分离装置,包括:提取器上盖1,提取器下盖2,WAX固相萃取柱3,固相萃取缸4,SPE转接头5,双公鲁尔接头6,鲁尔考克阀7与提取软管8;其中,所述提取器上盖1、所述提取器下盖2、所述SPE转接头5、所述双公鲁尔接头6与所述鲁尔考克阀7的材质均为聚丙烯;所述提取软管8的材质为硅胶,内径4mm,外径5mm。
所述提取器上盖1的结构如图1所示,所述提取器下盖2的结构如图2所示;其中,所述提取器上盖1中心设有小通孔,并在所述提取器上盖1的外顶面中心设置有公鲁尔接口1a;所述提取器下盖2中心设有小通孔,并在所述提取器下盖2的外底面中心设置有母鲁尔接口2b;通过设置在所述提取器上盖1内侧的外螺纹1c与设置在所述提取器下盖2内侧的相匹配的内螺纹2a,所述提取器上盖1与所述提取器下盖2实现可拆卸地闭合,旋紧闭合后可围成一个空腔;并且,所述提取器上盖1的内顶面固定连接有一个空心的饼状体1b,所述外螺纹1c设置在所述饼状体1b的侧面上,所述饼状体1b的底面上具有若干个透孔1d,供提取液流出。
步骤一:
先将提取器上盖1与提取器下盖2旋开,在提取器下盖2的内底面上垫置一片不锈钢筛网12(316不锈钢,直径10mm,400目),然后放入一个橡胶环11;接着,将该提取器下盖2放入天平,精密称取0.40g丹参饮片粉末填充于该提取器下盖2中,轻敲以整平丹参饮片粉末饼,再于所述丹参饮片粉末饼上覆盖一片不锈钢滤片13(316不锈钢,直径19mm,100目),之后旋紧所述提取器上盖1。
步骤二:
将WAX固相萃取柱3插入固相萃取缸4内,采用甲醇6ml,0.15%甲酸水6ml预洗活化该WAX固相萃取柱3,之后加水5 ml,以保持该WAX固相萃取柱中的提取液充盈且湿润;在所述WAX固相萃取柱3的入口处插接SPE转接头5,将所述SPE转接头5的上端插接至双公鲁尔接头6,最后将所述双公鲁尔接头6的上端插接至所述提取器下盖2的母鲁尔接口2b内;
步骤三:
将一端插接有鲁尔考克阀7的提取软管8的另一端插入提取液试剂瓶10,并浸没在提取液(70%甲醇水溶液)中;开启所述鲁尔考克阀7,再将注射器插入所述鲁尔考克阀7的母口,拉动注射器的活塞杆,抽吸提取液,直至提取液充满所述提取软管8和所述鲁尔考克阀7后,关闭所述鲁尔考克阀7并抽出该注射器;
步骤四:
将所述鲁尔考克阀7的母口插接至所述提取器上盖1的顶面中心设置的所述公鲁尔接口1a;将所述提取液试剂瓶10放置于高台上,使得所述提取液试剂瓶10的瓶底所处的水平面高于所述SPE转接头5的出液口;接着,开启所述鲁尔考克阀7,并启动抽气泵14进行抽气,使得提取液流经所述丹参饮片粉末并不断流入所述WAX固相萃取柱3内,进行固相萃取,如图5所示;待滴下的液体呈无色后,先关闭抽气泵14,再关闭所述鲁尔考克阀7,取下所述双公鲁尔接头6及其以上的构件;然后使用6ml甲醇冲洗该WAX固相萃取柱3,排尽柱内液体,再以3.5ml的10%氨水甲醇溶液洗脱两次,合并洗脱液;其中所使用的抽气泵14为Waters公司生产的隔膜抽气泵;
步骤五:
向上述合并的洗脱液中加入甲酸调pH至近中性,再定容至10ml,高速离心(14000rpm,10min),取上清液2ul进样至HPLC-MS系统;通过HPLC-MS系统,对丹参饮片中非法添加的若干种合成酸性色素完成检测。
在此实施例4中,HPLC色谱条件以及HPLC系统中线性关系的确定与实施例1相同,MS质谱仪及其所用调谐液由美国安捷伦公司提供,并按其操作手册设置合适的质谱条件。
对比例1
根据“聚酰胺固相萃取-HPLC法同时测定中药材中16种合成酸性色素”(《中成药》2015,37(5):1031-1036)所披露的方法,对某A厂生产的黄连饮片粉末中非法添加的合成酸性色素进行检测,主要步骤如下:
取黄连饮片粉末(过二号筛)1.0g,精密称定,置于50ml具塞离心管中,用甲醇-0.1%甲酸水溶液 (3:2) 避光超声提取,第1次10ml提取30min,第2次5ml提取15min,第3次5ml提取15min;然后离心3次,每次离心5min,合并上清液置25ml棕色量瓶中,用甲醇-0.1%甲酸水溶液 (3:2)稀释至刻度,摇匀;
精密取以上摇匀后的溶液5ml,快速通过聚酰胺固相萃取柱(1g,内径为1cm,依次用甲醇3ml和0.1%甲酸水溶液3ml预洗),用甲醇-氨水-水(7:2:1)8ml快速洗脱,收集洗脱液,精密加25%甲酸水溶液2ml,摇匀,离心(转速为每分钟12000转,5分钟),取上清液2ul进样至HPLC系统,完成检测。
在此对比例1中,HPLC色谱条件以及HPLC系统中线性关系的确定与实施例1相同;并且,此对比例1显然并未使用本实用新型所提供的提取分离装置。
对比例2
与对比例1的检测条件与具体操作步骤完全相同,唯一区别在于此对比例2的检测对象为某B厂生产的丹参饮片粉末中非法添加的合成酸性色素;并且,此对比例2显然并未使用本实用新型所提供的提取分离装置。
在以上实施例1~4中,提取环节的耗时,即从药材粉末中在线提取色素的所有操作步骤的耗时,根据样品中色素的深浅、以及抽气泵14的有无而异,包括渗漉时间在内总计约20~30分钟;而后续分离环节的耗时,包括使用氨水甲醇溶液洗脱柱子约3分钟,合并洗脱液后使用甲酸调pH以及定容操作约3分钟,高速离心等操作约10分钟,因此,总计约16分钟。由此可知,使用发明人所设计的全新提取分离装置来实施提取分离方法,在色素的提取分离阶段,或者称之为HPLC样品的前处理阶段(HPLC进样之前),提取环节与分离环节的总耗时约为46分钟。
然而,与此不同,在以上对比例1~2中,提取环节包括:离线超声提取3次共60分钟,离心3次共15分钟;期间还需每次等待离心机恢复到转速为0,并反复倾出离心后的上清液再补充溶剂,以及用甲醇-0.1%甲酸水溶液稀释的操作,共计约30分钟;因此,提取环节耗时约105分钟;而后续分离环节包括:精密移取约需3分钟,洗脱约需3分钟,加液定容等约3分钟,离心等操作约5分钟;因此,分离环节耗时约14分钟。由此可见,在色素的提取分离阶段,提取环节与分离环节的总耗时约为119分钟。
因此,通过比较可知,使用发明人所设计的全新提取分离装置以实施提取分离方法,在线操作更为简便,省去了一般方法所需的反复加液、离心、移取、超声的步骤;尤其是省去了需要精密移取一定量溶液进一步净化的操作;从而大幅缩短了HPLC样品的前处理耗时(总耗时缩短近一半),因此也提高了后续HPLC检测效率,甚至HPLC-MS检测的效率。
此外,发明人分别按照实施例1与对比例1中所记载的操作步骤,以某A厂生产的黄连饮片粉末为基质,考察了不同检测方法对以下16种合成酸性色素的回收率的影响,检测数据如下表3:
可见,采用本实用新型所提供的提取分离装置进行提取分离并随后对16种色素进行检测,与文献所记载的方法相比,其中,有14种色素的回收率显著提高,有1种色素(日落黄)的回收率基本一致,仅有1种色素(酸性橙)的回收率略低。因此,本实用新型所述提取分离装置的使用,普遍提高了色素的回收率。
此外,发明人分别按照实施例4与对比例2中所记载的操作步骤,以某B厂生产的丹参饮片粉末为基质,考察了不同检测方法对以下16种合成酸性色素的回收率的影响,检测数据如下表4:
可见,采用本实用新型所提供的提取分离装置进行提取分离并随后对16种色素进行检测,与文献所记载的方法相比,其中,有13种色素的回收率显著提高,仅有3种色素(柠檬黄、日落黄、酸性橙)的回收率基本一致。因此,本实用新型所述提取分离装置的使用,普遍提高了色素的回收率。
以上对本实用新型的具体实施例进行了详细描述,但其只是作为范例,本实用新型并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本实用新型进行的等同修改和替代也都在本实用新型的范畴之中。因此,在不脱离本实用新型的精神和范围下所作的均等变换和修改,都应涵盖在本实用新型的范围内。
- 还没有人留言评论。精彩留言会获得点赞!