分子分离装置的制作方法
本申请要求于2012年3月21日提交的第61/613578号美国临时申请的优先权,其通过引用并入本文。
技术领域
本发明使用穿孔的且选择性带电的膜来分离带电粒种。特别地,本发明利用带电的膜通过分子质量、分子大小和分子共振模式动态从溶液中分离生物活性蛋白。具体地,本发明利用带电的膜来分离混合物(如离子、聚合物悬浮液和生物活性蛋白),这些混合物目前很难从溶液中以有效的产率移除,并且需要使用大量的能量。
背景技术:
目前,生物活性蛋白质的隔离和回收是非常困难的。目前的解决方案依赖于能量密集型方法,如蒸发/扩散、电泳和多孔管粘附。这些方法用于从溶液中移除不期望的离子或混合物。该方法的一个示例为反渗透。在某些情况下,不存在移除不期望的离子或混合物的方法。
由于产量低、需要劳动密集型操作以及成本,目前用于回收生物活性蛋白质以治疗自身免疫缺乏、艾滋病(AIDS)、血友病狼疮等的系统是不充分的。这些20-50纳米长、50000道尔顿的蛋白质的具体示例为干扰素、胰岛素和凝血因子VIII。目前的方法如多孔管粘附使用超过滤进行分离,然后手动地获取蛋白质。遗憾的是,管的厚度妨碍溶剂血浆的流动并破坏蛋白质的完整性,从而导致该方法的低产率。
大多数生物活性蛋白质的末端是离子带电的。蛋白质是可适度溶于水的并且在该情况下保持极性。许多治疗疾病的蛋白质从活体组织获取或者大量存在于体外溶液中。这包括低动物血浆的悬浮液,包括但不限于干扰素(人类和选定的人科动物)、胰岛素(牛科动物和合成的人科动物)以及用于血友病的级联凝血因子VIII。目前的方法依赖于毛细管作用以使期望的蛋白质在特定的位置“停止”并唤起随后的动作(如漂洗和/或扩散),从而逐渐地回收所关注的分离蛋白质。所产生的蛋白质脱除经常使蛋白质损伤或变性。漂洗必须将蛋白质从其上拥有蛋白质的、数千纳米深的孔隙表面“撕离”。典型的渗透(采集器的输出)必须被进一步离心以递送医药级的试剂。目前的隔离膜和多孔管被认为是相当厚的,因此它们的厚度比的流动效率较低。
因此在该领域中需要更薄但仍允许有效地收集蛋白质的隔离膜。此外,在该领域中需要在收集和脱除期间不损坏蛋白质的分离蛋白质的装置。
技术实现要素:
根据以上所述,本发明的第一方面是提供分子分离装置。
本发明的另一方面是提供分子分离装置的第一实施方式,其包括:室,具有入口和出口,其中水悬浮液流经该室;多孔分离膜,与水悬浮液的流动基本正交地放置在室中;以及充电装置,连接到该分离膜以施加周期性电荷从而收集由多孔分离膜阻止的成分。
本发明的用于上述实施方式的另一方面提供控制水悬浮液通过室的流动的泵。
本发明的用于上述实施方式的又一方面是提供连接到泵和充电装置的控制器,其中该控制器使水悬浮液通过室的流动和向多孔分离膜施加周期性电荷同步。
本发明的用于上述实施方式的再一方面是提供设置在多孔分离膜的外围上的至少一个收集井以收集由多孔分离膜阻止的成分。
本发明的用于上述实施方式的再一方面是提供与每个收集井相关的导管以将所收集的成分传输至保持容器。
本发明的第一实施方式的一个方面是提供为多孔石墨烯的多孔分离膜。
本发明的第一实施方式的另一方面是提供使期望的分子发生迁移的周期性电荷以便这种迁移被调整为期望成分的不对称标准模式,从而使期望的分子朝着用于分离的分离膜的外围进行直线运动。
本发明的第一实施方式的又一方面是通过控制从膜内径向膜外径散发的驻波来提供使期望的分子发生迁移的周期性电荷,从而使期望的分子朝着用于分离的分离膜的外围进行直线运动。
本发明的另一方面是提供用于从水溶液分离分子成分的方法,其包括将多孔分离膜放置在室中,使水溶液流动到分离膜上,以及向分离膜施加电荷以将由分离膜阻止的水溶液的成分迁移至分离膜的外围。
本发明的用于上述实施方式的又一方面是利用泵控制水溶液的流动,以及利用充电装置控制电荷的施加。
本发明的用于上述实施方式的再一方面是同时控制电荷的流动和施加以移动水溶液中被阻止的成分;或者以被阻止成分的经调整的不对称标准模式来周期性地施加电荷,从而使被阻止的成分朝着分离膜的外围进行直线运动;或者周期性地施加电荷以使被阻止的成分在驻波中进行迁移,从而使这些被阻止的成分朝着用于分离的膜的外围进行直线运动,其中驻波从膜内径散发至膜外径。
在替代的实施方式中,上述实施方式可将迁移成分收集在设置在分离膜的外围上的至少一个收集井中,或者利用穿孔的石墨烯作为多孔分离膜。
附图说明
参考以下描述、所附权利要求以及附图,本发明的这些及其他特征和优点将被更好地理解,在附图中:
图1是根据本发明构思的分子分离装置的示意图;
图2是保持根据本发明构思的分离膜的室的示意图;
图3是由根据本发明构思的分离膜收集的蛋白质的示意表示;以及
图4示出了在操作根据本发明构思的装置的过程中,蛋白质的“行走”或带电迁移。
具体实施方式
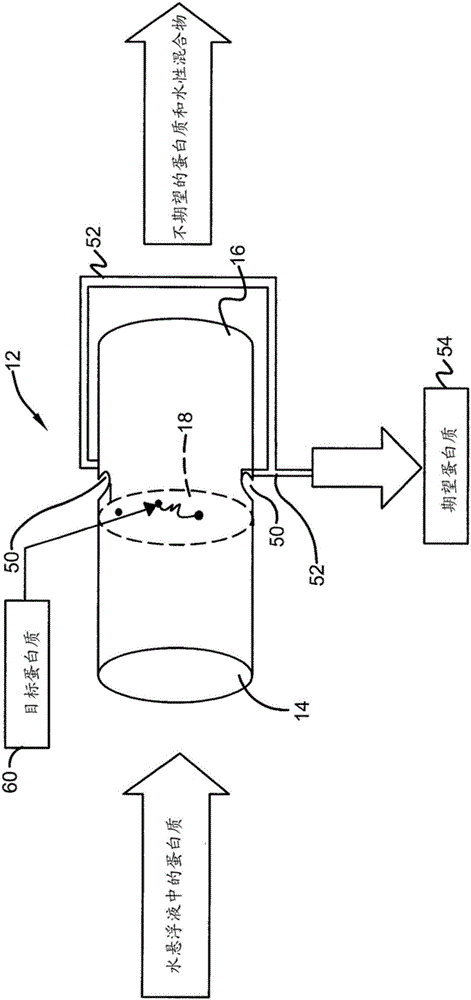
现在参照图1,可以看到根据本发明构思的分子分离装置大体上由数字10表示。装置10包括一端具有用于接收水悬浮液的入口14的室12,其中,水悬浮液包括将被移除的材料或成分。在本实施方式中,蛋白质将从悬浮液中分离。室12还设置有与入口相对的出口16,在其中副产物或“未过滤的”产物从室中排出或流出。
分离膜18由室12保持以与水悬浮液的流动正交。在本实施方式中,分离膜为多孔材料,如碳膜。在另一实施方式中,使用石墨烯膜,以及在其他实施方式中可使用多层石墨烯材料。
在本实施方式中,分离膜18是如通过引用并入本文的第8,361,321号美国专利中所描述的石墨烯膜。石墨烯膜是单原子层厚的碳原子层,碳原子结合在一起以限定片。可被称作层或片的单个石墨烯膜的厚度约为0.2至0.3纳米(nm)。在一些实施方式中,可形成多个石墨烯层,从而具有更大的厚度并相应地具有更大的强度。当膜产生或形成,并且通常被称为少层石墨烯时,多个石墨烯片可设置在多个层中。或者可通过在另一石墨烯层之上层叠或放置一个石墨烯层来实现多个石墨烯片。对于本文所公开的所有实施方式,可使用单层石墨烯或多个石墨烯层。测试表明,可能作为自我粘附的结果,多层的石墨烯保持层的完整性和功能。这提高了膜的强度并且在一些情况下改善了流动特征。相对于聚酰胺或其他聚合物材料的过滤材料,穿孔的石墨烯高通量吞吐率材料提供了显著提高的过滤性能。石墨烯层的碳原子限定由六个碳原子构成的六角环形结构(苯环)的重复型式,这形成碳原子的蜂窝晶格。间隙孔由片中的每六个碳原子环结构形成,并且此间隙孔的跨度小于1纳米。事实上,本领域技术人员将会理解,间隙孔被认为在其最长尺寸处具有约0.23纳米的跨度。因此,除非具有穿孔,否则间隙孔的尺寸和配置以及石墨烯的电子性质阻止任何分子跨过石墨烯厚度的运输。间隙孔的尺寸太小而难以允许水或离子通过。
为了形成穿孔的石墨烯膜,制成一个或多个穿孔。典型的大体上或名义上为圆形的孔或穿孔19通过石墨烯膜18限定。孔19的大体圆形的形状受以下事实的影响,即孔的边缘部分地由石墨烯膜18的六边形碳环结构限定。孔尺寸可根据所接收的水悬浮液的组分和该悬浮液中期望被阻塞或过滤的成分或组分来选择。因此,在一些实施方式中,孔19的尺寸可在0.5nm至1.2nm的范围内变化,或者在其他实施方式中,在1.0nm至10nm的范围内变化。并且在其他实施方式中,孔的尺寸可在10nm至100nm的范围内变化。在一些实施方式中,一些孔的直径可约为20nm;并且在其他实施方式中,一些孔的直径可约为50nm。
石墨烯膜中的孔可通过选择性氧化制成,选择性氧化意味着在氧化剂下暴露选定的时间段。相信孔312还可通过激光钻孔制成。如在出版物Nano Lett.2008年第8卷第7期的1965-1970页中所描述的,最直接的穿孔策略是在高温下用氩中的稀释氧气来处理石墨烯膜。如其中所描述的,通过在1个大气压(atm)的氩中使用350毫托(mTorr)的氧气,在500℃的温度下、在石墨烯中将20nm至180nm范围内的通孔或孔洞蚀刻2个小时。该论文合理地建议孔洞的数量与石墨烯片中的缺损相关,并且孔洞的大小与停留时间相关。这被认为是在石墨烯结构中制造期望的穿孔的优选方法。该结构可以是石墨烯纳米片和石墨烯纳米带。因此,期望范围中的孔可通过较短的氧化时间形成。Kim等在“Fabrication and Characterization of Large Area,Semiconducting Nanoperforated Graphene Materials(大范围、半导化的纳米穿孔的石墨烯材料的制备与表征)”(Nano Letters 2010,第10卷,第4期,2010年3月1日,1125-1131页)中所描述的另一更相关的方法利用自组装聚合物,该自组装聚合物使用反应离子刻蚀来制造适于形成图案的掩模。AP(S-blockMMA)块状共聚物形成PMMA柱的阵列,PMMA柱的阵列在重建时形成用于RIE的通孔。孔洞的格局非常密集。孔洞的数量和尺寸由PMMA块的分子重量和P(S-MMA)中PMMA重量百分率控制。任一种方法都有可能产生穿孔的石墨烯片。也可采用形成孔的其他方法。在本文所公开的实施方式中,将要理解的是孔的尺寸被确定为阻止悬浮液的选定成分并允许其他成分通过。此外,可修改孔的边缘以帮助阻止或通过选定的成分。
大体由数字20标示的充电装置连接至分离膜18,以便在水悬浮液流经该材料时向该材料选择性地施加电荷。随着描述的进行将描述该过程的细节。
泵24可联接至入口14以便控制水悬浮液通过室12的流动。
充电装置20包括大体由数字28标示的控制器。本领域技术人员将会理解,控制器28包括必要的硬件、软件、存储器和功能性以控制泵24和分离膜18的运作,从而以将要描述的方式操作该装置。连接到控制器28的是输入/输出装置30(如键盘)以允许技术人员操作该装置10。这可通过以下方式来完成:控制泵的运作从而控制悬浮液流过室的数量,和/或控制充电装置的运作从而控制施加于分离膜18的电压和/或电流的数量。通常,控制器28通过数字/模拟转换器32发送适当的控制信号,其产生施加于驱动电路34的电荷梯度。驱动电路34产生沿着驱动引线36A和36B向分离膜18上的位置递送的信号。通地连接40被设置为当回线42也连接到分离膜时,将分离膜连接至地面以在操作期间提供监控分离膜的状态的方法。特别地,回线42连接至模拟/数字转换器44,其中模拟/数字转换器44将数字信号传回至控制器28以供技术人员进行观察。
如图2中最好地示出的,室12正交地保持分离膜18以使(分离膜18)充分地暴露于流过该室的悬浮液。本领域技术人员将会理解,膜18由保持在室12内的适当的壁架、脊或任何其他支撑结构支持或支撑。具有比孔19大很多的开口的聚合物支撑层也可放置在该膜的下面。微俘获井50被定位为围绕分离膜的外圆周,其允许收集由该分离膜阻止或收集的蛋白质。这些井50被联接至俘获导管52,其中,俘获导管52将期望的蛋白质材料递送至收集容器54。剩余的未俘获的材料从出口16离开。
在操作中,分离膜是无菌的、疏水的、选择性穿孔的并且承受电荷的材料。穿孔或孔19的尺寸的选择根据下述最著名的实践来进行:在对期望类别的目标蛋白质进行期望的分离(俘获)的同时,对不需要的材料进行尺寸的排除(即通过)。本领域技术人员将会理解,水悬浮液被初步离心分离或预过滤以移除最大的和无效的蛋白质死骨,即不期望的和可能堵塞膜的混合物或成分。如前所述,分离膜被放置为与水悬浮液的大部分混合流正交。在一些实施方式中,悬浮液可以是包括所关注的期望蛋白质的溶剂化的血浆。因此,悬浮液流过分离膜,并且允许不需要的较小的辅助蛋白质与目标蛋白质类一同进行输送从而被获取。这将引起目标蛋白质和不需要的蛋白质通过对流压力而相对分离膜分布。在一些实施方式中,悬浮液可为直接切向地沿着膜18的表面。悬浮液中小于孔19的那些成分流过该膜并且相应地被处理。
本发明利用通常用于静态恒定电位(电压)电泳分离法的、生物活性蛋白的电子机械激励响应。在本实施方式中,驱动电路34激励分离膜18并随着时间推移生成周期性的电荷以逐渐地迁移所关注的、特定的单个蛋白质(表示为蛋白质60),如图3中示意性表示的,蛋白质60通过分离膜保持至膜的外圆周。事实上,在选择性时间对引线36A、36B施加选定的电荷允许产生蛋白质的“行走”运动。例如,电荷可被间歇地施加于每根引线以引发蛋白质的行走动作。因此,通过一起使用特定电荷对反对称蛋白质时间激励的模式和由泵24产生的同步对流压力(这允许在每个时间步骤对带电蛋白质进行法向力俘获),所关注的、选定的蛋白质被驱动至分离膜的外圆周。换句话说,电荷的施加引起蛋白质的一端朝着膜的外围向外延伸。电荷的去除引起在施加电荷期间蛋白质不移动的端部朝向(在施加电荷期间)蛋白质移动的端部迁移。周期性电荷的施加被认为适于管状或线状的蛋白质。
在本实施方式的另一方面,上述电荷本身可通过驱动电路34在驻波波型中产生,通过适当控制电荷定相可使驻波波型产生净向外运动。因此,当蛋白质16朝向膜18的外围向外移动时,其有效地被波运载。驻波的应用被认为适于球面或球状形状的蛋白质。一旦蛋白质被驱动至外圆周,由于受到微弱的重力和范德华力的驱动,其随即流入U形俘获井50中,从而俘获并集中选定的蛋白质。
控制器28与驱动电路34共同设置为用于在空间和时间中有效地产生使这些特定的蛋白质穿过分离膜迁移至俘获井50所需要的期望电荷。然后材料通过导管从该井迁移至适当的保持容器54中。换句话说,使期望的分子或蛋白质60发生迁移的周期性电荷被调整为期望成分的不对称标准模式,从而使它们(期望的分子或蛋白质60)朝着用于分离的分离膜外围进行直线运动。或者,在替代的实施方式中,使期望的分子或蛋白质60发生迁移的周期性电荷由从膜的内径向膜的外径散发的驻波控制,并且从而使它们(期望的分子或蛋白质60)朝着用于分离的分离膜的外围进行直线运动。
在一些实施方式中,分离膜为具有选定的孔洞直径和间隔的单原子碳石墨烯膜。通过向膜施加连续的时间电荷,期望获取的分子和/或蛋白质的非常特定的和选择性的推动力沿着分离膜表面产生,以便期望获取的分子和/或蛋白质向在外圆周处的等待俘获盆迁移。如图4中示意性示出的,蛋白质60大于孔19的一端朝着膜的外围延伸。蛋白质由产生二次谐波模式的交变电荷驱动,该二次谐波模式引起蛋白质形状的暂时的物理变化。最后,蛋白质的另一端从膜的表面几乎没有损坏或者毫无损坏地分离并朝着蛋白质的第一端运动。重复该过程直到蛋白质被俘获在井50中。这在图4中由时间序列A至E表示,其中A表示开始施加电荷以及E表示当蛋白质到达膜的外围时最后去除电荷。
通过控制孔洞直径和电荷对时间曲线,装置10获得通过现有技术的装置不可获得的精确的选择性、纯度和吞吐率。该装置的应用包括但不局限于药理学、烃悬浮液精炼以及生物医学。药理学应用允许从大量的水中提取高价值的蛋白质。烃悬浮液精炼允许用基于烃链尺寸的、使用微精炼方式的分级过滤器代替热/能量密集的蒸馏过程。生物医学处理允许在透析过滤器中使用装置10以从血流中过滤杂质。
通过将材料厚度缩小至如在石墨烯分离膜中的一个原子,流动阻力和表面磨擦力与现有技术的膜相比有了显著地减小,从而降低了所需要的泵压力和能量。该属性与支持时间依赖性电荷的、膜的独特高导电性一起允许高效率、高选择性、高活性保持/获取的膜系统。此外,利用较低的表面摩擦力与高导电性的结合,可从石墨烯膜材料中迅速地移除较大的不需要的混合物,从而显著地减少了对过滤成分的污染。
本领域技术人员将会理解,公开的装置提供用于制造生物材料过滤和分离的膜,该膜允许根据需要来对选定的和指定的生物活性蛋白进行唯一的、可预测的并且有效的迁移以进行分离。该装置也能够控制所需要的目标分子的、精确的分子性质和电活性性质。此外还相信,与现有装置相比,所公开的装置可显著地提高速率和数量效率。
因此,可看到已通过上述结构及其使用方法实现了本发明的目的。虽然根据专利法规,仅示出和描述了最佳方式和优选实施方式,但是应理解,本发明并不限于此,或由此限制。因此,应参考权利要求来认识本发明的真正范围和宽度。
- 还没有人留言评论。精彩留言会获得点赞!