含有水溶性聚合物缀合的纳米材料的猝灭剂和其用途的制作方法
本发明涉及含有水溶性聚合物缀合的纳米材料(water-soluble polymer-conjugated nanomaterial)的猝灭剂和其用途。
背景技术:
用于检测特定的核酸(DNA或RNA)或蛋白质的方法是科学研究的领域中的关键技术。由于可检测特定的核酸或蛋白质,研究者可以确定何种遗传或生物标记物是指示人类的健康状况的标记物。根据用于检测核酸或蛋白质的这类方法,可发现存在于样品中的致病基因的修饰或存在于样品中的特定基因的表达。
然而,例如氧化石墨烯(graphene oxide)等的具有填充有二维晶格的平面结构的有机或无机聚合物及其衍生物可转移电子。这种电子转移是由例如聚合物的晶体和晶格结构等的物理性质引起的。特别地,有机荧光染料的荧光信号可通过荧光共振能量转移(FRET)淬灭。
因此,可使用例如氧化石墨烯等的材料的物理性质观察荧光染料缀合的核酸聚合物的荧光信号的变化,因此可检测生物材料例如核酸或蛋白质(韩国专利公开号10-1496671)。此外,开发了用于使用这类材料检测基于荧光分析的酶的活性的方法(韩国专利公开号10-1554173)。最近,使用这类材料的技术已用于观察存在于样品中的病原体的基因或蛋白质,因此在对疾病和病患的初始研究中已变得重要。
然而,虽然使用氧化石墨烯的这类检测方法是简单的,其可由样品中包含的靶材料的量的大幅地影响,并且由于用于检测的核酸聚合物的尺寸分布不均匀,误差范围广。此外,在用于体外诊断的体外环境中,聚合物是不稳定的,因此再现性降低。
技术实现要素:
发明要解决的问题
本发明的目的是提供含有水溶性聚合物缀合的纳米材料的猝灭剂、和包含猝灭剂和荧光材料缀合的探针的组合物。此外,本发明的另一目的是提供用于使用组合物提供疾病的诊断需要的信息的方法。
用于解决问题的方案
为了实现所述目的,本发明提供含有水溶性聚合物缀合的纳米材料的猝灭剂。
此外,本发明提供包含猝灭剂和荧光材料缀合的探针的组合物。
此外,本发明提供用于提供疾病的诊断需要的信息的方法,所述方法包括:通过将组合物与分离的样品混合来制备混合物;测量组合物的荧光水平;和将所得的水平与正常对照样品的荧光水平比较。
此外,本发明提供包含猝灭剂和荧光材料缀合的探针的试剂盒。
发明的效果
含有本发明的水溶性聚合物缀合的纳米材料的猝灭剂有效地猝灭从荧光材料缀合的探针发射的荧光。此外,水溶性聚合物缀合的纳米材料与荧光材料缀合的探针稳定地结合。另外,在靶材料的存在下,由于探针结合靶材料,探针可从水溶性聚合物缀合的纳米材料容易地释放,因此可有效地检测靶材料。因此,包含猝灭剂和荧光材料缀合的探针的组合物还可检测以低浓度存在的靶材料。由于该原因,组合物可有效地用作用于提供生物材料的检测或疾病的诊断需要的信息的组合物或试剂盒。
附图说明
图1是示出用于制备水溶性聚合物缀合的纳米材料的方法和使用由其制备的材料的用于检测生物材料的方法的示意图。
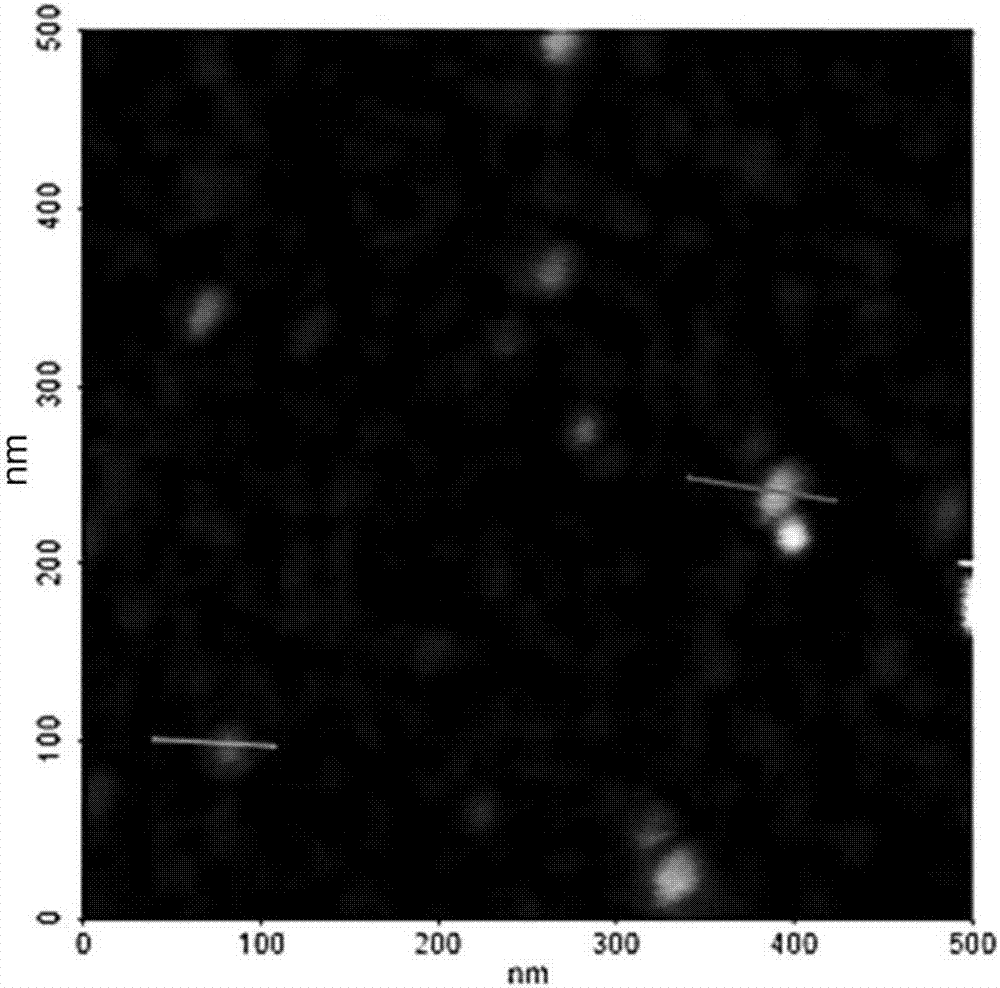
图2是在实施例中制备的氧化石墨烯纳米胶体(GON)的原子力显微镜(AFM)图像。
图3包括在实施例中制备的二维纳米材料、二氧化锰的扫描透射电子显微镜(STEM;a)和AFM(b)图像。
图4是在实施例中制备的纳米氧化石墨烯(NGO)的AFM图像。
图5包括用右旋糖酐(dextran)(DReGON)表面改性的GON的AFM图像(a)和表示拉曼光谱的图(b)。
图6是用聚乙二醇表面改性的NGO(PEG-NGO;a)、或用PEG和聚乙烯亚胺(PEI)表面改性的GON(PEG-PEI-GON;b)的AFM图像。
图7表示从DReGON和作为探针的PNA-US5-2(a)或PNA-DENV(b)的混合物发射的荧光信号、用于确认是否形成检测组合物的图。
图8是表示从PEG-NGO和作为探针的PNA-Sa(a)或PNA-Pa(b)的混合物发射的荧光信号、用于确认是否形成检测组合物的图。
图9是表示从PEG-PEI-GON和作为探针的PNA-TS的混合物发射的荧光信号、用于确认是否形成检测组合物的图。
图10包括用于将GON(a)的荧光稳定性与DReGON(b)比较的图。
图11是用于确认DReGON和GON的靶材料检测能力的图。
图12是用于确认当将miR-21(a)或miR-223(b)作为靶材料以各种浓度加入时PEG-NGO的检测能力的图。
图13是用于确认当将miR-TS作为靶材料以各种浓度加入时PEG-PEI-GON的检测能力的图。
图14包括用于确认当未将探针加入各种癌细胞系时未检测到荧光信号的图像。
图15包括用于确认与作为探针的PNA484或PNA31混合的DReGON在各种癌细胞系中的癌细胞检测能力的图像。
图16包括用于确认与作为探针的PNA21、PNA223、Let-7a或其混合物(混杂(scrambled))混合的DReGON的血细胞检测能力的图。
图17是在各种浓度的特异性地结合绿脓杆菌(Pseudomonas aeruginosa)(a)或金黄色葡萄球菌(Staphylococcus aureus)(b)的荧光标记的核酸序列与PEG-NGO混合、和与绿脓杆菌或金黄色葡萄球菌混合后示出的荧光水平的图。
图18是在特异性地结合人类巨细胞病毒(a)或登革病毒(b)的核酸序列与DReGON结合、和与人类巨细胞病毒或登革病毒混合后示出的荧光水平的图。
具体实施方式
以下,将详细描述本发明。
一方面,本发明提供含有水溶性聚合物缀合的纳米材料的猝灭剂。
本文使用的术语“水溶性聚合物”指的是可溶于水或在水中分散为细颗粒的树脂或聚合物。水溶性聚合物可为天然聚合物、半合成聚合物或合成聚合物。可用于本发明的水溶性聚合物可具有1至20kDa、5至15kDa或8至12kDa的分子量。在一个实施方案中,水溶性聚合物的分子量可为10kDa。
水溶性聚合物可选自由以下组成的组:壳聚糖和其衍生物、壳聚糖盐、右旋糖酐和其衍生物、透明质酸和其衍生物、透明质酸盐(hyaluronate)、果胶和其衍生物、果胶盐、藻酸盐和其衍生物、藻酸、琼脂、半乳甘露聚糖和其衍生物、半乳甘露聚糖盐、黄原胶和其衍生物、黄原胶盐、β-环糊精和其衍生物、β-环糊精盐、聚乙二醇(PEG)、聚乙烯亚胺(PEI),和其组合。在一个实施方案中,水溶性聚合物可选自由右旋糖酐、聚乙二醇、聚乙烯亚胺、和其组合组成的组。
本文使用的术语“纳米材料”指的是纳米级材料。由于较小的尺寸,纳米材料可容易地通过细胞膜。纳米材料可为片材或颗粒形状。片材可由单层或多层组成。此外,片材构型可包括平面或曲面,并且可以以各种形式存在。在一个实施方案中,纳米材料可为二维单层片材型纳米材料。此外,颗粒形状可包括各种形式例如球、椭圆、棒(rod)、和多边形。
纳米材料的粒径可为约10至500、10至200、10至150、10至100、10至50、20至200、20至150、20至100、20至50、30至200、30至150、30至100、30至50、50至200、50至150、50至100、50至80、60至200、60至100、60至80、80至200、80至150、80至100、90至200、90至150、或90至100nm,但本发明不限于此。在本发明的一个实施方案中,纳米材料的粒径优选50至80、90至200、90至150或80至100nm。在此,粒径是使用动态光散射测量的实验值的平均值、或者AFM或STEM图像中示出的尺寸,指的是在纳米材料为球形或圆形的假设下得到的值。
将纳米材料制备为碳纳米材料或二氧化锰。在此,碳纳米材料可选自由以下组成的组:NGO和其衍生物、还原的氧化石墨烯和其衍生物、GON,和其组合。在一个实施方案中,纳米材料可为NGO、GON或二氧化锰。
本文使用的术语“猝灭剂”指的是吸收通过吸收光或波长来发射荧光的材料的荧光能量的材料。由于荧光材料和纳米材料之间的相互作用,发生淬灭效应。当荧光材料位于纳米材料的例如约10nm以下等的较短的距离处时,通常发生淬灭效应。在此,荧光材料作为能量供体,并且纳米材料作为能量受体。
可通过由水溶性聚合物改性纳米材料的表面来制备猝灭剂。在此,水溶性聚合物和纳米材料可通过化学键或物理键缀合。化学键可为酰胺键、酯键或醚键,但本发明不限于此。此外,化学键可通过交联剂获得。在一个实施方案中,水溶性聚合物和纳米材料可通过EDC偶联缀合。此外,物理键可为静电吸引、氢键、或范德瓦尔斯键,但本发明不限于此。此外,用水溶性聚合物表面改性的这类纳米材料可在分散性、稳定性和生物相容性上改善。
此外,另一方面,本发明提供包含猝灭剂和荧光材料缀合的探针的组合物。
本文使用的术语“探针”指的是可以特异性地结合靶材料的材料。探针可为选自由抗体、核酸、肽、蛋白质、和其组合组成的组的任一种。此外,可使用已知为具有对靶材料的高亲和性的材料的任何材料。在一个实施方案中,抗体可特异性地结合靶蛋白的表位从而检测靶材料。此外,当核酸具有靶材料的核酸序列的互补序列时,核酸可结合靶碱基序列从而检测靶材料。此外,肽可特异性地结合细胞表面上表达的受体或配体从而检测靶材料。
核酸可为选自由以下组成的组的任一种:DNA、RNA、mRNA、miRNA、非编码RNA、双螺旋RNA、双螺旋DNA、基于DNA的酶(DNA-based enzyme)、脱氧核酶(deoxyribozyme)、适体、肽核酸(PNA)、锁核酸(locked nucleic acid,LNA),和其组合。
在此,虽然核酸可由10至50、10至30、12至28、15至25、或18至22个碱基组成,如果核酸可以互补结合靶核酸序列,不存在碱基的数量的限制。在一个实施方案中,核酸可由15至22个碱基组成。在本发明的一个实施方案中,核酸可为选自由SEQ ID NOs:1至20组成的组的任一种。
荧光材料结合根据本发明的探针。荧光材料通过由水溶性聚合物缀合的纳米材料吸收荧光能量来以猝灭的状态存在,并且当探针由于特异性结合靶材料而从纳米材料释放时,发射荧光。荧光材料可结合探针的一端或中间。当探针为核酸时,荧光材料可位于核酸的5’或3’位置处或核酸中。当探针为肽时,荧光材料可结合肽的N-末端或C-末端或者肽中。荧光材料可直接地或通过交联剂结合探针。
荧光材料可选自由以下组成的组:荧光素、氯三嗪基荧光素(fluorescein chlorotriazinyl)、罗丹明绿(rhodamine green)、罗丹明红、四甲基罗丹明、异硫氰酸荧光素(FITC)、俄勒冈绿(Oregon green)、Alexa Fluor染料、羧基荧光素(FAM)、6-羧基-4’,5’-二氯-2’,7’-二甲氧基荧光素(JOE)、羧基-X-罗丹明(ROX)、6-羧基-2',4,4',5',7,7'-六氯荧光素(HEX)、德克萨斯红(Texas red)(磺基罗丹明101酰氯)、6-羧基-2',4,7',7-四氯荧光素(TET)、四甲基罗丹明-异硫氰酸酯(TRITC)、羧基四甲基罗丹明(TAMRA)、花青系染料、硫代二羰花青染料(thiodicarbocyanine dye),和其组合。花青系染料可选自由Cy3、Cy5、Cy5.5、Cy7、和其组合组成的组。
猝灭剂可检测一种或多种靶标。为了检测一种或多种靶标,纳米材料可包括两种以上不同的探针。在此,各探针可包含不同的荧光材料。在此,各探针可结合不同的靶材料从而检测不同的靶材料。
此外,组合物可用于提供生物材料的检测或疾病的诊断需要的信息。疾病可为癌症、传染病、炎性疾病、或遗传病,并且在一个实施方案中,疾病可优选为癌症或炎性疾病。
癌症可选自由以下组成的组:乳腺癌、肺癌、肝癌、胰腺癌、胃癌、结直肠癌、骨癌、皮肤癌、脑肿瘤、肉瘤、眼癌、骨髓癌、血癌,和其组合。同时,传染病可由选自由细菌、真菌、病毒、寄生虫、和其组合组成的组的任一种的感染引起。在此,细菌可为肠细菌或肠道球菌。细菌的实例包括绿脓杆菌、金黄色葡萄球菌和鲍氏不动杆菌(Acinetobacter baumannii)。在本发明的一个实施方案中,细菌优选为绿脓杆菌或金黄色葡萄球菌。
病毒的实例可包括双链DNA病毒、单链DNA病毒、双链RNA病毒、正义单链RNA病毒、负义单链RNA病毒(negative-sense single-stranded RNA virus)、单链RNA反转录病毒和双链DNA反转录病毒。在本发明的一个实施方案中,病毒可选自由巨细胞病毒、登革病毒、和其组合组成的组。
在另一方面中,本发明提供用于提供疾病的诊断需要的信息的方法,所述方法包括:将包含猝灭剂和荧光材料缀合的探针的组合物与分离的样品混合;测量混合物的荧光水平;和将所得的水平与正常对照样品的荧光水平比较。
包含在组合物中的猝灭剂和荧光材料缀合的探针如上所述。此外,样品可为从诊断靶标分离和排出的样品,并且可为细胞、细胞培养基、组织、唾液、尿液、粪便、精液、血液、血浆或血清。此外,正常对照样品指的是从没有疾病的正常人分离和排出的样品。
根据本发明的方法可用于检测生物材料例如核酸或蛋白质、或诊断如上所述的疾病。在此,可通过测量在通过由纳米材料猝灭的荧光材料与靶材料特异性地接触或结合来释放时发射的光来测定荧光。为了测量荧光水平,可使用流式细胞术、荧光激活细胞分选术(FACS)、或用于分析荧光信号或图像的方法。
在又一方面中,本发明提供包含猝灭剂和荧光材料缀合的探针的试剂盒。包含在组合物中的猝灭剂和荧光材料缀合的探针如上所述。试剂盒可用于检测生物材料例如核酸或蛋白质、或诊断如上所述的疾病。
以下,将参考以下实施例充分地描述本发明。然而,仅提供以下实施例从而例示本发明,并且本发明不由实施例限制。
I.二维纳米材料的制备
实施例1.氧化石墨烯纳米胶体(GON)的制备
将4g的K2S2O8和4g的P4O10加入50ml的H2SO4并且在搅拌的同时溶解。将2g的石墨纳米纤维加入所得的溶液,并且在90℃下加热16小时。将加热的混合物冷却至室温,向其中加入250ml的蒸馏水,然后用纸滤器过滤(Whatman-GE Healthcare,USA)。纯化的混合物用蒸馏水洗涤两次以上,并且在空气中干燥。
将1.5g的干燥的粉末型石墨纳米纤维加入250ml的H2SO4,向其中缓慢地加入10g的KMnO4,并且在搅拌的同时反应。在此,反应温度不超过10℃。反应产物在35℃蒸馏水中预热,从而在搅拌的同时进一步反应6小时。在反应后,加入1,000ml的蒸馏水,并且在此,温度保持在55℃以下。将50ml的H2O2加入混合物从而允许反应,并且将所得的混合物在10,000rpm下离心30分钟,由此得到丸粒(pellet)。得到的丸粒使用离心机用3.4%(w/w)HCl和丙酮洗涤三次以上。
在真空下除去最终得到的褐色上清液中含有的丙酮,并且将蒸馏水加入残留的溶液从而将终浓度调节至1mg/ml,然后涡旋从而完全悬浮。使用10,000Da透析膜纯化并中和收集的产物,并且将终产物冻干从而得到粉末型GON。使用AFM观察得到的GON,并且结果在图2中示出。如图2所示,得到具有100nm以下的尺寸和2nm以下的厚度的GON。
实施例2.二氧化锰(MnO2)的制备
将蒸馏水加入32ml的十二烷基硫酸钠(SDS)和1.6ml的H2SO4的溶液从而将终体积调节至300ml。所得的溶液在95℃下加热15分钟,然后向其中讯速地加入3.2ml的KMnO4溶液。然后,继续加热60分钟,并且得到深褐色的二氧化锰片材。
将三蒸水(triple distilled water)和醇以1:1的体积比加入得到的二氧化锰片材,并且在12,000rpm下离心,由此得到丸粒。此外,在相同的条件下进行两次离心,从而允许得到的产物在三蒸水中重悬,由此得到终产物。由STEM和AFM观察得到的MnO2,并且结果在图3中示出。如图3b所示,得到具有200nm以下的尺寸和2nm以下的厚度的MnO2。
实施例3.纳米氧化石墨烯(NGO)的制备
将0.5g的Na2NO3加入23ml的H2SO4,并且在搅拌的同时溶解。将0.5g的石墨纳米纤维加入反应溶液,然后在搅拌的同时向其中缓慢地加入3g的KMnO4从而允许反应。在此,反应温度不超过10℃。将反应产物在搅拌的同时在35℃蒸馏水中预热从而进一步反应1小时,然后在90℃下进一步反应30分钟。反应后,加入1ml的蒸馏水,并且将温度保持在55℃以下。将3ml的H2O2加入反应产物从而允许反应,冷却至室温,然后向其中加入250ml的蒸馏水。在使用纸滤器过滤所得的溶液后,将由此得到的滤液用蒸馏水洗涤两次以上,并且在空气中干燥。
为了制备氧化石墨烯(GO),将50ml的9M NaOH加入10mg/ml的氧化石墨烯溶液,然后尖端超声破碎(tip-sonication)90分钟。使用3,800Da透析膜纯化并中和氧化石墨烯,并且冻干终产物从而得到粉末型NGO。使用AFM观察得到的NGO,并且结果在图4中示出。如图4所示,得到具有200nm以下的尺寸和1.5nm以下的厚度的NGO。
II.用聚合物表面改性的二维纳米材料的制备
实施例4.用右旋糖酐(DReGON)表面改性的GON的制备
用右旋糖酐改性在实施例1中得到的GON的表面。具体地,50mg的GON悬浮于50ml的蒸馏水中,并且向其中加入0.1%(w/w)右旋糖酐水溶液。混合物进行超声破碎30分钟,然后在95℃下、搅拌的同时与25μl的氨水溶液反应3小时。反应产物用蒸馏水洗涤,通过在10,000rpm下离心30分钟分离,并且冻干,由此得到终产物DReGON。
使用得到的DReGON进行拉曼分析。具体地,将DReGON置于硅晶片(silicon wafer)上,然后将硅晶片装入拉曼光谱仪(LabRAM HR UV/vis/NIR)中,然后通过514nm CW激光的照射来光谱分析。
由AFM观察得到的DReGON的结果在图5a中示出,并且拉曼光谱分析的结果在图5b中示出。如图5a所示,得到具有100nm以下的尺寸和7nm以下的厚度的DReGON。同时,如图5b所示,在1370cm-1和1600cm-1处相应地观察到D和G峰,并且ID/IG比为0.85。
实施例5.用聚乙二醇(PEG)表面改性的NGO的制备
用PEG改性实施例3中得到的NGO的表面。具体地,将5mg的NGO与相同量的PEG(10kDa)混合,然后进行浴超声破碎(bath-sonication)。在加入5mg的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)后,混合物的浴超声破碎进一步进行5分钟。在搅拌6小时后,使用10,000Da透析膜纯化并中和混合物,并且冻干终产物,由此得到用PEG表面改性的粉末型NGO(PEG-NGO)。
由AFM观察得到的PEG-NGO,并且结果在6a中示出。如图6a所示,得到具有200nm以下的尺寸和1nm以下的厚度的PEG-NGO。
实施例6.用聚乙二醇和聚乙烯酰亚胺(PEI)表面改性的GON的制备
用PEG和PEI改性在实施例1中得到的GON的表面。具体地,将20mg的PEG(10kDa)加入10ml的2mg/ml GON溶液,然后进行浴超声破碎5分钟。通过加入20mg的EDC,混合物的浴超声破碎进一步进行5分钟。在向反应产物加入10mg的PEI和EDC各自之后进行浴超声破碎5分钟,然后在室温下搅拌6小时从而允许均匀的反应。然后,使用12,000Da透析膜纯化并中和混合物,并且冻干终产物,由此得到用PEG和PEI表面改性的粉末型GON(PEG-PEI-GON)。
由AFM观察得到的PEG-PEI-GON,并且结果在6b中示出。如图6b所示,得到具有100nm以下的尺寸和10nm以下的厚度的PEG-PEI-GON。
III.用于检测靶材料的用聚合物表面改性的二维纳米材料的组合物的制备的确认
实验实施例1.用于检测靶材料的用聚合物表面改性的二维纳米材料的组合物的制备的确认
实验实施例1-1.用于检测靶材料的DReGON组合物的制备的确认-(1)
为了确认在实施例4中制备的DReGON是否可用作用于检测靶材料的组合物,如下进行实验。具体地,通过要求Panagene(韩国)在5’-端标记Cy5、并且包括其中两个碳原子与Cy5和探针序列之间的一个氧原子结合的两个单元作为连接体来制备用于检测靶材料的肽核酸(PNA)探针。将1μM的PNA探针加入20μl的无核酸酶的水,并且通过在80℃下加热约3分钟来完全地溶解。将20μl的溶解的PNA探针与在实施例4中制备的DReGON混合,并且在室温下反应30分钟。反应后四、八、十二或二十四小时,使用荧光读取器(fluorescence reader)在Ex/Em=647/670nm下测量荧光信号。在此,仅PNA探针用作对照。
作为结果,如果PNA探针的荧光信号为100%,当PNA探针与用聚合物表面改性的二维纳米材料反应时,荧光信号减少至小于5%,因此确认材料形成检测组合物。
实验实施例1-2.用于检测靶材料的DReGON组合物的制备的确认-(2)
为了确认在实施例4中制备的DReGON是否可用作用于检测靶材料的组合物,在如实验实施例1-1中相同的条件下并且以相同的方式进行实验。在此,作为PNA探针,使用表2中列出的PNA-US5-2或PNA-DENV。将10pmol的PNA探针与0、0.2、0.4、0.6、0.8、1.0、1.2、1.4或1.6μg的DReGON的每种混合。作为结果,测量的荧光信号的值在图7中示出。如图7所示,荧光信号的减少取决于加入的PNA探针的浓度,因此确认材料形成检测组合物。
实验实施例1-3.用于检测靶材料的PEG-NGO组合物的制备的确认
为了确认在实施例5中制备的PEG-NGO是否可用作用于检测靶材料的组合物,在如实验实施例1-1中相同的条件下并且以相同的方式进行实验。在此,将10pmol的PNA探针与0、0.1、0.2、0.5或1.0μg的PEG-NGO的每种混合。作为PNA探针,使用Cy5荧光染料与以下表1中列出的PNA-Sa或PNA-Pa结合的一种。作为结果,测量的荧光信号的值在图8中示出。如图8所示,荧光信号的减少取决于加入的PNA探针的浓度,因此确认材料形成检测组合物。
实验实施例1-4.用于检测靶材料的PEG-PEI-GON组合物的制备的确认
为了确认在实施例6中制备的PEG-PEI-GON是否可用作用于检测靶材料的组合物,在如实验实施例1-1中相同的条件下并且以相同的方式进行实验。将10pmol的PNA探针与0、0.1、0.2、0.5或1.0μg的PEG-PEI-NGO的每种混合。作为PNA探针,使用FITC荧光染料与以下表1中列出的PNA-TS结合的一种。作为结果,测量的荧光信号的值在图9中示出。如图9所示,荧光信号的减少取决于加入的PNA探针的浓度,因此确认材料形成检测组合物。
实验实施例2.DReGON颗粒的稳定性的确认
为了确认在实施例4中制备的DReGON颗粒的稳定性,如下进行实验。具体地,将0.1mg/ml的DReGON溶液充分悬浮于含有血清的PBS溶液中,并且在室温下保持0、4、8、12或24小时,然后随时间测量吸光度。作为对照,使用在实施例1中制备的GON。作为结果,如图10所示,DReGON(b)在生理活性环境中、长时间段显示比GON(a)更稳定的吸收光谱,并且这种稳定的分散性保留24小时以上。
IV.用聚合物表面改性的二维纳米材料的靶材料检测能力的确认
实验实施例3.检测癌细胞特异性的核酸序列的能力的确认
实验实施例3-1.DReGON的检测能力的确认
为了测量在实施例4中制备的DReGON的检测极限,如下进行实验。首先,将PNA21和DReGON混合作为探针,并且在如实验实施例1-1中相同的条件下和以相同的方式进行实验。反应后三十分钟,将包含癌细胞特异性序列的靶材料、即miR-21加入反应产物从而具有0、0.001、0.01、0.1、1、10、100或1,000nM的浓度,并且在室温下反应2小时。使用荧光读取器在Ex/Em=647/670nm下测量荧光信号。在实验中使用的PNA探针的序列和靶材料在以下表1和2中列出。
[表1]
[表2]
在图11中示出通过将在加入靶材料之前和之后的荧光的变化代入等式1得到的结果。在此,作为对照,使用实施例1中制备的GON。
[等式1]
*SD:标准偏差,S:校准线的斜率
如图11所示,GON检测高达230pM的靶材料,但DReGON检测高达10pM的靶材料。从结果,确认用根据本发明的聚合物表面改性的二维纳米材料还可在样品中检测以低浓度存在的靶核酸。
实验实施例3-2.PEG-NGO的检测能力的确认
在如实验实施例3-1中相同的条件下并且以相同的方式确认PEG-NGO检测癌细胞特异性的核酸序列的能力。在此,使用在实施例5中制备的10pmol的PEG-NGO、而不是DReGON,并且以0、0.002、0.02、0.2、2、20、200或2,000nM使用作为探针的PNA21和PNA233以及作为靶材料的miR-21和miR-233。此外,在加入靶材料后,进行反应4小时,以20分钟的间隔测量荧光变化,并且结果在图12中示出。如图12所示,随着靶材料的浓度增加,荧光信号变得更强,并且根据探针的浓度和类型,荧光恢复至不同的水平。
实验实施例3-3.PEG-PEI-GON的检测能力的确认
在如实验实施例3-1中相同的条件下并且以相同的方式确认PEG-PEI-NGO检测癌细胞特异性的核酸序列的能力。在此,使用在实施例6中制备的10pmol的PEG-PEI-NGO、而不是DReGON,并且以100、200、300或500nM使用作为探针的PNA-TS和作为靶材料的miR-TS。此外,在加入靶材料后,进行反应4小时,以20分钟的间隔测量荧光变化,并且结果在图13中示出。如图13所示,随着靶材料的浓度增加,荧光信号变得更强,并且根据探针的浓度和类型,荧光恢复至不同的水平。
实验实施例3-4.DReGON在癌细胞系中的检测能力的确认
使用各种类型的癌细胞系确认DReGON检测癌细胞特异性的核酸序列的能力。首先,通过在DMEM或RPMI培养基中培养来制备MCF-7、HeLa和SW620细胞系。然而,作为探针的PNA484或PNA31与DReGON在如实验实施例1-1中相同的条件下并且以相同的方式混合从而允许反应。将制备的细胞接种于12孔板从而具有每孔1×105个细胞的密度,并且在24小时后,将反应产物DReGON、和PNA484或PNA31以80pmol的浓度加入细胞。
14小时后,使用荧光显微镜观察的细胞的荧光信号的图像在图15中示出。在此,作为对照,在不向细胞加入探针下所取的图像在图14中示出。如图15所示,通过荧光材料缀合的探针的荧光信号来识别由DReGON的靶材料的检测。
实验实施例3-5.DReGON在血细胞中的检测能力的确认
为了确认DReGON对存在于血细胞中的特定碱基序列的检测能力,如下进行实验。具体地,通过已知方法从10ml的健康人类血液收集血细胞,并且在RPMI培养基中培养。固定培养的细胞,并且加入200nM的结合3.0μg的DReGON和Cy5荧光染料的PNA探针。在此,作为PNA探针,使用PNA21、PNA223、Let-7a或其混合物(混杂)。作为对照,使用未处理的细胞组。
4小时后,通过流式细胞术检测的血细胞中恢复的荧光强度在图16中示出。如图16所示,确认通过PNA探针检测到血细胞中表达的靶碱基序列。
实验实施例4.PEG-NGO检测细菌特异性核酸序列的能力的确认
在如实验实施例3-1中相同的条件下并且以相同的方式确认PEG-NGO检测绿脓杆菌或金黄色葡萄球菌特异性的核酸序列的能力。在此,加入在实施例5中制备的0.2μg的PEG-NGO、而不是DReGON,以及10pmol的PNA-Pa或PNA-Sa,然后向其中加入0、10、20、40、70或100nM的绿脓杆菌或金黄色葡萄球菌AS-DNA作为靶材料。作为结果,测量的荧光变化在图17中示出。如图17所示,荧光强度根据加入的绿脓杆菌或金黄色葡萄球菌AS-DNA的浓度增加。
实验实施例5.DReGON检测病毒特异性核酸序列的能力的确认
在如实验实施例3-1中相同的条件下并且以相同的方式确认DReGON检测人类巨细胞病毒(HCMV)或登革病毒(DENV)特异性的核酸序列的能力。在此,加入0.5μg的DReGON、和20pmol的PNA-US5-2或PNA-DENV,并且向其中加入20pmol的miR-US5-2或miR-DENV作为靶材料。作为结果,在反应时间内测量的荧光变化在图18中示出。如图18所示,根据反应时间加入的HCMV或DENV特异性的核酸序列的荧光强度增加。
因此,从结果可证明,与微阵列或RT-PCR不同,本发明的组合物可容易地检测靶序列,并且可用于间接地确认靶序列的浓度。
序列表自由文本
SEQ ID NO:1:tcaacatcag tctgataagc ta
SEQ ID NO:2:agctatgcca gcatcttgcc t
SEQ ID NO:3:atttgacaaa ctgac
SEQ ID NO:4:ggaggggact gagcctg
SEQ ID NO:5:aactatacaa cctactacct ca
SEQ ID NO:6:ctgccccaaa atgcct
SEQ ID NO:7:gcggcatggc tggatc
SEQ ID NO:8:acagagtttt acgatc
SEQ ID NO:9:agacatcgtc acacctatca ta
SEQ ID NO:10:gcgtttcagc atattga
SEQ ID NO:11:uagcuuauca gacugauguu ga
SEQ ID NO:12:aggcaagaug cuggcauagc u
SEQ ID NO:13:gucaguuugu caaau
SEQ ID NO:14:caggcucagu ccccucc
SEQ ID NO:15:ugagguagua gguuguauag uu
SEQ ID NO:16:aggcauuuug gggcag
SEQ ID NO:17:gauccagcca ugccgc
SEQ ID NO:18:gaucguaaaa cucugu
SEQ ID NO:19:uaugauaggu gugacgaugu cu
SEQ ID NO:20:ucaauaugcu gaaacgc
序列表
<110> 雷莫内克斯生物制药有限公司(Lemonex Inc.)
<120> 含有水溶性聚合物缀合的纳米材料的猝灭剂和其用途
<130> PCB603020LMN
<150> KR 10-2015-0139174
<151> 2015-10-02
<160> 20
<170> SIPOSequenceListing 1.0
<210> 1
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA21
<400> 1
tcaacatcag tctgataagc ta 22
<210> 2
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA31
<400> 2
agctatgcca gcatcttgcc t 21
<210> 3
<211> 15
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA223
<400> 3
atttgacaaa ctgac 15
<210> 4
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA484
<400> 4
ggaggggact gagcctg 17
<210> 5
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> Let-7a
<400> 5
aactatacaa cctactacct ca 22
<210> 6
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA-TS
<400> 6
ctgccccaaa atgcct 16
<210> 7
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA-Pa
<400> 7
gcggcatggc tggatc 16
<210> 8
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA-Sa
<400> 8
acagagtttt acgatc 16
<210> 9
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA-US5-2
<400> 9
agacatcgtc acacctatca ta 22
<210> 10
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> PNA-DENV
<400> 10
gcgtttcagc atattga 17
<210> 11
<211> 22
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-21
<400> 11
uagcuuauca gacugauguu ga 22
<210> 12
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-31
<400> 12
aggcaagaug cuggcauagc u 21
<210> 13
<211> 15
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-223
<400> 13
gucaguuugu caaau 15
<210> 14
<211> 17
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-484
<400> 14
caggcucagu ccccucc 17
<210> 15
<211> 22
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> Let-7a
<400> 15
ugagguagua gguuguauag uu 22
<210> 16
<211> 16
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-TS
<400> 16
aggcauuuug gggcag 16
<210> 17
<211> 16
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-Pa
<400> 17
gauccagcca ugccgc 16
<210> 18
<211> 16
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-Sa
<400> 18
gaucguaaaa cucugu 16
<210> 19
<211> 22
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-US5-2
<400> 19
uaugauaggu gugacgaugu cu 22
<210> 20
<211> 17
<212> RNA
<213> 人工序列(Artificial Sequence)
<220>
<221> unsure
<223> miR-DENV
<400> 20
ucaauaugcu gaaacgc 17
- 还没有人留言评论。精彩留言会获得点赞!