确定至少一种细胞类型和/或状况的方法和系统与流程
这里,细胞鉴别应该被理解为包括确定与组织细胞相关的信息,或者更一般地与细胞结构的细胞相关的信息。与细胞相关的信息尤其可以包括存在于组织中的细胞类型和/或其状况,例如包括炎性、癌性或健康的细胞的状况,尤其是包括增生期、异型增生期、原位癌期、侵袭性癌期、转移性癌期等的癌症阶段。
确定存在于组织中的细胞类型可以用于例如在安装了血管内支架之后追踪动脉内皮的愈合。已知血管内支架的插入会造成动脉内皮的伤口。这种伤口的结果是可能形成瘢痕组织,其可以包含内皮细胞、平滑肌细胞和血小板(或凝血细胞)。这些细胞中的一些的增殖会引起严重的病理,例如再狭窄或血栓形成。因此,尤其有利的是能够鉴别瘢痕组织细胞,特别是原位鉴别瘢痕组织细胞。
已经提出了许多装置和方法,旨在确定细胞结构的细胞类型和/或细胞状况,特别是在组织中的细胞结构的细胞类型和/或细胞状况。这些方法通常基于测量组织或细胞的阻抗。
US-B-6437551描述了用于检测和识别细胞的微流体装置。该微流体装置包括微流体芯片,该微流体芯片具有与电极一起提供的至少一个微导管和连接到电极的电路,以检测与通过微导管的颗粒相关的信号。根据该文件,可以根据所测量的阻抗的频谱变化来计算细胞的膜电容值,然后根据该值来区分细胞。然而,由此确定的膜电容在不同细胞之间,甚至在相同类型的两个细胞之间表现出很大的差异性。因此,这种方法表现出有限的可靠性,并且不能在体内实施。
EP-B-2271933描述了一种表征细胞或细胞结构的方法。该方法首先在于在一定频率范围确定待测样品的归一化阻抗。归一化阻抗对应于在所使用的测试系统中实际测量的样品的阻抗与测试系统中无测试样本的无负载阻抗之间的比率。根据该方法,之后可以根据归一化阻抗的一个或多于一个峰值的频率来确定样品的细胞类型。该方法也表现出有限的可靠性,因为每次测量之间和各个测试系统之间的峰值的频率可能会发生很大的变化。此外,该方法难以在体内实施,因为它需要“无负载”测量,其测试条件类似于当存在待测样品时遇到的条件,这可能难以实现,因为血液性质可能表现出快速和显著的变化。
EP-B-2271933也教导了确定用于建模归一化阻抗的等效电路是有可能的。在这种情况下,可以从以生物体和/或其生长阶段为特征的电路的电容值或电阻值得出结论。该专利没有提到在此背景下可以实施的模型。
US9121806描述了一种使用阻抗谱来监测体外细胞生长从而确定细胞是否癌变的仪器。用恒相位元件(CPE细胞)进行等效电路建模。绘制细胞层电阻和CPE细胞相对于时间的的演变。
US2012/0316454公开了一种使用阻抗谱来监测耳蜗植入物在人体内的定位的技术,其使用电极来识别植入物与组织的接近程度以及电极接近什么组织。该文件描述了用包括恒相位元件的等效电路模型进行等效电路建模。计算曲线并将其与已知曲线形状进行比较以识别电极与一个或多于一个组织结构的邻近度。
文章“A cell impedance sensor chip for cancer cells detection with single cell resolution”(Tien Anh Nguyen等人,IMTEK,弗莱堡大学,弗莱堡,德国)公开了一种使用阻抗谱和等效电路建模用于高分辨率检测癌细胞的芯片,其中所采用的模型包括恒相位元件。细胞鉴别基于等效模型的膜电容Cm的修改。
文章“A review of impedance mesurements of whole cells”(Youchun Xu等人,Biosensors and Bioelectronic,77(2016),第824-836页)描述了用细胞进行阻抗测量的各种技术,包括采用具有恒相位元件的等效电路建模的谱技术。计算各种参数,如细胞膜电容C膜。
文章“Determination of effective capacitance and film thickness from constant-phase-elements parameters”(Bryan Hirschorn等人,Electrochimica Acta(2010),第6218-6227页)讨论了对于两种类型的时间常数分布,即表面分布和正态分布,由CPE参数确定有效电容。公开了在电极表面对Faradaic反应的应用。计算人体皮肤的有效电容以试图估计皮肤厚度。
需要能够以相对准确的方式来确定细胞的类型和/或状况,并且在需要的情况下可以用于体内测量的方法和系统。
根据第一方面,本发明的示例性实施方案涉及一种用于确定细胞结构的至少一种细胞类型和/或状况的方法,所述方法包括将表示所述细胞结构的有效电容C有效(Ceff)的至少一个值与对于至少一种已知细胞类型和/或状况所确定的至少一个参考值进行比较,并且至少基于该比较来确定细胞结构的至少一种细胞类型和/或状况,所述有效电容C有效基于细胞结构阻抗的至少一个等效电路模型,该等效电路模型包括具有赝电容的至少第一恒相位元件,该有效电容C有效至少取决于第一恒相位元件的赝电容以及所述等效电路模型的至少一个电阻值。
C有效具有电容的量纲,并且可以表示为第一恒相位元件的赝电容的幂乘以电阻的幂。
已经发现,根据本发明的一些实施方案中的方法使得能够精确地区分细胞的不同类型和/或相同类型细胞的不同状况。该方法有效、准确并且快速。此外,该方法可以不需要任何校准测量。该方法可以在体内实施。
表示有效电容的值可以是有效电容本身或通过线性或非线性函数的有效电容的图像。该函数可以具有用于有效电容的唯一参数或涉及其它参数,以获得更高准确度的确定。
该方法可以包括基于细胞结构的至少一个阻抗谱来计算表示有效电容的值。所述阻抗谱可以根据该计算进行变换,例如通过一些缩放,或者可以使用原始阻抗谱。当阻抗谱变换时,表示有效电容的值的计算考虑在阻抗谱上进行的变换。
该方法可以包括在给定数学优化方法的情况下确定最适合阻抗谱的等效电路模型的参数。
该方法可以包括测量阻抗谱。换句话说,测量和计算表示有效电容的值可以由相同的系统进行。在变化方案中,计算表示有效电容的值的系统与进行测量的系统不同。例如,由第三方进行测量,并通过网络传输到计算表示有效电容的值的服务器。然后可以将确定的结果返回给第三方。
阻抗谱可以在约103赫兹到108赫兹的频率下测量,优选在约104赫兹到107赫兹的频率下测量。
该方法可以包括将表示细胞结构的有效电容的至少一个值与对多种已知细胞类型所确定的多个参考值进行比较,并至少基于该比较来确定细胞结构的至少一种细胞类型。
多种已知的细胞类型可以包含至少三种细胞类型,例如内皮细胞、平滑肌细胞和血小板。
该方法可以包括将表示细胞结构的有效电容的至少一个值与对多种已知细胞状况所确定的多个参考值进行比较,并至少基于该比较来确定细胞结构的至少一种细胞状况。所述状况可以是发炎状况、癌症状况、健康状况、以及干细胞的未分化或分化状况、以及癌症阶段的至少一种,癌症阶段包括增生期、异型增生期、原位癌期、侵袭性癌期、转移性癌期等。
该频谱可以在体内测量。在一些示例性实施方案中,该频谱在哺乳动物体内确定。细胞结构可以存在于手术装置的附近,手术装置为血管内支架、支架、移植物、导管、导丝、探针、封堵装置、心脏瓣膜、起搏器、ICD支架之一。
在变化方案中,该频谱在体外测量。
该频谱由至少两个电极确定,但优选使用至少四个电极。
第一恒相位元件优选地为具有以形式的阻抗的膜恒相位元件CPEm,其中Q0是恒相位元件的赝电容,α是0至1的实数,并且有效电容C有效至少取决于Q0和α。
表示细胞结构的有效电容C有效的至少一个值可以是C有效/S,其中S是用于测量阻抗谱的电极的总表面,其中有效电容是基于该阻抗谱来计算的。
表示细胞结构的有效电容C有效的至少一个值可以是log(C有效)或任何其他线性或非线性函数。
等效电路模型优选地包括第二恒相位元件,其为双层恒相位元件CPEdl。
等效电路模型可以包括由阻抗为的、由电阻器R2分流的第一恒相位元件构成的分流电路,以及与分流电路串联的电阻器R1。
优选地,等效电路还包括与电阻器R1串联的第二恒相位元件。
有效电容C有效可以由以下方程给出:
在一个变化方案中,有效电容C有效可以由以下方程给出:
优选地,有效电容至少基于第一恒相位元件的表面分布模型来确定。在变化方案中,或另外地,有效电容至少基于第一恒相位元件的厚度分布模型来确定。
该方法可以包括至少基于比较来传递与以下相关的至少一个信息:
-细胞结构的组成;
-存在于细胞结构中的细胞层数。
在一些实施方案中,提供了一种用于监测手术装置植入后愈合的方法,该方法包括进行如上定义的方法,以确定手术装置附近的以及表示愈合过程的演变的细胞结构的至少一种细胞类型和/或状况。
所述手术装置可以是血管内支架、支架、移植物、导管、导丝、探头、封堵装置、心脏瓣膜、起搏器、ICD中的一种。该装置可以为永久植入的或非永久植入的。该装置可以植入并取出。
在一些实施方案中,提供了用于评估细胞结构对至少一种刺激的响应的方法,该方法包括进行如上定义的方法,以确定表示对至少一种刺激的反应的细胞结构的至少一种细胞类型和/或状况。
所述刺激可以是化学刺激、生化刺激、或生物刺激。
示例性实施方案还涉及一种系统,特别是用于进行如上定义的方法的系统,其包括:
-测量单元,其包括至少一对电极,该至少一对电极用于测量细胞结构的阻抗谱,
-计算单元,其配置为用于计算表示细胞结构的有效电容C有效的至少一个值,有效电容C有效是基于细胞结构的阻抗的至少一个等效电路模型,该等效电路模型包括具有赝电容的至少第一恒相位元件,有效电容C有效至少取决于第一恒相位元件的赝电容以及所述等效电路模型的至少一个电阻值。
该计算单元还可以配置为将表示细胞结构的有效电容的至少一个值与对至少一种已知细胞类型和/或状况所确定的至少一个参考值进行比较,并至少基于该比较来确定细胞结构的至少一种细胞类型和/或状况。
该系统可以是可植入手术装置。
该系统可以包括具有测量单元和无线发射器的可植入手术装置,计算单元在可植入手术装置的外部并且包括用于接收由所述无线发射器发送的数据的接收器。所述可植入手术装置可以是血管内支架、支架、移植物、导管、导丝、探头、封堵装置、心脏瓣膜、起搏器、ICD支架中的一种。
在一些实施方案中,提供了一种用于鉴别细胞结构的细胞的方法,特别是用于鉴别细胞组织的细胞的方法,其包括:
a)确定细胞结构的阻抗的频谱;
b)定义包括恒相位元件的细胞结构的阻抗的至少一个模型;
c)确定恒相位元件的阻抗,其优化细胞结构的阻抗的每个模型与a)中确定的频谱的相关性;
d)从c)中确定的恒相位元件的阻抗来推导关于细胞结构的细胞的信息项。
使用具有恒相位元件的模型可以使得能够推导关于所测试细胞结构的更精确信息。
根据一些实施方案,该方法可以单独或组合地呈现以下特征中的一个或多于一个:
-步骤d)由两个子步骤组成:
d1)从每个恒相位元件的阻抗以及任选地从优化细胞结构的阻抗的每个模型与步骤a)中确定的谱的相关性的参数推导表示细胞结构的要素的一组单独电容的有效电容;和
d2)从步骤d1)中确定的有效电容推导关于细胞结构的细胞的信息项;
-在步骤d1)中,通过识别细胞结构的阻抗和将单独电路并联在一起的电模型的阻抗来确定有效电容,每个单独电路包括至少一个单独电阻和至少一个单独电容,有效电容表示由所有单独电容产生的电容;
-每个单独电路包括串联的第一单独电阻与并联安装件,优选地由其组成,该并联安装件为单独电容和第二单独电阻的并联安装件,有效电容等于单独电容的总和;
-在步骤d1)中,通过识别细胞结构的阻抗和电模型的阻抗来确定有效电容,所述电模型包括串联安装的第一电阻以及并联安装件,该并联安装件为第二电阻和有效电容的并联安装件;
-在步骤a)中,确定细胞结构的阻抗的实部和/或虚部和/或模和/或相位的频谱;
-步骤d)包括以下子步骤:将恒相位元件的阻抗和/或细胞结构的阻抗模型和/或细胞结构的有效电容的参数与预定值进行比较,预定值特别是对应于对已知组成的一种或多于一种细胞结构进行的测试;
-在步骤d)中,关于细胞结构的细胞的信息项包括以下至少一项:
-细胞结构的细胞类型;
-细胞结构的组成;
-存在于细胞结构中的细胞层数;和
-细胞的状况,特别是细胞的发炎状况、癌症状况、健康状况或干细胞的未分化或分化状况;
如果适当的话,从细胞结构的阻抗模型的参数和/或所确定的有效电容与一个或多于一个预定值的比较推导信息项;
-步骤a)在于:
i)建立细胞结构与至少两个电极、优选四个电极之间的接触;
ii)在植入的电极之间施加交流电;
iii)改变交流电的频率并确定相应的电流电压和电流强度;
iv)通过确定电压和强度之比来计算阻抗;
-细胞结构的阻抗模型包括串联安装的第一电阻与并联连接件,优选由其组成,该并联连接件为恒相位元件和第二电阻的并联连接件,优选地,该模型还包括第二恒相位元件,该第二恒相位元件与第一电阻串联安装;
-所述细胞结构的阻抗的一个模型还包括第三电阻,其与串联连接件并联安装,串联连接件为第一电阻及并联安装的第二电阻和恒相位元件的串联连接件,如果合适的话,优选模型还包括第二恒相位元件;
-细胞结构的阻抗模型包括电阻和串联安装的电阻与恒相位元件的并联连接件,优选地由其组成;
-恒相位元件的阻抗ZCPE的形式为:
其中:
-j是-1的平方根;
-ω是通过阻抗的电流脉冲;
-Q0是实数(赝电容);和
-α是0至1的实数,
参数Q0和α在步骤c)中确定;
-在步骤d1)中,有效电容由下式给出:
其中R1、R2和是第一电阻、并联的第二电阻和恒相位元件各自的阻抗,第一电阻及并联的第二电阻和恒相位元件串联安装,从而形成计算模型,根据细胞结构的模型的参数,确定这些阻抗以将细胞结构的模型与计算模型相关联;
-在步骤b)中选择细胞结构阻抗的单一模型,并且在步骤c)中选择恒相位元件的阻抗的单一形式;和
-在步骤b)中选择细胞结构的阻抗的多个模型,和/或在步骤c)中选择恒相位元件的阻抗的多种形式,在步骤A)期间、步骤c)和步骤d)之间选择细胞结构的阻抗模型和/或恒相位元件的阻抗形式,其优化阻抗模型与细胞结构的相关性标准,例如,相关性标准是细胞结构的阻抗模型与步骤a)中确定的谱之间的标准差的最小化。
在一些实施方案中,提供了一种用于实施如上所述方法的全部组合的系统,包括:
-用于测量细胞结构的阻抗的装置;和
-连接到测量装置的电子控制单元,其用于实施如上定义的方法。
根据一些实施方案,该系统单独或组合地呈现一个或多于一个以下特征:
-测量装置包括交流发电机,其连接到旨在与细胞结构接触的两个、优选四个电极,以及包括用于测量两个所述电极之间的电压或电流强度的装置,则相应的阻抗能够在所述电子控制单元中确定;和
-所述测量装置包括医疗装置,特别是可以被植入人体中或者可以被应用至人体的医疗装置,电极固定至该医疗装置,从而该医疗装置优选在不接触患者身体外部的情况下,适于传送与阻抗或与电极之间的强度和电流电压相关的信息项。
在阅读以下详细描述后,各种实施方案的其他特征和优点将变得明显,所述描述参考附图,其中:
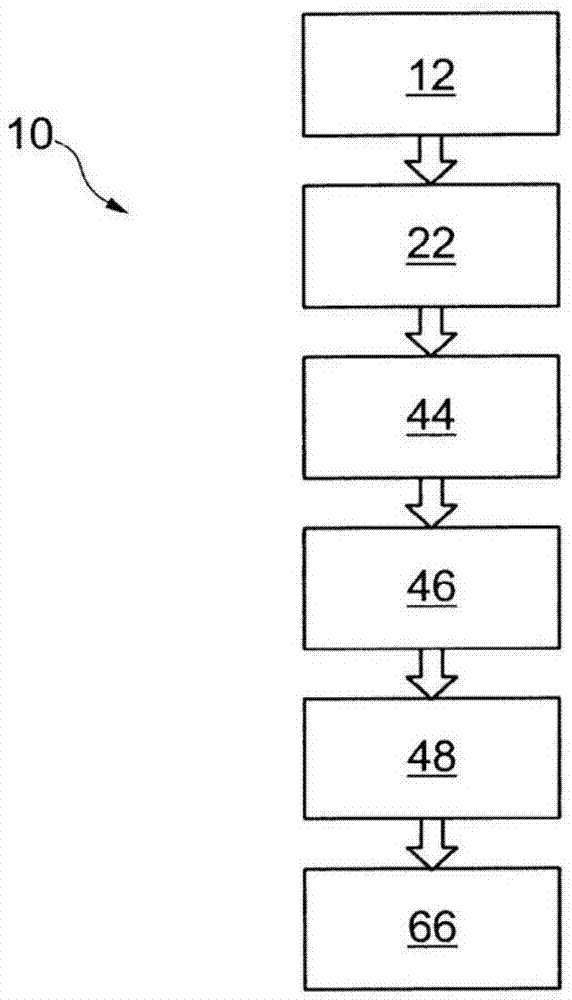
-图1是用于鉴别组织中细胞的示例性方法的流程图;
-图2是用于从频谱确定组织的阻抗的示例性方法的流程图;
-图3表示细胞组织的阻抗模的示例性频谱;
-图4至图7示出可以在图1的方法中实现的包括恒相位元件的组织阻抗的示例性模型;
-图8以图解形式示出通过图1的方法确定细胞结构的有效电容的实例;
-图9示出用于实施图1的方法的示例性系统;
-图10A和10B显示实验数据的振幅和相位谱;
-图11A和11B以及12A至12F示出各种参数分布;
-图13至15显示代表不同细胞类型的有效电容的数值分布;
-图16和17示出根据本发明制造的系统的实例。
在一些实施方案中,一种方法能够用于鉴别细胞结构中,特别是细胞组织中的细胞。“鉴别”在这里应该被理解为包括由该方法提供的区分细胞的可能性,例如确定组织细胞类型的可能性。更一般地,通过该方法能够实现鉴别是在于确定与被测组织中的细胞有关的至少一项信息。后文给出可以根据这种方法确定信息项的实施例。
如图1中示意性示出的细胞鉴别方法10,包括第一步骤12,确定待测细胞结构的阻抗的频谱。下文中,细胞组织的结构将作为细胞结构的实例。
这里,谱应该被理解为包括一组成对的组织阻抗值,后者可以是复数,并且具有相应的频率。因此,该谱可以是离散的并且仅包括有限数目的配对。这些配对可以尤其是以几赫兹分隔,甚至以几十赫兹甚至几百赫兹分隔。然而,优选地,在该步骤中确定的谱在频带上是连续的、伪连续的、或离散的。伪连续应该被理解为表示该谱确定为相隔100赫兹或更小、优选10赫兹或更小、更优选1赫兹或更小的连续频率。确定组织阻抗的频带例如从10千赫兹延伸,优选为从100千赫兹延伸。实际上,在低频率下,组织细胞的膜起电绝缘体的作用,因此阻抗非常高,并且最重要的是几乎没有变化。而且,确定组织阻抗的频带延伸至,例如最高100兆赫兹,优选为1兆赫兹。实际上,在高频率下,构成组织的细胞的壁从电学角度变得透明。因此,测得的阻抗不再表示细胞壁。所述谱可以是细胞结构的复阻抗的实部和/或虚部和/或模和/或相位的频谱。
特别地,确定组织的阻抗频谱的第一步骤12可以按照下述进行。
首先,在步骤14中,将两个、优选三个、甚至更优选四个电极与待测组织接触放置,所述电极连接到交流发电机。优选用四个电极测量,因为这能够实现两个电极将电流传递到待测组织并测量另外两个电极之间的电位差。这可以提高测量的准确性。然后,在步骤16中,在植入组织中的电极之间施加交流电。然后,通过改变在步骤18中施加电流的频率,对于不同的频率在电极端子处测量相应的电压。最后,在步骤20中,针对已经进行测量的每个频率计算所测量的电压与所施加的电流之比。该比给出作为测量频率的函数的测试组织的阻抗。计算出的比使得可以确定组织阻抗的频谱。
当所述谱是连续的或伪连续的时,其可以如图3所示以曲线的形式给出,在该特定情况下,组织的阻抗模为频率的函数,后者根据对数标度绘制。这里应该指出,对数标度在X轴上使用。
在鉴别方法10的步骤22中,之后选择组织的阻抗的不同模型,也就是可以模拟组织的不同电路。这里选择的模型包括恒相位元件,而不是电容。实际上,已经发现恒相位元件比电容更真实地模拟组织的行为。
恒相位元件(或CPE)具有以下形式的阻抗ZCPE:
其中:
-j是-1的平方根(j2=-1);
-ω是电流的具体脉冲(ω=2πf,其中f是电流的频率);
-Q0是恒相位元件的实参数,也被称为赝电容;和
-α是恒相位元件的另一个实参数,为0至1,使得恒相位元件的相位等于-απ/2。
在下文的描述中,通过示例来选择其阻抗由上述方程[1]给出的恒相位元件。
关于图4至图7,组织的阻抗模型可以特别地从下文中描述的模型中选择。显然地,模型越简单,计算就越简单。然而,复杂的模型可以与测量得到的阻抗谱更好地关联,由此可以得到更准确的结果。
根据图4所示的第一模型24,细胞组织的阻抗通过第一电阻26与并联连接件28的串联安装来模拟,并联连接件28为恒相位元件30和第二电阻32的并联连接件。
在这种情况下,细胞组织的总电阻Z总(Ztot)具有以下形式:
其中:
-Z总是表示细胞组织的第一模型24的总阻抗;
-R1和R2是第一电阻26和第二电阻32的电阻值。
这种模型特别好地描述了覆盖测量电极的组织,如一组单独的并联安装件,每个单独的安装件由单独电阻与并联安装的单独电阻和单独电容串联组成。根据可具有不同参数的不同并联电路,这种安装件可能够模拟测量电极的所有表面上时间常数的分布,这些并联电路的每个代表组织的细胞。因此,可以模拟出组织细胞可以表现出不同电特性、特别是不同电阻和/或电容的事实。
图5中示出的第二模型34通过串联安装第二恒相位元件36来补充图4的模型24。该第二恒相位元件36的阻抗ZCPE,2也可以选择以下形式:
其中:
-β是0至1的实参数,使得第二恒相位元件的常相位等于-βπ/2;和
-Q1是恒相位元件的赝电容(实数),对于双层赝电容也称为Qdl。
因此,根据该第二模型34的组织的总阻抗Z总由以下方程给出:
图5A中示出第二模型34的变化方案34',其与图5的模型不同之处在于添加了与图5的电路并联的电容C,以更好地拟合在高频处的阻抗曲线。
图6中所示的第三模型38对应于并联安装了第三电阻40的图4的模型,第三电阻40即电阻R3。在这种情况下,该组织的总阻抗Z总由以下方程给出:
最后,图7中示出了第四示例性模型42。如图所示,该模型42包括第一电阻26,其与第二电阻32和恒相位元件30的串联安装件并联安装。
对于该模型42,组织的总阻抗Z总由下式给出:
然后,该鉴别方法继续进行步骤44,在此期间,对于在步骤22中选择的每个模型,确定恒相位元件30和模型的所有其他部件的阻抗,使得模型的阻抗在某种程度上与在步骤12中确定的谱匹配。
改善组织的阻抗模型与步骤12中确定的谱的匹配性,这一步骤可以通过本领域技术人员已知的任何优化方法来实现。举例来说,可以实施最小二乘法,其可以使得步骤44的实施可操作且相对简单。
之后,可以提供鉴别方法10的中间步骤46。该步骤46在于确定有可能改进模型与所测量的阻抗之间匹配的模型。这个模型可以是例如使测量谱的标准差最小化的模型。在下文中,假定模型24保持与组织阻抗的测量谱最相关的情况。
在步骤48中,从恒相位元件的阻抗参数和相应的模型推导出细胞组织的有效电容。
理论上,该有效电容是表示细胞结构要素的一组单独电容。有效电容表示细胞结构要素的分布的局部电容。特别地,这些细胞结构要素可以是细胞结构的全部或一些细胞核,也可以是细胞的其他部分,如高尔基体、囊泡、线粒体、溶酶体、以及可以在膜相互作用中起作用的其他要素。有效电容也会受到细胞几何形状和细胞之间空间的影响。该有效电容是能够用于表示部分或全部细胞结构的电膜行为的模型。该模型使得能够确切地鉴别细胞。至少因为其不考虑电测量的总电容值,而是由等效于局部电容分布的分布式模型给出,因此,有效电容不同于膜电容。
更实际地,这种有效电容是通过用包括单独并联安装件的模型识别所选的细胞结构的阻抗来确定的,每个单独的安装件包括至少一个单独电阻和一个单独电容。特别地,每个安装件可以包括串联的第一单独电阻与并联安装件,并联安装件为单独电容和第二单独电阻的并联安装件,优选地由其组成。这些单独的安装件旨在模拟细胞结构每种细胞的行为。
在模型24(或34或34')的情况下,有效电容的确定可以特别地如下进行。将具有恒相位元件的模型24的阻抗与等效或相同模型的阻抗进行比较,等效或相同模型中恒相位元件被有效电容替代。严格地说,有效电容的计算之后可以通过比较具有恒相位元件的对于细胞结构所选模型的阻抗的实部和/或虚部和/或相位和/或模与其中恒相位元件被有效电容取代的相同模型来进行。
在模型24(或34或34')的情况下,例如,通过将时间常数引入模型24的导纳方程中,直接从方程[3]推导,获得下面的方程[8]:
从中可以推导出有效电容的公式,形式如下:
在选择具有恒相位元件的细胞结构的另一个阻抗模型的情况下,可以确定有效电容的对应方程。为此,如果合适的话,由于模型24或34或34'与所选择细胞结构的阻抗模型电等效,计算模型24或34或34'的阻抗R1、R2、ZCPE和ZCPE,2即可,其为所选模型参数的函数。然后可以通过用相应的值代替R1、R2、Z0和α来计算有效电容,其表示为所选模型参数的函数。
然后,细胞鉴别方法10继续进行步骤66,从先前确定的有效电容推导关于组织细胞的信息项。
该推导可以通过将步骤48中确定的有效电容值与预定有效电容值进行比较来进行。预定有效电容值可以对于已知组成的组织(例如细胞类型和/或细胞状况)、在已知介质中、以及已知测试条件下进行测试获得。预定值可以在有效电容值的数据库(或其他形式的数据结构或数据存储)中组合在一起,将针对不同细胞类型和/或不同细胞的不同状况和/或在不同的测试条件下测量的有效电容组合在一起。有效电容值可以与在本测量中容易发现的细胞类型和状况的有效电容数据库进行比较。对于该比较,有效电容C有效可以与其他参数一起使用。所述比较可以不完全匹配,并且包括确定有效电容值是否落在预定范围内。
因此可以鉴别组织的细胞,也就是说,确定以下信息项中的至少一种:
-组织中的细胞类型;
-组织的组成,特别是组织是否由不同类型的细胞或不同状况下的细胞组成;
-存在于组织中的细胞层数;和/或
-细胞的状况,特别是细胞是否处于健康状况、发炎状况、退化状况,特别是是否存在一种或多于一种癌细胞、感染状况,或者它们是否分化。
作为示例,图8以图表形式表示出根据前述方法进行测试的情况下确定的有效电容68、70、72、74。
在测试的情况下,培养细胞直至获得细胞汇合。在进行了示例性测试的情况下,需要在37℃和5%CO2的培养箱中培养两天,以通过汇合获得待测试的组织。使用阻抗谱系统来确定待测试的不同组织的阻抗谱。通过施加估计为相当低的以避免所研究的细胞电兴奋、但足以进行正确测量的交流电压,在1千赫兹至10兆赫兹确定所述谱。在所进行测试的实例中,交流电压的振幅保持为20mV。
有效电容68是单独的静态测试介质的有效电容。该测试介质是细胞培养基。有效电容70是牛主动脉内皮细胞(BAEC)的有效电容。有效电容72是牛主动脉平滑肌细胞(BAOSMC)的电容。最后,有效电容74是血小板(凝血细胞)的有效电容。如该图所示,不同类型细胞的有效电容显示出彼此明显不同的值,这使得可以准确地有效区分不同类型的细胞,而没有混淆的风险。
因此,上述一些实施方案的鉴别方法的一个优点是它能够由简单测量待测结构的阻抗的频谱来鉴别覆盖电极的细胞结构中的细胞,特别是汇合和单层细胞结构中的细胞。所得的结果是准确的。不需要对所测量的阻抗进行归一化,也不需要在没有任何待测样品的情况下进行参考测量。因此,该方法可以在体内实施,也就是说不需要事先进行待测细胞或细胞结构的取样。
应该注意的是,在确定有效电容的情况下,一次有效电容的单个值可足以鉴别组织的细胞。这与其他进行电容分析的技术形成对比,该技术需要随时间多次确定电容。在这些实施方案中,待测细胞结构阻抗的所选模型的参数也可以与预设值进行比较,以具体化有效电容的比较结果。例如,当细胞发炎时,细胞之间的连接更松散。与健康细胞相比,低频下的电阻——即例如模型24的电阻32——会较低。因此,这种电阻值与预先对健康非发炎细胞预定值的比较使得能够确定这些细胞的发炎状况。
还应该注意的是,除有效电容之外,阻抗模型的其他参数也可以用来考虑鉴别细胞。在一些实施方案中,这些其他参数还可以确定关于所测试的细胞结构的附加信息项。因此,例如,模型24的R2或者电阻26、32的R1+R2之和可以被认为用以确定细胞结构的厚度。为此,在一些实施方案中,确定R2值和可能的R1值,特别是伴随着恒相位元件的阻抗的确定,从而优化模型24与测量的阻抗谱的相关性。然后可以将R2值或R1+R2之和与在已知条件下例如体外预定的相应值进行比较。这些预定值可以特别地以数据库(或其他数据结构)形式进行存储。
如先前所述,该方法可以容易地在可植入人体或应用于人体的装置的情况下实施。
通过举例的方式,图9示出了用于实现如前所述的一些实施方案的方法的实例系统100。
所述系统100主要包括用于测量细胞结构104的阻抗的装置102以及连接到测量装置102的电子控制单元106,从而实施该方法并根据测量阻抗鉴别细胞结构104的细胞,这里的细胞结构104为浸入介质105例如血液的汇合细胞的单层组织。
这里,测量装置102包括交流发电机108,其连接到与细胞结构104接触的两个电极110、112。所述测量装置102还包括穿过细胞结构104用于确定强度的装置114,装置114通过与细胞结构104接触的两个电极116、118连接到所述细胞结构104。所述电子控制单元106连接到发电机108和强度测量装置114,以能够确定细胞结构104的阻抗,例如根据电极110、112、116、118端子处的电压和强度的测量值。
电极110、112、116、118由导电材料组成,例如金。
在此,有利的是,测量装置102还包括可以植入人体内的医疗装置120,或者可以应用于人体的装置,医疗装置120这里是血管内支架120。在这种情况下,电极110、112、116、118、交流电压发生器和强度测量装置可以被固定到该医疗装置上。该医疗装置例如,如2014年10月3日提交的申请FR3026631A1“MEDICAL DEVICE PROVIDED WITH SENSORS HAVING VARIABLE IMPEDANCE”中所述,其整个内容,特别是对包括测量装置的可植入医疗装置的讨论通过引用并入本文。
在这种情况下,交流发电机108可以包括电枢,例如医疗装置的主体或与医疗装置的主体电绝缘的天线,该电枢适于在由血管内支架120外部的询问单元发射的电磁场的作用下发射电流。然后电极可以形成具有可变阻抗的传感器,其阻抗根据覆盖它们的细胞结构而变化。最后,电子控制单元可以接收与电极之间的阻抗相关的信息项,特别是通过固定在可植入医疗装置120主体上的天线发射的磁场。
因此,血管内支架120能够在其被安装之后检查内皮愈合的正确进程。实际上,这种血管内支架120与电子控制单元协作,使得能够通过实施图1的方法来确定在内皮表面上形成的细胞结构是否基本上包含健康的内皮细胞、发炎的内皮细胞、平滑肌细胞、和/或血小板。
本发明不限于上述实施例,并且在由所附权利要求给出的定义的范围内,许多变化方案是可能的。
因此,例如,可以在步骤22中选择组织阻抗的单个模型。在这种情况下,不需要对多个模型进行优化。因此,在这种情况下更简单且更快速地实现该方法。当模型被认为是更相关的时,以这种方式进行尤其是可能的。
而且,在所描述的实例中,细胞的鉴别主要基于所计算的有效电容以及其与预定值的比较。然而,作为变化方案,能够从细胞结构阻抗的所选模型的参数来进行细胞的鉴别。然而,看起来只有有效电容值的比较是简单的并且能够可靠地鉴别细胞。
图16示出根据本发明制造的系统300的实例。该系统包括测量模块301,测量模块301可以是植入装置如血管内支架或用于体外培养细胞的装置的一部分。
所述测量模块包括至少两个电极,并且可以为如上参考图9所述的。
所述系统300还包括内部处理单元302,内部处理单元302配置为例如由来自测量模块的数据生成阻抗谱。
该系统300可以包括发射器303,以将数据(来自测量模块301的数据和/或由内部处理单元302确定的阻抗谱)无线传输到接收器304,接收器304可以在测量发生在体内的情况下在身体外部。传输可以在任何无线协议下进行,例如RFID、NFC、蓝牙、Wifi、无线电或红外等。在一些实施方案中,传输可以包括经由一个或多于一个有线和/或无线局域和/或广域网的传输,广域网包括因特网。
该系统300可以包括外部处理单元305,以基于所接收的数据和显示装置306来计算阻抗谱(在从发射器303接收来自测量模块301的数据的情况下)和/或各种参数和有效电容C有效,显示装置306如LCD屏,以显示基于表示C有效的值与参考数据的比较所确定的与细胞类型和/或状况有关的信息。为了确定各种参数和有效电容,外部处理单元305可以配置有关于阻抗的一个或多于一个等效电路模型的信息,并且用如上所述的方式确定至少一个模型的参数。如上所述,外部处理单元305还可以配置为在确定模型的参数之后选择模型中的一个作为确定有效电容的模型。所述外部处理单元可以基于等效电路模型与阻抗谱之间的拟合程度来进行选择。该系统可以基于由此明确的至少一种细胞类型和/或状况来提供表示愈合过程演变的信息,例如关于在执行程序的区域(例如,组织的区域)中当前状态的信息(包括植入物如血管内支架的定位)和/或提供关于区域状态随时间的变化的信息,该信息可以反映对该区域中程序的反应,诸如愈合或疤痕反应。
所述外部处理单元可以是专用装置,其包括专用硬件,如ASIC、EEPROM或专门为执行上述外部处理单元的操作而配置的其他部件。在其他实施方案中,外部处理单元可以是通用装置,如笔记本电脑或台式个人计算机、服务器、智能/移动电话、个人数字助理、平板电脑、或包括移动计算装置的其他计算装置。在外部处理单元用通用装置实施的情况下,通用装置可以包括一个或多于一个处理器和非临时性计算机可读存储介质(例如,指令寄存器、单片超高速缓存器、存储器、硬盘驱动器、诸如光学介质的可移动介质),其上编码了由处理器执行的指令,其中指令使得处理器执行上述由外部处理单元执行的操作。在一些实施方案中,内部处理单元可以是任何适当的IC芯片或具有处理能力的其他硬件部件。外部处理单元和内部处理单元可以位于彼此附近(例如,在同一个房间内,或在5英尺内)或者可以彼此远离(例如,在建筑物或建筑群的不同部分)或在地理上彼此远离(例如,相隔数英里),例如外部处理单元在服务器中执行并且数据通过一个或多于一个网络或因特网传输的情况。
在变化方案中,如图17所示,处理的一部分在远程服务器310中执行,例如通过因特网将数据传输到远程服务器310。
实施例
图10A和图10B显示了对于分别包含三种细胞类型,即血小板、平滑肌细胞和内皮细胞的细胞结构测量的阻抗谱的振幅和相位的集合。
对比例
首先,使用不具有CPE的等效电路模型,其由双层电容Cdl以及串联的溶液电阻和R0C混合(R0电阻与C混合并联)串联组成。
然后,计算描述细胞层对复阻抗影响的C混合参数。
图11A显示了两种细胞类型的C混合的分布结果。其能够区分这两种细胞类型。但是,如果添加第三种细胞类型,则不能再区分三种细胞类型,如图11B所示。
如果使用更复杂的方法并将CPE元件补充到等效电路模型中,和使用例如图5中所示的模型34,则存在描述系统的六个参数,即R0、Rinf、Q0、β、Qd1和α。
可以计算这些参数,使得等效电路模型的阻抗最好地拟合图10A和10B的实验阻抗谱曲线。
然后,可以对于三种细胞类型的每个参数显示该参数的分布,如图12A至12F所示。
可以看出,对于每个参数,三种细胞类型不能被清楚地区分,并且这些参数的线性组合不能提供所寻求的细胞鉴别。
根据本发明的实施例
图13显示了基于上述公式[9]确定的表示三种细胞类型的有效电容C有效值的分布。
可以看出,可以清楚地区分所有三种细胞类型。精确度超过90%。与图12A至图12F相比,细胞之间的差异显着提高。
如果等效电路是图5A的34',则获得图14的C有效分布。
如果考虑R0-Rinf相对于Rinf较大,则等式[9]可以简化为
由此获得的C有效分布如图15所示。可以看到三种细胞类型仍然可以以大约85%的精确度来区分。
图13至15所示的分布可以用作细胞类型确定的参考数据。
例如,可以在与图10A和10B的阻抗谱类似的条件下测量阻抗谱,并且基于该谱确定参数R0、Rinf、Q0、β、Qdl和α的值。该确定可以基于振幅和相位的阻抗曲线与图5等效电路模型34的最小二乘拟合。
然后,一旦参数值R0、Rinf、Q0和α已知,就可以计算有效电容C有效,并将该值与图13的分布进行比较,以确定其对应的细胞类型。例如,以nF/cm2表示的C有效的低值表明细胞是第一种类型;大约50至大约100的值表明细胞是第三种类型,值大于约100表明细胞是第二种类型。
- 还没有人留言评论。精彩留言会获得点赞!