自然杀伤细胞活性测定方法与流程
本发明涉及一种自然杀伤细胞活性测定方法,属于生物检测领域。
背景技术:
nk细胞(naturalkillercells,nkcell,自然杀伤细胞)最初因为无需预先致敏便可杀伤自体肿瘤细胞,而被称为天然免疫淋巴毒性细胞。经过数十年来对其表型及功能的细致研究,发现nk细胞的主要生物学功能主要有分泌细胞因子参与免疫调节及对靶细胞的直接杀伤作用[1,2]。nk细胞分布在不同组织中功能各异,不仅具有抗肿瘤、参与各种病理过程、维持免疫稳态,还可促进妊娠期胎盘血管形成过程。与之相应,恶性肿瘤、各种感染、自身免疫性疾病等均涉及nk细胞紊乱[3-6]。
nk细胞杀伤活性是评价免疫状态的重要指标,可用于监测免疫治疗过程中免疫状态的改变等方面。已有文献报道,其还与恶性宫颈癌化疗疗效、胰腺癌化疗后生存情况及阿尔茨海默病进展速度相关[7-9]。在家族性或获得性噬血细胞性淋巴组织细胞增多症、炎症、自身免疫性疾病及免疫缺陷病中nk杀伤活性受损是其特点之一,但由于该指标各实验室结果无法比较,缺少正常参考值范围,在相关疾病诊断中常作为其他诊断指标的确证指标[10]。nk杀伤活性检测急需严谨、标准化的检测分析方法及相应正常参考值范围,解决其应用的瓶颈问题。
nk杀伤检测方法的“金标准方法”是51cr释放实验,但由于放射性污染等问题限制了其在临床检测中的应用[11,12]。其他用于nk细胞杀伤活性检测的方法还包括低毒染料calcein-am释放实验、ldh释放实验、基于流式细胞术或生物发光的检测方法[13-17]。其中基于流式细胞术的检测方法具有操作简便、稳定、污染少、基线低且与51cr释放实验方法相关性好等优点,现临床多采用此方法进行nk细胞杀伤活性检测[14,18]。
但现有技术的方法仅以有核细胞数与靶细胞数计算,可能会导致检测结果的偏移,无法实现对nk细胞杀伤能力的严谨评估。
技术实现要素:
本发明提供一种自然杀伤细胞活性测定方法,其特征在于包括以下步骤:
1)将靶细胞传代培养;
2)对效应细胞中自然杀伤细胞比例进行分析;
3)将靶细胞与效应细胞按照设定的效靶比进行培养;
4)检测步骤3)中待测靶细胞死亡率;
5)将步骤4)中靶细胞死亡率带入公式计算自然杀伤细胞活性:
自然杀伤细胞活性=(待测靶细胞死亡率-对照组靶细胞死亡率)/(1-对照组靶细胞死亡率)×100%。
进一步地,步骤3)中的效靶比为4以上。
进一步地,步骤1)中对传代细胞进行密度和/或死亡率的质量控制。
进一步地,步骤2)中对效应细胞进行细胞密度、活细胞率及自然杀伤细胞比例至少之一的质量控制。
进一步地,所述质量控制方法包括将传代培养的靶细胞进行染料标记。
进一步地,包括用抗体对自然杀伤细胞进行标记。
进一步地,控制靶细胞自然死亡率在3%以内。
进一步地,靶细胞与效应细胞fh1通道mif(平均荧光强度)值之比为80倍以上。
进一步地,步骤4)中,舍弃如下检测度数:与仅有靶细胞对照管相比,效靶细胞混合孵育检测管内靶细胞浓度低于前者85%。
进一步地,依据检测对象是否患过肿瘤选择效靶比。
本发明建立了一种全新的nk细胞杀伤活力检测方法,在效应细胞与靶细胞比例计算时引入“nk细胞比例”及“有核细胞活率”参数,提高了该检测的严谨性,同时与将nk细胞分选后进行检测相比,不存在nk细胞磁珠分选成本高昂及流式细胞仪分选的机械损伤等问题。
本方法与以往传统检测方法相比,提高了不同来源样本间nk细胞杀伤活力评估的可比性,具有更广阔的应用前景。
本发明首次提出对该检测各环节进行质量控制,目的是降低室间检测的差异性,有望解决各实验室检测结果不能互相参考的现状。
本发明首次评估可供不同实验室参考的人外周血nk细胞杀伤活力正常参考值范围。
附图说明
图1待检标本有核细胞中nk细胞比例分布规律
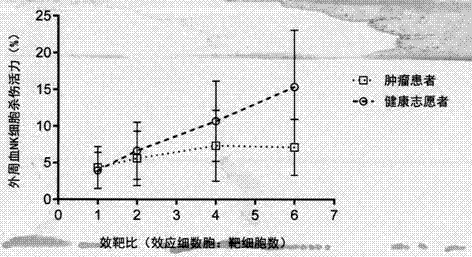
图2肿瘤患者组与健康志愿者组外周血nk细胞杀伤活性
具体实施方式
1资料与方法
1.1研究对象选取2014年6月至2016年10月在军事医学科学院附属医院就诊查体健康志愿者及肿瘤患者共108例,收集年龄、性别及nk杀伤活性检测相关结果。另收集其他nk杀伤活性检测标本158例的有核细胞nk比例信息。参考值组入选标准:①健康人群;②血象正常;③签署知情同意书。参考值排除标准:①免疫相关疾病者;②有服用激素及免疫调节剂应用史者;③3周内有明确感染者;④有心脑血管疾病者;⑤疑似或明确诊断为肿瘤患者;⑥其他影响免疫功能疾病或病史。
1.2试剂与仪器pi荧光染料、人nk细胞亚群分析用单克隆抗体(cd45-apc、cd56-pe、cd3-percp)及其同型对照购于美国bd公司,csfe荧光染料购于日本同仁公司,人淋巴细胞分离液购于天津灏洋华科生物科技有限公司,细胞培养用1640培养基及胎牛血清购于thremofisher公司。检测用bdaccuric6流式细胞仪。
1.3实验方法
1.3.1靶细胞的传代培养:k562细胞按1-2×105cells/ml密度,接种于含有20ml的1640完全培养基t75培养瓶中,每三天传代一次,维持其良好增殖状态。
1.3.2靶细胞的染料标记:收集k562细胞培养悬液于15ml离心管内,置于水平离心机内1000rpm离心10分钟。用生理盐水洗涤两次后,单细胞状态重悬于500ul无血清1640培养基中,充分混匀后取样,使用c6计数待用。另取一定体积1640无血清培养基稀释csfe染料工作液并充分混匀,将其迅速加入待用的k562细胞悬液中混匀,使csfe染料终浓度为5μm,细胞悬液密度为1×107cells/ml。置于37℃的5%co2孵育箱内,每5分钟摇动一次。孵育10分钟后加入等体积4℃预冷的胎牛血清,置于4℃冰箱内终止染色反应10分钟。补足生理盐水混匀后1000rpm离心10分钟,弃上清重悬于1640完全培养基中,置于孵育箱内孵育1小时。收集细胞,生理盐水洗涤一次,1640完全培养基重悬细胞,取样用c6计数待用。
1.3.3效应细胞的分离:如样本是全血,则进行外周血单个核细胞(peripheralbloodmononuclearcell,pbmc)的分离,即将全血样本1800rpm离心10分钟,去血浆后等体积生理盐水重选细胞,轻轻加在淋巴细胞分离液上离心后,小心吸走白膜层。用生理盐水洗涤两次,1640完全培养基重悬细胞,取样稀释于白细胞计数液,用c6计数待用。如样本为免疫细胞培养产物,则仅用生理盐水洗涤两次。取样稀释于1640完全培养基中,用c6计数待用。
1.3.4效应细胞nk细胞亚群的标记:取约含5×105个单个核细胞(pbmc)的100ul效应细胞悬液,按流式检测抗体说明书进行cd3-cd56+nk细胞亚群抗体标记,用bdfacscalibur流式细胞仪进行检测,分析有核细胞中nk细胞比例。如是pbmc则进行红细胞裂解步骤,如是免疫细胞培养产物则不进行红细胞裂解步骤。
1.3.5效应细胞活细胞率的检测:如样本为免疫细胞培养产物,则需检测其有核细胞活细胞率。取100ul细胞悬液,加入pi染料至终浓度3.75ug/ml,平衡5-10分钟,流式细胞仪检测效应细胞死亡率。
1.3.6效应细胞与靶细胞混合培养:设定效靶比(nk细胞与标记csfe的靶细胞之比)为0∶1、1∶1、2∶1、4∶1及6∶1,依据效应细胞有核细胞密度、效应细胞活率及其有核细胞中nk细胞比例计算所需效应细胞体积,混合效应细胞及靶细胞,用1640完全培养基补足至200ul共培养体系。各组至少三个复孔,混匀共孵育2.5小时。
1.3.7靶细胞死亡率检测:重悬1.3.6步的混合培养细胞,加入pi染料至终浓度3.75ug/ml,平衡5-10分钟,流式细胞仪检测各管csfe阳性的靶细胞死亡率。
1.3.8nk细胞杀伤活力的计算:将各管靶细胞死亡率带入公式(实验组靶细胞死亡率-对照组靶细胞死亡率)/(1-对照组靶细胞死亡率)×100%,计算各效靶比nk细胞杀伤活性平均值。
1.4质量控制
1.4.1靶细胞的质量控制按固定密度接种传代k562细胞,观察生长状态及速度,必要时检测细胞周期等指标。控制csfe标记后k562在1640完全培养基中的平衡时长,要求标记后的k562细胞系自然死亡率低于3%,靶细胞与效应细胞fh1通道平均荧光强度(medianfluorescenceintensity,mif)值之比为80倍以上,以此保障每次检测所用靶细胞的一致性。
1.4.2效应细胞的质量控制edta抗凝管采集外周血标本,离体后3小时内送达实验室,置于室温放置,效应细胞备用时重悬于1640完全培养基中。如非新鲜血液样本或长时间放置于其他条件,需检测有核细胞活率,以有核细胞的细胞密度、活细胞率及nk比例计算各效靶比所需pbmc悬液体积。
1.4.3流式细胞仪的质量控制按仪器固定维护校准,用fh3通道检测pi荧光染料信号,用accuric6计量细胞绝对数功能替代手工计量效应细胞或靶细胞悬液密度。
1.4.4数据分析的质量控制同一名技术人员在同一标准下进行读数,如有数据的取舍和分析则由固定三名技术人员共同完成。与仅有靶细胞对照管相比,效靶细胞混合孵育检测管内靶细胞浓度低于前者85%时,认为部分靶细胞死亡后完全破裂,致使检测结果低于实际靶细胞死亡率,则该检测结果不可信。
1.5统计学方法采用spss21.0软件进行统计学分析,各指标以x±s表示,因素相关性分析采用多重线性回归分析,两组间均数比较采用独立样本t检验。p<0.05为差异有统计学意义。
2结果
2.1纳入研究对象本基本情况
正常参考值组包含健康志愿者47例,女性22例[28岁-68岁,平均(47.5±9.1)岁],男性25例[27岁-69岁,平均(47.3±11.2)岁]。肿瘤组包含各类肿瘤患者61例[肝癌23例,胰腺癌8例,肺癌与结肠癌各5例,直肠癌、胃癌、乳腺癌和卵巢癌各3例,甲状腺癌2例,肾癌、阴道癌、下咽癌、食道癌、肝胆管癌及胆管癌各1例],女性18例[36岁-84岁,平均(60.2±11.9)岁],男性43例[17岁-85岁,平均(53.9±13.5)岁],详见表1。
表1一般情况表(例)
2.2nk比例差异
分析nk杀伤活性检测中各来源标本中nk细胞占有核细胞比例分布情况(见图1),结果提示肿瘤患者组中该参数分布情况为10.8%±7.87%(3%-42%),偏度为1.714,峰度为3.609;健康志愿者者组中该参数分布情况为12.31%±5.25%(4%-23%),偏度为0.576,峰度为-0.860;其他来源组中该参数分布情况为13.48%±12.30%(0.11%-75.19%),偏度为3.095,峰度为11.283,由此可见各来源nk杀伤活性待检标本有核细胞中nk细胞比例分布规律各异,如在计算效应细胞与靶细胞比例时不考虑该参数的巨大差异,仅以有核细胞数与靶细胞数计算,可能会导致检测结果的偏移,无法实现对nk细胞杀伤能力的严谨评估。
2.3nk细胞杀伤活性相关因素分析
将年龄按44岁以下、45岁-59岁、60岁以上进行分组,分析了年龄、性别及是否患过肿瘤与nk杀伤活性之间的相关。结果提示当效靶比为1和2时年龄、性别及是否患过肿瘤三者与nk杀伤活性之间无相关性(p>0.05)。效靶比为4及6时,性别、年龄与其相关性无统计学意义(p>0.05),患过肿瘤与否与其相关性有统计学意义(p<0.05)。基于本研究数据的分析,未发现年龄及性别影响外周血nk细胞杀伤能力,而是否患过肿瘤将会对该指标产生影响,且应将效靶比设定在4或6以上。
2.4nk细胞杀伤活性正常参考值范围
考虑本研究健康对照组数据表现为年龄和性别均与nk细胞杀伤活性无关,故在确定参考值范围时,不再依据年龄或性别进行分组。参考范围的确定采用百分位数法,设定nk细胞杀伤活性双侧90%参考值范围,结果见表2。
表2外周血nk细胞杀伤活性正常参考值范围(%)
2.5肿瘤患者的nk杀伤活性特征
比较肿瘤患者组与健康志愿者组外周血nk细胞杀伤活性差异,结果提示效靶比分别为4和6时,两组间差异有统计学意义(p>0.05)。当效靶比为1与2时,两组间差异无统计学意义(p<0.05)。提示肿瘤患者该指标低于健康供者,且该检测项目应考虑设定效靶比为4与6。
参考文献
1.cooper,m.a.,etal.,humannaturalkillercells:auniqueinnateimmunoregulatoryroleforthecd56(bright)subset.blood,2001.97(10):p.3146-51.
2.cerwenka,a.andl.l.lanier,naturalkillercells,virusesandcancer.natrevimmunol,2001.1(1):p.41-9.
3.yu,j.,a.g.freud,andm.a.caligiuri,locationandcellularstagesofnaturalkillercelldevelopment.trendsimmunol.34(12):p.573-82.
4.vivier,e.,etal.,functionsofnaturalkillercells.natimmunol,2008.9(5):p.503-10.
5.parham,p.anda.moffett,variablenkcellreceptorsandtheirmhcclassiligandsinimmunity,reproductionandhumanevolution.natrevimmunol.13(2):p.133-44.
6.orange,j.s.,naturalkillercelldeficiency.jallergyclinimmunol.132(3):p.515-25;quiz526.
7.cosiskimarana,h.r.,.j.santanadasilva,andj.moreiradeandrade,nkcellactivityinthepresenceofil-12isaprognosticassaytoneoadjuvantchemotherapyincervicalcancer.gynecoloncol,2000.78(3pt1):p.318-23.
8.prolo,p.,etal.,physiologicmodulationofnaturalkillercellactivityasanindexofalzheimer′sdiseaseprogression.bioinformation,2007.1(9):p.363-6.
9.karakhanova,s.,etal.,prognosticandpredictivevalueofimmunologicalparametersforchemoradioimmunotherapyinpatientswithpancreaticadenocarcinoma.brjcancer.112(6):p.1027-36.
10.ishii,e.,hemophagocyticlymphohistiocytosisinchildren:pathogenesisandtreatment.frontpediatr.4:p.47.
11.brunner,k.t.,etal.,quantitativeassayofthelyticactionofimmunelymphoidcellson51-ct-labelledallogeneictargetcellsinvitro;inhibitionbyisoantibodyandbydrugs.immunology,1968.14(2):p.181-96.
12.fehniger,t.a.,etal.,potentialmechanismsofhumannaturalkillercellexpansioninvivoduringlow-doseil-2therapy.jclininvest,2000.106(1):p.117-24.
13.lichtenfels,r.,etal.,care-lass(calcein-release-assay),animprovedfluorescence-basedtestsystemtomeasurecytotoxictlymphocyteactivity.jimmunolmethods,1994.172(2):p.227-39.
14.valiathan,r.,etal.,evaluationofaflowcytometry-basedassayfornaturalkillercellactivityinclinicalsettings.scandjimmunol.75(4):p.455-62.
15.cho,d.,etal.,cytotoxicityofactivatednaturalkillercellsagainstpediatricsolidtumors.clincancerres.16(15):p.3901-9.
16.konjevic,g.,v.jurisic,andi.spuzic,associationofnkcelldysfunctionwithchangesinldhcharacteristicsofperipheralbloodlymphocytes(pbl)inbreastcancerpatients.breastcancerrestreat,2001.66(3):p.255-63.
17.karimi,m.a.,etal.,measuringcytotoxicitybybioluminescenceimagingoutperformsthestandardchromium-51releaseassay.plosone.9(2):p.e89357.
18.kim,g.g.,etal.,anovelmultiparametricflowcytometry-basedcytotoxicityassaysimultaneouslyimmunophenotypeseffectorcells:comparisonstoa4h51cr-releaseassay.jimmunolmethods,2007.325(1-2):p.51-66.
19.defining,establishing,andverifyingrisintheclinicalaboratory.approvedguideline3rded.clinicallaboratoryandstandardsinstitute,2008.
20.mace,e.m.,etal.,cellbiologicalstepsandcheckpointsinaccessingnkcellcytotoxicity.immunolcellbiol.92(3):p.245-55.
- 还没有人留言评论。精彩留言会获得点赞!