一种交联透明质酸或其盐的交联度的测定方法与流程
本发明属于化学分析技术领域,具体涉及一种交联透明质酸或其盐的交联度的测定方法。
背景技术:
透明质酸(ha)是由葡糖醛酸和乙酰基氨基葡糖双糖单位重复连接组成的链状聚阴离子黏多糖,它是构成玻璃体、皮肤、关节滑液和软骨组织的重要成分,参与多种细胞活动和生理过程。由于ha具有良好的保湿性、润滑性、黏弹性、非免疫原性以及对药物吸收的促进作用,因此在临床上得到了广泛应用。但是天然的ha存在水溶性强、在组织中易扩散和被酶降解、体内存留时间短等缺点,而经修饰和交联后得到的ha衍生物则可弥补这些缺陷。一些交联ha产品已被成功应用于预防术后粘连、治疗骨关节炎、软组织填充、组织工程和药物控释。
交联透明质酸钠是交联透明质酸钠上糖环活性基团与交联剂在一定条件下反应,交联形成的凝胶大分子,也称为交联玻璃酸钠凝胶,是交联ha衍生物的一种。交联反应是大分子包含空间多位点的复杂反应。交联透明质酸钠的理化性质与交联度的大小密切相关。因此,交联度是控制交联透明质酸钠产品质量的指标之一。
目前,对于交联ha凝胶或交联透明质酸钠凝胶中交联剂残留量这一指标已有一定研究。如cn105606602a公开了一种测定交联透明质酸钠凝胶中二巯基聚乙二醇残留的方法,葛翠兰等(“交联透明质酸凝胶中交联剂的hplc测定”,葛翠兰,《上海生物医学杂志》,2006年第27卷第4期,第223-225页)公开了一种交联透明质酸钠凝胶中二乙烯基砜残留量的测定方法,cn103630536a公开了一种测定交联透明质酸钠凝胶中聚乙二醇残留量的方法,cn106053369a公开了一种医用交联透明质酸钠凝胶中游离透明质酸钠含量的检测方法,cn102435708a公开了一种交联透明质酸水凝胶中交联剂1,2,7,8-二环氧辛烷残留量的测定方法。但是,上述方法均只能检测凝胶中残留的交联剂的含量,或定性分析交联的程度,而无法用于交联度的测定。
因此,在本领域期望得到一种能够直接测定交联透明质酸或其盐的交联度的方法。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供一种交联透明质酸或其盐的交联度的测定方法。该方法能够直接测定交联透明质酸或其盐的交联度。
为达此目的,本发明采用以下技术方案:
本发明提供一种交联透明质酸或其盐的交联度的测定方法,包括如下步骤:
(1)将交联透明质酸或其盐在透明质酸酶的作用下发生酶解反应,生成寡糖和二糖;
(2)用液相色谱联合紫外吸收,分离和检测所述寡糖和二糖,得到吸光度-保留时间色谱图,分别测定所述寡糖和二糖的色谱峰面积;
(3)
本发明中,对交联透明质酸及其盐的交联方式没有特殊限制,示例性地可以是以二乙烯基砜、二巯基聚乙二醇或其组合作为交联剂进行交联。以二巯基聚乙二醇交联的透明质酸钠为例,其酶解反应式如下:
需要说明的是,步骤(2)中的“吸光度-保留时间色谱图”是指以保留时间为横坐标,吸光度为纵坐标的色谱图,二糖和寡糖的色谱峰面积是以吸光度对保留时间积分得到。由于液相色谱的保留时间与淋出体积为线性关系,因此也可以将保留时间等效替换为淋出体积,以吸光度对淋出体积积分得到色谱峰面积,从而计算交联度。
作为本发明的优选技术方案,所述酶解反应的温度为10-45℃,例如可以是10℃、12℃、15℃、18℃、20℃、22℃、25℃、28℃、30℃、32℃、35℃、38℃、40℃、42℃或45℃等;时间为5-24h,例如可以是5h、6h、7h、8h、10h、12h、13h、15h、18h、20h、22h或24h等。
作为本发明的优选技术方案,所述酶解反应是在磷酸盐缓冲液中进行。
优选地,所述磷酸盐缓冲液的浓度为1-10mmol/l,例如可以是1mmol/l、2mmol/l、3mmol/l、4mmol/l、5mmol/l、6mmol/l、7mmol/l、8mmol/l、9mmol/l或10mmol/l等;ph为4.5-8.0,例如可以是4.5、4.8、5.0、5.2、5.5、5.8、6.0、6.2、6.5、6.8、7.0、7.2、7.5、7.8或8.0等。
优选地,所述磷酸盐缓冲液的浓度为5mmol/l,ph为6.0。
作为本发明的优选技术方案,所述交联透明质酸或其盐与所述磷酸盐缓冲液的质量体积比为0.1-0.4g/ml;例如可以是0.1g/ml、0.15g/ml、0.2g/ml、0.25g/ml、0.3g/ml、0.35g/ml或0.4g/ml等。
作为本发明的优选技术方案,所述透明质酸酶的添加量为1×102-1×104iu/g底物。
需要说明的是,本发明中“1×102-1×104iu/g底物”是指对应每克交联透明质酸或其盐,添加1×102-1×104酶活力单位的透明质酸酶。
作为本发明的优选技术方案,在所述酶解反应结束后还对反应液进行纯化操作。
优选地,所述纯化操作为:将反应液离心,取上清液过0.22μm的滤膜。
作为本发明的优选技术方案,所述液相色谱为体积排除色谱(sec)。
优选地,所述体积排除色谱的色谱柱为分子筛色谱柱。
作为本发明的优选技术方案,所述体积排除色谱的流动相为kcl-磷酸盐缓冲液。
优选地,所述kcl-磷酸盐缓冲液的浓度为0.1-1mol/l,例如可以是0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l、0.5mol/l、0.6mol/l、0.7mol/l、0.8mol/l、0.9mol/l或1mol/l等;进一步优选为0.25mol/l。
优选地,所述kcl-磷酸盐缓冲液的ph为5.0-7.0,例如可以是5.0、5.2、5.5、5.8、6.0、6.2、6.5、6.8或7.0等;进一步优选为6.2。
优选地,所述流动相的流速为0.1-5ml/min,例如可以是0.1ml/min、0.2ml/min、0.3ml/min、0.4ml/min、0.5ml/min、0.6ml/min、0.7ml/min、0.8ml/min、0.9ml/min、1ml/min、1.5ml/min、2ml/min、2.5ml/min、3ml/min、3.5ml/min、4ml/min、4.5ml/min或5ml/min等;进一步优选为0.5ml/min。
流动相的流速会影响色谱柱的分离效率。若流速过慢,则容易导致寡糖和二糖延流动方向扩散,色谱峰变宽,准确度下降;若流速过快,则容易导致寡糖和二糖的色谱峰重叠。
作为本发明的优选技术方案,所述紫外吸收的检测波长为210-400nm,例如可以是210nm、232nm、250nm、280nm、300nm、310nm、330nm、350nm、380nm或400nm等;进一步优选232nm。
作为本发明的优选技术方案,所述测定方法包括如下步骤:
(1)将交联透明质酸或其盐溶解于1-10mmol/l,ph=4.5-8.0的磷酸盐缓冲液中,加入1×102-1×104iu/g底物的透明质酸酶,在10-45℃下酶解反应5-24h,生成寡糖和二糖,将反应液离心,取上清液过0.22μm的滤膜,得到含有所述寡糖和二糖的滤液;
(2)用体积排除色谱分离所述滤液中的寡糖和二糖,并用232nm波长处的紫外吸收进行检测,得到吸光度-保留时间色谱图,分别测定所述二糖和寡糖的色谱峰面积;
(3)
与现有技术相比,本发明具有以下有益效果:
本发明提供的测定方法能够实现对交联透明质酸或其盐的交联度的直接测定,测定结果稳定可靠,具有较高的可重复性。
附图说明
图1为实施例1中实验组和对照组的色谱图;
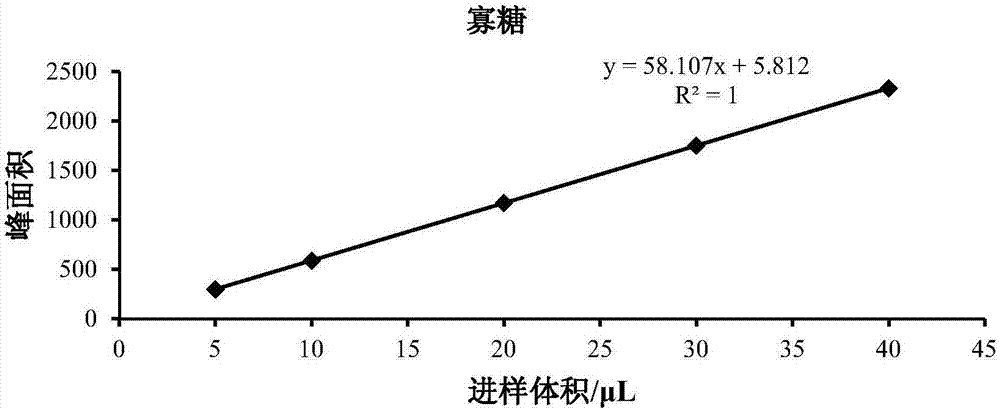
图2为寡糖的峰面积-进样体积曲线图;
图3为二糖的峰面积-进样体积曲线图。
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述具体实施方式仅仅是帮助理解本发明,不应视为对本发明的具体限制。
下述实施例中对寡糖和二糖进行分离和检测的条件如下:
体积排除色谱
流动相:0.25mol/l,ph=6.2的kcl-磷酸盐缓冲液,流速0.5ml/min;
色谱柱:以亲水性乙烯基聚合物为基材的sec色谱柱(tosohtskgelg-oligo-pw,7.8mm×30cm,7μm),柱温25℃。
紫外吸收
检测器:紫外分光光度计或二极管阵列检测器,检测波长232nm。
对照组如下:
空白溶液:0.7ml,ph=7.4的磷酸盐缓冲液;
二巯基聚乙二醇溶液:1.2mg/ml,0.7ml;
透明质酸钠二糖溶液:2mg透明质酸钠二糖溶于0.7ml,ph=7.4的磷酸盐缓冲液中。
实施例1
一种交联透明质酸或其盐的交联度的测定方法,包括如下步骤:
(1)取0.7g二巯基聚乙二醇交联的透明质酸钠作为待测样品,溶解于3ml磷酸盐缓冲液(5mmol/l,ph=6)中,加入1×103iu透明质酸酶,在37℃水浴下反应24h,摇匀后取1ml反应液,在12×103r/min转速下离心15min,取上清液过0.22μm的滤膜,得到含有寡糖和二糖的滤液;
(2)取10μl上述滤液,用体积排除色谱和紫外吸收对其进行分离和检测,得到吸光度-保留时间色谱图,分别测定二者的色谱峰面积;
(3)
按照实施例1的方法,分别以空白溶液、二巯基聚乙二醇溶液和透明质酸钠二糖溶液为对照组,代替二巯基聚乙二醇交联的透明质酸钠,测定色谱图,结果如图1所示。
由图1可知:空白溶液组的色谱图中,在寡糖和二糖保留时间处没有其他杂质峰存在;在二巯基聚乙二醇溶液组的色谱图中,二巯基聚乙二醇的色谱峰面积小于实验组的5%,可忽略不计;在实验组的色谱图中,寡糖的保留时间为12min,二糖的保留时间为20min,与透明质酸钠二糖溶液组的结果一致。
按照实施例1的方法,分别测定步骤(2)中进样量为5μl、20μl、30μl、40μl时,寡糖和二糖的色谱峰面积,构建峰面积-进样体积曲线,结果如图2和图3所示。
由图2和图3可知,寡糖和二糖的色谱峰面积均与进样体积/物质的量线性相关,表明本发明提供的方法理论可行。
按照实施例1的方法,重复6次实验,测定寡糖和二糖的色谱峰面积以及交联透明质酸钠的交联度,结果如下表1所示。
表1
由表1可知,本发明提供的测定方法结果稳定,具有较高的可重复性。
实施例2
与实施例1的区别在于,二巯基聚乙二醇交联的透明质酸钠的浓度为0.35g/3ml,透明质酸酶的添加量为0.5×103iu。
实施例3
与实施例1的区别在于,二巯基聚乙二醇交联的透明质酸钠的浓度为1.05g/3ml,透明质酸酶的添加量为1.5×103iu。
实施例4
与实施例1的区别在于,步骤(1)中的磷酸盐缓冲液的ph为4.5。
实施例5
与实施例1的区别在于,步骤(1)中的磷酸盐缓冲液的ph为8.0。
实施例6
与实施例1的区别在于,步骤(1)中酶解反应的时间为5h。
按照上述实施例1-6的方法测定寡糖和二糖的色谱峰面积以及交联透明质酸钠的交联度,每个实施例设置3个平行试验,结果如下表2所示。
表2
表2的结果表明,本发明提供的方法对于不同浓度的样品的测定结果基本相同,测定结果稳定可靠。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!