一种应用斑马鱼毒性和代谢同步进程分析中药毒性作用新方法与流程
本发明涉及一种用模式生物斑马鱼毒性评价和斑马鱼代谢同步进程法分析中药毒性作用的应用新方法,尤其是在用斑马鱼评价测试药毒性的过程中同步分析代谢产物,具体涉及斑马鱼毒性和代谢同步进程分析法,即用斑马鱼评价中药成分、组分或提取物的毒性过程中,同步动态分析代谢产物,评价中药及中药配伍毒性作用的同时,分析毒性的产生与成分变化的相关性,以发现中药中毒及配伍减毒的原因。
背景技术:
壮骨中药肝毒性受到关注,仙灵骨葆口服制剂引起的肝损伤风险于2016年12月药品不良反应信息通报发布,该制剂处方中重用君药淫羊藿(占整个组方的70%),其潜在肝毒性风险逐渐显现,为临床应用带来巨大挑战[国家食品药品监督管理总局.警惕仙灵骨葆口服制剂引起的肝损伤风险。药物不良反应信息通报(第72期),http://www.sda.gov.cn/ws01/cl0078/167184.html]。
早期发现中药潜在毒性,揭示中药中毒的物质基础,研究中药配伍减毒及其机制,对临床安全用药至关重要,但相关研究进展缓慢。
药物的毒性产生与其在体内的代谢转化密切相关,但现有体内、体外模型难以进行毒性与代谢的实时、动态同步观察,是制约中药毒性物质发现的难点、瓶颈:体内毒性实验周期较长、成本高、化合物用量大,不适于高效的毒性筛选及代谢动态检测;体外实验不能体现在体代谢的综合效果,无法进行毒性和代谢同步分析。
斑马鱼(zebrafish)是近年来进行药物在体高通量筛选、毒性和代谢研究等热门模式生物。斑马鱼发育速度快,在1周内形成主要的脏器及代谢酶系,幼鱼体小透明,实验可在微板中进行并实时动态观察。我们之前专利[zl201010258459.3,cn201210202465.6,cn201210187191.8]公开了“斑马鱼药物代谢新方法”,该方法突破了量微成分难以进行在体代谢的瓶颈,具简单、高效、低成本、化合物用量少(μg~mg)的优势,药液基质干扰小等优势。斑马鱼毒性评价法已在国内、外广泛用于药物的安全性评价。与哺乳动物类似,药物经斑马鱼作用后发生代谢转化,产生药效或毒性,故采用斑马鱼进行毒性动态评价的同时可同步分析代谢物,即实现斑马鱼毒性和代谢同步进程分析。
现有斑马鱼毒性评价仅限于给予测试药后的鱼形态、行为、死亡情况等毒性指标,而未见同步分析测试药成分动态变化,不能发现毒性的产生与成分的相关性,从而不能揭示测试药致毒的相关物质基础,也不能揭示中药配伍后毒性的变化与成分变化的相关性,从而难于揭示配伍减毒机制。
综上,我们课题组建立了斑马鱼代谢方法,斑马鱼评价药物毒性已被国内外认可并应用,在斑马鱼毒性评价过程中,药物也经斑马鱼作用发生代谢转化,故药物的斑马鱼毒性评价和代谢分析可同步进行,有利于发现致毒相关物质。整个实验样品用量少(μg至几mg),即用斑马鱼可实现量微样品的毒性与代谢同步动态分析。这方面研究在国内尚属空白。
技术实现要素:
发明目的:本发明所要解决的技术问题是克服现有技术的不足,提供一种操作方便、成本低、样品用量少、劳动强度低,且仅需在一般实验室就可进行的中药斑马鱼毒性与代谢同步进程分析方法,以期简单、高效评价中药毒性同时发现代谢成分变化,发现致毒相关物质,亦可揭示中药配伍减毒与代谢相关的作用机制。
技术方案:为了实现以上目的,本发明采取的技术方案为:
一种斑马鱼毒性评价和代谢产物同步进程分析的方法,其特征在于,包括以下步骤:
步骤一:斑马鱼受精卵的收集:控制斑马鱼成鱼日夜节律,昼夜时间控制在14-12小时:10-12小时,收集受精卵,置于培养皿中,加入培养基,于26℃-30℃恒温培养箱中培养;
步骤二:给药方案:取受精后1天(1dpf)斑马鱼胚胎放入盛有胚胎培养基的培养板中,根据培养板孔的大小每孔加入培养基1-2ml,每个孔里放6-10条幼鱼,分为数组,溶媒阴性对照组和测试药物组,加药方法是吸净培养板孔里的培养基后迅速加入溶液,溶媒对照浓度与药物测试组的溶媒浓度相当,将培养板密封放入26℃-30℃恒温培养箱中培养,培养周期5-7天,必要时隔1-3天将每个孔里的溶液用移液枪吸出部分,再加入等体积新溶液,培养至斑马鱼胚胎受精后3-8天;
步骤三:斑马鱼给药期间(受精后1天到受精后8天)定时每天或隔天取药液和鱼体,药液吹干,鱼体匀浆后吹干,加溶剂溶解,高速离心或用微孔滤膜过滤后,取上清液或滤液,采用高效液相色谱或联用质谱技术分析代谢产物。
步骤四:斑马鱼毒性评价:斑马鱼给药期间(受精后1天到受精后8天),每天计数鱼死亡数量,用spss16.0软件计算各测试药给药后的动态斑马鱼半数致死浓度lc50。定时用显微镜观察主要脏器形态变化或斑马鱼行为变化。
步骤五:斑马鱼毒性评价和斑马鱼代谢的相关分析:将斑马鱼毒性结果如死亡率或半数致死浓度lc50与经斑马鱼作用后的测试药成分代谢动态变化进行相关分析,分析致毒的相关成分。
作为优选方案,其中步骤(1)和(2)所述的培养温度为26℃-29℃。
作为优选方案,其中步骤(2)所述的培养板为96孔、48孔、24孔、12孔或6孔培养板,其中较优的为24孔板,每孔加入培养基1-2ml,每孔放5-10条幼鱼。
作为优选方案,其中步骤(2)所述的溶媒为水或者是含有0~1%二甲基亚砜(dmso)助溶剂的水溶液。对于水溶性较差的药物,采用二甲基亚砜助溶,可以有效提高药物的水溶性,使药物均匀分散于水溶中。
作为优选方案,步骤(2)中斑马鱼鱼龄选择受精后1天的斑马鱼胚胎或斑马鱼幼鱼,培养周期为4-5天,培养至受精后5-6天。
作为优选方案,步骤(3)中取样时间为给药后每天取药液,必要时取鱼体。取样时间点为受精后1天到受精后6天,每天连续取样。
作为优选方案,步骤(3)中吹干后的药液或鱼体,用含50%至100%甲醇的水溶液溶解,于每分钟10000转至29000转离心10到20分钟,或用0.2-0.45μm的微孔滤膜过滤,离心后上清液或过滤后滤液,用高效液相色谱仪或联用质谱仪分析代谢产物。
作为优选方案,毒性观察时间可为受精后1-6天,每天计数鱼死亡数量,观察鱼行为或形态变化,在受精后2天-4天在显微镜下观察并拍照。
作为优选方案,本发明所述的斑马鱼毒性和代谢同步进程分析法受试药物为量微成分、组分、中药提取物或配伍其它中药的毒性与代谢同步分析。所述的受试药物为淫羊藿的代表黄酮成分、淫羊藿总黄酮、淫羊藿水煎液及分别配伍巴戟天水煎液。
研究拟选择抗骨质疏松活性明确且有肝毒风险的知名壮骨中药淫羊藿为代表。淫羊藿为小檗科植物淫羊藿(epimediumbrevicornummaxim.)、箭叶淫羊藿[epimediumsagittatum(sieb.etzucc.)maxim.]、柔毛淫羊藿(epimediumpubescensmaxim.)或朝鲜淫羊藿(epimediumkoreanumnakai)的干燥地上部分。具补肾阳,强筋骨,祛风湿之功效。近年来,临床用量大、社会关注度广的淫羊藿潜在肝毒性已引起重视[王伽伯,肖小河,杜晓曦,邹正升,宋海波,郭晓昕。基于转化毒理学的中药肝损害客观辨识与早期诊断.中国中药杂志,2014,39(1):5-9。]。淫羊藿化学成分复杂,主含黄酮类、多糖、有机酸及生物碱等成分,其中淫羊藿黄酮成分是抗骨质疏松的主要活性成分,其安全性对淫羊藿临床合理应用至关重要。但受评价模型及化合物数量等制约,淫羊藿毒性相关研究相对薄弱且进展缓慢,何物质有毒亟待明晰。中药配伍减毒是中药组方的重要方面,寻找淫羊藿配伍减毒药味对其临床安全应用具有重要意义。但中药配伍的毒性变化也难以在体、高效评价,致毒相关的物质基础难以同步阐释。
本发明选择淫羊藿及其黄酮成分/组分,以及配伍巴戟天为中药代表测试药。
与小鼠、大鼠、犬等哺乳动物不同,斑马鱼的体积较小,口服或注射给药方式很困难,因此,步骤(2)中本发明将受试药物溶解于斑马鱼所生活的溶媒中,斑马鱼会自主的通过腔道和皮肤连续的从溶液中吸收受试药物,给药方式简单、易行。
有益效果:本发明提供的斑马鱼毒性和代谢同步进程分析方法,和现有技术相比具有以下优点:克服传统动物模型无法进行量微成分在体毒性与代谢同步动态分析的技术盲点,克服体外模型无法体现在体综合作用效果的缺陷,可实现毒性评价过程中同步分析代谢产物的动态变化。实验可在微板中进行,化合物用量少(μg~mg),周期短,为高效评价中药及中药配伍毒性作用,同时分析代谢成分动态变化,揭示致毒相关物质提供新思路与方法,具有意义。
附图说明
图1淫羊藿水煎液(yyh)、淫羊藿总黄酮(ytf)、朝藿定c、淫羊藿苷及分别配伍巴戟天水煎液(bjt)暴露斑马鱼(1dpf-6dpf)即给药后0天-5天(0d-5d)的药液动态变化高效液相色谱图。
色谱峰1:朝藿定a;色谱峰2:朝藿定b;色谱峰3:朝藿定c;色谱峰4:淫羊藿苷;色谱峰5:箭藿苷c;色谱峰6:宝藿苷i。
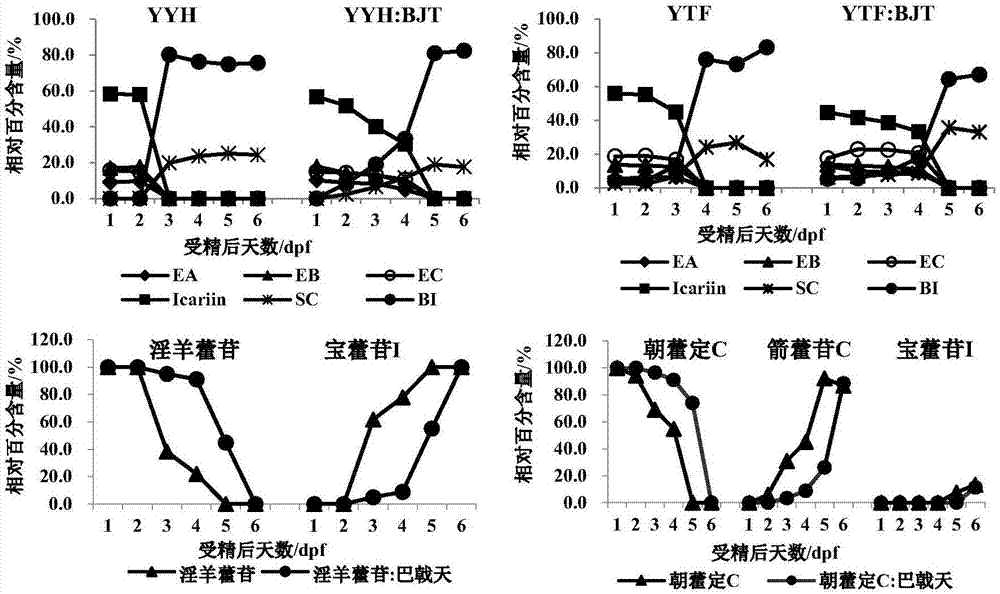
图2淫羊藿水煎液(yyh)、淫羊藿总黄酮(ytf)、朝藿定c、淫羊藿苷及分别配伍巴戟天水煎液(bjt)暴露斑马鱼(1dpf-6dpf)即给药后0天-5天(0d-5d)的相对百分含量动态变化图。
ea,朝藿定a;eb,朝藿定b;ec,朝藿定c;icariin,淫羊藿苷;sc,箭藿苷c;bi,宝藿苷i。
图3淫羊藿水煎液(yyh)、淫羊藿总黄酮(ytf)、朝藿定c、淫羊藿苷及分别配伍巴戟天水煎液(bjt)暴露斑马鱼5天后的斑马鱼鱼体高效液相色谱图。
图4淫羊藿水煎液(yyh)、淫羊藿总黄酮(ytf)、朝藿定c、淫羊藿苷及分别配伍巴戟天水煎液(bjt)暴露斑马鱼后在3dpf的显微镜观察照片(放大100倍)。
图5淫羊藿水煎液(yyh)、淫羊藿总黄酮(ytf)、朝藿定c、淫羊藿苷及分别配伍巴戟天水煎液(bjt)对斑马鱼死亡率(受精后2天-6天)的影响。淫羊藿与巴戟天水煎液、淫羊藿总黄酮、朝藿定c和淫羊藿苷的浓度单位分别是μg生药·ml-1,μg·ml-1和μmol·l-1。
图6朝藿定c与其代谢物箭藿苷c的相对百分含量动态变化相关分析
图7箭藿苷c的相对百分含量与斑马鱼的半数致死浓度lc50(2dpf,3dpf至4dpf,5dpf或6dpf)的动态变化相关分析。画圈数据点表示朝藿定c和淫羊藿总黄酮(ytf)及其分别配伍巴戟天水煎液(bjt)的数据被排除,原因是在此圈点的斑马鱼5dpf和/或6dpf的lc50值不再降低,即毒性增加达到稳定。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的具体的样品浓度、给药方式与方法、斑马鱼毒性观察及代谢产物分析方法仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例
基于斑马鱼毒性和代谢同步进程法分析巴戟天配伍淫羊藿的减毒作用。
1、材料
实验动物斑马鱼成鱼(南京大学模式动物研究所),来自德国tuebingen品系。
试剂与仪器培养基母液:2.9‰nacl、0.1258‰kcl、0.4851‰cacl2·2h2o、0.8118‰mgso4·7h2o;巴戟天药材(产地广东,亳州中药饮片厂,批号:1404018038);淫羊藿药材(产地陕西,南通三越中药饮片有限公司,批号:161203);淫羊藿总黄酮/黄酮组分(ytf,自制,含朝藿定a、朝藿定b、朝藿定c和淫羊藿苷(icariin)的含量分别为3.0%、7.1%、9.9%和29.0%);朝藿定a(epimedina,ea,纯度98%,批号:jz16042502)、朝藿定b(epimedinb,eb,纯度98%,批号:jz15110905)、箭藿苷c(sagittatosidec,sc,又名2"-鼠李糖基淫羊藿次苷ii,2"-o-rhamnosylicarisideii,纯度98%,批号:jz16071606)、朝藿定c(epimedinc,朝藿定c,纯度98%,批号jz16042503)、宝藿苷i(baohuosidei,bi,纯度98%,批号jz15070602)购自南京景竹生物科技有限公司;淫羊藿苷(纯度98%,批号:110737-200415)购自中国食品药品检定研究院。nikonaphaphot-2ys2显微镜(日本nikon尼康公司);生化培养箱spx-80(宁波海曙赛褔实验仪器厂),olypusstylustg-4相机(日本olypus公司);agilent1200型系列高效液相色谱仪(美国agilent公司);organomationn-evaptm112氮吹仪(美国origanomationassociates公司);kq3200b超声波清洗器(昆山市超声仪器有限公司);mettlertoledoab135-s分析天平(瑞士mettlertoledo公司)。
2、实验方法
高效液相色谱(hplc)分析液相条件1:色谱柱为agilentzorbaxc18色谱柱(5μm,150mm×4.6mm)和c18预柱(4.6mm×12.5mmid,5μm);流动相,a为0.1%甲酸水;b为乙腈;a十b=100%,采用梯度洗脱:10%b(0~5)min;10%~25%b(5~15min);25%~90%b(15~40min);90%b(40~45min)。柱温:30℃;流速:1ml·min-1。
液相条件2:色谱柱为agilentzorbaxc18色谱柱(5μm,250mm×4.6mm)和c18预柱(4.6×12.5mmid,5μm);流动相,a为0.1%甲酸水;b为乙腈;a十b=100%,采用梯度洗脱b相比例随时间的变化:10%~23%(0~10min);23%~26%(10~35min);26%~48%(35~65min);48%~80%(65~80min);80%~100%(80~85min);100%~100%(85~90min)。柱温:25℃;流速1.0ml·min-1;检测波长270、272、325和353nm;运行时间:90min。进样量:20μl。
采用上述液相条件,分析淫羊藿水煎液(yyh)、淫羊藿总黄酮(ytf)、朝藿定c、淫羊藿苷及分别配伍巴戟天水煎液(bjt)经斑马鱼作用前后的6个代表黄酮成分,分别为朝藿定a、朝藿定b、朝藿定c、淫羊藿苷、箭藿苷c及宝藿苷i。淫羊藿水煎液及巴戟天水煎液提取方法:取淫羊藿或巴戟天药材,适当粉碎,称取10g,加水200ml浸泡半小时,煎煮两次,每次30min,滤过,合并滤液,分别加纯水适量定容,即得淫羊藿水煎液(yyh,10mg生药·ml-1)或巴戟天水煎液(bjt,20mg生药·ml-1)贮备液。
斑马鱼毒性和代谢同步进程法分析yyh、ytf、朝藿定c和淫羊苷及其配伍bjt的安全性及代谢物将收集到的受精卵移入培养基中,28.5℃培养箱中继续培养24h待用。将1dpf的健康胚胎置于24孔板中给药,每孔8个胚胎,每个实验组16个胚胎。包括0.4%dmso培养基组、yyh及其配伍bjt(1μg生药·ml-1yyh:1μg生药·ml-1bjt)(200、500、1000、1500和2000μg生药·ml-1,以yyh计)、bjt(200、500、1000、2000和3000μg生药·ml-1)、ytf及其配伍bjt(1μg·ml-1ytf:10μg生药·ml-1bjt)(10、25、50、100和200μg·ml-1,以ytf计)、代表黄酮成分淫羊藿苷、朝藿定c及分别配伍bjt(1μmol·l-1淫羊藿苷或朝藿定c:20μg生药·ml-1bjt)(10、25、50、100和200μmol·l-1,以淫羊藿苷或朝藿定c计),具体给药浓度见表1。每孔给药液2ml,将24孔板放入28.5℃恒温培养箱中培养,培养至6dpf。并于3dpf在显微镜下观察各实验组的斑马鱼的主要脏器形态,观察并记录2dpf~6dpf斑马鱼的死亡数。
上述斑马鱼1dpf~6dpf毒性观察同步,各组分别选取代表浓度(表2),增加幼鱼数量供代谢取样(增设6~12孔,每孔8个胚胎):yyh及其配伍bjt(1μg生药·ml-1yyh:1μg生药·ml-1bjt)(500μg生药·ml-1,以yyh计)、ytf及其配伍bjt(1μg·ml-1ytf:10μg生药·ml-1bjt)(50μg·ml-1,以ytf计)、代表黄酮成分淫羊藿苷、朝藿定c及分别配伍bjt(1μmol·l-1淫羊藿苷或朝藿定c:20μg生药·ml-1bjt)(25μmol·l-1,以淫羊藿苷或朝藿定c计)。分别于斑马鱼暴露溶液后0、1、2、3、4及5天时吸取药液适量(表2),于-20℃冰箱放置。
表1不同测试组斑马鱼毒性评价的给药浓度。
yyh:淫羊藿水煎液;bjt:巴戟天水煎液;yyh配伍bjt:1μg生药·ml-1淫羊藿:1μg生药·ml-1巴戟天;ytf:淫羊藿总黄酮;ytf配伍bjt:1μg·ml-1ytf:10μg生药·ml-1巴戟天;淫羊藿苷配伍bjt:1μmol·l-1淫羊藿苷:20μg生药·ml-1巴戟天;朝藿定c,朝藿定c;朝藿定c配伍bjt:1μmol·l-1朝藿定c:20μg生药·ml-1bjt。
表2不同测试药斑马鱼代谢浓度与取样量。
yyh:淫羊藿水煎液;bjt:巴戟天水煎液;yyh配伍bjt:1μg生药·ml-1淫羊藿:1μg生药·ml-1巴戟天;ytf:淫羊藿总黄酮;ytf配伍bjt:1μg·ml-1ytf:10μg生药·ml-1巴戟天;淫羊藿苷配伍bjt:1μmol·l-1淫羊藿苷:20μg生药·ml-1巴戟天;朝藿定c,朝藿定c;朝藿定c配伍bjt:1μmol·l-1朝藿定c:20μg生药·ml-1bjt
斑马鱼代谢样品处理将上述各组1~6dpf(给药后0-5天)代谢药液分别于室温空气吹干,加80%甲醇适量溶解,同时将各组斑马鱼鱼体(给药后第5天,即6dpf)吸干药液,用生理盐水洗涤3次,鱼体加入80%甲醇0.5ml匀浆,yyh及其配伍bjt(3mg生药·ml-1)、ytf及其配伍bjt(50μg·ml-1)、代表黄酮成分淫羊藿苷、朝藿定c及分别配伍bjt(25μmol·l-1),15000rpm离心10min,上清进样20μl进行hplc分析。
数据分析利用数据统计软件spss16.0计算各供试液对斑马鱼半数致死浓度(lc50)。
3、结果
3.1淫羊藿黄酮成分经斑马鱼作用前后的高效液相色谱动态分析结果
yyh、ytf、朝藿定c、淫羊藿苷及分别配伍bjt经斑马鱼作用1~6dpf的药液高效液相色谱见图1,经与对照品对照,色谱峰1、2、3、4、5和6为淫羊藿6个主要黄酮成分,分别为朝藿定a(ea)、朝藿定b(eb)、朝藿定c(ec)、淫羊藿苷、箭藿苷c(sc)和宝藿苷i(bi)。
以外标法计算上述6个主要淫羊藿黄酮成分含量,并以每个成分占6个黄酮含量和的百分比计为相对百分含量(图2),可见yyh和ytf中以朝藿定a、朝藿定b、朝藿定c和淫羊藿苷为主,约占6个黄酮成分的93.7%~100%,经斑马鱼代谢脱糖基后,全部动态转化为箭藿苷c和宝藿苷i。斑马鱼代谢研究表明,朝藿定a、朝藿定b和淫羊藿苷均转化为共同代谢物宝藿苷i,而朝藿定c则产生箭藿苷c。
yyh单独给予1dpf斑马鱼2天后(3dpf),朝藿定a、朝藿定b、朝藿定c和淫羊藿苷全部代谢,伴随代谢物箭藿藿c和宝藿苷i相对含量显著升高至19.8%和80.2%;但是,配伍bjt后,朝藿定a、朝藿定b、朝藿定c和淫羊藿苷的代谢速度减慢,于给药后4天后(5dpf)代谢完全,箭藿藿c和宝藿苷i相对含量动态上升至最高值,分别为24.1%和75.9%。
ytf单独给予斑马鱼3天后(4dpf),朝藿定a、朝藿定b、朝藿定c和淫羊藿苷全部代谢,箭藿藿c和宝藿苷i含量显著升高至24.0%和76.0%;但在给药后5天后(6dpf),箭藿藿c含量下降至16.8%,宝藿苷i含量上升至83.2%,系箭藿藿c脱鼠李糖基转变为宝藿苷i所致。与yyh相似,ytf配伍巴戟天后,朝藿定a、朝藿定b、朝藿定c和淫羊藿苷的代谢速度减慢,于给药4天后(5dpf)代谢完全。
淫羊藿代表黄酮成分淫羊藿苷和朝藿定c分别单独给予斑马鱼后1天内(2dpf)均相对稳定,未见相应代谢物宝藿苷i和箭藿藿c;给药后2~4天(3~5dpf),淫羊藿苷和朝藿定c均动态代谢完全,淫羊藿苷的代谢物宝藿苷i相对含量上升至100%;朝藿定c的主要代谢物为箭藿藿c(相对含量为92.3%),另一次要代谢物为宝藿苷i(相对百分含量为7.7%)。淫羊藿苷和朝藿定c分别配伍bjt给予斑马鱼后,代谢速度均减慢,给药后3天内(4dpf),淫羊藿苷和朝藿定c相对百分含量均未明显改变,相应代谢物宝藿苷i和箭藿藿c未见明显产生;直至给药后4天(5dpf),淫羊藿苷和朝藿定c量分别开始显著降至44.9%和73.2%,相应代谢物宝藿苷i和箭藿藿c量分别显著上升至55.1%和26.8%;至6dpf,淫羊藿苷和朝藿定c均全部代谢,淫羊藿苷的代谢物宝藿苷i含量上升至100%;朝藿定c的主要代谢物箭藿藿c含量显著上升至88.7%,并开始产生次要代谢物宝藿苷i(11.3%)。
yyh、ytf、朝藿定c、淫羊藿苷及分别配伍bjt经斑马鱼作用5天(6dpf)后的斑马鱼体内吸收高效液相色谱见图3,与0.4%dmso空白组比较,除了ytf配伍bjt斑马鱼组可检测到代谢物宝藿苷i及箭藿藿c,但信噪比较小,箭藿藿c和宝藿苷i的信噪比分别为1.2和4.8;其他各组斑马鱼色谱峰均未见与空白组明显差异。结果提示淫羊藿黄酮成分或其代谢物是可吸收入斑马幼鱼体内的,但含量很低,有时难以检测到。
3.2yyh、ytf、朝藿定c、淫羊藿苷及其配伍bjt对斑马鱼的毒性作用
以光学显微镜检视斑马鱼脏器形态和死亡率为主要指标考查毒性。在显微镜下观察结果:斑马鱼受精3dpf后孵化成幼鱼,各脏器发育基本完全,鱼体透明,在载薄片上易侧卧,显微镜下检视脏器形态清楚、直观。0.4%dmso培养基组为空白对照组,在给药期间未见死亡,亦未见致鱼脏器产生毒性。各供试液均与培养基组比,3dpf斑马鱼显微检视结果见图4。
yyh在500μg生药·ml-1及以下浓度对斑马幼鱼(3dpf)脏器未见明显改变,鱼存活最大浓度1000μg生药·ml-1致斑马幼鱼肠道略肿大;bjt在2000μg生药·ml-1及以下浓度对斑马幼鱼(3dpf)脏器未见明显改变,在3000μg生药·ml-1时致斑马鱼肠道略肿大、围心囊肿大,脑部和眼部变小,眼部色素变浅;yyh配伍bjt后,在2000μg生药·ml-1(以yyh计)时致斑马鱼肠道肿大、围心囊肿大,脑部和眼部变小,眼部色素变浅。
与培养基组比,ytf在200μg·ml-1致斑马幼鱼围心囊水肿、肠道肿大,脑部和眼部变小,眼部色素变浅,但配伍巴戟天后,相同浓度组幼鱼(3dpf)脏器均未见明显改变;淫羊藿苷及其配伍bjt各浓度组斑马幼鱼(3dpf)脏器均未见明显改变;朝藿定c在200μmol·l-1时致斑马幼鱼(3dpf)全部死亡,配伍巴戟天后则全部存活,但见斑马幼鱼围心囊水肿、肠道肿大,脑部和眼部变小,眼部色素变浅。
死亡率结果:yyh、ytf、朝藿定c、淫羊藿苷及各自配伍bjt对斑马鱼的死亡率与给药浓度和时间基本呈依赖性,其给药时间-给药剂量-死亡率关系见图5。
yyh给药后24h,1500和2000μg生药·ml-1组鱼全部死亡;1000μg生药·ml-1浓度组鱼死亡37.5%,在给药后48h,死亡率上升至56.25%,并至6dpf保持不变;200和500μg生药·ml-1组给药期间鱼的死亡率小于6.25%。巴戟天各浓度组鱼在给药期间无死亡。淫羊藿配伍巴戟天(1μg生药·ml-1yyh:1μg生药·ml-1bjt,以yyh计)后,给药后24h,1500和2000μg生药·ml-1鱼死亡率分别降低至31.3%和50%,并至6dpf保持不变;其他各浓度组鱼给药期间未见死亡。
ytf给药后48h,仅见200μg·ml-1浓度组斑马幼鱼(3dpf)死亡56.25%;给药后72h,100和200μg·ml-1浓度组斑马幼鱼均全部死亡;配伍巴戟天后(1μg·ml-1ytf:10μg生药·ml-1bjt,以ytf计),给药后72h,200μg·ml-1浓度组斑马幼鱼全部死亡,100μg·ml-1()浓度组斑马幼鱼仅死亡18.75%,给药后96h,100μg·ml-1组斑马幼鱼死亡率达43.75%(5dpf),并至6dpf保持不变;ytf及其配伍巴戟天,低于50μgytf·ml-1浓度组鱼给药期间不死亡或少量死亡(小于20%)。
淫羊藿苷及其配伍巴戟天各浓度组鱼在给药期间均无死亡。
200和100μmol·l-1朝藿定c致斑马幼鱼全部死亡的时间分别是给药后48h和72h,朝藿定c配伍巴戟天(1μmol·l-1朝藿定c:20μg生药·ml-1bjt,以朝藿定c计)后,均推迟至给药后96h全部死亡。其他低浓度朝藿定c及其配伍巴戟天对鱼毒性相当(部分死亡或不死亡)。
3.3代谢物箭藿藿c的动态变化与斑马鱼动态毒性(lc50)的相关分析
淫羊藿黄酮成分按代谢特征主要分别两类,一类是朝藿定a、朝藿定b和淫羊藿苷,其共同主要代谢物为含一个鼠李糖基的宝藿苷i;另一类是朝藿定c,其主要代谢物为含两个鼠李糖基的箭藿藿c。朝藿定a、朝藿定b、朝藿定c和淫羊藿苷是淫羊藿中主要黄酮成分。朝藿定a、朝藿定b和淫羊藿苷对斑马鱼的毒性小,本实验以淫羊藿苷为代表,发现其给予斑马鱼后动态转化为宝藿苷i,但未见斑马鱼产生毒性,提示代谢转化不会增加淫羊藿苷毒性。而朝藿定c给予斑马鱼后,发现动态转化为箭藿藿c后毒性增加,提示代谢转化增加朝藿定c毒性。本实验发现,yyh、ytf和朝藿定c及各自配伍巴戟天的斑马鱼代谢物箭藿藿c主要来源于朝藿定c,二者的相对含量呈明显的负相关(r2>0.9)(图6)。
spss16.0计算各样品给药后的动态斑马鱼半数致死浓度lc50(2dpf或3~6dpf),并与箭藿藿c的相对含量动态变化进行相关分析(图7)。发现斑马鱼产生毒性(死亡)至毒性达到高峰稳定期间,lc50值的降低(即毒性增加)与箭藿藿c的增加密切相关(r2>0.9),提示淫羊藿中黄酮的毒性主要来自朝藿定c的代谢物箭藿藿c。yyh、ytf和朝藿定c配伍bjt后,代谢物箭藿藿c的产生速度减慢,相应致鱼的毒性也减缓,特别是yyh与bjt配伍后,给药期间未见斑马鱼畸形。
结果讨论
本发明提出并采用斑马鱼毒性和代谢同步进程分析法,即用斑马鱼评价毒性的过程中同步动态分析代谢物的变化,用于分析淫羊藿水煎液、淫羊藿总黄酮、朝藿定c、淫羊藿苷及其配伍巴戟天水煎液经斑马鱼作用后的毒性与代谢动态变化,发现淫羊藿致毒关键黄酮成分及配伍巴戟天后的减毒作用。
采用1dpf斑马鱼胚胎实验,于3dpf时孵化成幼鱼,至5dpf各种脏器基本发充完全,鱼体小且透明,实验可在微板中进行,在显微镜下检视脏器形态。以鱼的脏器形态变化和死亡率为指标评价毒性,具有可视、动态、实时等优势。斑马幼鱼即具有较完善的代谢酶系和肠道菌群,也是进行药物代谢研究的理想模式动物。可见,本实验选择1~6dpf斑马鱼可实现药物毒性与代谢的同步动态分析。
近年来淫羊藿的潜在毒性风险受到重视,其抗骨质疏松主要活性成分黄酮的安全性至关重要,此外寻找配伍减毒药,对临床安全有效使用淫羊藿具有意义。故本研究以淫羊藿水煎液、淫羊藿总黄酮、代表黄酮成分(淫羊藿苷和朝藿定c)及其配伍巴戟天水煎液为研究对象,用斑马鱼评价毒性同时分析淫羊藿黄酮类成分的代谢变化,一方面揭示淫羊藿致毒相关物质及其与代谢转化的关系,另一方面探讨巴戟天配伍淫羊藿的减毒作用。
斑马鱼毒性评价发现,淫羊藿苷各浓度(10~200μmol·l-1)及其配伍巴戟天给药期间(1~6dpf)均未致斑马鱼脏器变形,也未致斑马鱼死亡,且不受淫羊藿苷动态转化为主要代谢物宝藿苷i的影响,提示代谢转化及配伍巴戟天均不会影响淫羊藿苷的安全性。淫羊藿(1000μg生药·ml-1及以上浓度)、淫羊藿总黄酮(50μg·ml-1及以上浓度)和朝藿定c(50μmol·l-1及以上浓度)致斑马鱼中毒(斑马鱼畸形或死亡),毒性与给药浓度和时间相关,配伍巴戟天后,毒性均减弱,主要表现为致鱼中毒浓度提高、鱼出现死亡时间延迟、死亡率降低等。
经斑马鱼作用后同步分析黄酮成分动态变化发现,淫羊藿水煎液和淫羊藿总黄酮中主要黄酮成分朝藿定a、朝藿定b、朝藿定c和淫羊藿苷分别于斑马鱼3和4dpf全部代谢转化为箭藿藿c和宝藿苷i;朝藿定c于3~5dpf逐步转化为箭藿藿c,各组斑马鱼死亡率也相应随代谢物的增加而增加,提示代谢物是潜在致毒因素,其中朝藿定a、朝藿定b和淫羊藿苷的共同代谢物为宝藿苷i,安全性相对较好,推测朝藿定c的代谢物箭藿藿c可能是致毒的关键成分。
淫羊藿水煎液、淫羊藿总黄酮、朝藿定c及各自配伍巴戟天水煎液组经斑马鱼作用后,朝藿定c和代谢物箭藿藿c的相对含量动态变化呈明显负相关(r2>0.90),提示箭藿藿c主要来源于朝藿定c。进一步对箭藿藿c的动态变化与斑马鱼动态半数致死浓度lc50进行相关分析,发现箭藿藿c动态增加至稳定过程中,斑马鱼lc50也相应动态线性降低(r2>0.97),提示鱼毒性随着箭藿藿c的增加而增加。巴戟天配伍淫羊藿、淫羊藿总黄酮和朝藿定c后,箭藿藿c产生时间延迟,对斑马鱼的毒性也相应减弱,提示巴戟天可能通过减慢朝藿定c代谢而减毒。
斑马鱼毒性和代谢同步进程分析法突破了现有体内、外模型无法同步进行毒性与代谢动态分析的技术瓶颈,具有样品用量小、劳动强度小、高效率、高实验在体化、微板化等优点,为高效辩识中药毒性物质及发现配伍减毒作用提供新方法。
- 还没有人留言评论。精彩留言会获得点赞!