一种乳酸脱氢酶检测试剂的制作方法
本发明涉及临床体外检测试剂
技术领域:
,特别涉及一种乳酸脱氢酶检测试剂。
背景技术:
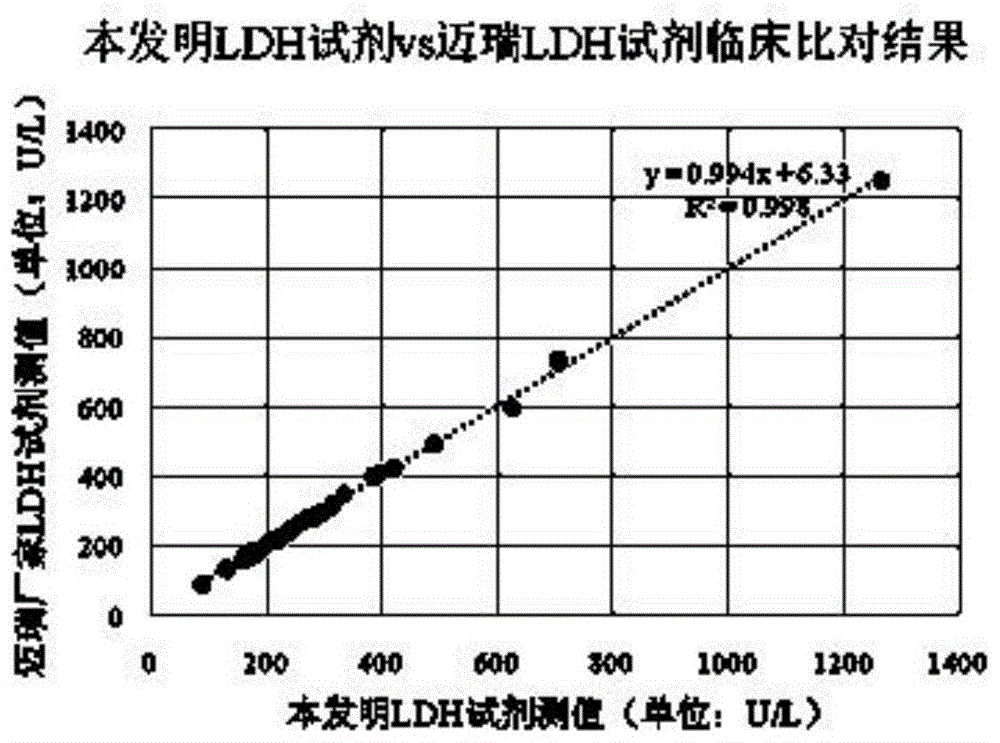
:心脏是人体最活跃的脏器之一,为完成各种生理活动,心脏内存在大量的细胞酶。心肌梗死(ami)发生后,因为心肌缺血坏死或细胞膜通透性增加,使得心肌内的细胞酶释放入血,根据心肌受损的情况不同,血清酶升高的幅度也不同,因此可以用血清酶的变化来反应ami的发生以及病灶的大小。同时由于各种酶的生理特性不同,例如:在细胞内定位不同,分子量大小不同,生物半寿期不同等等,造成了各种酶入血的时间,入血的快慢以及在血清内的持续时间不同,为临床用作病程和愈后的判断提供了依据。以乳酸脱氢酶(ldh)为例,乳酸脱氢酶是一种氧化还原性酶,能够催化丙酮酸和乳酸的相互转化反应。根据亚单位的不同,乳酸脱氢酶可以分成5种同工酶,分别属于两种类型:心肌型和肌肉型。由于临床上乳酸脱氢酶的增高主要见于心肌梗死、肝炎、恶性肿瘤、肺梗塞、白血病、溶血性贫血、肾脏疾病、进行性肌萎缩等疾病。因此,乳酸脱氢酶的活性可以用来评价细胞和组织的损害情况,测定人体血清中乳酸脱氢酶的活性对疾病的诊断具有重要的辅助意义。由于目前国内对于乳酸脱氢酶检测的手段相对缺乏,因此,提供一种能够准确检测人体血清中乳酸脱氢酶的检测方法或者检测试剂已经成为本领域亟待解决的技术问题。技术实现要素:为解决上述技术问题,本发明提供一种乳酸脱氢酶检测试剂,该试剂配制简单,成本低廉,性能稳定,测值准确。能够用于生化仪检测人体血清中乳酸脱氢酶的活性,可以对乳酸脱氢酶进行准确、定量的体外监测,辅助诊断患者的病情。本发明所述的一种乳酸脱氢酶的检测试剂,包括试剂r1和试剂r2;所述试剂r1包括:第一碱性缓冲体系,l-乳酸锂,螯合剂,第一电解质平衡剂,第一酸度调节剂;所述试剂r2包括:第二碱性缓冲体系,β-nad,第二电解质平衡剂,第二酸度调节剂。优选的,所述试剂r1中各成分的含量为:第一碱性缓冲体系30-60g/l,l-乳酸锂3.5-6.5g/l,螯合剂0.1-0.4g/l,第一电解质平衡剂5.5-9.5g/l,第一酸度调节剂0.1-1ml/l。优选的,所述试剂r2中各成分的含量为:第二碱性缓冲体系8-10g/l,β-nad15-20g/l,第二电解质平衡剂5.5-9.5g/l,第二酸度调节剂1-5ml/l。优选的,使用时,所述试剂r1与所述试剂r2的混合比例为3:1-5:1;所述试剂r1与所述试剂r2的混合比例优选4:1。优选的,所述试剂r1与所述试剂r2的混合液的ph值为8.0-9.0。优选的,所述第一电解质平衡剂为氯化钾或者氯化钠;和/或,所述第二电解质平衡剂为氯化钾或者氯化钠。优选的,所述第一碱性缓冲体系为tris碱缓冲体系、mes缓冲体系、pipes缓冲体系中的一种;和/或,所述第二碱性缓冲体系为tris碱缓冲体系、mes缓冲体系、pipes缓冲体系中的一种。优选的,所述螯合剂为egta或者edta。优选的,所述试剂r1还包括防腐剂,和/或,所述试剂r2还包括防腐剂。防腐剂的加入有利于保证试剂的稳定性,使试剂可以长时间储存待用而不变质。优选的,所述防腐剂为pc300、山梨酸钾、叠氮钠中的一种或几种。优选的,所述第一酸度调节剂为盐酸;和/或,所述第二酸度调节剂为盐酸。本发明提供的乳酸脱氢酶检测试剂包括试剂r1和试剂r2,其中试剂r1中各物质的选择依据如下:第一碱性缓冲体系,其主要是缓冲作用,保证反应时外环境的稳定,确保检测结果不会受到波动和影响;l-乳酸锂,作为反应底物参与反应,在乳酸脱氢酶的催化作用下还原成为丙酮酸;螯合剂,能有效的螯合金属离子,防止一些杂质离子对检测反应引起不必要的干扰;第一电解质平衡剂,用于保持反应体系的电解质平衡,模拟人体内血液环境,保证反应的进行是在体外相同条件下进行的,从而保证检测的真实性和可靠性;第一酸度调节剂,用于中和第一碱性缓冲体系中的部分碱,调节缓冲体系的酸碱度,使缓冲体系满足使用所需的ph值。试剂r2中各物质的选择依据如下:第二碱性缓冲体系,其主要是缓冲作用,保证反应时外环境的稳定,确保检测结果不会受到波动和影响;β-nad,作为反应底物参与反应,在乳酸脱氢酶的催化作用下,由β-nad+还原成为β-nadh,引起340nm波长处吸光度的变化,从而来定量的测定乳酸脱氢酶的活性,吸光度的增加速率与样品中乳酸脱氢酶的活性成正比;第二电解质平衡剂,用于保持反应体系的电解质平衡,模拟人体内血液环境,保证反应的进行是在体外相同条件下进行的,从而保证检测的真实性和可靠性;第二酸度调节剂,用于中和第二碱性缓冲体系中的部分碱,调节缓冲体系的酸碱度,使缓冲体系满足使用所需的ph值。应用本发明进行体外样品检测时,操作方法如下,将试剂r1与试剂r2按比例混合均匀后,用样本针吸取适量样本加入试剂r1与试剂r2的混合液中,由于样本中的乳酸脱氢酶能够催化β-nad+还原成为β-nadh,且β-nadh的生成速率与样本中的乳酸脱氢酶活性成正比。因此,通过计算混合液的吸光度变化率(a1-a0)/△t,可以计算出样本中乳酸脱氢酶的活性。作为优选,为了使测量结果更加准确。应用本发明进行体外样品检测时,还可以通过如下操作方法进行:设置生化分析仪的波长为340nm,,用样本针吸取适量样本加入试剂r1中,混合均匀后,在37±5℃条件下进行孵育,孵育时间为1~5min,然后加入试剂r2,在37±5℃条件下孵育1min后开始读取起始吸光度值a0,由于样本中的乳酸脱氢酶能够催化β-nad+还原成为β-nadh,且β-nadh的生成速率与样本中的乳酸脱氢酶活性成正比,因此,待其在37±5℃条件下反应1~3min后再读取吸光度值a1,通过计算它们的吸光度变化率(a1-a0)/△t,进而计算出乳酸脱氢酶的活性。本发明提供的乳酸脱氢酶检测试剂,准确度高,重复性好,抗干扰能力强,适用于生化分析仪,临床使用价值较大。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是为了更好地理解本发明,而不应该理解为对本发明的限制。对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1为实施例7中本发明ldh试剂与迈瑞ldh试剂临床对比结果图。具体实施方式为了使本
技术领域:
的人员更好地理解本申请中的技术方案,下面将结合具体实施例对本申请进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本申请保护的范围。实施例1本实施例1提供的一种乳酸脱氢酶检测试剂由以下组分组成:试剂r1,tris碱缓冲体系30g/l,l-乳酸锂3.5g/l,egta0.1g/l,氯化钾5.5g/l,盐酸0.1ml/l;试剂r2,tris碱缓冲体系8g/l,β-nad15g/l,氯化钾5.5g/l,盐酸1ml。使用时,将试剂r1与试剂r2以5:1的比例混合,混合液的ph值为8.3。实施例2本实施例2提供的一种乳酸脱氢酶检测试剂由以下组分组成:试剂r1,tris碱缓冲体系60g/l,l-乳酸锂6.5g/l,egta0.4g/l,氯化钾9.5g/l,盐酸1ml/l;试剂r2,tris碱缓冲体系10g/l,β-nad20g/l,氯化钾9.5g/l,盐酸5ml。使用时,将试剂r1与试剂r2以3:1的比例混合,混合液的ph值为8.8。实施例3本实施例3提供的一种乳酸脱氢酶检测试剂由以下组分组成:试剂r1,tris碱缓冲体系45g/l,l-乳酸锂4.5g/l,edta0.25g/l,氯化钾7.5g/l,盐酸0.5ml/l,叠氮钠1g/l;试剂r2,tris碱缓冲体系9g/l,β-nad18g/l,氯化钾7.5g/l,盐酸3ml,pc3000.5g/l。使用时,将试剂r1与试剂r2以3:1的比例混合,混合液的ph值为8.0。实施例4本实施例4提供的一种乳酸脱氢酶检测试剂由以下组分组成:试剂r1,mes缓冲体系45g/l,l-乳酸锂4.5g/l,edta0.25g/l,氯化钠7.5g/l,盐酸0.5ml/l,叠氮钠1.5g/l;试剂r2,mes缓冲体系9g/l,β-nad18g/l,氯化钠7.5g/l,盐酸3ml,山梨酸钾0.5g/l。使用时,将试剂r1与试剂r2以4:1的比例混合,混合液的ph值为8.5。实施例5本实施例5提供的一种乳酸脱氢酶检测试剂由以下组分组成:试剂r1,pipes缓冲体系45g/l,l-乳酸锂4.5g/l,edta0.25g/l,氯化钠7.5g/l,盐酸0.5ml/l,叠氮钠1g/l;试剂r2,pipes缓冲体系9g/l,β-nad18g/l,氯化钠7.5g/l,盐酸3ml,山梨酸钾1.5g/l。使用时,将试剂r1与试剂r2以3.5:1的比例混合,混合液的ph值为9.0。实施例6本实施例6提供的一种乳酸脱氢酶检测试剂由以下组分组成:试剂r1,pipes缓冲体系50g/l,l-乳酸锂5.5g/l,edta0.3g/l,氯化钠7.8g/l,盐酸0.8ml/l,叠氮钠1.2g/l;试剂r2,pipes缓冲体系9g/l,β-nad18g/l,氯化钠7.5g/l,盐酸3ml,山梨酸钾1.5g/l。使用时,设置生化分析仪的波长为340nm,用样本针吸取10μl样本加入试剂240μlr1中,混合均匀后,在37±1℃条件下进行孵育,孵育时间为3min,然后加入试剂60μlr2,混合液的ph值为8.7;在37℃条件下孵育1min后开始读取起始吸光度值a0,由于样本中的乳酸脱氢酶能够催化β-nad+还原成为β-nadh,且β-nadh的生成速率与样本中的乳酸脱氢酶活性成正比,因此,待其在37℃条件下反应3min后再读取吸光度值a1,通过计算它们的吸光度变化率(a1-a0)/△t,进而计算出乳酸脱氢酶的活性。实施例7:乳酸脱氢酶检测试剂的性能检测将实施例1用于乳酸脱氢酶测定试剂盒,并从互换性,线性,准确度,精密度,抗干扰能力,稳定性及相关性来进行评价。(1)临床样本比对采用40例临床样本,分别用生化仪进行测试,每个样本重复测试2次,与ldh竞品试剂盒迈瑞测试值做对比(用本试剂与已上市竞品试剂盒测试临床样本,将他们的值做线性回归,相关系数大于0.99,表明该试剂与竞品测试值存在良好的相关性,测值相一致,故互换性良好。),分别求出检测结果的均值。同时,以迈瑞ldh试剂测值(xi)为自变量,以本发明ldh试剂检测结果均值(yi)为因变量求出线性回归方程。计算线性回归的相关系数(r),如下表所示:表1.临床比对结果由表1数据可知,本发明提供的试剂配方测定的ldh平均值与迈瑞ldh试剂的测试值很接近,相对偏差在±5.0%以内,线性拟合度大于0.9900,表明本发明的ldh试剂互换性很好。(2)线性范围测试用接近线性区间下限的低活性样品(s1)和接近线性区间上限的高活性样品(s6),混合成6个稀释活性(xi)。分别用生化仪测试,每个稀释活性测试3次,分别求出检测结果的均值(yi)。以稀释活性(xi)为自变量,以检测结果均值(yi)为因变量求出线性回归方程。计算线性回归的相关系数(r),如下表所示:表2.线性范围分析结果由表2数据可知,本发明提供的试剂配方测定的ldh线性区间为(25~1000)u/l,线性相关系数大于0.9900,表明本发明的试剂呈现良好的线性关系,且检测的精密度良好。(3)准确度检测采用国家标准物质的高、低值校准血清各两支,对其进行测试,每支重复3次,与参考靶值比较,见表3:表3.准确度测试结果参考物质靶值测值1测值2测值3均值准确度s11901901891921900.18%s24204204214194200.00%由表3数据可知,本发明提供的试剂配方测定的ldh平均值与靶值很接近,与靶值的相对偏差均在±10.0%以内,表明本发明的试剂准确度高。(4)精密度测试取ldh浓度高、中、低值三个血清样本,重复10次,计算其变异系数,结果见表4:表4.精密度测试结果序号低值中值高值测值128247641测值227246642测值327247643测值427245642测值527246643测值627245641测值726244640测值827245641测值927246639测值1027245639av27246641sd0.51.01.4cv1.9%0.4%0.2%结果显示,ldh测值高、中、低值的cv均小于5.0%,表明本发明的ldh试剂测试精密度高。(5)抗干扰能力对本发明的试剂进行抗干扰能力测试,评价其抗干扰能力,下表中的干扰物及干扰物的浓度均参考《ep-07临床化学中的干扰实验》第二版。实验采用往低值和高值样本中加入一定浓度的干扰物质,再在生化仪上进行测试,每个干扰物重复测试3次,计算它与不加干扰物的测试值偏差。表5.干扰物测试由以上数据显示可知,往低值和高值样本的中添加一定浓度的干扰物对于测试过程中本发明的ldh试剂没有干扰影响,测值的偏差均在±10.0%以内。这结果表明,本发明的ldh试剂抗干扰能力优良。(6)稳定性测试对本发明的试剂进行稳定性测试,将它们分别放在4℃和37℃环境下贮存7天,分别在第4、第7天对朗道质控品和自制质控品进行测试,计算7天后测试结果偏差值,结果见表4:表6.稳定性测试结果结果表明,ldh试剂在2~8℃环境下储存7天后的偏差在±10%以内,37℃环境下储存7天后的偏差仍然在±10.0%以内。表明本发明试剂具有良好的稳定性,能满足检测需求。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1