一种细胞计数方法、装置、计算机设备及可读存储介质与流程
本申请涉及医疗影像技术领域,尤其是涉及一种细胞计数方法、装置、计算机设备及可读存储介质。
背景技术:
在数字病理图像分析中,细胞的分割和检测对获取病理图像信息有着至关重要的作用,通常是图像自动分析的基础。
目前,数字病理图像的分析过程大多是通过分析病理数字扫描切片图像而进行的。然而,由于病理数字扫描切片的数字病理图像具有一定的复杂性,例如病理图像中可能出现噪声、污染、模糊、前景与背景对比度较差等问题,并且由于细胞形态差异以及细胞重叠等情况,因此难以进行稳定且准确的细胞的分割和检测过程。
由于数字病理图像的分析通常需要在数字扫描切片上进行数字病理图像分析,而数字扫描仪市场价格较高,同时,扫描一张数字切片耗时较长,约为2~5分钟,且扫描后的数字切片图像文件大小约1g,由此导致使用数字扫描切片进行图像智能判读的成本高效率低。同时,对应数字病理图像的分析只能在配备有数字扫描仪的医疗与科研机构进行,巨大的数字切片存储容量,限制了图像自动分析方法的应用推广。
技术实现要素:
有鉴于此,本申请的目的在于提供一种细胞计数方法、装置、计算机设备及可读存储介质,在不进行数字切片全片扫描的情况下,通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的细胞染色图像,通过对细胞染色图像进行分析处理,提高了对于图像分析判读的效率。
本申请实施例提供了一种细胞计数方法,所述细胞计数方法包括:
将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像的多张二值图像;其中,所述二值图像中包括多个第一连通量;
确定所述二值图像对应的距离图像包括的多个峰值点,以及每个所述第一连通量包括的峰值点个数;
选取包括多个所述峰值点的第二连通量,并对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数;
基于所述第二连通量中包括的细胞个数,以及所述二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。
一种可选的实施方式中,通过以下方法对所述颜色分离模型进行训练:
获取第一细胞染色图像样本,并将所述细胞染色图像样本输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像样本;
对所述第二细胞染色图像样本进行无监督机器学习,基于预设的聚类中心特征,得到多个颜色特征聚类,当每个所述颜色特征聚类中各个样本特征的相似度满足预设的相似度阈值时,完成训练,得到训练好的颜色分离模型。
一种可选的实施方式中,所述将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像的多张二值图像,包括:
获取第一细胞染色图像,并将所述第一细胞染色图像输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像;
将所述第二细胞染色图像输入至训练好的颜色分离模型中,分离出所述第二细胞染色图像中各像素位置对应的细胞类别;
基于所述第二细胞染色图像中各像素位置对应的细胞类别,生成对应不同细胞类别的多张二值图像。
一种可选的实施方式中,所述确定所述二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数,包括:
对所述二值图像进行距离变换,得到二值图像对应的距离图像,确定所述距离图像包括的多个峰值点,以及每个峰值点对应的像素位置;
基于每个峰值点对应的像素位置,以及每个第一连通量对应的像素位置,确定每个第一连通量包括的峰值点个数。
一种可选的实施方式中,所述对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数,包括:
根据预设的收缩距离阈值,对大于所述收缩距离阈值的第三连通量进行收缩处理,得到多个第四连通量;
对所述第四连通量进行距离变换,确定每个第四连通量包括的峰值点个数;
选取包括多个峰值点的第五连通量,并对所述第五连通量进行收缩处理,直至得到多个包括一个峰值点的第六连通量,确定所述第六连通量的个数为所述第二连通量中包括的细胞个数。
一种可选的实施方式中,通过以下方法确定收缩距离阈值:
基于所述二值图像对应的距离图像,确定每个第三连通量对应的距离值,构建包括多个距离值的距离列表;
从所述距离列表中,选取不小于预设距离阈值的最小值为所述收缩距离阈值。
一种可选的实施方式中,还包括:
基于不同细胞类别对应的细胞总数,确定不同细胞类别的占比情况。
本申请实施例还提供了一种细胞计数装置,所述细胞计数装置包括:
输入模块,用于将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像对应不同细胞类别的多张二值图像;其中,所述二值图像中包括多个第一连通量;
第一确定模块,用于确定所述二值图像对应的距离图像包括的多个峰值点,以及每个所述第一连通量包括的峰值点个数;
分割模块,用于选取包括多个所述峰值点的第二连通量,并对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数;
第二确定模块,用于基于所述第二连通量中包括的细胞个数,以及所述二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。
一种可选的实施方式中,所述细胞计数装置还包括:训练模块;
所述训练模块具体用于:通过以下方法对所述颜色分离模型进行训练:
获取第一细胞染色图像样本,并将所述细胞染色图像样本输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像样本;
对所述第二细胞染色图像样本进行无监督机器学习,基于预设的聚类中心特征,得到多个颜色特征聚类,当每个所述颜色特征聚类中各个样本特征的相似度满足预设的相似度阈值时,完成训练,得到训练好的颜色分离模型。
一种可选的实施方式中,所述输入模块具体用于:
获取第一细胞染色图像,并将所述第一细胞染色图像输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像;
将所述第二细胞染色图像输入至训练好的颜色分离模型中,分离出所述第二细胞染色图像中各像素位置对应的细胞类别;
基于所述第二细胞染色图像中各像素位置对应的细胞类别,生成对应不同细胞类别的多张二值图像。
一种可选的实施方式中,所述第一确定模块具体用于:
对所述二值图像进行距离变换,得到二值图像对应的距离图像,确定所述距离图像包括的多个峰值点,以及每个峰值点对应的像素位置;
基于每个峰值点对应的像素位置,以及每个第一连通量对应的像素位置,确定每个第一连通量包括的峰值点个数。
一种可选的实施方式中,所述分割模块具体用于:
根据预设的收缩距离阈值,对大于所述收缩距离阈值的第三连通量进行收缩处理,得到多个第四连通量;
对所述第四连通量进行距离变换,确定每个第四连通量包括的峰值点个数;
选取包括多个峰值点的第五连通量,并对所述第五连通量进行收缩处理,直至得到多个包括一个峰值点的第六连通量,确定所述第六连通量的个数为所述第二连通量中包括的细胞个数。
一种可选的实施方式中,所述细胞计数装置还包括:第三确定模块;
所述第三确定模块具体用于:通过以下方法确定收缩距离阈值:基于所述二值图像对应的距离图像,确定每个第三连通量对应的距离值,构建包括多个距离值的距离列表;
从所述距离列表中,选取不小于预设距离阈值的最小值为所述收缩距离阈值。
一种可选的实施方式中,所述细胞计数装置还包括:第四确定模块;
所述第四确定模块具体用于:基于不同细胞类别对应的细胞总数,确定不同细胞类别的占比情况。
本申请实施例还提供了一种计算机设备,处理器、存储器,所述存储器存储有所述处理器可执行的机器可读指令,所述处理器用于执行所述存储器中存储的机器可读指令,所述机器可读指令被所述处理器执行时,所述机器可读指令被所述处理器执行时执行上述任一种可能的实施方式中的步骤。
本申请实施例还提供了一种计算机可读存储介质,该计算机可读存储介质上存储有计算机程序,该计算机程序被运行时执行上述任一种可能的实施方式中的步骤。
本申请实施例提供的一种细胞计数方法、装置、计算机设备及可读存储介质,包括:将第一细胞染色图像输入至训练好的颜色分离模型中,获取第一细胞染色图像对应不同细胞类别的多张二值图像;其中,二值图像中包括多个第一连通量;确定二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数;选取包括多个峰值点的第二连通量,并对第二连通量进行分割处理,确定第二连通量中包括的细胞个数;基于第二连通量中包括的细胞个数,以及二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。通过对细胞染色图像进行分析处理,确定图像中各细胞类别对应的数量,并基于各细胞类别的细胞对该细胞染色图像进行分析,从而能够提高对于图像分析判读的效率。
使本申请的上述目的、特征和优点能更明显易懂,下文特举较佳实施例,并配合所附附图,作详细说明如下。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本申请的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1示出了本申请实施例所提供的一种细胞计数方法的流程图;
图2a示出了本申请实施例所提供的细胞染色图像;
图2b-1示出了本申请实施例所提供的颜色分离模型预测结果图;
图2b-2示出了本申请实施例所提供的细胞染色图像中阴性细胞的二值图像;
图2b-3示出了本申请实施例所提供的细胞染色图像中阳性细胞的二值图像;
图2c示出了本申请实施例所提供的细胞计数实施结果图;
图3示出了本申请实施例所提供的一种细胞计数装置的结构示意图;
图4示出了本申请实施例所提供的另一种细胞计数装置的结构示意图;
图5示出了本申请实施例所提供的一种计算机设备的结构示意图。
具体实施方式
为使本申请实施例的目的、技术方案和优点更加清楚,下面将结合本申请实施例中附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本申请实施例的组件可以以各种不同的配置来布置和设计。因此,以下对在附图中提供的本申请的实施例的详细描述并非旨在限制要求保护的本申请的范围,而是仅仅表示本申请的选定实施例。基于本申请的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本申请保护的范围。
经研究发现,目前,数字病理图像的分析过程大多是通过分析病理数字扫描切片图像而进行的。然而,由于病理数字扫描切片的数字病理图像具有一定的复杂性,例如病理图像中可能出现噪声、污染、模糊、前景与背景对比度较差等问题,并且由于细胞形态差异以及细胞重叠等情况,因此难以进行稳定且准确的细胞的分割和检测过程。
基于上述研究,本申请实施例提供了一种细胞计数方法、装置、计算机设备及可读存储介质,包括:将第一细胞染色图像输入至训练好的颜色分离模型中,获取第一细胞染色图像对应不同细胞类别的多张二值图像;其中,二值图像中包括多个第一连通量;确定二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数;选取包括多个峰值点的第二连通量,并对第二连通量进行分割处理,确定第二连通量中包括的细胞个数;基于第二连通量中包括的细胞个数,以及二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。通过对细胞染色图像进行分析处理,确定图像中各细胞类别对应的数量,并基于各细胞类别的细胞对该细胞染色图像进行分析,从而能够提高对于图像分析判读的效率。
针对以上方案所存在的缺陷,均是发明人在经过实践并仔细研究后得出的结果,因此,上述问题的发现过程以及下文中本申请针对上述问题所提出的解决方案,都应该是发明人在本申请过程中对本申请做出的贡献。
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
为便于对本实施例进行理解,首先对本申请实施例所公开的一种细胞计数方法进行详细介绍,本申请实施例所提供的细胞计数方法的执行主体一般为具有一定计算能力的计算机设备,该计算机设备例如包括:终端设备或服务器或其它处理设备,终端设备可以为用户设备(userequipment,ue)、移动设备、用户终端、终端、蜂窝电话、无绳电话、个人数字处理(personaldigitalassistant,pda)、手持设备、计算设备、车载设备、可穿戴设备等。在一些可能的实现方式中,该细胞计数方法可以通过处理器调用存储器中存储的计算机可读指令的方式来实现。
下面以执行主体为终端设备为例对本申请实施例提供的细胞计数方法加以说明。
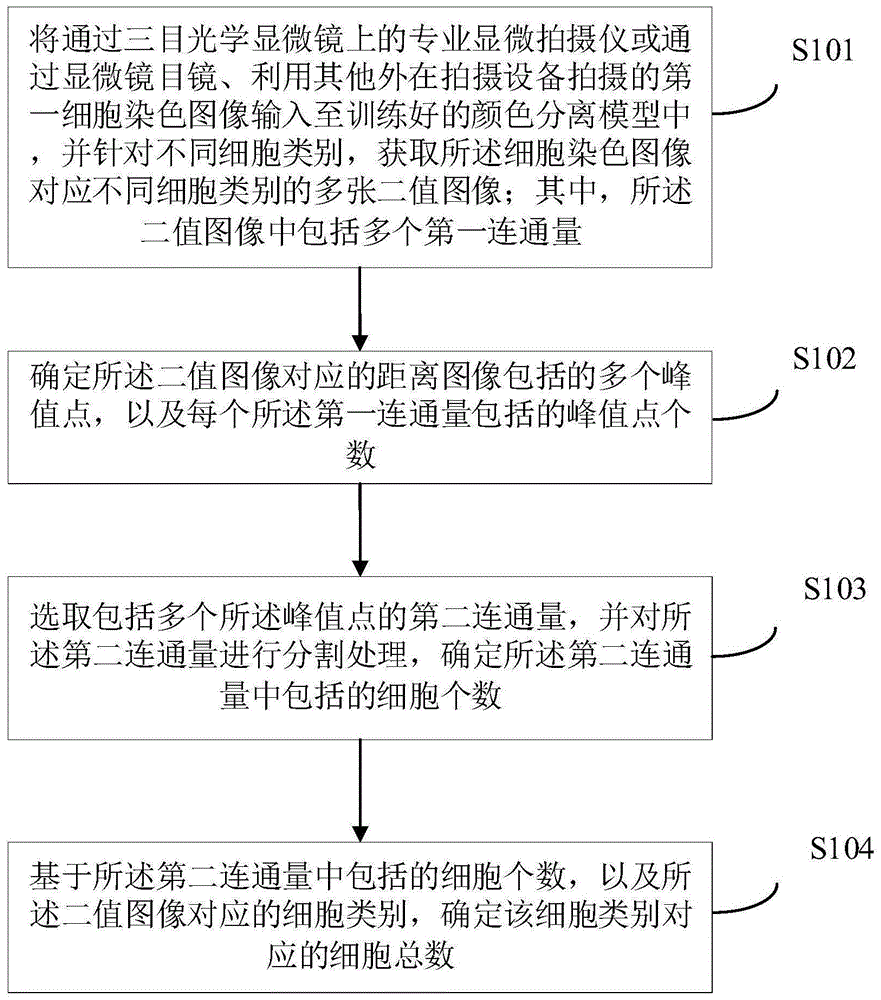
参见图1所示,为本申请实施例提供的细胞计数方法的流程图,所述细胞计数方法包括步骤s101~s104,其中:
s101:将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像对应不同细胞类别的多张二值图像;其中,所述二值图像中包括多个第一连通量;
s102:确定所述二值图像对应的距离图像包括的多个峰值点,以及每个所述第一连通量包括的峰值点个数;
s103:选取包括多个所述峰值点的第二连通量,并对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数;
s104:基于所述第二连通量中包括的细胞个数,以及所述二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。
本申请实施例通过将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取第一细胞染色图像对应不同细胞类别的多张二值图像;其中,二值图像中包括多个第一连通量;确定二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数;选取包括多个峰值点的第二连通量,并对第二连通量进行分割处理,确定第二连通量中包括的细胞个数;基于第二连通量中包括的细胞个数,以及二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。通过对细胞染色图像进行分析处理,确定图像中各细胞类别对应的数量,并基于各细胞类别的细胞对该细胞染色图像进行分析,从而能够提高对于图像分析判读的效率。
下面分别对上述s101~s104加以详细说明。
一、在上述s101中,所述第一细胞染色图像可以为使用专业的三目光学显微镜上的显微拍摄仪而拍摄的图像,也可以为使用手机等摄像设备通过目镜而拍摄的图像。
目前,对于数字病理图像的分析通常需要在数字扫描切片上进行数字病理图像分析,数字扫描仪市场价格在30万~100万人民币,扫描一张数字切片耗时2~5分钟,扫描后的数字切片图像文件大小约1g,因此,导致使用数字扫描切片进行图像智能判读的成本高效率低。此外,对应数字病理图像的分析只能在配备有数字扫描仪的医疗与科研机构进行,巨大的数字切片存储容量,限制了该分析方法的应用推广。
在本申请实施例中,不需要使用数字切片扫描仪进行切片扫描,可以使用专业的三目光学显微镜上的显微拍摄仪拍摄图像,也可以使用手机等摄像设备通过目镜拍摄的图像,并进行自动分析,大幅度降低了对于数字病理图像的分析的成本,提升了对于数字病理图像的分析的效率,同时应用场景更为广泛。
示例性的,可以对免疫组化细胞核染色图像的肿瘤区域进行自动分析。例如对乳腺癌的ki67、er、pr,前列腺癌的ar,胶质瘤的ki67和淋巴瘤的cyclind1等生物指标进行分析处理。具体的,可以针对显微拍摄下的免疫组化细胞核染色的数字病理图像进行分析处理。
示例性的,以胶质瘤ki67核染色的数字病理图像为例进行进一步说明。胶质瘤ki67表达需要计算图像中阴性细胞数、阳性细胞数、细胞总数及阳性比。对胶质瘤数字病理切片进行免疫组化ki67染色后,会使细胞核被染色,阴性细胞核显色为蓝色,阳性细胞核显色为棕色。
具体的,首先,获取多个病人关于胶质瘤ki67核染色数字病理图像。所有图像数据均为使用手机在显微镜目镜下拍摄的胶质瘤ki67核染色图像,尽量选取图像质量较好的区域,所获取的图像大小为4032×3024(宽×高)。其中,可以在高倍镜和中倍镜下分别获取胶质瘤ki67核染色数字病理图像,因此,本申请对于显微镜的倍数要求不高,一定程度上节省了试验成本。
在一个实施例中,如图2a所示,图2a为本申请实施例所提供的细胞染色图像。由于提交的附图不能含有色彩,所以图2a中的阴性细胞核的蓝色像素点区域和阳性细胞核的棕色像素点区域显示不出来,只能通过颜色深浅加以区分。在获取第一细胞染色图像之后,便将第一细胞染色图像输入至训练好的颜色分离模型中,获取所述细胞染色图像对应不同细胞类别的多张二值图像。
其中,通过以下方法对所述颜色分离模型进行训练:
获取第一细胞染色图像样本,并将所述细胞染色图像样本输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像样本;
对所述第二细胞染色图像样本进行无监督机器学习,基于预设的聚类中心特征,得到多个颜色特征聚类,当每个所述颜色特征聚类中各个样本特征的相似度满足预设的相似度阈值时,完成训练,得到训练好的颜色分离模型。
示例性的,所述颜色空间模型可以为rgb空间、hsv空间,优选的,还可以为rgb空间和hsv空间的融合空间。以rgb空间和hsv空间的融合空间为例,对于给定的第一细胞染色图像样本,首先将其从rgb空间转化到hsv空间,然后将rgb空间和hsv空间融合,合成一个新空间,再使用模型进行预测。
其中,rgb空间和hsv空间融合方法为:将一张图像形状为(h,w,c)的rgb图像与转化到hsv空间下的图像进行通道连接,合成一个图像形状为(h,w,2c)的新图像,再将其拉伸为(h×w,2c)的形状大小,作为聚类模型训练和预测过程中的输入数据。其中,h为图像高度,w为图像宽度,c为通道数。
基于合成的新空间,获取第一细胞染色图像样本,并将所述细胞染色图像样本输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像样本。之后,为了实现颜色分离,从获取到的病理图像中随机选取部分数据作为训练集进行无监督kmeans聚类模型的训练。
具体的,所述将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像的多张二值图像,包括:
获取第一细胞染色图像,并将所述第一细胞染色图像输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像;
将所述第二细胞染色图像输入至训练好的颜色分离模型中,分离出所述第二细胞染色图像中各像素位置对应的细胞类别;
基于所述第二细胞染色图像中各像素位置对应的细胞类别,生成对应不同细胞类别的多张二值图像。
示例性的,如图2b-1所示,图2b-1为本申请实施例所提供的颜色分离模型预测结果图。通常免疫组化染色的细胞着色类别包括阴性细胞和阳性细胞,在得到颜色分离模型后,对于给定的细胞染色图像,首先将其从rgb空间转化到hsv空间,然后将rgb空间和hsv空间融合,合成一个新空间,再使用颜色分离模型进行预测,获取细胞染色图像中每个位置对应的类别,从而提取出阴性细胞和阳性细胞的位置,并分别根据阴性细胞和阳性细胞的位置生成两张二值图像。如图2b-2、图2b-3所示,图2b-2为本申请实施例所提供的细胞染色图像中阴性细胞的二值图像,图2b-3为本申请实施例所提供的细胞染色图像中阳性细胞的二值图像,细胞所在区域的像素为白。其中,所述二值图像中包括多个第一连通量。
二、在上述s102中,在获取到二值图像之后,可以确定所述二值图像对应的距离图像包括的多个峰值点,以及每个所述第一连通量包括的峰值点个数。
在确定峰值点之前,还可以包括以下处理过程,具体的,舍弃面积较小的细胞不作计数。根据二值图像中连通量的分布,计算每个连通量的面积大小,并进行排序,去掉首尾面积较小和较大的数据,取中间区域的一半数据求其平均值,作为单个细胞的面积大小。细胞面积小于单个细胞面积大小三分之一的细胞认为是未切割完整的细胞,将其舍弃。一方面可以提高图像处理的效率,另一方法可以减少无用的图像区域对于结果的干扰。
具体的,所述确定所述二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数,包括:
对所述二值图像进行距离变换,确定所述二值图像对应的距离图像包括的多个峰值点,以及每个峰值点对应的像素位置。
示例性的,可以对二值图像进行距离变换,获取一定区域内的距离峰值点,其中,区域大小的选取以单个细胞面积大小为基准进行选取。
在确定每个峰值点对应的像素位置之后,可以基于每个峰值点对应的像素位置,以及每个第一连通量对应的像素位置,确定每个第一连通量包括的峰值点个数。
其中,若峰值个数为1,认为是单个细胞,不需要再进行细胞分割,否则认为是未分离的细胞簇。
三、在上述s103中,对于包括多个峰值点的连通量,需要对所述第二连通量进行分割处理,以确定所述第二连通量中包括的细胞个数。
具体的,所述对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数,包括:
根据预设的收缩距离阈值,对大于所述收缩距离阈值的第三连通量进行收缩处理,得到多个第四连通量;
对所述第四连通量进行距离变换,确定每个第四连通量包括的峰值点个数;
选取包括多个峰值点的第五连通量,并对所述第五连通量进行收缩处理,直至得到多个包括一个峰值点的第六连通量,确定所述第六连通量的个数为所述第二连通量中包括的细胞个数。
示例性的,对每个未分离的细胞簇按照一定的距离阈值进行细胞收缩,然后再次进行距离变换并获取一定区域内的距离峰值点,重新判断是否存在未分离的细胞簇。这是一个反复迭代的过程,直到二值图像中所有连通量的距离峰值个数均为1或无法再收缩时,细胞分割完成。考虑到细胞的重叠,在对细胞簇获取一定区域内的距离峰值点时,区域大小的选取以单个细胞面积大小的一半为准。
其中,可以通过以下方法确定收缩距离阈值:
基于所述二值图像对应的距离图像,确定每个第三连通量对应的距离值,构建包括多个距离值的距离列表;
从所述距离列表中,选取不小于预设距离阈值的最小值为所述收缩距离阈值。
示例性的,每个细胞簇在细胞收缩过程中距离阈值的设置方法为:距离变换后获取单个细胞簇的距离列表,从距离列表中取大于最大距离值三分之一的最小值作为距离阈值进行细胞收缩,将小于距离阈值的点舍弃。
四、在上述s104中,在完成分割处理之后,便可以基于每一张二值图像所对应的细胞类别,确定该细胞类别对应的细胞总数。
示例性的,如图2c所示,图2c为细胞计数实施结果图,白色圆点标记出了每个分割后的细胞位置。细胞分割完成后,按照图像中连通量的分布可以确定每个分割后的细胞位置并计数,得到阴性细胞数,阳性细胞数,以及细胞总数。由于本实施例中的图像数据为胶质瘤,在胶质瘤中几乎均为肿瘤细胞,所以所有细胞均当作肿瘤细胞处理,最终计算出ki67阳性比。
此外,还可以基于不同细胞类别对应的细胞总数,确定不同细胞类别的占比情况,即进行细胞计数和阳性比计算,还可以对本申请所涉及的细胞计数方法进行评价。
示例性的,高倍镜下细胞分割及阴阳性判别的精确率为98.76%,召回率为91.77%,f1-score为95.14%;中倍镜下细胞分割及阴阳性判别的精确率为98.52%,召回率为91.94%,f1-score为95.12%。高倍镜和中倍镜下算法性能基本无差异,细胞分割和阴阳性判别表现均较好。性能评价指标的计算方式如下:
精确率=细胞分割及阴阳性判别正确的细胞数/预测的细胞总数;
召回率=细胞分割及阴阳性判别正确的细胞数/实际的细胞总数;
f1-score=2×精确率×召回率/(精确率+召回率)。
本实施例中涉及的数字病理图像的自动分析,在临床和科研工作中受到了广泛的关注,极大地造福于临床医生、生物医学科研人员和患者。与耗时耗力的人工判读相比,智能化的图像分析方法可以给临床医生和生物医学科研人员提供更精准的判读结果,减少了医学观察者之间的判读差异,为患者提供更加精准的个性化治疗方法。
本申请实施例中,为实现对免疫组化细胞核染色图像的自动分析,首先对细胞染色图像进行阴阳性细胞分离提取,由于免疫组化细胞核染色使阴性细胞显色为蓝色,阳性细胞显色为棕色,通过颜色分离的方法可以将阴性细胞,阳性细胞和背景三者分离,为使算法过程更加自动化,通过聚类实现自动的颜色分离过程;然后对提取出的阴性细胞和阳性细胞分别进行细胞分割,通过图像形态学操作、距离变换等方法可以实现细胞核的检测和分割;最后对分割结果进行计数,计算出阴性细胞数、阳性细胞数、细胞总数及阳性比。在不进行数字切片全片扫描的情况下,使用显微镜目镜或物镜直接拍摄后的免疫组化细胞核染色图像的肿瘤区域进行自动的图像分析,提高了对于细胞染色图像的分析效率。
本领域技术人员可以理解,在具体实施方式的上述方法中,各步骤的撰写顺序并不意味着严格的执行顺序而对实施过程构成任何限定,各步骤的具体执行顺序应当以其功能和可能的内在逻辑确定。
基于同一发明构思,本申请实施例中还提供了与细胞计数方法对应的细胞计数装置,由于本申请实施例中的装置解决问题的原理与本申请实施例上述细胞计数方法相似,因此装置的实施可以参见方法的实施,重复之处不再赘述。
参照图3、图4所示,图3为本申请实施例所提供的一种细胞计数装置的结构示意图,图4为本申请实施例所提供的另一种细胞计数装置的结构示意图。所述细胞计数装置包括:输入模块310、第一确定模块320、分割模块330、第二确定模块340,其中:
输入模块310,用于将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像对应不同细胞类别的多张二值图像;其中,所述二值图像中包括多个第一连通量;
第一确定模块320,用于确定所述二值图像对应的距离图像包括的多个峰值点,以及每个所述第一连通量包括的峰值点个数;
分割模块330,用于选取包括多个所述峰值点的第二连通量,并对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数;
第二确定模块340,用于基于所述第二连通量中包括的细胞个数,以及所述二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。
本申请实施例通过将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取第一细胞染色图像对应不同细胞类别的多张二值图像;其中,二值图像中包括多个第一连通量;确定二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数;选取包括多个峰值点的第二连通量,并对第二连通量进行分割处理,确定第二连通量中包括的细胞个数;基于第二连通量中包括的细胞个数,以及二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。通过对细胞染色图像进行分析处理,确定图像中各细胞类别对应的数量,并基于各细胞类别的细胞对该细胞染色图像进行分析,从而能够提高对于图像分析判读的效率。
一种可选的实施方式中,所述细胞计数装置还包括:训练模块350;
所述训练模块350具体用于:通过以下方法对所述颜色分离模型进行训练:
获取第一细胞染色图像样本,并将所述细胞染色图像样本输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像样本;
对所述第二细胞染色图像样本进行无监督机器学习,基于预设的聚类中心特征,得到多个颜色特征聚类,当每个所述颜色特征聚类中各个样本特征的相似度满足预设的相似度阈值时,完成训练,得到训练好的颜色分离模型。
一种可选的实施方式中,所述输入模块310具体用于:
获取第一细胞染色图像,并将所述第一细胞染色图像输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像;
将所述第二细胞染色图像输入至训练好的颜色分离模型中,分离出所述第二细胞染色图像中各像素位置对应的细胞类别;
基于所述第二细胞染色图像中各像素位置对应的细胞类别,生成对应不同细胞类别的多张二值图像。
一种可选的实施方式中,所述第一确定模块320具体用于:
对所述二值图像进行距离变换,得到二值图像对应的距离图像,确定所述距离图像包括的多个峰值点,以及每个峰值点对应的像素位置;
基于每个峰值点对应的像素位置,以及每个第一连通量对应的像素位置,确定每个第一连通量包括的峰值点个数。
一种可选的实施方式中,所述分割模块330具体用于:
根据预设的收缩距离阈值,对大于所述收缩距离阈值的第三连通量进行收缩处理,得到多个第四连通量;
对所述第四连通量进行距离变换,确定每个第四连通量包括的峰值点个数;
选取包括多个峰值点的第五连通量,并对所述第五连通量进行收缩处理,直至得到多个包括一个峰值点的第六连通量,确定所述第六连通量的个数为所述第二连通量中包括的细胞个数。
一种可选的实施方式中,所述细胞计数装置还包括:第三确定模块360;
所述第三确定模块360具体用于:通过以下方法确定收缩距离阈值:基于所述二值图像对应的距离图像,确定每个第三连通量对应的距离值,构建包括多个距离值的距离列表;
从所述距离列表中,选取不小于预设距离阈值的最小值为所述收缩距离阈值。
一种可选的实施方式中,所述细胞计数装置还包括:第四确定模块370;
所述第四确定模块370具体用于:基于不同细胞类别对应的细胞总数,确定不同细胞类别的占比情况。
本申请实施例还提供了一种计算机设备,如图5示,为本申请实施例提供的计算机设备结构示意图,所述计算机设备10包括:
处理器11和存储器12;所述存储器12存储有所述处理器11可执行的机器可读指令,当计算机设备10运行时,所述机器可读指令被所述处理器11执行以实现下述步骤:
将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像的多张二值图像;其中,所述二值图像中包括多个第一连通量;
确定所述二值图像对应的距离图像包括的多个峰值点,以及每个所述第一连通量包括的峰值点个数;
选取包括多个所述峰值点的第二连通量,并对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数;
基于所述第二连通量中包括的细胞个数,以及所述二值图像对应的细胞类别,确定该细胞类别对应的细胞总数。
一种可选的实施方式中,处理器11执行的指令中,通过以下方法对所述颜色分离模型进行训练:
获取第一细胞染色图像样本,并将所述细胞染色图像样本输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像样本;
对所述第二细胞染色图像样本进行无监督机器学习,基于预设的聚类中心特征,得到多个颜色特征聚类,当每个所述颜色特征聚类中各个样本特征的相似度满足预设的相似度阈值时,完成训练,得到训练好的颜色分离模型。
一种可选的实施方式中,处理器11执行的指令中,所述将通过三目光学显微镜上的专业显微拍摄仪或通过显微镜目镜、利用其他外在拍摄设备拍摄的第一细胞染色图像输入至训练好的颜色分离模型中,并针对不同细胞类别,获取所述细胞染色图像的多张二值图像,包括:
获取第一细胞染色图像,并将所述第一细胞染色图像输入至颜色空间模型中,得到在目标颜色空间中的第二细胞染色图像;
将所述第二细胞染色图像输入至训练好的颜色分离模型中,分离出所述第二细胞染色图像中各像素位置对应的细胞类别;
基于所述第二细胞染色图像中各像素位置对应的细胞类别,生成对应不同细胞类别的多张二值图像。
一种可选的实施方式中,处理器11执行的指令中,所述确定所述二值图像对应的距离图像包括的多个峰值点,以及每个第一连通量包括的峰值点个数,包括:
对所述二值图像进行距离变换,得到二值图像对应的距离图像,确定所述距离图像包括的多个峰值点,以及每个峰值点对应的像素位置;
基于每个峰值点对应的像素位置,以及每个第一连通量对应的像素位置,确定每个第一连通量包括的峰值点个数。
一种可选的实施方式中,处理器11执行的指令中,所述对所述第二连通量进行分割处理,确定所述第二连通量中包括的细胞个数,包括:
根据预设的收缩距离阈值,对大于所述收缩距离阈值的第三连通量进行收缩处理,得到多个第四连通量;
对所述第四连通量进行距离变换,确定每个第四连通量包括的峰值点个数;
选取包括多个峰值点的第五连通量,并对所述第五连通量进行收缩处理,直至得到多个包括一个峰值点的第六连通量,确定所述第六连通量的个数为所述第二连通量中包括的细胞个数。
一种可选的实施方式中,处理器11执行的指令中,通过以下方法确定收缩距离阈值:
基于所述二值图像对应的距离图像,确定每个第三连通量对应的距离值,构建包括多个距离值的距离列表;
从所述距离列表中,选取不小于预设距离阈值的最小值为所述收缩距离阈值。
一种可选的实施方式中,处理器11执行的指令中,还包括:
基于不同细胞类别对应的细胞总数,确定不同细胞类别的占比情况。
本申请实施例还提供一种计算机可读存储介质,该计算机可读存储介质上存储有计算机程序,该计算机程序被处理器运行时执行上述方法实施例中所述的细胞计数方法的步骤。其中,该存储介质可以是易失性或非易失的计算机可读取存储介质。
本申请实施例所提供的细胞计数方法的计算机程序产品,包括存储了程序代码的计算机可读存储介质,所述程序代码包括的指令可用于执行上述方法实施例中所述的细胞计数方法的步骤,具体可参见上述方法实施例,在此不再赘述。
本申请实施例还提供一种计算机程序,该计算机程序被处理器执行时实现前述实施例的任意一种方法。该计算机程序产品可以具体通过硬件、软件或其结合的方式实现。在一个可选实施例中,所述计算机程序产品具体体现为计算机存储介质,在另一个可选实施例中,计算机程序产品具体体现为软件产品,例如软件开发包(softwaredevelopmentkit,sdk)等等。
所属领域的技术人员可以清楚地了解到,为描述的方便和简洁,上述描述的系统和装置的具体工作过程,可以参考前述方法实施例中的对应过程,在此不再赘述。在本申请所提供的几个实施例中,应该理解到,所揭露的系统、装置和方法,可以通过其它的方式实现。以上所描述的装置实施例仅仅是示意性的,例如,所述单元的划分,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式,又例如,多个单元或组件可以结合或者可以集成到另一个系统,或一些特征可以忽略,或不执行。另一点,所显示或讨论的相互之间的耦合或直接耦合或通信连接可以是通过一些通信接口,装置或单元的间接耦合或通信连接,可以是电性,机械或其它的形式。
所述作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本实施例方案的目的。
另外,在本申请各个实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中。
所述功能如果以软件功能单元的形式实现并作为独立的产品销售或使用时,可以存储在一个处理器可执行的非易失的计算机可读取存储介质中。基于这样的理解,本申请的技术方案本质上或者说对现有技术做出贡献的部分或者该技术方案的部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)执行本申请各个实施例所述方法的全部或部分步骤。而前述的存储介质包括:u盘、移动硬盘、只读存储器(read-onlymemory,rom)、随机存取存储器(randomaccessmemory,ram)、磁碟或者光盘等各种可以存储程序代码的介质。
最后应说明的是:以上所述实施例,仅为本申请的具体实施方式,用以说明本申请的技术方案,而非对其限制,本申请的保护范围并不局限于此,尽管参照前述实施例对本申请进行了详细的说明,本领域的普通技术人员应当理解:任何熟悉本技术领域的技术人员在本申请揭露的技术范围内,其依然可以对前述实施例所记载的技术方案进行修改或可轻易想到变化,或者对其中部分技术特征进行等同替换;而这些修改、变化或者替换,并不使相应技术方案的本质脱离本申请实施例技术方案的精神和范围,都应涵盖在本申请的保护范围之内。因此,本申请的保护范围应所述以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!