用作离子循环电池的电解质中的添加剂的化合物的制作方法
本发明典型地应用于(但不仅应用于)以锂离子(Li+)或钠离子(Na+)作为电化学载体而工作的电池领域。可以列举的实例包括锂离子(Li离子)电池、钠离子(Na离子)电池、锂空气(Li空气)电池和锂硫(Li硫)电池。
电池是储能装置,如根据串联或并联安装的电化学电池的原理而工作的电化学发生器,这些储能装置能够借助存在于各电化学电池中的由电解质隔开的电极对(至少一个正极和至少一个负极)来传递电流,所述电极由特定材料制成,该特定材料能够经由氧化还原反应而相互反应以产生作为电流源的电子、并且产生离子,所述离子借助于电解质而从一个电极循环到另一个电极。
所述发生器可以更具体地为锂发生器或钠发生器,其工作原理分别为锂的嵌入-脱嵌或钠的嵌入-脱嵌。尤其可列举锂离子电池或钠离子电池。
在锂离子电池中,液体电解质是决定系统的性能和安全性的重要组分。已知电解质的有机溶剂在电池的第一次充电过程中被还原,并且在负极的表面处形成被称为钝化层的保护层(称为“固体电解质中间相”(SEI))。
钝化层通过防止该电解质的后续降解,从而能够使系统运转。因此,加强该钝化层是最根本的,以确保其在电池的整个寿命周期中的保护性质,并限制在第一次充电/放电循环期间的电容损失。
已经做出了相当大的努力来找到这样的分子,该分子能够先于溶剂被还原,并且能够产生对于电解质的降解更具保护性的层,并且该分子也更能抵抗温度的升高。
举例来说,可以例举WO 2015033619,其描述了包括正极、负极和非水电解质的二次电池,该非水电解质由溶解在非水溶剂中的锂盐和NC-(CH2)n-CN(“n”是大于或等于1的整数)型的直链二腈化合物组成。
然而,在通过离子循环而工作的电池中,这种类型的化合物不能获得具有充分保护性的SEI层。
本发明的目的是:通过提出使用某种化合物作为通过离子循环而工作的电池的电解质添加剂,从而使得可以形成这样的钝化层,该钝化层通过减少第一充电/放电周期期间的电容损失从而尤其可优化所述电池的功能,由此克服现有技术的缺点。
本发明的主题是至少一种化合物用作为通过离子循环而工作的电池的电解质中的添加剂,所述化合物包含至少一种1,1-二氰基乙烯基。
通过本发明,在电解质中包含所述添加剂(即,用作添加剂的本发明的化合物)的电池具有显著限制或甚至阻止循环期间的电容损失、以及负极/电解质界面处的热失控的优点。添加剂有利地使得可在包含于电解质中的溶剂被还原之前形成钝化层。
添加剂
用作添加剂的所述化合物或(换句话说)所述添加剂包含至少一种1,1-二氰基乙烯基。
换言之,1,1-二氰基乙烯基是一种α,β-不饱和二腈基,其中两个腈官能团,或者更尤其是两个氰基官能团都由两个不饱和碳中的一个碳(即,α碳)承载。
优选地,1,1-二氰基乙烯基为2,2-二取代的1,1-二氰基乙烯基,其中两个取代基(位于2位)中的至少一者为醚基。
更具体而言,本发明的添加剂可以选自化合物A、化合物B以及它们的混合物,
-化合物A由下式表示:
其中基团R选自任选被取代的亚烷基、任选被取代的亚烯基、任选被取代的卤代亚烷基和任选被取代的卤代亚烯基;并且X选自氧原子、含氮基团和亚烷基;
-化合物B由下式表示:
其中R1和R2是选自直链或支链烷基、直链或支链烯基、直链或支链卤代烷基、以及直链或支链卤代烯基中的相同或不同的基团;并且X选自氧原子、含氮基团和亚烷基。
卤代亚烷基、卤代亚烯基、卤代烷基和卤代烯基可以分别为氟代亚烷基、氟代亚烯基、氟代烷基和氟代烯基。
基团R可以是C2-C10基团,优选C2-C5基团。举例来说,基团R可以选自-CH2-CH2-基团、-CH2-CH2-CH2-基团和-CH(CH3)-CH2-基团。
基团R1和/或R2可以是C1-C10基团,优选C2-C5基团。举例来说,基团R1和/或R2可以选自-CH2-CH3基团、-CH2-CH2-CH3基团和-CH(CH3)-CH3基团。
当X是含氮基团时,其可以是N-R'类型的基团,其中R'选自氢原子、直链或支链烷基、和直链或支链烯基。基团R'可以优选为C1-C10基团且优选C1-C5基团。
当X是亚烷基时,其优选是-CH2-基团。
在特别优选的实施方案中,添加剂是非离子化合物。
电解质
本发明的另一主题涉及一种电解质,或换句话说,涉及包含至少一种溶剂和至少一种碱金属盐的电解质组合物,其特征在于:所述电解质还包含至少一种化合物和/或其反应产物作为添加剂,所述化合物如本发明中所定义。
本发明的电解质可以有利地用于通过离子循环而工作的电池中。
电解质的溶剂和碱金属盐可以是在锂离子电池、锂硫电池、锂空气电池或钠离子电池中通常使用的那些。
术语“其反应产物”是指本发明的添加剂的还原形式。可以通过在电池的首次充电期间供应电子、或通过与锂金属的氧化还原反应来获得所述添加剂的还原形式。
更具体而言,在锂离子或钠离子类型的电池中,只要未进行电池的第一次充电,则电解质仅包含本发明的添加剂的非还原形式。
在包含锂金属的锂硫或锂空气型电池中,电解质包含本发明的添加剂的非还原形式和/或本发明的添加剂的还原形式。
电解质中的添加剂
因此,电解质可以包含本发明的所述添加剂和/或本发明的添加剂的反应产物中的至少一种。
相对于本发明电解质的总重量,本发明的电解质可以包含0.1重量%至10.0重量%(包括端值)的所述添加剂,优选0.1重量%至5.0重量%(包括端值)的所述添加剂,并且特别优选0.2重量%至1.0重量%(包括端值)的所述添加剂。
换句话说,可以有利地以上述比例将本发明的添加剂添加到本领域技术人员已知的电解质中。
溶剂
本发明的电解质的溶剂可以是单一溶剂或几种溶剂的混合物。
电解质的溶剂可以是任选地用聚合物凝胶化的液体溶剂,或者任选地用液体增塑的极性聚合物溶剂。
电解质的溶剂使得尤其可以溶解碱金属盐以及本发明的添加剂。
溶剂优选是非质子溶剂。更具体而言,溶剂是极性有机溶剂(即,非水溶剂)。
举例来说,本发明的电解质可以包含一种或多种选自以下溶剂中的液体溶剂:
-碳酸酯类,特别是环状碳酸酯类,例如碳酸亚乙酯(EC)、碳酸亚丙酯(PC)、碳酸亚丁酯(BC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸甲乙酯(MEC)、碳酸二丙酯(DPC)、碳酸甲丙酯(MPC)、碳酸乙丙酯(EPC)、碳酸亚乙烯酯(VC)或者它们的混合物;
-酯类,例如乙酸甲酯、乙酸乙酯、乙酸正丙酯、乙酸二甲酯、丙酸甲酯、丙酸乙酯、己内酯或者它们的混合物;
-直链或环状醚类,例如二甲氧基乙烷(DME)、2至5个氧亚乙基单元的低聚乙二醇的甲基醚、二氧戊环、二噁烷、二丁醚、氢呋喃(hydrofuran)(例如四氢呋喃(THF)或2-甲基四氢呋喃(2MeTHF))或者它们的混合物;
-酮类,例如环己酮;
-醇类,例如乙醇或异丙醇;
-腈类,例如乙腈;
-硝基衍生物类;
-酰胺类,如二甲基甲酰胺;
-砜类,例如乙基甲基砜、环丁砜或甲基环丁砜;
-烷基磺酰胺类;和
-部分氢化的烃类。
特别优选的溶剂是环状碳酸酯类。
优选地,本发明的电解质可以包含至少两种上述溶剂的混合物。
极性聚合物溶剂可以选自任选地带有接枝的离子基团的交联或非交联的溶剂化聚合物。溶剂化聚合物是这样的聚合物,该聚合物包含含有至少一个选自硫、氧、氮和氟中的杂原子的溶剂化单元。
可以列举的溶剂化聚合物的实例包括基于聚环氧乙烷或者含有环氧乙烷或环氧丙烷或烯丙基缩水甘油醚单元的共聚物的线型、梳型或嵌段结构的聚醚,其任选地形成网络;聚磷腈,其为基于与异氰酸酯交联的聚乙二醇的交联网络或通过缩聚并包含能够引入交联性基团的基团而获得的网络。
还可以提及嵌段共聚物,其中某些嵌段含有具有氧化还原性能的官能团。不必说的是,上述列举并不是限制性的,并且可以使用具有溶剂化性质的任何聚合物。
电解质的溶剂可以同时包含选自上述非质子液体溶剂的非质子液体溶剂和极性聚合物溶剂,该极性聚合物溶剂包含含有至少一个选自硫、氮、氧和氟中的杂原子的单元。作为这种极性聚合物的例子,可以列举主要含有衍生自丙烯腈、偏二氟乙烯、N-乙烯基吡咯烷酮或甲基丙烯酸甲酯的单元的聚合物。
溶剂中的非质子溶剂的比例可以在2%(对应于增塑溶剂)到98%(对应于凝胶化溶剂)的范围内。
碱金属盐
本发明的碱金属盐可以是单一碱金属盐或几种碱金属盐的混合物。
本发明的碱旨在溶解于电解质的溶剂中:因此,本发明的电解质包含溶解在所述溶剂中的至少一种碱金属盐。
本发明的碱金属盐可以选自锂盐、钠盐以及它们的混合物。
锂盐可以选自(例如)LiClO4、LiPF6、LiBF4、LiAsF6、LiNO3、含有全氟链烷磺酸盐阴离子的锂盐(例如,三氟甲磺酸锂(LiCF3SO3))、双(全氟链烷磺酰基)甲烷锂(例如,双(三氟甲烷磺酰基)甲烷锂)、双(全氟烷基磺酰基)酰亚胺锂(例如,双(全氟乙烷磺酰基)酰亚胺锂或双(三氟甲烷磺酰基)酰亚胺锂(LiN(CF3SO2)2,以名称LiTFSI为人熟知)、双(氟甲磺酰基)酰亚胺锂(LiN(FSO2)2)以及它们的混合物。
钠盐可以选自(例如)NaClO4、NaBF4、NaPF6、NaNO3、含有全氟链烷磺酸盐阴离子的钠盐、双(全氟链烷磺酰基)甲烷钠、三(全氟链烷磺酰基)甲烷钠、双(全氟链烷磺酰基)酰亚胺钠(例如,双(三氟甲烷磺酰基)酰亚胺钠(以名称NaTFSI为人熟知的NaN(CF3SO2)2))、双(氟甲磺酰基)酰亚胺钠(NaN(FSO2)2)以及它们的混合物。
电池
本发明的另一主题涉及通过离子循环而工作的电池,其包括至少一个电化学电池,该电化学电池包括:
-至少一个正极,
-至少一个负极,和
-包含于所述正极和所述负极之间的电解质,
其特征在于,所述电解质为如本发明所述。
根据本发明的电池可以包括一个或多个电化学电池,所述电化学电池包括由所述电解质隔开的所述负极和所述正极。
当电池包括多个电化学电池时,可以以串联和/或并联的方式来组装电化学电池。
在一个特定实施方案中,电池还可以包括至少一个隔离体(separator)和/或至少一个集电体,这些元件是本领域技术人员所熟知的。
更具体而言,正极可以与至少一个第一集电体组合,并且负极可以与至少一个第二集电体组合。
本发明的电池更具体而言是“二次”电池,或者(换句话说)可充电电池。
本发明的电池可以是各种类型,即,(例如)锂离子型、钠离子型、锂空气型或锂硫型,这四种类型的电池对于本领域技术人员来说是公知的。
正极
术语“正极”通常是指当电池正在释放电流时(即当电池正在放电时)充当阴极、并且当电池正在充电时充当阳极的电极。
正极可以是在Li离子电池、Na离子电池、Li空气电池或Li硫电池中通常使用的正极。
正极通常由包含至少一种正极活性材料、任选的电子传导剂和任选的粘合剂的复合材料形成。正极活性材料是能够可逆地插入离子的材料。
作为关于锂离子电池的实例,相对于复合材料的总重量,所述复合材料的正极活性材料的含量可以为5重量%至98重量%,电子传导剂的含量可以为0.1重量%至30重量%,并且粘合剂的含量可以为0至25重量%。
在针对Li离子电池的第一实施方案中,正极活性材料尤其能够在高于负极的工作电位的电位下可逆地插入锂离子。
活性材料可以特别包含一定数量的本领域技术人员所熟知的氧化物。
可以列举的活性材料的实例包括二氧化锰(MnO2)、氧化铁、氧化铜、氧化镍、锂锰复合氧化物(例如LixMn2O4或LixMnO2)、锂镍复合氧化物(例如LixNiO2)、锂钴复合氧化物(例如LixCoO2)、锂镍钴复合氧化物(例如LiNi1-yCoyO2)、锂镍钴锰复合氧化物(例如LiNixMnyCozO2,其中x+y+z=1)、富含锂的锂镍钴锰复合氧化物(例如Li1+x(NiMnCo)1-xO2)、锂和过渡金属的复合氧化物、尖晶石结构的锂锰镍复合氧化物(例如LixMn2-yNiyO4)、橄榄石结构的锂磷氧化物(例如LixFePO4、LixFe1-yMnyPO4或LixCoPO4)、硫酸铁(Fe2(SO4)3)、钒氧化物(例如V2O5)。
锂和过渡金属的复合氧化物可以是以下复合氧化物:
-以名称NMC公知的Li(Ni,Co,Mn)O2,例如Li(Ni1/3Mn1/3Co1/3)O2;
-以名称NCA公知的Li(Ni,Co,Al)O2,例如Li(Ni0.8Co0.15Al0.05)O2;或
-Li(Ni,Co,Mn,Al)O2。
电子传导剂可以是碳类材料,例如炭黑、乙炔黑、天然或合成石墨、碳纳米管或者它们的混合物。
粘合剂可以是这样的聚合物,该聚合物选自(例如)乙烯和丙烯的共聚物,其任选地含有能够进行交联的单元;苯乙烯-丁二烯共聚物,例如苯乙烯-丁二烯橡胶(SBR);丙烯腈-丁二烯共聚物(ABR);聚四氟乙烯,例如聚四氟乙烯(PTFE)或聚偏二氟乙烯(PVDF);纤维素衍生物,例如羧甲基纤维素(CMC)或羟乙基纤维素(HEC)。
在针对Na离子电池的第二实施方案中,正极活性材料尤其能够在高于负极的工作电位的电位下可逆地插入钠离子。
作为活性材料的实例,可以列举的是层状氟磷酸盐Na2TPO4F,其中T表示选自Fe、Mn、Co和Ni的二价元素,其可以部分地被Mg或Zn取代;不同于上述氟磷酸盐的氟磷酸盐,所述氟磷酸盐选自Na3V2(PO4)2F3、Na3V2(PO4)3和NaVPO4F;氟代硫酸盐NaT'SO4F,其中T'表示选自Fe、Mn、Co、V和Ni中的至少一种元素,该元素的一部分可以被Mg取代,并且一部分硫酸根基团SO42-可以被等电子排列且等电荷的基团PO3F2-取代;多硫化物Na2Sn(1≤n≤6)以及二巯基噻二唑和二巯基噁唑的钠盐;二硫代氨基甲酸酯Na[CS2NR'R”],其中基团R'和R”各自表示甲基、乙基或丙基,或者R'和R”形成环(例如吡咯烷或吗啉)。
电子传导剂和粘合剂可以是上述用于Li离子电池的正极的那些。
在针对锂空气电池的第三实施方案中,正极由碳(特别是多孔碳)和任选的细粒状的催化剂(例如MnO2或Mn3O4类型的金属氧化物)构成。
在针对锂硫电池的第四实施方案中,正极由与碳混合的单质硫组成,优选将该单质硫吸收到中间相碳的孔中。
负极
术语“负极”通常是指当电池在释放电流时(即当电池在放电时)充当阳极、并且当电池在充电时充当阴极的电极。
负极可以是在Li离子电池、Na离子电池、Li空气电池或Li硫电池中通常使用的负极。
负极通常由包含至少一种负极活性材料、任选的电子传导剂和任选的粘合剂的复合材料形成。负极活性材料是能够可逆地插入离子的材料。
作为关于锂离子电池的实例,相对于复合材料的总重量,所述复合材料的负极活性材料的含量可以为至少60重量%,电子传导剂的含量可以为0至30重量%,并且粘合剂的含量可以为0至30重量%。
在针对Li离子电池的第一实施方案中,负极活性材料可以是能够可逆地插入锂离子的材料。
这种材料尤其可以是硬碳、软碳、中等硬度的碳、天然或人造石墨、或二羧酸锂(特别是对苯二甲酸锂)。活性材料还可以是锂合金(例如硅-锂合金或锡-锂合金)或另一种金属间锂化合物(例如化合物LiAl)、任选地掺杂有Mg或钼的Li4Ti5O12或TiO2型的钛酸锂、或二氧化钨。当负极材料含有Li合金或金属间锂化合物作为活性材料时,其必然含有电子传导剂。
电子传导剂和粘合剂可以分别是上述用于锂离子电池正极的那些。
在针对钠离子电池的第二实施方案中,负极活性材料是能够可逆地插入钠离子的材料。
该材料尤其可以是:中孔碳;二羧酸钠(特别是对苯二甲酸钠);铁酸钠NaxFeO2;钛酸钠Na2+x’Ti3O7(0≤x’≤2);层状结构的钛铝酸钠NaxTi1-zAlzO2(0≤x≤1,0≤z≤0.4),也被称为“锰钡矿”;或钠合金,例如锡-钠合金或铅-钠合金。
电子传导剂和粘合剂可以是上述用于锂离子电池正极的那些。
在针对锂空气电池的第三实施方案中,负极由锂金属构成。
在针对锂硫电池的第四实施方案中,负极由锂金属构成。
隔离体
隔离体通常位于正极和负极之间,从而防止正极与负极间发生直接物理接触。隔离体通常是电绝缘材料。
可以有利地用电解质浸渍和/或覆盖隔离体。
隔离体的特征在于:电解质对其具有高润湿性,并且特别是其优选与电解质间的接触角小于20°。
更具体而言,隔离体可以是诸如聚合物纤维之类的非织造材料,或者布置成一层或多层的多孔材料,例如聚合物材料。
聚合物可以选自(例如)聚乙烯(PE)、聚丙烯(PP)、聚酰亚胺(PI)、聚对苯二甲酸乙二醇酯(PET)以及它们的混合物。
在特定的实施方案中,多孔聚合物材料可以是由插在两层聚丙烯之间的聚乙烯层构成的三层。
当然,也可以使用本领域技术人员熟知的其他材料,例如被陶瓷、或基于聚芳酰胺(PAI)的化合物、或陶瓷/PAI混合物覆盖的隔离体。
集电体
可以通过集电体来承载电极材料。在一个特定实施方案中,可以用电极材料覆盖集电体的两个面:然后称其为双面电极。
集电体可以由导电材料构成,特别是可以由选自(例如)铜、铜合金、铝、铝合金、铁和铁合金(例如钢)的金属材料构成。
根据本发明添加剂的使用的非限制性例子的描述,本发明的其他特征和优点将变得显而易见。
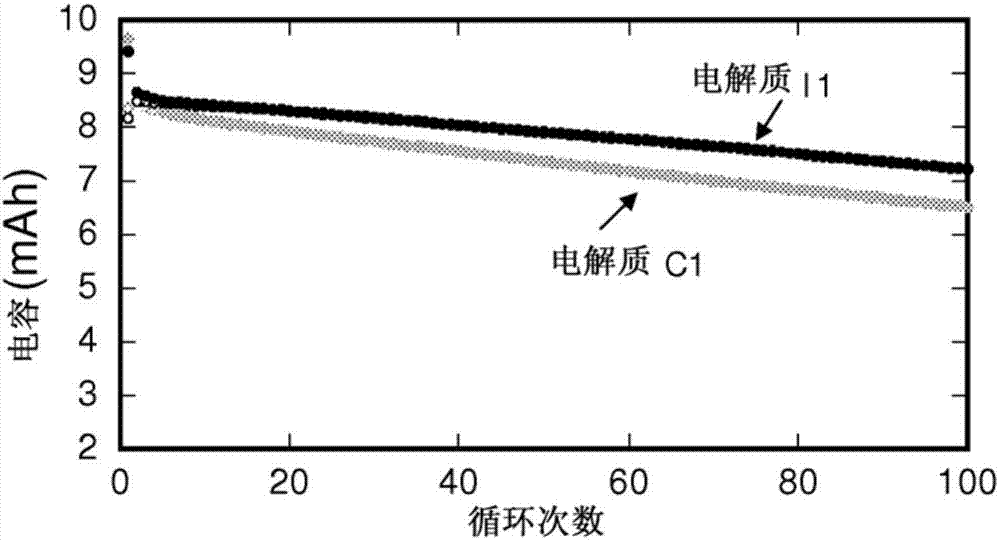
图1a示出了在20℃的温度下,对于包含本发明的添加剂的电解质和不包含本发明的添加剂的电解质而言,作为循环次数的函数的电容的变化。
图1b示出了在45℃的温度下,对于包含本发明的添加剂的电解质和不包含本发明的添加剂的电解质而言,作为循环次数的函数的电容的变化。
图2a示出了对于在20℃的温度下循环的包含本发明添加剂的电解质和不包含本发明添加剂的电解质而言,源自循环过程中的电解质的降解的化合物11的相对丰度。
图2b示出了对于在45℃的温度下循环的包含本发明添加剂的电解质和不包含本发明添加剂的电解质而言,源自循环过程中的电解质的降解的化合物11的相对丰度。
图3a示出了对于在20℃的温度下循环的包含本发明添加剂的电解质和不包含本发明添加剂的电解质而言,在锂化的石墨/电解质界面处释放的热流随温度的变化。
图3b示出了对于在45℃的温度下循环的包含本发明添加剂的电解质和不包含本发明的添加剂的电解质而言,在锂化的石墨/电解质界面处释放的热流随温度的变化。
实施例
为了示出本发明的优点,制造了电化学电池并且该电化学电池包括以下连续层:
-第一集电体,
-正极,
-浸渍有电解质的隔离体,
-负极,和
-第二集电体。
这五个元件共同组成多层系统。
电化学电池的电解质浸渍隔离体,电解质是根据本发明的电解质I1或作为比较例的电解质C1,电解质I1和C1如下所述。
将电化学电池放置在柔性铝包封型容器内,因此通常将该电化学电池称为“软包电池”。
正极
正极由这样的复合材料形成,相对于复合材料的总重量,该复合材料包含94重量%的作为正极活性材料的NMC(化学式Li(Ni1/3Mn1/3Co1/3)O2)、3重量%的作为电子传导剂的碳、和3重量%的作为粘合剂的PVDF。
正极形成厚度为60μm的层。
正极与厚度为20μm的铝集电体组合。
负极
负极由这样的复合材料形成,相对于复合材料的总重量,该复合材料包含94重量%的作为负极活性材料的石墨、2重量%的作为电子传导剂的碳、和4重量%的作为粘合剂的CMC和SBR的50/50(重量%)混合物。
负极形成厚度为60μm的层。
负极与厚度为10μm的铜集电体组合。
隔离体
隔离体是多孔聚合物材料,其由插在两层聚丙烯之间的聚乙烯层形成。
由这三层形成的隔离体的厚度为25μm。
电解质I1和C1
电解质I1和C1是液体电解质。
电解质C1仅由包含1mol/L的LiPF6(作为锂盐)的溶液构成,该盐溶解于包含EC和DMC的50/50(重量%)混合物的溶剂中。
电解质I1包含电解质C1,其中相对于电解质I1的总重量,向电解质C1中添加了0.5重量%的本发明的添加剂。
本实施例中使用的本发明的添加剂(参见电解质I1)是具有下式(CAS号100517-17-7)的化合物A1:
也可根据W.J.Middleton和V.A.Engelhardt,J.Am.Chem.Soc.80,第2793页,1958的科学出版物容易地合成该添加剂。
电化学电池进行循环。每个循环持续约10小时,包括约5小时的充电和约5小时的放电。在每次充电后以及每次放电后,有30分钟的暂停或松弛时间。
在第一实施方案中,在室温(20℃)下进行400次循环。
在第二实施方案中,通过将电化学电池放置在45℃的烘箱中,在高于20℃的温度下进行100次循环。
测量了各种性质,并且在图1a、1b、2a、2b、3a和3b中整理了所有结果。
图1a和1b示出了分别在20℃和45℃的温度下,对于电解质I1和C1,作为循环次数的函数的电容变化(以毫安/小时计)。
使用连接到电化学电池的电极的VMP3多通道恒电位仪(由Biologic公司出售)来测量循环期间的电容。
可以清楚地看到,电解质I1中化合物A1的存在使其可以改善在20℃和45℃下的循环期间的电容保持性。
图2a和2b示出了对于电解质I1和C1,分别在20℃和45℃的温度下循环之后,在循环过程中由电解质降解得到的化合物11的相对丰度。
在循环结束之后,使用GC/MS色谱仪测量电解质的相对丰度。更具体而言,在循环结束时,从电化学电池中移除浸渍有电解质的隔离体,然后将电解质溶解在溶剂(例如乙腈)中。最后,将一定体积的所述电解质(在乙腈中稀释)注入色谱仪中。
图2a和2b的左手部分(介于第18分钟和第19分钟之间)示出了分子“11”的峰(该峰已经被放大十倍(“×10”))。
命名为“11”的分子是2,5-二甲基二氧己烷二羧酸酯,其在G.Gachot等人的Journal of Power Sources 178(2008),第409-421页的科学出版物中可以找到。该分子源自循环过程中电解质的降解过程,并被报道为SEI的钝化性质的指标。
在这些图中可以清楚地看到,电解质I1中的化合物A1的存在抑制了分子“11”的形成。
图3a和3b示出了对于分别在20℃和45℃的温度下循环的电解质I1和C1而言,在锂化的石墨/电解质界面处释放的热流(任意单位a.u.)随温度(℃)的变化。
在氩气气氛下,通过差示量热分析(DSC)以10℃/分钟的升温速度测量热流。热能对应于在DSC测量(放热现象)期间,负极/电解质界面处释放的总能量。为此,在循环结束时,从电化学电池中移除与电解质接触、特别是在其孔中包含电解质的负极(锂化石墨)。接着,回收所述电极的一部分以便通过DSC进行分析。
图3a和3b示出了:电解质I1中化合物A1的存在使得可以将负极/电解质界面处的热失控过程推向更高的温度。
有利的是,根据本发明的化合物A1(其在电解质中用作添加剂)使得可在电解质中所包含的溶剂的还原之前形成钝化层。更具体而言,与所有的预期相反,由于存在1,1-二氰基乙烯基(其仅含有比氧的电负性低的氮和碳原子),使得化合物A1的C-O键的极化增加。结果,与(例如)溶剂混合物中使用的碳酸亚乙酯(EC)的C-O键相比,化合物A1更容易被还原。
因此,经证实,在通过离子循环而工作的电池的电解质中存在根据本发明的添加剂对于在20℃和45℃下的循环是最特别有益的。具体而言,电容的保持性更好,并且显著限制或甚至阻止了溶剂降解过程。类似地,负极/电解质界面处的热失控过程开始于更高的温度下。
- 还没有人留言评论。精彩留言会获得点赞!