用于锂‑硫电池的电解质添加剂的制作方法
本申请要求于2014年5月29日提交的美国临时专利申请第62/004,603号的优先权,该专利申请的内容通过引用全文结合入本文。
政府权益的声明
本发明是在美国能源部DE-SC0005397号的政府资助下进行的。政府对本发明拥有某些权利。
技术领域
本发明涉及用于电化学电池的电解质添加剂。
背景
电池和电化学电池的基本原理
电池可划分为两种主要类型:一次电池和二次电池。一次电池可使用一次,然后耗尽。二次电池通常也被称作可充电电池,因为可在使用后将它们连接至电源(例如墙壁插座),然后充电并再次使用。在二次电池中,每个充电/放电过程被称作一个循环。二次电池最终会耗尽它们的使用寿命,但通常仅在大量的充电/放电循环后发生。
二次电池由电化学电池和任选的其他材料构成,所述其它材料例如保护电池的外壳以及使电池能够与外界连接的线或其他连接器。电化学电池包括两个电极(正极或阴极以及负极或阳极)、将两个电极隔开从而使电池不会短路的绝缘体、和化学连接两个电极的电解质。
在运转过程中,二次电池交换了化学能和电能。在电池的放电过程中,带负电荷的电子离开阳极并通过外部电导体(例如移动电话或计算机中的线)转移至阴极。在通过这些外部电导体转移的过程中,电子产生电流而提供电能。
与此同时,为了使阳极和阴极的电荷保持中性,带正电荷的离子离开阳极并进入电解质,然后正离子离开电解质并进入阴极。为了使该电子运动产生功效,通常相同类型的离子离开阳极并与阴极结合。而且,电解质通常还含有该相同类型的离子。为了对电池进行再充电,反向进行相同的过程。通过向电池提供能量,诱导电子离开阴极并与阳极结合。同时,例如Li+的正离子离开阴极并进入电解质,然后Li+离开电解质并与阳极结合,以使整体电极的电荷保持中性。
除了包含交换电子和离子的活性材料以外,阳极和阴极通常含有其他材料,例如施涂了浆料并干燥的金属背衬。浆料通常含有活性材料以及帮助浆料粘附于背衬和导电材料(例如碳粒子)的粘合剂。一旦浆料干燥,其在金属背衬上形成涂层。
除非具体说明其他材料,否则,本文描述的电池包括仅为电化学电池的系统以及更复杂的系统。
可充电电池的几个重要指标包括能量密度、功率密度、倍率容量、循环寿命、成本和安全性。现有的基于嵌入化合物阴极和阳极的锂离子电池技术受限于能量密度。该技术还受到与在过充情况下氧化物阴极的化学不稳定性有关的安全性困扰,并且其经常需要使用昂贵的过渡金属。因此,针对开发用于锂离子电池的替代性阴极材料存在极大的兴趣。认为硫是这类替代性阴极材料中的一种。
锂-硫电池
锂-硫(Li-S)电池是可充电电池的一种具体类型。与现有的离子实际上进出晶格的锂离子电池不同,锂-硫电池中的离子与阴极中的硫反应以产生具有不同结晶结构的放电产物。大多数Li-S电池中,阳极是锂金属(Li或Li0)。在运行过程中,当电池放电时,锂以锂离子(Li+)的形式离开金属并进入电解质。当电池再充电时,锂离子(Li+)离开阴极并以金属锂(Li)的形式淀积在锂金属阳极上。在放电过程中,元素硫(S)的粒子在阴极与锂离子(Li+)反应以形成Li2S。当电池再充电时,锂离子(Li+)离开阴极,使得能够恢复至元素硫(S)。
与常规的锂离子电池阴极相比,硫是具有吸引力的阴极候选物,因为其提供比目前采用的阴极(<200mAh g-1)高一个数量级的理论容量(1672mAh g-1),并在更安全的电压范围(1.5-2.5V)内运行。这种高的理论容量是由于每个原子能够接收两个电子(e-)。另外,硫廉价且对环境友好。
然而,Li-S电池的实际应用目前受到其较差的循环稳定性的限制。硫阴极的放电涉及中间体多硫化物离子的形成,其在充-放电过程中容易溶解于电解质中,导致循环过程中活性材料的不可逆的损失。放电过程的初始阶段中产生的高级多硫化物(high-order polysulfide)(Li2Sn,4≤n≤8)可溶于电解质并朝向锂金属阳极移动,该过程中它们被还原为低级多硫化物。进一步,这些高级多硫化物在液体电解质中的溶解性和不溶的低级硫化物(即,Li2S2和Li2S)的成核导致低容量保持性和低库伦效率(Coulombic efficiency)。另外,充电过程中这些高级多硫化物在阴极和阳极之间的穿梭是另一个挑战,其中涉及与锂阳极的寄生反应(parasitic reaction)和在阴极的再氧化。该过程导致在延长的循环过程中产生不可逆的容量损失并使得在电极上累积厚且不可逆的Li2S阻隔层,使得无法完成电化学反应。
近期在阴极设计上的改进已经制备了具有高性能的Li-S电池,所述改进例如用导电性多孔材料将硫包封在阴极内并抑制多硫化物的穿梭。但是,这种改进与受限的硫含量(进而与阴极容量和能量密度)和循环时间相关。随着硫含量增加或循环时间延长,多硫化物溶解和穿梭是不可避免的并直接损害了锂金属阳极的稳定性,这是由于溶解的多硫化物和锂金属阳极之间的寄生反应导致了锂树枝状晶体的形成以及电解质损耗。不可能在未解决锂金属阳极劣化问题的情况下制备一种可行的可充电Li-S电池。
锂金属阳极的稳定性主要取决于形成于锂表面上的钝化层或表面电极界面(SEI)的稳定性。钝化膜的组成和微结构极大地受到电解质的影响。已证明用于Li-S电池的硝酸锂(Li(NO3))电解质添加剂减少了多硫化物的穿梭,从而得到较高的可逆容量。LiNO3在锂金属表面上分解,但不能形成稳定或坚固的钝化层并且其在循环过程中持续消耗。因此,在富多硫化物环境中限制了LiNO3稳定用于长期循环的锂阳极的能力。
因此,需要在延长的循环中并在高浓度的多硫化物存在下稳定锂阳极的Li-S电池电解质添加剂。
发明概述
在一个方面,本发明涉及Li-S可充电电池,其包括含有通式为M-X的添加剂的电解质,其中M是过渡金属,X是阴离子。
在一个方面,本发明提供了用于电化学电池的电解质添加剂,其与阳极原位反应以在所述阳极的表面形成坚固的钝化层。所述钝化层能用于保护所述阳极免于寄生反应和/或控制化学物质在所述阳极上的沉积从而防止在循环过程中所述阳极的物理降解。在某些实施方式中,所述阳极包含锂金属阳极表面。公开的电解质添加剂可在锂金属阳极表面形成坚固的钝化层。所述钝化层可通过在锂金属阳极表面上控制锂沉积的位置来抑制锂树枝状晶体形成。钝化层可额外或替代性地保护锂金属阳极免于寄生反应。
在本说明书中一般使用以下缩写:
Li+-锂离子
Li或Li0–元素或金属锂或锂金属
S-硫
Li-S-锂-硫
Li2S-硫化锂
LiCF3SO3-三氟甲磺酸锂
CNF–碳纳米纤维
OCV-开路电压
DME–二甲氧基乙烷
DOL-1,3-二氧戊环
SEM-扫描电子显微镜
XRD–X射线衍射
XPS–X射线光子光谱
附图的简要说明
可通过参考下述结合附图的说明来获得对本发明某些实施方式和优势的更全面的理解,这些附图与本发明的实施方式有关。本说明书包含彩色附图。这些附图的拷贝可从USPTO获取。
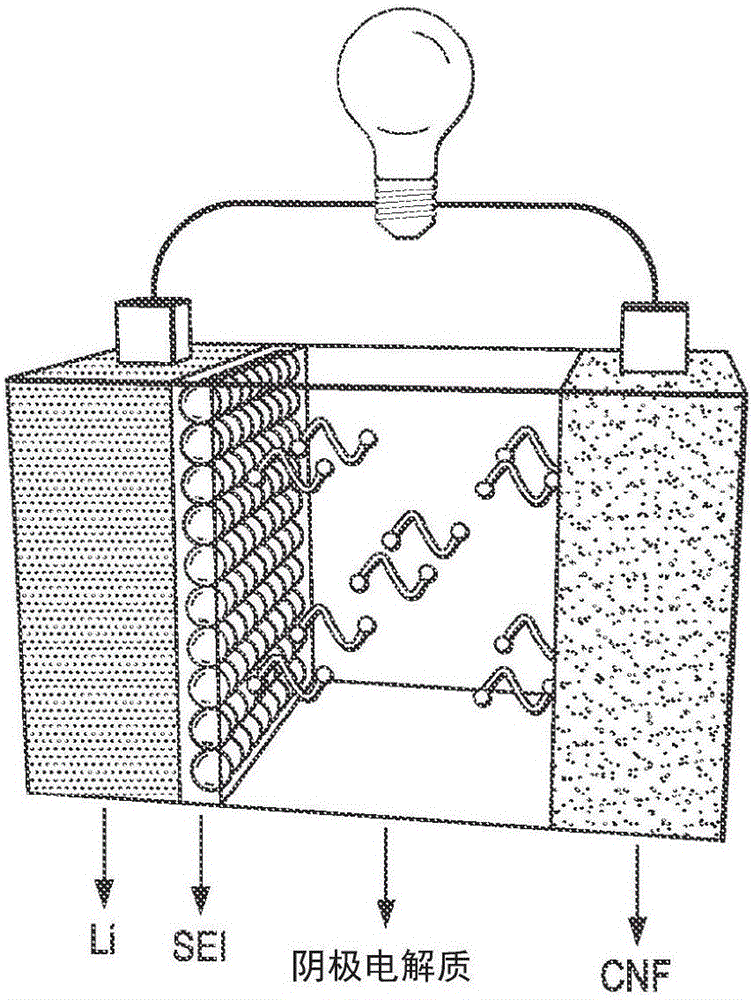
图1A提供了根据本发明某些实施方式的具有CNF纸电极和溶解的多硫化物阴极电解质的Li-S电池的示意性说明。
图1B提供了如图1A中示意性说明构建的,不含有M-X添加剂的Li-S电池(“对照电池”),在C/5(1C=1,672mA g-1)的速率下循环的第一和第二次放电/充电循环的放电/充电电压分布的曲线图。
图1C提供了如图1A中示意性说明构建的,含有M-X添加剂(乙酸铜)的Li-S电池(“添加剂电池”),在C/5的速率下循环的第1次、第25次和第100次放电/充电循环的放电/充电电压分布的曲线图。
图1D提供了对照电池(“对照电池”)和添加剂电池(“试验电池”)在C/5的速率下高达300个循环的循环性能(放电容量和库伦效率)的曲线图。
图2A提供了对照电池以C/5的循环速率在循环前、第一次充电后和第100次充电后的电阻抗的奈奎斯特(Nyquist)曲线,并提供了等效线路的插入示意图。
图2B提供了添加剂电池以C/5的循环速率在循环前、第一次充电后和第100次充电后的奈奎斯特(Nyquist)曲线,并提供了等效线路的插入示意图。
图3提供了具有三明治结构的阴极并含有乙酸铜的Li-S电池的1-13个循环的放电容量的曲线图。在插入图中示意性地说明了阴极结构,其中CNF 2表示原始CNF纸集电器,CNF 1表示改性的含有碳和聚合物涂层的CNF纸集电器。
图4提供了在C/2和1C的循环速率下,对照Li-S电池(具有三明治结构的阴极)和含有乙酸铜的电池(具有三明治结构的阴极)的1-10个循环的放电容量的曲线图。
图5提供了在C/5的循环速率下,具有三明治结构阴极并含有0.03M乙酸铜,0.015M乙酸铜,或0.0015M乙酸铜的Li-S电池的1-10个循环的放电容量的曲线图。
图6提供了在C/2的循环速率下,含有和不含M-X添加剂(乙酸铜)并由沉积在铝箔集电器上的硫阴极构建的Li-S电池的高达20个循环的放电容量的曲线图。
图7A-7D提供了对照电池和添加剂电池在以C/5的速率循环后的锂金属阳极表面的SEM显微图,比例尺表示100um长,其中:
图7A表示第一次充电后对照电池阳极表面;
图7B表示第一次充电后添加剂电池阳极表面;
图7C表示第100次充电后对照电池阳极表面;以及
图7D表示第100次充电后添加剂电池阳极表面。
图8A-8D提供了重叠在图7A-7D的显微图上的EDS元素标示,硫显示为红色,铜显示为蓝色,其中:
图8A表示第一次充电后对照电池阳极表面;
图8B表示第一次充电后添加剂电池阳极表面;
图8C表示第100次充电后对照电池阳极表面;以及
图8D表示第100次充电后添加剂电池阳极表面。
图9A-9B提供了SEM显微图,其显示了对照电池和添加剂电池在以C/5的速率第一次放电后从锂金属阳极表面的锂提取,比例尺表示100um长,其中:
图9A显示对照电池阳极;以及
图9B显示添加剂电池阳极。
图10A提供了截面EDS线扫描,显示在以C/5的速率循环,在第100个循环后硫信号沿对照电池的锂金属阳极的截面的强度。扫描的方向在插入图中提供。
图10B提供了截面EDS线扫描,显示在以C/5的速率循环,在第100个循环后硫信号沿添加剂电池的锂金属阳极的截面的强度。扫描的方向在插入图中提供。
图11A和11B提供了对应于图10A和图10B的截面线扫描的对照电池和添加剂电池的锂金属阳极的SEM显微图,其中
图11A显示了对照电池阳极的截面;以及
图11B显示了添加剂电池阳极的截面。
图12A提供了第一次充电后,添加剂电池的锂金属阳极的钝化层表面处100μm2场的TOF-SIMS化学标示图像,硫信号显示为红色,铜信号显示为蓝色。
图12B提供了第一次充电后,添加剂电池的锂金属阳极的钝化层表面处100μm2场的TOF-SIMS化学标示图像,硫信号显示为红色,锂信号显示为蓝色。
图12C提供了第一次放电后添加剂电池的锂金属阳极的XRD图像。
图12D提供了第一充电后添加剂电池的锂金属阳极的XRD图像。
图12E提供了在含有M-X添加剂(例如乙酸铜)的Li-S电池中的锂金属阳极上的锂沉积的示意模型。
图13A提供了第一次充电后对照电池(“对照”)和添加剂电池(“试验”)的锂阳极的表面的高分辨率S 2p XPS谱。电池以C/5的速率循环。
图13B提供了第100次充电后对照电池(“对照”)和添加剂电池(“试验”)的锂阳极的表面的高分辨率S 2p XPS谱。电池以C/5的速率循环。
图13C提供了第100次充电后阴极分析物的UV可见光吸收光谱。电池以C/5的速率循环。
图14提供了在C/2的循环速率下,不含有M-X添加剂的Li-S电池的1-45个循环的放电容量的曲线图。
图15提供了在1C的高循环速率下,含有M-X添加剂(硝酸铜)的Li-S电池的1-200个循环的放电容量和库伦效率的曲线图。
图16提供了如图所示含有浓度为0.05M、0.1M或0.5M的M-X添加剂(硝酸铜)和阴极硫含量为60重量%或70重量%的Li-S电池的电阻抗的奈奎斯特曲线。
图17提供了在C/2的循环速率下,含有M-X添加剂(氟化铜)的Li-S电池的1-10个循环的放电容量的曲线图。
图18提供了在C/2的循环速率下,含有M-X添加剂(如图所示,乙酸铜、乙酸镍(II)、或乙酸铁(II))的Li-S电池的1-50个循环的放电容量的曲线图。
发明详述
本发明的一个方面提供了一种电化学电池,其包括阳极、阴极、电解质和一种或多种具有通式M-X的电解质添加剂,其中M是过渡金属,X是阴离子。根据本发明,所述阳极可由在电化学电池中易于降解的任何合适的阳极材料构成。在某些实施方式中,所述阳极是金属阳极。作为举例而非限制,所述金属阳极可由选自下组的金属构成:锂、钠、钾、镁、钙、锌、铝、钇和它们的组合。在某些实施方式中,电化学电池是可充电的Li-S电池。
Li-S电池
在某些非限制性的实施方式中,本发明提供了一种电化学电池,其包括阳极,所述阳极包含锂;阴极和/或阴极电解质,其包含含有电活性硫的材料;以及电解质,所述电解质包含一种或多种具有通式M-X的添加剂,其中M是过渡金属,X是阴离子。所述电化学电池还可包括在所述阳极和阴极之间的分隔件。
a)包含锂的阳极
在某些实施方式中,电池包括含锂阳极。阳极可由能嵌入或沉积锂离子(Li+)的任意材料制成。合适的阳极材料包括但不限于锂金属(Li或Li0阳极),例如锂箔和沉积在基材上的锂;锂合金,包括硅-锂合金,锡-锂合金、铝-锂合金和镁-锂合金;以及锂嵌入型(intercalation)材料,包括加锂碳(lithiated carbon)、加锂锡和加锂硅。
阳极可具有适合用于给定的电化学电池的任意结构。阳极可以设置为单层结构或多层结构。合适的阳极结构包括例如在授予Skotheim等的美国专利第8,105,717号中公开的多层结构,该专利的全部内容通过引用纳入本文。
b)阴极、阴极电解质和分隔件
在某些实施方式中,阴极包括含有电活性硫的材料。作为举例而非限制,阴极可包含元素硫,包括但不限于晶体硫、无定形硫、沉淀硫和熔化-固化硫,硫化物,多硫化物,硫氧化物,含硫有机材料,及它们的组合。当阴极包含元素硫时,所述元素硫可被导电性材料(例如导电碳)涂覆。
阴极可具有适合用于给定的电化学电池的任意结构。例如,阴极可以是单层结构,例如沉积在集电器上的元素硫,或者是多层结构。
其他或替代性地,根据本发明的某些实施方式可包含导电性阴极和多硫化物阴极电解质。本文所用的“阴极电解质”是指作为电解质起作用并对阴极有作用的电池组分。在这些实施方式中,阴极可包括导电性电极,例如碳纳米纤维电极。作为举例而非限制,合适的阴极电解质和阴极在授予Visco等的美国专利第2013/0141050号和2013年3月11日提交的Manthiram等的美国专利申请第13/793,418号中被公开,两篇文献的全部内容均通过引用纳入本文。
多硫化物阴极电解质可含有标称分子式为Li2S6的多硫化物。在一些实施方式中,多硫化物可含有通式为Li2Sn的组分,其中4≤n≤8。在更具体的实施方式中,多硫化物可以硫浓度为1-8M,更具体为1-5M,更具体为1-2M的量存在。例如,其可以1M的量、1.5M的量或2M的量存在。阴极电解质也可含有溶解有多硫化物的材料。例如,如以下所述,阴极电解质还可包含LiCF3SO3、LiTFSI、LiNO3、二甲氧基乙烷(DME)、1,3-二氧戊环(DOL)、四甘醇二甲醚、其它锂盐、其它醚基溶剂及它们的任意组合。
所述电池还可包括在阴极和阳极之间的电绝缘分隔件。在包含阴极电解质的实施方式中,分隔件可是对阴极电解质可渗透的。或者,在固体电解质体系中,分隔件也可以是有益于锂离子的电解质。只要阴极和阳极保持足够的电断开从而使得电池运作,也可使用其它分隔件。所述分隔件通常可以是聚合物、凝胶或陶瓷。
c)电解质
电解质可以是适合用于电化学电池并合适与本文公开的电解质添加剂共同使用的任意电解质。在优选的实施方式中,电解质是非水性的电解质并与含锂阳极直接接触。非水性电解质可以是液体电解质,例如非离子液体或有机液体。
在某些实施方式中,液体电解质包括一种或多种有机溶剂。合适的有机溶剂包括但不限于无环醚,例如二乙醚、二丙醚、二丁醚、二甲氧基甲烷、三甲氧基甲烷、二甲氧基乙烷、二乙氧基乙烷、1,2-二甲氧基丙烷和1,3-二甲氧基丙烷;环醚,例如四氢呋喃、四氢吡喃、2-甲基四氢呋喃、1,4-二噁烷、1,3-二氧戊环和三噁烷;聚醚,例如二乙二醇二甲醚(二甘醇二甲醚)、三乙二醇二甲醚(三甘醇二甲醚)、四乙二醇二甲醚(四甘醇二甲醚)、更高级的甘醇二甲醚、乙二醇二乙烯基醚、二乙二醇二乙烯基醚、三乙二醇二乙烯基醚、二丙二醇二甲醚和丁二醇醚;和砜,例如环丁砜、3-甲基环丁砜和3-环丁烯砜。在某些实施方式中,液体电解质包括有机溶剂的混合物。合适的有机溶剂混合物包括但不限于授予Nimon等的美国专利第6,225,002号中公开的那些,该专利的全部内容通过引用纳入本文。
在某些实施方式中,电解质包括一种或多种离子型电解质盐。一种或多种离子型电解质盐优选包括一种或多种离子型锂电解质盐。合适的离子型锂电解质盐包括但不限于LiSCN、LiBr、LiI、LiClO4、LiAsF6、LiCF3SO3、LiSO3CH3、LiBF4、LiB(Ph)4、LiPF6、LiC(SO2CF3)3和LiN(SO2CF3)2。
d)电解质添加剂
由于与电池的组分(包括电解质盐以及硫化物和由阴极形成的多硫化物)的化学反应,Li-S电池中的锂阳极形成了表面膜或固体电解质界面(SEI),本文中也称为钝化层。在循环过程中,SEI可优选释放锂离子,同时通过阴极物质限制锂消耗。不过,在锂阳极上沉积多硫化物是电化学可逆的且会腐蚀阳极并使阳极绝缘,从而导致减少的放电电压和电池容量。
根据本发明,提供一种或多种具有通式M-X的电解质添加剂,其中M是任意过渡金属,X是任意阴离子。所述一种或多种电解质添加剂可以是任意过渡金属盐。作为举例而非限制,添加剂的过渡金属可以是钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、钇、锆、铌、钼、锝、钌、铑、钯、银、镉、铪、钽、钨、铼、锇、铱、铂、金、汞、鑪、鎶以及它们的组合。过渡金属可具有任何其氧化态。作为进一步的例子,合适的阴离子包括但不限于F-、Cl-、Br-、I-、NO3-、PO43-、SO42-、SO32-、C2O42-、CH3(COO)-以及它们的组合。
过渡金属盐添加剂在电池的电解质中解离。在电池的初次循环之前或之中,添加剂的过渡金属离子稳定地结合在SEI中以在阳极表面上形成稳定的钝化层。不受理论限制,试验性的观察显示,过渡金属离子结合入SEI以形成稳定的钝化层得到在阳极的锂离子的受控沉积,从而防止形成锂树枝状晶体。稳定的钝化层还防止了腐蚀性的多硫化物物质的沉积和渗透以及相关的阳极与多硫化物物质之间的寄生反应。因此,在某些实施方式中,与现有技术的Li-S电池相比,本发明的电解质添加剂使得本发明的电池具有改善的循环稳定性和较高的库伦效率中的至少一个特性。
可根据测试电池中的性能或根据在给定电池中预计的性能来选择过渡金属盐添加剂。含有过渡金属盐添加剂的电池的性能可与过渡金属离子的化学性质相关,所述化学性质包括预期的电阻率和预计的锂阳极和过渡金属之间的界面的稳定性。过渡金属与硫物质的化学反应性还可影响含有过渡金属盐添加剂的电池的性能,这是由于过渡金属阳离子与电解质中的硫物质之间的相互作用也可影响钝化层的形成和坚固性。过渡金属的相对成本和其环境影响也是需要重点考虑的。铜是示例性优选的与本发明公开的添加剂一起使用的过渡金属。
过渡金属盐的阴离子可根据选择的盐的解离速率控制溶液中过渡金属阳离子的释放从而影响钝化层的形成和坚固性。可根据盐的解离速率、电解质的组成和电池需要的电化学组成等选择阴离子。相对高腐蚀性的阴离子(即强路易斯酸(Lewis acids))可损害钝化层的形成并可削弱钝化层的稳定性。其中稳定的循环性是及其重要的,优选更小极性的阴离子,例如乙酸根。
本发明的电解质添加剂可以任何合适的浓度提供。例如,可以约0.001-1M,或约0.01-0.5M,或约0.1-0.2M的浓度提供添加剂。合适浓度的确定将取决于要钝化的锂金属阳极的表面积等。一种或多种M-X添加剂可直接结合入电化学电池的电解质中或可通过结合在电池的任意组分之中或之上来加入到电池中。
在一个具体实施方式中,金属盐使得形成具有三维基质结构的钝化层。在一个例子中,基质可包括Li2S、Li2S2和MS产物,例如CuS和Cu2S,以及任选的电解质分解产物。
在本发明的某些实施方式中,除了具有通式M-X的一种或多种添加剂以外,电解质还可含有其它添加剂以改善电池的循环稳定性。通过示例而非限制性的方式,合适的添加剂包括授予Michaylek的美国专利第7,553,590号中公开的硝酸锂和相关添加剂。
电化学性能
根据本发明的电池在C/2的速率下可具有至少1100mAh/g(基于硫原子的质量)的放电容量。其在C/5的速率下可具有至少1300mAh/g(基于硫的质量)的放电容量。其在C/10的速率下可具有至少1400mAh/g(基于硫的质量)的放电容量。
根据本发明的电池在C/2至C/10的范围内可具有至少1.0e-/硫原子的容量。更具体地,C/10时容量可至少为2.0e-/硫原子,或C/2时容量可至少为1.5e-/硫原子。
当在1.8-3.0V之间循环时,根据本发明的电池可在超过50个循环后或甚至超过100个循环后保持其放电容量的至少85%。在更具体的实施方式中,当在1.8-3.0V之间循环时,它们可在超过50个循环后或甚至超过100个循环后保持其放电容量的至少88%或甚至至少93%。如果在窄电压窗口中循环,例如1.8-2.2V,电池甚至可在超过200个循环后保持其放电容量的至少85%,至少88%或至少93%。
根据本发明的电池可具有至少95%的库伦效率。
本发明的电池可包含接触部、壳体或线。在更复杂的电池的情况下,其可包括更复杂的组件,例如在电池过热、破裂或短路时防止危害的安全装置。具体的复杂电池可包括电子件、储存介质、处理器、在计算机可读介质上编码的软件和其他的复杂调节组件。
电池可以是常规形式,例如纽扣电池或果冻卷(jelly roll),或者是更复杂的形式,例如棱柱型电池。电池可包括一种以上的电化学电池,并可包括用于连接或调节这些多个电化学电池的组件。
本发明的电池可用于多种应用。其可以是标准电池尺寸模式的形式,消费者可在多种装置中交换使用。它们可以在电源组中,例如用于工具和器具的电源组。它们可用于消费级电子件,包括相机、移动电话、游戏装置或膝上型计算机。它们也可用于更大型的装置,例如电动汽车、摩托车、巴士、运输卡车、列车或船。进一步,根据本发明的电池可具有工业用途,例如与能源生产有关的能量储存,例如在智能电网中,或用于工厂或健康护理设施的能量存储,例如在发电机中。
这些过程的细节和可形成的电池组件在上述示例或后续示例中进行描述。
实施例
提供下列实施例以进一步说明本发明的具体实施方式。所述实施例无意完整并详细地公开或描述本发明的每个方面,也不应按上述方式理解。
实施例1
在Ar填充的手套箱中组装图1A中所示意性显示的锂/溶解的多硫化物可充电Li-S电池(CR2032纽扣电池)。将CNF纸电极插入电池中。随后,在CNF纸电极中加入40μL多硫化物阴极电解质。随后在CNF电极的顶部放置Celgard 2400隔膜。在隔膜上加入20μL测试电解质。最后,将锂金属阳极放置在隔膜上。
用CNF纸阴极和溶解的多硫化物阴极电解质制备电池以评估在金属锂阳极上的乙酸铜的表面稳定性效果。CNF纸的大尺寸孔允许腐蚀性多硫化物与锂金属阳极直接接触。选择50重量%相对高的阴极硫浓度以评估在促进阳极腐蚀的条件下M-X添加剂的效果。在阳极电解质中加入LiNO3从而在形成稳定的钝化层之前通过乙酸铜添加剂抑制多硫化物穿梭。
用分散过滤方法制备CNF纸集电器。将90mg CNF分散在去离子水(700mL)和异丙醇(50mL)混溶溶液中并进行超声15分钟。通过真空过滤收集产物并用去离子水、乙醇和丙酮清洗几次。
通过在DME和DOL(1:1体积/体积)混合溶剂中溶解LiCF3SO3来制备“空白”电解质溶液。LiCF3SO3的最终浓度为1M。通过加入LiNO3至0.3M的浓度得到测试电解质。
对于试验电池,在测试电解质中加入一水合乙酸铜。电池中一水合乙酸铜的浓度为0.3M。将一水合乙酸铜在空气烘箱中干燥24小时从而在加入到电解质中前去除任何吸收的水分。
多硫化物阴极电解质含有1-2M标称分子式为Li2S6的硫。在45℃下,在Ar填充的手套箱中,通过市售升华硫和Li2S以5:1的摩尔比化学反应18小时来制备阴极电解质从而形成具有中等粘度的棕红色溶液。
在室温下,用阿宾电池循环器(Arbin battery cycler)在2.6-1.8V(相对于Li+/Li)下进行恒电流循环。根据电池中硫的质量计算具体放电容量。用Solartron 1260A阻抗分析仪,以1MHz至0.1Hz的频率在开路电压(OCV)中以5mV的AC电压振幅进行电化学阻抗谱测量。
除了前述单层阴极电池外,同样将如图3中示意性说明的三明治结构的阴极电池组装在CR2032纽扣电池中以评估具有复合硫阴极和受保护的锂金属阳极的Li-S电池的性能。首先,在CNF纸集电器中加入40μL多硫化物阴极电解质。随后,插入碳涂覆的和聚合物涂覆的CNF纸集电器,然后插入Celgard 2400隔膜。随后加入20μL测试电解质,并插入锂金属阳极。调整天然的和碳涂覆的CNF纸集电器的重量以保证硫浓度(50重量%)和负荷(大约2mg/cm2)与上述讨论的单层电池的硫浓度和负荷相等。
通过浆料浇铸制备碳涂覆的CNF纸集电器。将120mg的CNF,40mg科琴黑(ketjenblack)碳纳米粉末,10mg藻酸钠和10mg聚乙烯醇分散在水(100mL)和异丙醇(100mL)的混溶溶液中并在超声下搅拌30分钟以制备成膜浆料。将浆料悬浮在尼龙滤纸上,用去离子水和乙醇清洗,并干燥24小时。或者,将浆料悬浮在扁平玻璃板上并在室温下自然干燥。随后将得到的碳涂覆的CNF纸冲孔成1.2cm直径的圆盘状。如上文所述制备用于三明治结构阴极电池的其它材料。
为了评估在简单结构并具有相对廉价的材料的“常规”电池中的M-X添加剂的效果,组装并测试具有硫电极盘阴极和铝箔阴极集电器的CR2032纽扣电池。阴极盘由硫、市售碳添加剂和粘合剂组成,三者的重量百分数分别为50%、40%和10%。硫负荷大约为1.2mg/cm2。如上所述制备电解质和阳极。
锂金属箔(99.9%)购自西格玛-奥德里奇公司(Sigma-Aldrich)(美国密苏里州圣路易斯(St.Louis,MO))。升华硫粉末(99.5%)、Li2S(99.9%)、LiCF3SO3(98%)、DME(99+%)、DOL(99.5%)和LiNO3(99+%)购自阿科斯有机品公司(Acros Organics)(美国新泽西州(New Jersey))。用于这些实施例的电池的2400聚丙烯隔膜购自赛尔格德公司(Celgard)(北卡罗来纳州夏洛特市(Charlotte,NC))。
i)电化学分析
以C/5(1C=1,672mA/g)的速率进行循环。图1B中显示了对照电池中第一和第二次循环的放电/充电电压分布。图1C中显示了含有乙酸铜的电池中第一次、第25次和第100次循环的放电/充电电压分布。
与图1B中显示的不含乙酸铜的对照电池的放电/充电电压分布的下部电压平台不同,乙酸铜处理的电池的下部电压曲线(图1C)出现了倾斜区域。不受理论限制,相信所述倾斜区域表明乙酸铜、多硫化物和锂金属之间额外的氧化还原反应。这些调节反应在大约25个循环后完成,如乙酸铜处理的电池的放电/充电电压分布的上部平台的恢复所示。100次循环后,观察到Li-S电池的典型放电性能,其中大约2.25V的上部平台和相邻倾斜区域对应于S/Li2S8还原至Li2S4,其中大约2.0V的下部电压平台对应于Li2S4还原至Li2S2/Li2S。在充电循环中观察到相应的氧化平台在大约2.35-2.5V。
图1D说明了对照电池和含有乙酸铜的添加剂电池(“试验电池”)的循环性能。如图所示,在前几次循环中,添加剂电池的放电容量比对照电池的放电容量低。不受理论限制,这可能是由于在试验电池的锂金属表面上形成了钝化层。对照电池在接近第100次循环时呈现出容量和库伦效率的突然减少。这样的减少可能是由于在锂阳极上形成树枝状晶体或由于因寄生反应而发生的电解质消耗。相反地,试验电池呈现出稳定的放电容量和库伦效率,300次循环后容量保留75%并且对于大多数循环库伦效率为100%。
通过电化学阻抗谱(“EIS”)观察到相似的结果。图2A显示了循环前、第一次充电后和第100次充电后对照电池的奈奎斯特曲线,而图2B显示了循环前、第一次充电后和第100次充电后添加剂电池的奈奎斯特曲线。图2A和图2B中显示的曲线描述了在给定的频率下观察到的电池的阻抗(“Z”),频率(“f”)沿x轴降低。同时说明对应的电路:Re表示电解质电阻;Rg表示来自锂阳极表面上的钝化层的电阻;Rct表示充电转移电阻;Wo表示瓦尔堡阻抗(Warburg impedence);CPE1和CPE2是相位常数。
如EIS结果所示,对照电池证明了电解质电阻的增加和100次循环后在低频率区域线性曲线部分的演变(图2A),而添加剂电池用相对于对照电池较低的电阻保持了守恒的阻抗谱(图2B)。
图3说明了在C/5的放电速率下,具有乙酸铜的三明治结构的阴极电池的循环性能。当三明治结构阴极电池的硫负荷与上文讨论的单层集电器电池的硫负荷相同时,可逆放电容量增加至大约1,300mA*h/g。
图4说明了在C/2和1C的放电速率下,含有和不含乙酸铜的电池的性能。对照电池和添加剂电池都由所述三明治结构阴极构建。对于对照电池和添加剂电池保持硫浓度和负荷。
在较高的测试的放电速率(C/2和1C)下,含有乙酸铜的添加剂电池的初始放电容量比对照电池的放电容量低,与EIS结果相符,EIS结果证明了添加剂电池在循环前具有较高的电阻,这可能是因为在该多硫化物电解质环境中钝化膜相对厚。不过,相对于对照电池改善了添加剂电池的容量保留,并且在一些循环后添加剂电池呈现出比对照电池更高的放电容量。在高放电速率下,仅在一些循环之后对照电池就呈现出容量的显著下降。
不受理论限制,相对于对照电池,添加剂电池的改善的高速率性能可能是由于添加剂电池的循环时较低的电阻,如上文讨论的EIS结果所示的。相信添加剂电池具有相对于对照电池更低的电阻,因为在试验电池的阳极表面上没有大绝缘Li2S颗粒或多硫化物的显著钝化,使得在试验电池中形成的钝化层的离子导电性更大。进一步相信,锂均匀地沉积在试验电池的阳极上,得到持久的导电性。
在电池中用三明治结构阴极评估乙酸铜浓度对Li-S电池的电化学性能的影响。评估浓度为0.03、0.015和0.0015M的电解质乙酸铜。如图5所示,与含有0.015M和0.0015M乙酸铜的电池相比,0.03M乙酸铜电池呈现较低的初始放电容量和较高的容量保持。几个循环后,与具有较低乙酸铜电解质浓度的电池相比,含有0.03M乙酸铜的电池呈现较大的放电容量。
同样用恒电流循环评估“常规”电池的电化学性能,所述“常规”电池包括用铝箔作为集电器的硫盘状电极和含有或不含M-X添加剂(乙酸铜)的电解质。如图6所示,与对照电池相比,含有乙酸铜的电解质的电池呈现较低的初始放电容量和较高的容量保持。几个循环后,含有添加剂的电池比对照电池呈现更大的放电容量。
阳极化学物质和形态分析
对于如上所述用单层CNF纸阴极制备并循环的电池,评估乙酸铜添加剂对于锂金属阳极的化学和结构影响。
在第一次和第100次电池充电后,通过扫描电子显微镜/能量色散X-射线光谱(SEM/EDS,FEI Quanta 650)检测锂阳极的表面形态。
在锂金属阳极表面上的钝化层表面,用飞行时间二次离子质谱(TOF-SIMS)标示感兴趣的化学物质(锂、硫和铜)。使用购自ION-TOF公司(ION-TOF GmbH)的TOF/SIMS5机器,在具有高空间分辨率(<200nm)和高质量分辨率(>5000,m/δm)的突发对准模式(Burst Alignment mode)中,通过具有测得的0.04pA样本电流的30kV Bi1+一次离子束以256×256像素光栅扫描100um2的面积。为了提高感兴趣的物质的二次离子信号并减少电解质残留对钝化层化学组成的可能的干涉,分析的区域位于之前用二次离子束(具有2kV能量以及测得的大约85nA样本电流的Cs+)溅射的250um2区域的中央。所有探测的二级离子具有负极性。在UHV中以<10-9mbar的基础压力进行标示。
使用Rigaku X射线衍射器通过X射线衍射进行锂金属阳极表面的晶体结构的表征。在10-80°下以0.02°每秒的扫描速率用CuKα辐射来进行所述表征。使用Kapton膜以保护在表征过程中循环的锂金属。
在室温下使用Kratos分析光谱仪和单色Al Kα(1486.6eV)X射线源,通过X射线光电子谱(XPS)分析检测锂金属阳极的表面化学物质组成。在去除Shirley型背景后,用Voigt函数在CasaXPS软件中拟合光谱。根据以下条件施加硫组分峰的限制:(i)S 2p3/2和S 2p1/2峰之间1.18eV的能量差;(ii)S 2p3/2和S 2p1/2之间2:1的峰面积比;以及(iii)相等的半峰全宽。
进行UV可见光吸收谱分析以在第100次充电后确认多硫化物物质。将循环的CNF纸电极浸渍在10mL DOL/DME(1:1体积比)5分钟。用具有Varian基线校正的Cary 5000分光光度计表征阴极分析物。
在图7A-7D中提高锂金属阳极表面的扫描电子显微镜(SEM)显微图。图7A和7C分别表示第一次和第100次充电后对照电池的锂阳极表面;图7B和7D分别表示第一次和第100次充电后试验电池的锂阳极表面。电池以C/5的速率循环。
在图8A-8D中提供相应的能量分散X射线光谱(EDS)结果。图8A和8C分别表示第一次和第100次充电后对照电池的锂阳极表面;图8B和8D分别表示第一次和第100次充电后试验电池的锂阳极表面。硫沉积显示为红色,铜沉积显示为蓝色。图7A-7D和8A-8D的比例尺表示100um长。
如图7A和8A所示,第一次充电后,对照电池的阳极表面用Li2S/Li2S2的体相沉淀和非均匀的苔藓状锂沉积表征,表明LiNO3电解质添加剂并没有在富多硫化物电池中保持锂形态。相反地,如图7B和8B所示,第一次充电后,试验电池的阳极表面相对平滑并被含硫和含铜钝化层覆盖。第100次充电后,如图7C和8C所示,对照电池阳极表面呈现树枝状晶体形态并累积了含硫产物,而如图7D和8D所示,试验电池阳极表面呈现均匀的锂沉积。不受理论限制,相信在多次循环后试验电池的均匀的锂沉积是由于在第一次循环后观察到的减少的阳极表面粗糙度造成的,这是由于含硫和含铜沉积填充了由锂提取产生的表面凹点并保护了锂表面免受体相Li2S/Li2S2沉积。在图9A和图9B中分别显示了对照电池和试验电池在第一次放电后阳极表面的锂提取。
图10A和10B分别是在第100次充电后对照电池和试验电池的锂金属阳极的截面的硫的EDS线扫描。图10A和图10B中的标尺表示在锂金属阳极截面中的位置。如图所示,在对照电池阳极中硫沉积至显著深度,而在试验电池阳极中,硫在涂覆锂表面的层中浓缩。这些结果表明在试验电池中的钝化层有效地防止了多硫化物迁移的渗透以及相关的锂电极的污染。不受理论限制,相信防止多硫化物渗透能抑制从电极的内部形成树枝状晶体结构。
图11A和11B分别是在第100次充电后对照电池和试验电池的锂金属阳极截面的对应的SEM图像。
进行TOF-SIMS分析以确定在第一次充电之后在试验电池中的通过含硫和含铜钝化层的锂沉积。图12A显示观察到的硫(显示为红色)和铜(显示为蓝色)的TOF-SIMS化学标示的图像重叠;图12B显示观察到的硫(显示为红色)和铜(显示为蓝色)的TOF-SIMS化学标示的图像。锂呈现与铜广泛重叠并且密集地沉积在含硫簇的空隙中。不受理论限制,由于铜和硫物质之间的相互反应,锂表面上的铜的存在可抑制体相Li2S颗粒的形成,从而中断Li2S晶体的形成。
图12C和图12D分别显示了在第一次放电和第一充电后试验电池的锂阳极表面的XRD分析。在图12C和图12D中观察到的两个峰位于2θ=36.0°和2θ=51.2°。这些峰与晶体锂的(011)和(002)峰对应。峰的相对强度在充电和放电之间变化,说明锂沉积具有优先取向,而不是体相锂金属沉积。相信该优先取向是由于钝化层的存在造成的,并使得锂的沉积是颗粒状而不是如对照电池中观察到的树枝状晶体(参见图7A和图7C)。通过XRD分析确认在试验电池中锂阳极表面上不存在晶体Li2S,XRD分析没有显示Li2S信号。
TOF-SIMS和SRD分析证明锂沉积受到与乙酸铜相关的钝化层的影响。不受理论限制,相信锂离子沉积在均匀分布的含硫簇的空隙中,紧挨着铜物质和锂阳极。从而相对于对照电池阳极减少了表面粗糙度并避免了树枝状晶体形成。图12E提供了与在电解质中添加乙酸铜有关的锂沉积的示意模型,硫簇显示为蓝色的点,锂离子显示为小的红色的点。如图所示,排除了较大的多硫化物分解产物。
进行XPS分析以检测乙酸铜对锂阳极的表面化学性质的的影响。图13A显示在第一次充电后对照电池和试验电池的锂表面的S 2p XPS谱;图13B显示在第100次充电后对照电池和试验电池的锂表面的S 2p XPS谱。分别在下述表1和表2中提供在第一次充电后和在第100次充电后观察到的对应的化学组成。
表1:一次充电后锂阳极表面的XPS谱分析
表1:100次充电后锂阳极表面的XPS谱分析
如图13A显示,观察到在第一次充电之后,相对于观察到的对照电池的多硫化物粘附,试验电池的锂表面呈现少得多的多硫化物粘附,如在164.1eV下S 2p3/2峰的消失所表明的。试验电池中锂表面上的钝化层主要由Li2S、Li2S2/CuS/Cu2S物质、锂盐和电解质分解产物组成,其分别在159.8、162.1、169.1和167.0eV下识别。
如图13B显示,100次循环后,对照电池阳极电解质分解产物(例如硫化物或砜物质)的浓度增加,但试验电池阳极没有发生所述增加,这表明在试验电池的锂表面上发生了较少的寄生反应,并表明相对于在对照电池中锂表面的稳定性,试验电池中钝化层的稳定性更高。
在第100次充电后在阴极分析物上进行UV可见光吸收谱分析以证明在循环的电极中观察到的物质的化学组成。图13C中显示了对照电池和试验电池的光谱。如图所示,相对于对照电池分析物,试验电池分析物在~310nm处呈现归因于S6物质的强的吸收峰。试验电池分析物还呈现在~260nm、~280nm和~420nm处的峰,分别对应于S62-、S8和S42-物质,其强度比对照电池的分析物更大。相对于对照电池,试验电池的分析物中的这些物质的相对丰度进一步表明在试验电池中多硫化物和锂材料之间发生较少的寄生反应,与活性电极和阴极电解质材料的保持有关。
实施例2
制备具有高硫含量的电化学电池以确定在高锂金属阳极腐蚀条件下MX电解质添加剂对于电化学性能的影响。
用由重量百分数分别为60%、30%和10%的硫、市售碳添加剂和聚乙烯基二硫化物粘合剂组成的常规硫阴极圆盘制备CR2032纽扣电池。将铝箔用作集电器。硫负荷大约为1.5mg/cm2。通过在DME和DOL(1:1体积/体积)混合物溶剂中溶解LiCF3SO3(1M)以及不同浓度的LiNO3来制备电解质。在试验电池中,在所述电解质中加入MX电解质添加剂。在室温下通过用阿宾电池循环器以2.6-1.8V(相对于Li+/Li)进行的恒电流循环在不同放电速率下评估电池的电化学性能。根据电池中硫的质量计算具体放电容量。
不含有MX电解质添加剂的Li-S电池的循环稳定性
在C/2的放电速率和0.1M LiNO3下对照电池的循环性能示于图14。如图所示,对照电池Li-S电池仅在一些循环后即呈现容量减退。
硝酸铜电解质添加剂对于Li-S电池的循环稳定性和电阻的影响
在1C的高放电速率下,含有0.05M LiNO3和硝酸铜(Cu(NO3)2)电解质添加剂的试验电池的循环性能和库伦效应示与图15。如图所示,通过添加硝酸铜作为电解质添加剂得到稳定的循环。
用Solartron 1260A阻抗分析仪,以1MHz至0.1Hz的频率范围在开路电压(OCV)中以5mV的AC电压振幅对含有不同浓度的硝酸铜的试验电池进行EIS测量。电池含有的硝酸铜的浓度为0.05M、0.1M或0.5M。同时制备含有0.1M硝酸铜和如上所述构建的但含有70重量%硫的阴极的其它电池。
观察到的EIS测量的奈奎斯特曲线示于图16。如图所示,随着硝酸铜的添加电池电阻降低。将硝酸铜的浓度由0.05M增加至0.1M显著降低了电池电阻,但相似的增加并没有在将浓度由0.1M增加至0.5M的情况中观察到。不受理论限制,相信电池电阻的下降是由于在锂金属阳极上形成稳定的钝化层,而平台是由于用0.1M硝酸铜完成钝化。通过将阴极的硫浓度从60重量%增加至70重量%并没有改变电池电阻。
氟化铜电解质添加剂对于Li-S电池的循环稳定性的影响
含有0.1M LiNO3和氟化铜(CuF2)电解质添加剂的试验电池在C/2的放电速率下的循环性能示于图17。如图所示,通过添加氟化铜作为电解质添加剂得到相对稳定的循环。
乙酸铜、乙酸镍(II)和乙酸铁(II)电解质添加剂对于Li-S电池的循环稳定性的影响
含有1M LiNO3和乙酸铜、乙酸镍(II)(Ni(CH3COO)2)或乙酸铁(II)(Fe(CH3COO)2)电解质添加剂的试验电池以C/2的放电速率的循环性能示于图18。如图所示,电解质添加剂于变化的初始容量和循环稳定性相关。Ni2+得到在第一次循环中最高的硫使用,但相对于Cu2+和Fe2+呈现较低的容量保留。相对于观察到的含有Ni2+和Cu2+的试验电池的初始容量,观察到含有Fe2+的试验电池中的初始容量是低的。
***
尽管上面仅详细描述了本公开的示例性实施方式,但是应理解,在不偏离本公开的精神和预期保护范围的情况下,可以对这些示例进行改进和变化。例如,本文表述的数值应理解为包括小变化,因此实施方式中“约”或“大约”表示的数值除非另外说明,例如报告实验数据,都是使该数字用于表示的精确量更清楚。另外,本领域普通技术人员会理解,本文描述的包含MWCNT和阴极电解质或微粒的阴极或阴极/阴极电解质组合可独立于阳极而根据本公开制备。这种阴极或阴极/阴极电解质组合将清楚地用于本公开的电池。
- 还没有人留言评论。精彩留言会获得点赞!