空气呼吸式硫水溶液可充电电池的制作方法
本申请要求2015年10月30日提交的名称为“oxygen-breathingaqueoussulfurstoragebattery”的美国申请号62/248,672、2015年12月11日提交的名称为“air-breathingaqueoussulfurrechargeablebatteries”的美国申请号62/266,159以及2016年4月4日提交的名称为“electrochemicalstoragefromseawater”的美国申请号62/317,825的优先权,这些申请中的每一份特此全文以引用方式并入本文以用于所有目的。
政府支持
本发明是依据美国能源部颁发的合同号de-ac02-06ch11357,在政府支持下完成的。政府在本发明中享有某些权利。
背景技术:
风能和太阳能发电之类的可再生能源的成本在过去几十年中迅速下降,并可能与化石燃料发电相竞争。但这些能源通常是间歇性的,从而凸显了对电力存储的需求,原因是电力存储可以将间歇性的可再生电力转变为可预测和可调度的发电量,甚至可以充当基载电力。
传统的储能技术包括抽水储能(phs)和地下压缩空气储能(caes),其成本可能低至100美元/千瓦时左右。但这些技术也受到可能限制其进一步部署的地理条件和环境条件的种种制约。
技术实现要素:
本发明的实施方案包括用于低成本储能的设备、系统和方法。在一个实例中,电化学设备包括阴极电解液、阳极电解液,以及设置在阴极电解液与阳极电解液之间、并且能够透过至少一种金属离子的隔板。该阴极电解液包含溶解在水中的至少一种金属盐,从而提供至少一种金属离子。该阳极电解液包括多硫化物溶液。该电化学设备在充电过程中,阴极电解液中产生氧气,多硫化物溶液中的多硫化物在阳极电解液中经受还原反应,并且至少一种金属离子从阴极电解液移至阳极电解液。该设备在放电过程中,氧气在阴极电解液中被消耗,多硫化物在阳极电解液中氧化,并且至少一种金属离子从阳极电解液移至阴极电解液。
应当理解,前述概念和下文将更详细讨论的附加概念(前提是这些概念不相互抵触)的所有组合被认为是本文所公开的本发明主题的一部分。特别地,出现在本公开结尾处的要求权利的主题的所有组合被认为是本文所公开的本发明主题的一部分。还应当理解,也可能出现在以引用方式并入的任何公开中的本文明确采用的术语应当被赋予与本文所公开的特定概念最一致的含义。
附图说明
本领域技术人员将理解,附图主要是用于进行示意性的说明,而并非旨在限制本文所述的本发明主题的范围。附图未必按比例绘制;在一些情况下,本文所公开的本发明主题的各个方面可能在附图中被夸大或放大示出,以便理解不同的特征。在附图中,相同的附图标记通常指代相同的特征(例如,功能上相似的元件和/或结构上相似的元件)。
图1和图2示出了使用硫来储能的电化学设备的示意图。
图3示出了图1至图2所示的电化学设备的甫尔拜图(pourbaixdiagram),展示了电池单元的电压与阴极电解液的ph值的函数关系。
图4a和图4b示出了被构造为开放系统且使用硫来储能的电化学设备的示意图。
图5a和图5b示出了被构造为流动电池且使用硫来储能的电化学设备的示意图。
图6a至图6i示出了不同的空气呼吸式硫水溶液流动电池单元构造的示意图和照片。
图7示出了使用硫来储能的示例电化学电池单元的充电/放电曲线。
图8示出了使用硫来储能并且在阴极上使用催化剂的示例电化学电池单元的充电/放电曲线。
图9示出了在阴极上使用催化剂的电化学电池单元的输出电压与比容量(mah/g)的函数关系。
图10a和图10b示出了图6a所示的标准h电池单元的充电/放电曲线,用于验证阴极电解液中发生了oer/orr。
图11示出了使用碱性阴极电解液并使用li+作为工作离子的电化学电池单元的充电/放电曲线,证实发生了orr/oer反应。
图12示出了使用酸性阴极电解液并使用li+作为工作离子的电化学电池单元的充电/放电曲线,证实发生了orr/oer反应。
图13示出了使用酸性阴极电解液并使用na+作为工作离子的电化学电池单元的充电/放电曲线,证实发生了orr/oer反应。
图14示出了使用铂集流体的电化学电池单元的充电/放电曲线,表明在该集流体上形成了可逆的铂氧化物(ptox)。
图15示出了在开放系统中使用为悬浮液的阴极电解液的电化学电池单元的充电/放电曲线。
图16a和图16b分别示出了使用li+和na+作为工作离子的电化学电池单元的电池单元电压与充电状态的函数关系。
图17a和图17b分别示出了使用li+和na+作为工作离子的电化学电池单元在三个温度下的电压效率与电流密度的函数关系。
图18示出了对于h电池单元中的li化学物质来说,极化和功率密度与电流密度的函数关系。
图19示出了在使用双参比电极配置的电化学电池单元中,充电和放电之间的电压差与电流密度的函数关系。
图20示出了在使用单电极和双电极的电化学电池单元中,电压效率与电流密度的函数关系,展示了催化剂和温度对电压效率的影响。
图21a和图21b示出了使用经改进的不流动h电池单元对典型的阴极电解液和阳极电解液进行长持续时间循环的实验结果。
图22a和图22b示出了电池单元的电阻和耐久性的实验结果。
图23a示出了结合了具有连续流动的阴极电解液和阳极电解液的空气呼吸式电池单元的实验室规模流动电池的照片。
图23b示出了图23a所示流动电池的极化和功率密度与电流密度的函数关系。
图23c示出了图23a所示流动电池的电压-容量曲线,这些曲线是以0.325ma/cm2进行20个循环而测得的。
图24展示了储存波浪能量来发电的一般概念。
图25示出了使用海水作为阴极电解液的一部分的流动电池的示意图。
图26a和图26b示出了被构造为开放系统且用来储存波浪能量的电化学设备的示意图。
图27示出了几种储能技术的安装成本与储存持续时间的函数关系。
具体实施方式
鉴于可再生能源不但成本不断下降、而且环境效益逐渐增多,可能期望开发其成本远低于当前技术的成本轨迹的储能技术。还可能期望的是,这项技术安全、可扩展且有足够高的能量密度来支持广泛部署,包括在空间有限的环境中部署。
在已知的氧化还原活性材料中,除了水和空气之外,按每个储存电荷的成本计,单质硫理应是最便宜的。下表1示出了可以用作储存电极的电活性材料的单位成本、比容量和每个储存电荷的成本(以美元/千安时为单位)。从表1可以看出,硫的每个储存电荷的成本仅为0.12美元/千安时,相比之下,锌为2.90美元/千安时,石墨为27.03美元/千安时,licoo2为285.71美元/千安时。另外,硫在地壳中的丰度前列第14位,并且由于广泛地存在于天然气和石油精炼的副产物中,所以很容易获得。
表1.可用作储存电极的所选择电活性材料的单位成本、比容量和每个储存电荷的成本。
硫通常用作无水锂-硫电池和高温钠-硫电池中的阴极材料。在全水性系统中,使用硫作为阳极材料,在达到有意义的电池单元电压的同时保持水稳定性,这种做法是有益的。增溶的硫水溶液电极可以与流动电池中的卤化阴极电解液配对,用作阴极电解液对“受保护的”金属锂阳极,并用作阳极电解液对锂嵌入阴极。如本申请通篇所用,“阳极”和“阴极”是指具有固相活性材料的电极,而“阳极电解液”和“阴极电解液”是指具有增溶的活性材料的电解液。在这些情况中的每一种当中,储存电荷的化学成本可以由非硫电极支配。因此,如果廉价且高度可溶的碱金属多硫化物的阳极电解液水溶液(最高达12m)能够与成本差不多低的阴极电解液匹配,则可以实现前所未有的电化学储存经济性,与phs和caes的经济性相当。
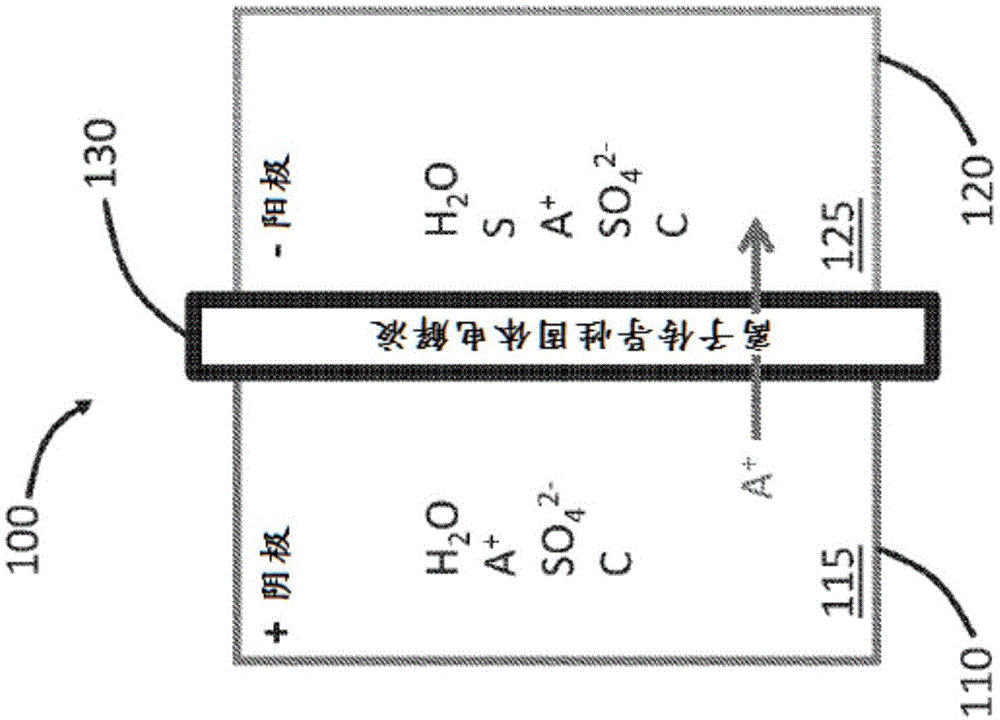
图1至图2示出了使用硫来储能的电化学设备100的示意图。设备100包括容纳有阴极电解液115的阴极电解液室110和容纳有阳极电解液125的阳极电解液室120。隔板130设置在阴极电解液115与阳极电解液125之间。阴极电解液115包含溶解在水中的至少一种金属盐,从而提供至少一种金属离子(也称为工作离子)。阳极电解液125包括多硫化物溶液。多硫化物的实例可以包括li2sx和na2sx,其中x可以为约1至约8(例如,约1至约8、约2至约7、约2至约5,或约3至约6等)。
图1示出了电化学设备100的充电过程。阴极电解液115中的反应包括2h2o→o2↑+4h++4e-,而阳极电解液中的反应包括s+2e-→s2-,其中a+是工作离子(例如na+或li+)并且从左向右(从阴极电解液115向阳极电解液125)输送。因此,在充电过程中,阴极电解液115中的水分解为氧气,而阳极电解液125中的硫通过还原反应获得电子。需注意,为了进行示意性的说明,图1至图2所示的阴极电解液115是酸性的。实际上,也可以使用碱性的阴极电解液(下面详细讨论)。
图2示出了电化学设备100的放电过程。阴极上的反应包括o2+4h++4e-→2h2o,而阳极电解液中的反应包括s2-→s+2e-,其中工作离子a+从阳极电解液125输送到阴极电解液115。因此,在放电过程中,阴极电解液115中的氧重新化合为水,而阳极电解液125中的硫通过氧化反应失去电子。图1和图2一起展示的电池单元完整反应为:
电化学设备100的电池单元电压取决于阴极电解液的ph值,以及阴极电解液115中的反应与阳极电解液125中的反应之间的电位差。在酸性阴极电解液中,阴极电解液115中的反应为
在碱性阴极电解液中,阴极电解液115中的反应可以为
图3示出了电化学设备100的甫尔拜图,展示了电池单元的电压与阴极电解液115的ph值的函数关系。如图3所示,可以通过改变阴极电解液的ph值,而在约0.85v(即碱性阴极电解液)与约1.7v(即酸性阴极电解液)之间连续地调节电池单元电压。除了阴极电解液115的ph值之外,还可以通过改变s2-还原过程的阶段、质子浓度[h+]和氧分压po2来调节该电化学设备的电池单元电压。
电化学设备100的能量密度可以通过首先仅考虑阴极电解液115和阳极电解液125来计算。在这种情况下,不受任何特定理论或运作模式的约束,该能量密度由电池单元的电压与体积充电容量的乘积决定。阴极电解液115的体积充电容量可以由工作离子的盐在设备100于放电状态下组装的情况下的溶解度决定。例如,3m的li2so4或na2so4摩尔浓度可以提供(3摩尔/l)x(2个碱离子)x(6.02x1023摩尔-1)x(1.6x10-19c)=5.78x105c/1=160.5ah/l体积充电容量,该体积充电容量在1.67v的电池单元平均电压下可以为阴极电解液115单独产生268wh/l的高能量密度。3
在阳极电解液125含有固体硫的情况下,硫的体积容量可以远高于阴极电解液115的体积容量,因而化学能量密度可以由阴极电解液支配。
各种类型的离子可以用作电化学设备100中的工作离子a+,以平衡电荷。在一个实例中,工作离子可以包括一种或多种碱离子a+,其中a可以是第1族金属,诸如li、na、k、rb或cs。在另一个实例中,工作离子可以是第2族碱土金属离子b2+,诸如be、mg、ca、sr或ba,或者另一种二价金属离子。在又一个实例中,工作离子可以包括三价金属离子,包括但不限于al3+或y3+。
工作离子a+可以通过各种方法提供。在一个实例中,工作离子可以至少部分地由阴极侧上的工作盐提供。在这种情况下,电化学设备100可以在放电状态下组装。例如,电化学设备100可以在正电极侧上(即阴极电解液中)使用溶解的碱性盐(例如a2so4)组装。在充电期间,氧气在正电极上析出,同时产生h+离子,从而降低了阴极电解液115的ph值。与此同时,工作离子a+被输送到阳极侧并与硫反应生成该工作离子的硫化物,同时通过外部电路提供电子。例如,在li或na为工作离子的情况下,所形成的硫化物可以是一种或多种可能能够溶于阳极电解液的多硫化物物质a2sx,直到固体a2s(包括其在内)。
在另一个实例中,工作离子a+可以至少部分地由阳极侧上(即阳极电解液125中)的工作离子硫化物提供。例如,电化学设备100可以在阳极室120中使用li或na的可溶性多硫化物、或者固体li2s或na2s,以及酸性阴极电解液溶液115组装。在这种情况下,设备100可以在充电状态下组装。在放电期间,工作离子从阳极室120被输送到阴极室110,在那里工作离子置换阴极电解液115中的h+,并通过h+与o2的反应形成水,并且电子通过外部电路供应。
在又一个实例中,可以既使用酸性阴极电解液、又使用含有工作离子硫化物的阳极,来在部分充电状态下组装电化学设备100。
在阴极室110中,提供工作离子的酸或盐可以具有许多可能的阴离子团中的一种或多种,这些阴离子团包括但不限于硫酸根、氯离子、硝酸根、磷酸根、柠檬酸根、醋酸根或本领域已知的任何其他有机阴离子团。换句话说,酸性阴极电解液溶液115可以含有硫酸、盐酸、硝酸、磷酸、柠檬酸、醋酸或有机酸(诸如羧酸或磺酸)。工作离子盐可以是金属盐,这些酸中的任一种酸的氢可以被电化学设备100的工作离子置换。
在阳极室120中,可以提供工作离子的碱或盐可以具有许多可能的阴离子团中的一种或多种,这些阴离子团包括但不限于碳酸根、硫酸根、氯离子、硝酸根、磷酸根、柠檬酸根、醋酸根或其他有机阴离子团。
在一个实例中,阴极电解液115和/或阳极电解液125可以是悬浮液。在另一个实例中,阴极电解液115和/或阳极电解液125可以是凝胶。该悬浮液和/或凝胶可以包括电子导体的渗透网络,该渗透网络可以提高电化学利用率与电荷转移速率。关于在电极中使用渗透网络的更多信息可以在美国专利申请号61/903574、美国专利申请号61/903739、美国专利申请号61/789964和美国专利申请号61/760436中找到,这些专利申请中的每一份以引用方式并入本文。
在一些实例中,阴极电解液115和/或阳极电解液125可以包含氧化还原介体(例如lii或nai),该介体可以增大阴极电解液115和/或阳极电解液125内的电荷转移速率。例如,这些氧化还原介体可以有效地增大li-s反应速率。
在一些实例中,阴极电解液115可以包含氧析出反应(oer)催化剂(例如iro2或ruo2),以降低用于形成氧气的过电位。在一些实例中,阴极电解液115可以包含氧还原反应(orr)催化剂(铂黑或pt3ni),以降低用于氧还原的过电位。oer催化剂和/或orr催化剂可以降低电池极化并提高电化学设备100的效率。
在一些实例中,阴极电解液115和/或阳极电解液125可以被主动或被动地搅拌,以便分别在电极室110和125内使反应物循环流动。主动搅拌可以通过例如将搅拌装置(例如三叶螺旋浆)放置在储存容器中来实现。被动搅拌可以通过例如使电解液循环流动的泵来实现。搅拌或对流可以具有几种益处,包括加快反应动力学过程、增大电荷转移速率以及降低电极处的极化程度,由此增大电化学设备100的容量利用率或效率。
在一些实例中,阴极电解液115可以充入氧气或另一种气体,以便在充电期间改善氧气的成核与去除过程。充气还可以改善氧向反应位点的质量输送,以便在充电期间减少氧。
在一些实例中,阴极电解液115是含水的,而硫阳极电解液125可以使用非水溶剂。这两个电极(阴极电解液115和阳极电解液125)可以被不可渗透溶剂的膜分开。非水性的硫阳极125可以包括金属-硫化学计量可以在从纯硫到a2s的范围内的化合物。
在一些实例中,为了避免阴极电解液115(例如,位于开放系统中)受到污染,可以将过滤器结合到设备100中,以将颗粒物以及非氧气态物质(诸如氮气或二氧化碳)排除在外。在一个实例中,过滤器可以放置在氧气或空气进入阴极的孔口(例如,图4a至图4b所示的通气孔412)处。在另一个实例中,过滤器可以是单独的子系统,进气在该过滤器处得到过滤,之后才用于电化学设备100的运作中。在又一个实例中,整个电化学设备100可以被封装在具有孔口的容器中,所有进气都通过该孔口过滤。在又一个实例中,可以将一种化合物用作氮气或二氧化碳的吸收剂或吸气剂,以便净化气体系统。例如,该化合物可以包括为更强的成碳酸盐物的氧化物,诸如na2o、cao或本领域已知的任何其他材料。
把阴极电解液115和阳极电解液125分开的隔板130(也称为膜)包括工作离子的导体。在一个实例中,隔板130可以是固体无机化合物,诸如称为nasicon或lisicon的结晶碱离子传导性化合物,或者玻璃或玻璃-陶瓷固体离子导体。在另一个实例中,隔板130可以包括诸如nafion之类的聚合物离子导体,其中锂可以被取代以便把离子导电性赋予锂。在又一个实例中,隔板130可以包括无机-有机复合材料。在又一个实例中,隔板130可以包括填充有液体或聚合物离子导体的多孔有机或无机化合物。隔板130的孔隙度在尺度上可以足够小(包括纳米多孔材料),以便传导工作离子并且在很大程度上把工作离子盐的阴离子团和/或硫或工作离子的硫化物排除在外。
电化学设备100还可以包括集流体(图1至图2中未示出)。例如,阴极电解液室110可以包括与阴极电解液115接触的阴极集流体,而阳极电解液室120可以包括与阳极电解液125接触的阳极电解液集流体。
可以用各种各样的材料来制作这些集流体。在一个实例中,这些集流体可以包括金属。在另一个实例中,这些集流体可以包括碳。在又一个实例中,这些集流体可以包括金属氧化物。在又一个实例中,这些集流体可以包括金属氮化物。在又一个实例中,这些集流体可以包括金属碳化物。在一个实例中,这两个集流体可以包括相同的材料。在另一个实例中,这两个集流体可以包括不同的材料。
可以将这些集流体选择为在电化学设备100的运作条件下保持化学稳定。例如,阴极电解液115可以是酸性的,因而阴极集流体可以使用诸如碳基材料之类的酸稳定材料。在另一个实例中,阳极电解液125可以经历碱性运作条件,并且可以富含溶解的金属硫化物,在这种情况下,阳极集流体可以使用过渡金属(例如钴或镍)、过渡金属合金(例如不锈钢)、石墨、硬碳、碳纤维、网状碳、无序碳、炭黑、富勒烯、石墨烯、氧化石墨烯、过渡金属氧化物、还原的氧化钛、和/或氧化铟锡。
也可以用各种各样的形状和构造来制作这些集流体。在一个实例中,这些集流体可以被构造为板。在另一个实例中,这些集流体可以包括波纹板以增大表面积。在又一个实例中,这些集流体可以包括纤维。在又一个实例中,这些集流体可以包括织物。在又一个实例中,这些集流体可以包括纤维编织物。在又一个实例中,这些集流体可以包括开孔泡沫。在又一个实例中,这些集流体可以包括烧结颗粒。在又一个实例中,这些集流体可以包括堆积粒子床。
如上所述,阴极电解液115中的化学反应可以在该电化学设备的充电过程中产生氧气。例如,在将3m浓度的阴极电解液充满电时,一升阴极电解液产生3摩尔o2气体,这些气体在300k和1个标准大气压(atm)下可以占据73.89l的体积。
在一个实例中,电化学设备100可以被构造为开放的空气呼吸式系统(参见下面的图4a至图4b中的更多细节)。在这种情况下,产生的氧气可以排放到外部大气中。
在另一个实例中,电化学设备100可以被构造为如图1至图2所示的封闭系统。该封闭系统可以使用氧气密封罐来以加压形式储存氧气。例如,体积与阴极电解液115相同的罐可以储存上面那个实例中在74atm下产生的氧气,忽略阴极电解液本身的氧溶解度,这些氧气在25℃和1atm下通常仅有约40mg/l=0.0025m。
在又一个实例中,设备100可以被构造为流动电池(参见例如下面的图4),其中阴极电解液115和阳极电解液125可以从至少一个储罐循环流动到对应的室(例如,分别流动到阴极电解液室110和阳极电解液室120)。
在又一个实例中,电化学设备100可以被构造为半流动电池,其中一个电极是静止的,而另一个电极是流动的。例如,阴极电解液115可以在储罐与阴极电解液室110之间循环流动,而阳极电解液125被保持在阳极电解液室120中。作为替代,阳极电解液125可以在储罐与阳极电解液室120之间循环流动,而阴极电解液115被保持在阴极电解液室110中。
电化学设备100可以在宽泛的温度范围内运作,该范围从约0℃至约100℃(例如0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃或100℃,包括其间的任何值和任何子范围)。因此,电化学设备100可以安装在各种环境条件下并且以极高的环境稳定性运作。
电化学设备100可以用于各种应用中。例如,电化学设备100可以用于季节性储能,诸如储存在夏季(例如北半球的夏季)产生的光伏(pv)电以供冬季使用。在另一个实例中,电化学设备100可以用于储存在白天期间产生的pv电以供夜间使用。在又一个实例中,电化学设备100可以用作应急备用电源。
图4a和图4b示出了被构造为开放系统且使用硫来储能的电化学设备400的示意图。设备400包括容纳有阴极电解液415的阴极电解液室410和容纳有阳极电解液425的阳极电解液室420。隔板430设置在阴极电解液415与阳极电解液425之间。阴极电解液415、阳极电解液425和隔板430可以分别与如上所述的图1至图2中所示的阴极电解液115、阳极电解液125和隔板130基本上相同。
电化学设备400还包括位于阴极电解液室410中的通气孔412,用于向阴极电解液室410中通入氧气(或其他气体,诸如空气)并且排出该阴极电解液室中的氧气(或其他气体,诸如空气)。例如,在充电过程中,水分解期间产生的氧气可以从阴极电解液室410移除。相比之下,在放电过程中,可以将氧气或空气泵送到阴极电解液室410中,以促进与h+离子反应而产生水。
图5a至图5b示出了被构造为流动电池且使用硫来储能的电化学设备500的示意图。电化学设备500可以用作环境温度下的含水可充电流动电池,该电池使用低成本的多硫化物化学物质、连同锂或钠作为工作离子,还使用了空气或氧气呼吸式阴极。该解决方案的能量密度可以为约30wh/l至约150wh/l,超过了基于当前解决方案的流动电池,并且所储存能量的化学成本可能格外低,尤其是在使用多硫化钠时(约1美元/千瓦时)。预计在系统水平上,该电化学设备500可以具有与抽水储能(phs)和地下压缩空气储能(caes)相当的能量成本和电力成本,但可以在受到位置较少制约的情况下实现较高的能量密度。
电化学设备500包括容纳有阴极电解液515的阴极电解液室510和容纳有阳极电解液525的阳极电解液室520。隔板530设置在阴极电解液515与阳极电解液525之间。阴极电解液室510还包括两个阴极集流体512a和512b。阳极电解液室520还包括两个阳极集流体522a和522b。电化学设备500还包括与阴极电解液室510流体连通的阴极电解液储罐540。采用阴极电解液泵545来使阴极电解液515在阴极电解液室510与阴极电解液储罐540之间循环流动。类似地,阳极电解液储罐550也与阳极电解液室520流体连通,并且采用阳极电解液泵555来使阳极电解液525在阳极电解液室520与阳极电解液储罐550之间循环流动。
设备500中的阳极电解液525可以包括多硫化物水溶液,其中工作离子(例如li+或na+)进行硫氧化还原反应。阴极电解液515可以包括含有作为溶解盐(例如li2so4或na2so4)的工作离子的酸性或碱性溶液。在充电时,如图5a所示,随着[h+]减少以适应工作离子的损耗,发生氧析出。在放电时,如图5b所示,发生氧还原,并且阴极电解液富含工作离子。
在阳极电解液侧,集流体522a与阳极电解液525接触,并且还用于与外部电路560连接。在阴极电解液侧,使用包括两个集流体512a和512b的双阴极配置。在充电期间(图5a),具有氧析出反应(oer)催化剂的集流体512b与外部电路560连接,而另一个集流体512a则断开。在放电期间(图5b),只有具有氧还原反应(orr)催化剂的集流体512a才与外部电路560连接,而另一个集流体512b则断开。
与传统的可充电化学物质不同,设备500将两个不共用工作离子的半反应(即多硫化物氧化/还原与oer/orr)配对。具体来说,在运作期间,li+离子和na+离子(或原则上任何形成硫化物的金属离子)可以在阴极电解液515与阳极电解液525之间穿梭以保持电中性。在阳极电解液525中,这些工作离子可以参与多硫化物氧化还原反应。在阴极电解液515中,将水既用作溶剂又用作反应物,通过氧电化学反应产生或消耗离子。由于存在过量的水,因而电化学设备500的可逆容量可以通过碱金属离子的浓度或阳极电解液525中的硫浓度(无论哪个是极限浓度)来确定。
质子(酸性阴极电解液)和羟基(碱性阴极电解液)的产生和消耗可能导致阴极电解液515中的ph值波动。在碱性阴极电解液的情况下,预计羟基交换不会对性能不利。在酸性阴极电解液的情况下,将质子限制在阴极电解液室510以防止与碱性阳极电解液525混合可能是有帮助的。需注意,该方案不是硫-空气电池,因为硫和氧之间不存在直接反应。
类似于图1至图2所示以及如上所述的电化学设备100,电化学设备500可以在放电状态或充电状态下组装。在一个实例中,电化学设备500可以在放电状态下组装,在这种情况下,碱金属工作离子由溶解在阴极电解液515中的几种可能的低成本盐(诸如li2so4和na2so4)之一提供。在另一个实例中,电化学设备500可以在充电状态下组装,在这种情况下,工作离子由溶解在阳极电解液525中的多硫化锂或多硫化钠提供。
实际上,避免或减少阳极电解液525处形成h2s可能是有益的。为此,通过添加合适的碱(例如lioh或naoh)可以保持足够高的ph值。阳极电解液525的ph值可以例如基本上等于或大于9(例如,大于9、大于10、大于11、大于12、大于13或大于14,包括其间的任何值和任何子范围)。
阴极电解液515可以是酸性或碱性的,分别在标准状态下提供约1.68v和约0.85v的电池单元平衡电压,如由下列电池单元反应所解释:
酸性阴极电解液
阴极:
阳极:
碱性阴极电解液
阴极:
阳极:
电池单元平衡电压在这些限值之间,可以随ph值连续不断变化(参见例如上面的图3)。例如,在中性ph值下,电化学设备500的电池单元电压可以为约1.26v。
图6a至图6i示出了不同的空气呼吸式硫水溶液流动电池单元构造的示意图和照片。图6a示出了标准h电池单元601的示意图。图6b是图6a所示标准h电池单元的照片。标准h电池单元601包括用于容纳阴极电解液的阴极电解液室611和用于容纳阳极电解液的阳极电解液室621。隔板631设置在阴极电解液室611与阳极电解液室621之间。阴极电解液室611与阴极电解液管641流体连接,并且阳极电解液室621与阳极电解液管651流体连接。这两根管641和651可以将电解液输送进和输送出对应的电解液室。
在一些实例中,隔板631可以具有约1.5cm2的电池单元膜面积,并且电解液体积可以为约5ml(阴极电解液和阳极电解液具有基本上相似的体积)。标准h电池单元610可以用于浅循环测试,以验证半电池单元反应并表征电压效率。在电池单元601中,相对于电解液体积很小的膜面积0.3cm-1可以限制通过该膜的总电流,因而循环时间可以很长。
图6c示出了用于长期循环阴极电解液的经改进h电池单元603的示意图。图6d是图6c所示的经改进h电池单元的照片。经改进h电池单元603包括连接到阴极电解液管643的阴极电解液室613。该经改进h电池单元还包括阳极电解液室623和隔板633,该隔板用于把阴极电解液室613和阳极电解液室623分开。
图6e示出了用于长期循环阳极电解液的经改进h电池单元605的示意图。图6f是图6e所示的经改进h电池单元的照片。经改进h电池单元605包括连接到阳极电解液管655的阳极电解液室625,用于循环容纳在阳极电解液室625中的阳极电解液。隔板635与阳极电解液室625接触,以将该阳极电解液室和阴极电解液室(图6e中未示出)分开。
与标准h电池单元601相比,这两个经改进h电池单元603和605的膜与电解液比率是前者的十倍,即3cm-1。经改进h电池单元603和605可以分别用于阴极电解液和阳极电解液的深循环测试。组装不流动电池单元604和605的一般程序可以如下。可以把lisicon或nasicon膜夹在附接到玻璃室的两个硅o型环之间。可以用一个夹钳将该组件保持在一起,以确保良好的密封。在插入电极之前,可以用阴极电解液和阳极电解液填充这些电池单元室。对于硫水溶液侧,可以把电极固定在盖上,再进一步用环氧树脂密封,以确保气密状况。
图6g示出了既有气体流动又有液体流动的流动电池单元607的示意图,而图6h至图6i是图6g中所示流动电池单元的照片。流动电池单元607包括连接到阴极电解液储罐647的阴极电解液室617和连接到阳极电解液储罐657的阳极电解液室627。隔板637设置在阴极电解液室617与阳极电解液室627之间。外部电路667连接到与阴极电解液和阳极电解液接触的集流体。
流动电池单元607在作为orr阴极的碳微孔层上包括气体扩散层(gdl),该gdl用pt/c加以改进(vulcan上有50重量%的pt,0.2mgpt/cm2gdl)。涂覆iro2的单独的镀铂钛筛网(约0.1mg/cm2几何面积)可以用作oer阴极。双阴极配置可以用于orr和oer,以避免oer期间出现碳腐蚀。硫化镍网可以通过将镍网浸泡在约100℃的1mli2s4+1mlioh溶液中3小时来制备,该硫化镍网可以用作阳极电解液反应的催化阳极。可以使用蠕动泵(masterflex,cole-parmer)以1ml/min使阴极电解液和阳极电解液循环通过上述电极室。用气体流量计(cole-parmer)控制的干燥空气(airgas,零级,总烃含量<1ppm)流率在放电期间可以为10ml/min。
图6a所示的标准h电池单元601可以用于验证半电池单元反应并表征电压效率,而图6c和图6e所示具有较高的膜面积与电解液体积比率的两个经改进h电池单元603和605则允许分别对阴极电解液和阳极电解液进行深循环测试。所有的h电池单元都是不流动配置。阴极电解液和阳极电解液同时流动的空气呼吸式电池单元607可以用来演示流动电池的运作过程。
为了在阴极电解液侧催化oer/orr,电池单元(601至607)可以使用不同的集流体。在一个实例中,电池单元(601至607)可以使用铂网作为单阴极和双功能催化剂。在另一个实例中,电池单元(601至607)可以使用双阴极(钛或铂网),其上可以涂覆oer催化剂iro2和orr催化剂铂黑。在阳极电解液侧,阳极集流体可以包括h电池单元(601、603和605)中的网状不锈钢或包裹碳泡沫的不锈钢棒,以及流动电池单元607中的用硫化物处理过的镍网。
在酸性阴极电解液和碱性阳极电解液的情况下,ph分离膜可以用作隔板(631、633、635和638)。例如,分别用于基于li+和na+的化学过程的锂超离子导体(例如来自oharacorp.(sagamihara-shi,kanagawa,japan)的lisicon膜)和钠超离子导体(例如来自ceramatec(saltlakecity,utah,usa)的nasicon膜)可以用作隔板。对于碱性阴极电解液,可以使用聚合物膜,但也可以使用lisicon或nasicon。
电池单元601至607可以使用酸性阴极电解液和碱性阴极电解液、li+和na+工作离子以及氧气和空气呼吸式电池单元配置来表征。在表征过程中,尽管用5ms进行一些实验,但可以使用4摩尔s/l(相当于8摩尔电子/升)的阳极电解液浓度。这些浓度仍然不到室温下硫溶解度限值的一半。需注意,典型的含水流动电池使用1m至2m的活性物质浓度,但与硫不同,这些物质中的大多数都不能支持多电子转移。
几种类型的参比电极可以用于具有三电极配置的电化学电池单元(601至607)中。ag/agcl参比电极(例如来自bioanalyticalsystems,inc.)或hg/hg2so4参比电极(例如来自chinstruments,inc.)可以在酸性阴极电解液侧使用。hg/hgo参比电极(例如来自chinstruments,inc.)可以在碱性多硫化物溶液中使用。碳泡沫(例如,
阴极电解液可以通过将li2so4溶解在0.1m或0.5mh2so4溶液中来制备。阴极电解液中的li2so4的摩尔浓度在下面讨论的每个实验结果中指定。用于阳极电解液时,li2s4溶液可以按下列步骤制备。可以按目标摩尔比混合s、li2s和lioh,然后加入去离子水中。可以使用lioh来调节该溶液的ph值。可以在气密瓶中有利地搅拌该混合物,直到形成透明的微黄色溶液为止。由于碱金属多硫化物溶液通常含有许多不同的物质,所以li2s4阳极电解液是指名义上由比率为3∶1的s和li2s组成的溶液。对于基于钠的阴极电解液和阳极电解液,锂盐的钠对应物可以用于制备这些溶液。
对电池单元601至607的电化学表征可以在biologicvmp3恒电位仪上执行。恒电流充电/放电的测试条件在下面讨论的每个实验结果中指定。可以使用控制在±2℃的恒温搅拌水浴在升高的温度下进行电化学测试。可以将不流动的电池单元(601、603和605)直接浸入该水浴中。对于流动电池单元607,可以把电池单元贮存器和流动电池单元电力叠堆封装在聚乙烯袋内,然后浸入水浴中。可以使用第二个热电偶来监测该电池单元叠堆处的温度。
图7示出了具有下列实验条件的封闭电池单元的充电/放电曲线。阴极包括5体积%的c、1mh2so4和1mli2so4。阳极包括5%c、2mli2s4和0.25mlioh。隔板包括ohara锂离子固体电解液。该电池单元的测试条件包括约0.09ma的电流和约0.5v至约2.5v的电压。图7示出了可能由于不存在催化剂而导致的高极化。还观察到了高oer过电位。
为了解决高极化和高oer过电位以及较低的电压滞后,可以使用基于过渡金属化合物的许多可能的低成本催化剂。例如,添加到阴极中的高锰酸盐化合物(例如kmno4、namno4)可以被还原为mno2,然后用作催化剂。此外,α-mno2和nifeox也可以添加到阴极中作为催化剂。
图8示出了两个电化学电池单元即电池单元a和电池单元b的充电/放电曲线。电池单元b在阴极上具有催化剂,而电池单元a在阴极上不具有催化剂。详细的实验条件如下。在电池单元a中,阴极包括5体积%的c、1mh2so4、1mli2so4,阳极包括5%c、2mli2s4、0.25mlioh,而隔板包括ohara锂离子固体电解液。在电池单元b中,阴极包括2体积%的高表面积α-mno2作为催化剂,还包括3体积%的c、1mh2so4和1mli2so4。阳极包括5%c、2mli2s4和0.25mlioh。隔板还包括ohara锂离子固体电解液。这些电池单元用0.27ma的电流和约0.5v至约2.5v的电压进行测试。阴极室的容积为约83.9mm3,隔板的面积为约31.7mm2。从图8中可以看出,由于阴极中包含了催化剂,电池单元b的充电/放电曲线表现出优越的性能。
图9示出了电池单元b的输出电压与比容量的函数关系。li2so4的理论容量为约492mah/g。
图10a至图10b示出了图6a所示的标准h电池单元601的充电/放电曲线,用于验证阴极电解液中发生了oer/orr,如通过改变气体组成或通过开启和关闭循环气流而引起的电池单元电压变化所指示的那样。图10a示出了具有酸性阴极电解液1mh2so4+1mli2so4的标准h电池单元的充电/放电曲线,图10b示出了具有碱性阴极电解液2mlioh的标准h电池单元的充电/放电曲线。铂网可以用作阴极电解液唯一的集流体,而包裹碳泡沫的不锈钢可以在阳极电解液2mli2s4+0.25mlioh中用作该阳极电解液的集流体。这两个实验的放电电流均为0.065ma/cm2。
为了测试阴极电解液的半反应,让使用ag/agcl(在3mkcl中)参比电极(re)的三电极h电池单元在氩气或氧气流过分散管进入阴极电解液的同时以恒电流放电。就相对于8m硫(2mli2s4)阳极电解液的酸性阴极电解液(图10a)和碱性阴极电解液(图10b)这两者来说,当气体的类型或流率改变时,都看到了工作电极(we)与参比电极之间立即出现电压响应。
由于在放电期间所推荐的反应为orr,所以当氧气(o2)关闭时,阴极电解液侧的o,供应减少可能导致电池单元的电压下降,如图10a和图10b中所见。当o2气体流量恢复时,电池单元的电压恢复回到初始水平。接下来,当o2气体关闭且氩气分散到阴极电解液中时,随着溶解的o2耗尽,电压的下降速度变快。当不使用氩气时,orr反应消耗溶解的o2,导致电压较为温和地降低。对不同的气体供应条件和o2浓度的明确响应为正在发生氧还原反应提供了证据。需注意,当硫阳极电解液经受非常浅的充电状态(soc)波动时,硫反电极(ce)与参比电极之间的电压保持不变。这些结果和稍后示出的结果与循环期间阴极电解液侧的oer/orr反应相符。
图11示出了使用碱性阴极电解液并使用li+作为工作离子的电化学电池单元的充电/放电曲线,证实发生了orr/oer反应。阴极包括铂网作为阴极集流体,并包括2mlioh作为阴极电解液。阳极包括碳泡沫/不锈钢(ss)作为阳极集流体,并包括2mli2s4与0.25mlioh作为阴极电解液。参比电极包括3mkcl中的ag/agcl,隔板包括ohara锂离子固体电解液。测试电流为约0.1ma,容量利用率为约2%充电状态(soc)。测试电池单元为阴极受限的电池单元,阴极室的容积为约4ml,隔板的面积为约1cm2。
图12示出了使用酸性阴极电解液并使用li+作为工作离子的电化学电池单元的充电/放电曲线,证实发生了orr/oer反应。阴极包括铂网作为阴极集流体,并包括1mh2so4与1mli2so4作为阴极电解液。阳极包括碳泡沫/不锈钢作为阳极集流体,并包括10mmli2s4与3mlioh作为阳极电解液。参比电极包括3mkcl中的ag/agcl,隔板包括ohara锂离子固体电解液。测试电流为约0.1ma,容量利用率为约2%充电状态(soc)。测试电池单元为阴极受限的电池单元,阴极室的容积为约4ml,隔板的面积为约1cm2。
图13示出了使用酸性阴极电解液并使用na+作为工作离子的电化学电池单元的充电/放电曲线,证实发生了orr/oer反应。阴极包括铂网作为阴极集流体,并包括5mnano3作为阴极电解液。阳极包括不锈钢网作为阳极集流体,并包括10mmna2s4、2mnacl和1mnaoh作为阳极电解液。参比电极为3mkcl中的ag/agcl,隔板包括钠离子固体电解液。测试电流为约0.1ma。阳极的s容量利用率为100%,阴极的容量利用率为约1%。该电池单元为阳极受限的电池单元,阴极室的容积为约4ml,隔板的面积为约1cm2。
图14示出了使用铂集流体的电化学电池单元的充电/放电曲线,表明在该集流体上形成了可逆的铂氧化物(ptox)。阴极电解液包括1mh2so4和1mli2so4。阳极包括碳泡沫/ss作为集流体,并包括2mli2s4与0.25mlioh作为阴极电解液。参比电极包括3mkcl中的ag/agcl,隔板包括ohara锂离子固体电解液。该测试先用0.1ma电流充电1小时,然后放电至相对于ag/agcl为0.8v。
图15示出了在开放系统中使用为悬浮液的阴极电解液的电化学电池单元的充电/放电曲线。阴极包括钛连接作为集流体。阴极电解液包括3体积%的vulcanexc72、1mh2so4和1mli2so4。阳极包括不锈钢连接作为集流体。阳极电解液包括2%c、2mli2s4和0.25mlioh。参比电极为3mnacl中的ag/agcl,隔板包括带硅酮橡胶密封的ohara锂离子固体电解液。图15示出工作电极(we)的电位范围低于oer/orr,这可能是由于碳氧化或电容效应引起的。此外,通过使用无限集流体,可以减轻阳极极化。
除了图7至图15所示的实例之外,这里还描述了另外两个实例。第一个实例包括使用li和/或na化学物质的酸性阴极电解液电池单元。对于锂化学电池,阴极包括铂网作为集流体。阴极电解液包括3mlich3coo和1mhch3coo。阳极包括不锈钢网作为集流体。阳极电解液包括固体硫。作为替代,阳极电解液可以包括2mli2s4、3mlicl和1mlioh。参比电极可以为3mkcl中的ag/agcl,隔板可以包括固体电解液。
对于钠化学电池,阴极包括铂网作为集流体。阴极电解液可以包括3mnach3coo与1mhch3coo。阳极可以包括不锈钢网作为集流体。阳极电解液可以包括固体硫。作为替代,阳极电解液可以包括2mna2s4、3mnacl与1mnaoh。参比电极可以为3mkcl中的ag/agcl,隔板可以包括固体电解液。
第二个实例包括使用li和/或na化学物质的碱性阴极电解液电池单元。对于锂化学电池,阴极包括铂网作为集流体。阴极电解液包括3mlicl和1mlioh。阳极可以包括不锈钢网作为集流体。阳极电解液包括固体硫。作为替代,阳极电解液可以包括2mli2s4、3mlicl和1mlioh。参比电极为3mkcl中的ag/agcl,隔板包括固体电解液或nafion膜。
对于锂化学电池,阴极包括铂网作为集流体。阴极电解液包括3mnacl和1mnaoh。阳极可以包括不锈钢网作为集流体。阳极电解液可以包括固体硫。作为替代,阳极电解液可以包括2mna2s4、3mnacl和1mnaoh。参比电极为3mkcl中的ag/agcl,隔板包括固体电解液或nafion膜。
图16a和图16b分别示出了使用li+和na+作为工作离子的电化学电池单元的电池单元电压与充电状态的函数关系。对li和na化学物质的这种比较在使用4ms阳极电解液与1mli阴极电解液(图16a)或1mna阴极电解液(图16b)的经改进h电池单元(例如,图6c所示的电池单元603)中进行。每个测试都在由起始阴极电解液中的盐浓度提供的整个容量范围内循环。
图17a和图17b分别示出了使用li+和na+作为工作离子的电化学电池单元在三个温度下的电压效率与电流密度的函数关系。在最低电流密度下,oer反应和orr反应将循环效率限制在71%至74%。随着电流密度不断增大,陶瓷膜电阻可能起限制作用。需注意,nasicon膜的厚度是lisicon膜的6.7倍,这说明了随着电流密度不断增大,效率下降得更快的原因。所有电池单元均使用不锈钢网阳极和具有催化剂(iro2用于oer,铂黑用于orr)的双阴极。阴极电解液侧的气流在orr期间为氧气,在oer期间为氩气。
针对li和na化学物质,到100%阴极电解液容量(基于盐浓度)的一个完整的循环分别在图16a和图16b中示出。需注意,对碱金属离子的选择并未显著改变充电和放电的电压分布,这从上面的电池单元反应可以预料到。标准h电池单元(例如,图6a所示的601)可以用来表征在25℃、55℃和70℃的温度下,电压效率与电流密度的函数关系。使用较高的温度提高了反应速率,还有助于增大na2so4在阴极电解液中的溶解度,该溶解度在35℃左右急剧增大。
针对li和na化学物质,恒电流步骤的充电和放电产生的电压效率结果分别在图17a和图17b中示出。在使用酸性阴极电解液和具有催化剂(iro2用于oer,铂黑用于orr)的双阴极时,在55℃和70℃下,对于li和na这两者来说,电压效率在测试的最低电流密度0.065ma/cm2下都在71%至74%范围内,并且随着电流密度不断增大而减小。
当阴极电解液和阳极电解液均在高库仑效率的稳定溶液体系内循环时,这些电池单元的能量效率可能主要受电压效率限制。在低电流密度下,电压效率可能主要受oer/orr反应的限制。然而,随着电流密度不断增大,膜电阻可能起支配作用。图17a中的结果可以使用150μm厚的lisicon膜获得,该膜在室温下测得的离子导电率为0.28ms/cm,在50℃下测得的离子导电率为0.4ms/cm。图17b中的结果可以使用nasicon膜获得,该膜不仅离子导电率较高,在室温下为2ms/cm,而且厚度也大得多,为1mm。因此,尽管后者的离子导电率较高,但随着电流密度增大,其效率下降得更多。
图18示出了在使用两种不同厚度的lisicon膜和单阴极(该单阴极在铂网上具有铂黑作为催化剂)的h电池单元中,在55℃下测得的li化学物质的极化和功率密度与电流密度的函数关系。与具有组成相同的150μm厚膜的电池单元相比(在5.5ma/cm2下,峰值功率密度为3.4mw/cm2),具有50μm厚膜的电池单元显示出减弱的极化和较高的功率密度(在7.1ma/cm2下,峰值为5.1mw/cm2)。该观察结果可以进一步证实,极化和功率密度变得受膜电阻限制。
图19示出了在使用双参比电极配置的电化学电池单元中,充电和放电之间的电压差与电流密度的函数关系。促成极化的各种起因可以由该电池单元确定,其中碱性hg/hgo(在1mlioh中)参比电极位于阳极电解液侧,hg/hgso4(在饱和k2so4中)参比电极位于阴极电解液侧。在高于约2ma/cm2的电流密度下,由膜电阻引起的极化相比阴极电解液和阳极电解液的氧化还原反应所造成的极化占优势地位。不锈钢网阳极和具有iro2/铂黑催化剂的双阴极可以分别在阳极电解液1mli2s4+1mlioh和阴极电解液0.5mli2so4+0.1mh2so4中使用。阴极处的气流在orr期间为氧气,在oer期间为氩气。
图19所示结果的实验条件与图17a中的条件相同,只不过使用了两种不同的参比电极,包括在阳极电解液侧的碱性hg/hgo(在1mlioh中)参比电极和在阴极电解液侧的hg/hgso4(在饱和k2so4中)参比电极。不锈钢网阳极和具有iro2/铂黑催化剂的双阴极分别在阳极电解液1mli2s4+1mlioh和阴极电解液0.5mli2so4+0.1mh2so4中使用。可以使用分步式恒电流扫描来获得总极化、阴极电解液的贡献和阳极电解液的贡献。在测量电压的同时,可以在各种电流密度下执行连续5分钟的分步式恒电流充电或放电。
如图19所示的充电和放电之间的电压差可以在该特定的电流密度下提供极化。总极化是由阴极和阳极之间的电压获得的,阴极电解液对极化的贡献是由阴极和hg/hgso4参比电极之间的电压获得的,而阳极电解液对极化的贡献是由阳极和hg/hgo参比电极之间的电压获得的。图19绘制了总极化,以及阴极电解液的贡献、阳极电解液的贡献和膜的贡献这四者与电流密度的函数关系。阴极电解液的贡献和阳极电解液的贡献在测量的电流密度范围内保持相对恒定,而膜的贡献随电流密度迅速攀升。因此,膜阻抗在较高的电流密度下是对极化的主要贡献因素,并且电池单元的功率密度变得受陶瓷膜限制。
图20示出了在使用单电极和双电极的电化学电池单元中,电压效率与电流密度的函数关系,展示了催化剂和温度对电压效率的影响。电压效率随温度升高而增大。在每种温度和低电流密度下,使用具有iro2/铂黑的双阴极的电池单元显示出比只使用单阴极(铂网)的电池单元更高的电压效率。在相对高的电流密度下,电压效率不随阴极电解液集流体的配置而变化,因为此时极化主要是由陶瓷膜造成的。这些测试在分别用0.1mh2so4+0.5mli2so4和1mli2s4+1mlioh作为阴极电解液和阳极电解液的标准h电池单元中进行。150μm厚的lisicon膜用作隔板,不锈钢用作阳极。
在使用单阴极(铂网)而不是具有iro2/铂黑催化剂的双阴极、并且保持电池单元的所有其他参数恒定的情况下,70℃下的电压效率降低了约20%(参见例如图20)。总的来说,这些结果表明,目前的方法适用于li和na这两种化学物质,然而从成本的角度看,na显然是优选的。需注意,我们的大部分实验都是用li化学物质进行的,原因是在研究开始时lisicon膜更容易获得。
图20示出,在三种测试温度25℃、55℃和70℃中的每一种下,使用具有iro2/铂黑催化剂的双阴极可以产生比使用具有铂网作为双功能催化剂的单阴极时更高的电压效率。在低电流密度体系下,具有双阴极配置的电池单元与具有单阴极的电池单元相比,电压效率提高了约15%。当膜电阻开始支配电池单元的阻抗时,随着电流密度不断增大,电压效率提高的程度减小。
阴极电解液和阳极电解液经受持续深循环的能力,以及与阴极电解液和阳极电解液接触的电池单元部件的耐久性可以使用经改进h电池单元设计(例如,分别在图6c和图6e中示出的电池单元603和605)进行测试。为了测试阴极电解液,可以组装出图6c所示的经改进h电池单元603(酸性阴极电解液),其中该电池单元的容量可以由阴极电解液中的盐浓度(通过使用4ms浓度的阳极电解液,其总容量比阴极电解液的高)来限制。可以在这个实验中使用单阴极(铂网)。可以在25℃下,以0.325ma/cm2进行恒电流循环,每个循环期间的容量被限制为阴极电解液理论容量(基于起始碱离子浓度)的96%。
图21a和图21b示出了使用经改进的不流动h电池单元对典型的阴极电解液和阳极电解液进行长持续时间循环的实验结果。图21a所示的电池单元利用超过总容量96%的容量,对抗过量的多硫化物阳极电解液循环1mli+酸性阴极电解液。在室温下1600小时的总测试时间内累积的30个循环期间观察到稳定的循环。观察到的极化最主要是由150μm厚的lisicon膜的电阻造成的。图21b示出了使用150μm厚的lisicon膜,5ms阳极电解液在li2s2至li2s4该组成范围内的对称电池单元测试。活性硫浓度为1.25ms(2.5m电子)。将hg/hgo(1mnaoh,相对于she为约0.1v)置于反电极侧,因而在工作电极上获得的电位(如图所示,相对于hg/hgo)是指电极电位加上工作电极与参比电极之间的ir电池单元。在室温下,在对应于720小时总测试时间的30个循环内观察到稳定的循环。
图21a和图21b所示的结果被绘制成第1次、第10次、第20次和第30次恒电流充电/放电循环的电压-容量曲线,总测试时间跨度超过1600小时。干燥空气在放电期间经由分散管连续流入阴极电解液室,并且水被周期性地添加到阴极电解液中以补偿蒸发的损失。充电曲线在第一次充电之后就几乎不变,还发现放电曲线极化的微小变化与阴极电解液的水位和空气流率的波动相关联,预期这些微小变化可能影响orr动力学过程。在超过2个月的测试持续时间内,电池单元的阻抗没有出现可检测到的增大,这表明与酸性阴极电解液接触的lisicon膜具有适当的稳定性,还表明阴极电解液和阳极电解液在其相应电极处(分别为铂网和不锈钢)的反应具有稳定性。
多硫化物阳极电解液的循环稳定性可以在具有容纳相同的阳极电解液但容积不同的两个气密室(从而使较小的室深度循环)的电池单元中进行测试。可以使用lisicon膜和不锈钢电极。可以将1mlioh中的碱性hg/hgo参比电极置于较大的室中。选择在其中循环阳极电解液的适当形态范围需要考虑复杂的平衡。
碱金属多硫化物水溶液含有许多不同的物质,包括碱金属阳离子(li+、na+或k+)、h2o、oh-、h+、h2s、hs-、s2-、s22-、s32-、s42-和s52-。多硫化物的溶解度和稳定性高度依赖于ph值、碱金属阳离子、标示的多硫化物形态和浓度,以及温度。在低ph值(<7)下,hs-可以是主要物质,并且h2s分子是多硫化物溶液中占主导地位的还原产物。在中等碱度(ph值为9至14)下,主要的多硫化物物质是s42-和s52-,而非hs-,尽管没有良好的密封性,h2s仍然可以在约12的ph值下产生,尤其是在还原反应期间。将多孔sba-15二氧化硅吸附剂添加到该多硫化物阳极电解液中可以减少不可逆的容量损失并提高容量保持率。这些改进可能归因于抑制了气态h2s的释放,从而防止硫持续损耗。在高度碱性的多硫化物溶液(例如>3moh-)中,占主导地位的物质可以是s32-和s22-。
在这些条件下,li2s4溶液在长期储存期间可能歧化为s0和s22-/s32-。在高于80℃的温度下,硫代硫酸盐可以轻易地经由反应sn2-+moh-→sn-mom2-+mhs-形成。该歧化副反应可能对多硫化物阳极电解液的稳定性有害,但在中等温度下其反应速度慢。因此,可以将起始的多硫化物溶液制备成在室温下包含标称化学计量的li2s4和1m或3mlioh,并且在从室温至70℃的温度下操作,使得起始占主导地位的硫物质为s42-,并且主要的降解反应被降至最低。将上述组成范围约束为li2s2至li2s4可能有助于实现稳定的循环(参见例如图21b中以5ms浓度在480小时内获得的循环结果)。为了提高能量密度并进一步降低成本,可逆地循环至li2s极限的能力是可取的。可以使用渗透纳米碳悬浮液来改善流动电池中所使用的流体电极中的电荷转移,因而在此可以应用类似的策略来扩大多硫化物容量范围。
图22a和图22b示出了电池单元的电阻和耐久性的实验结果。电池单元的复原力可以在具有对抗过量的多硫化物阳极电解液的1mli+酸性阴极电解液的电池单元上,在深循环(理论容量的96%)期间加以表征。图22a示出了在不同循环期间的充电和放电的电压分布。图22b示出了电池单元从三种扰乱(即水耗尽、水过量和氧供应中断)恢复到稳定运作。这些循环测试可以在室温下,在分别用0.1mh2so4+0.5mli2so4和1mli2s4+1mlioh作为阴极电解液和阳极电解液的经改进h电池单元中进行。150μm厚的lisicon膜可以用作膜,而纯氧可以用作orr进气。阴极和阳极可以分别包括铂网和不锈钢。
图22a和图22b展示了空气呼吸式硫水溶液电池单元从三种扰乱(即水耗尽、水过量和氧供应中断)恢复的能力。该实验使用图6c所示的经改进h电池单元设计来进行阴极电解液受限的循环,总测试时间为约2个月。施加0.4v的截止电压以避免深度放电期间出现氢析出反应。如图22b中所见,这些事件中的每一个都造成库仑效率损失。然而,在水位或氧流率恢复到初始的测试条件之后,库仑效率恢复到接近100%,这表明该电池单元稳健地对抗此类扰乱。
图23a示出了结合了具有连续流动的阴极电解液和阳极电解液的空气呼吸式电池单元的实验室规模流动电池的照片。图23b示出了在55℃下以1ml/min的流体流率测得的极化和功率密度与电流密度的函数关系。图23c示出了以0.325ma/cm2进行20个循环(对应于480小时的运作时间)而测得的电压-容量曲线。阳极电解液由于硫沉淀而在第11个循环(约255小时)之后更换,硫沉淀归因于空气意外地进入阳极电解液电路中。
图23a所示的流动电池单元使用基于酸性li2so4的阴极电解液和150μm厚的lisicon膜。图23b示出了在55℃下,在用空气束流向空气室进气时测得的流动电池单元的极化和功率密度。在放电时,该流动电池单元提供比图18中的静态对应物更高的峰值功率(3.3mw/cm2对2.4mw/cm2),并且在较高的电流密度下达到峰值功率(6ma/cm2对4ma/cm2)。这可能归因于改进的阴极设计、以及流动架构,此改进的阴极设计在用pt/c改进的气体扩散层(gdl)上具有较高密度的催化剂(pt)-气体(o2)-电解液(h+)三联结构,这一点与图18中所使用的不流动电池单元中的经铂黑改进而用作orr阴极的铂网大不相同,并且此流动架构改善了电解液-集流体界面处的质量传递。
图23c示出了在室温下将空气呼吸式流动电池单元以0.325ma/cm2进行了30个循环(720小时)的充电-放电曲线。室温下的放电电压(约1.00v)低于55℃下的放电电压(对于相同的电流密度,为约1.15v,图23b),原因在于室温下的膜电阻较高,但观察到了稳定的循环,这与使用类似的部件和运作条件(例如,图21a)的不流动的经改进h电池单元(例如,图6c)的结果类似。每10个循环(240小时)之后在阳极电解液贮存器中观察到硫沉淀,此时更换阳极电解液。该电池单元在0.325ma/cm2下的往返能量效率为42%。使用电阻较低的膜诸如薄nasicon膜可以增大受到oer/orr效率限制的往返效率值,该薄nasicon膜在室温下的离子导电率为2ms/cm,与之相比,lisicon膜在室温下的离子导电率为0.28ms/cm。
上面关于图1至图23c所描述的系统和方法利用海水作为阴极电解液的至少一部分,可以轻易地应用于储存由海洋的波浪产生的能量。使用空气呼吸式硫水溶液电池储存波浪能量的这种方法有几个优点。第一,海洋可以用作天然的阴极电解液或阳极电解液罐(0.5mnacl,ph值为约7.5至约8.4)。第二,波浪运动、潮汐运动与江河入海都会产生流动,这种流动可以用来使盐水作为可流动的电池电解液循环流动。第三,在移动式船载应用中,无需单独的泵送系统,运载工具的运动就可以产生含水电池电解液的流动。第四,高度稀释的反应物使储能的安全性得到保障。第五,这种方法还允许使用低成本的oer催化剂和orr催化剂。
图24展示了用波浪能量来发电的系统2400。系统2400包括漂浮在海洋2405中的产能装置2410,用于将波浪能量转换成电。厚板2420被构造为镇重物,用于固定产能装置2410。产能装置2410进一步连接到电力电子器件2430,该电力电子器件可以将能量递送到储能单元。
图25示出了可以用于储存波浪能量的流动电池单元2500的示意图。流动电池单元2500包括容纳有阴极电解液的阴极电解液室2510和容纳有阳极电解液的阳极电解液室2520。隔板2530设置在阴极电解液室2510与阳极电解液室2520之间。阴极电解液室2510包括供海水进入阴极电解液室2510的输入孔口2512a和供海水离开阴极电解液室2510的输出孔口2512b。阳极电解液室2520包括供阳极电解液进入阳极电解液室2520的输入孔口2522a和供阳极电解液离开阳极电解液室2510的输出孔口2522b。
在运作中,由于海洋中的海水取之不尽,所以海水可以连续流过阴极电解液室2510,而无需循环利用。这还可以在设备2500中省去至少一个流体泵,从而降低设备2500的总成本和复杂度。相比之下,阳极电解液可以在阳极电解液室2520内再循环,以供重复使用。设备2500还包括连接到阴极电解液室2510的通气孔2540,用于允许空气(或其他气体,诸如氧气)进入和/或离开阴极电解液室2510。
图26a和图26b示出了被构造为开放系统且使用硫来储能并使用na+离子作为工作离子的电化学设备2600的示意图。设备2600包括容纳有阴极电解液2615的阴极电解液室2610和容纳有阳极电解液2625的阳极电解液室2620。隔板2630设置在阴极电解液2615与阳极电解液2625之间。阴极电解液2615、阳极电解液2625和隔板2630可以分别与如上所述的图1至图2中所示的阴极电解液115、阳极电解液125和隔板130基本上相同。
电化学设备2600还包括位于阴极电解液室2610中的通气孔2612,用于向阴极电解液室2610中通入氧气(或其他气体,诸如空气)并且排出该阴极电解液室中的氧气(或其他气体,诸如空气)。例如,在充电过程中,水分解期间产生的氧气可以从阴极电解液室2610移除。相比之下,在放电过程中,可以将氧气或空气泵送到阴极电解液室2610中,以促进与h+离子反应而产生水。
如图26a至图26b所展示,设备2600的电池单元电压可以由下列两个反应之间的电位差决定。在酸性阴极电解液(约1.7v电池单元)的情况下:
阴极充电反应包括:
2h2o→o2↑+4h++4e-ec0=1.229v(相对于she)
2cl-→cl2↑+2e-ec0=1.358v(相对于she)
阴极放电反应包括:
o2↑+4h++4e-→2h2oec0=1.229v(相对于she)
阳极反应包括:
在强碱性阴极电解液(约0.85v电池单元)的情况下:
阴极充电反应包括:
阴极放电反应包括:
o2↑+2h2o+4e-→4oh-ec0=0.401v(相对于she)
阳极充电/放电反应包括:
在弱碱性海水阴极电解液(约1.2v电池单元)的情况下:
阴极充电反应包括:
阴极放电反应包括:
o2↑+2h2o+4e-→4oh-ec0=0.75v(相对于she)
阳极充电/放电反应包括:
在一些实例中,设备2500和2600可以使用天然存在的水作为电极材料,并且该天然存在的水中的一种或多种天然存在的离子可以用作设备2500和2600的工作离子。在一个实例中,天然存在的水包括海水。在另一个实例中,天然存在的水包括淡水。在又一个实例中,天然存在的水包括废水。
在一些实例中,设备2500和2600可以使用天然存在的水的贮存器作为电极材料,并且该贮存器的总电荷储存容量可以是反电极的电荷储存容量的至少5倍。例如,天然存在的水的贮存器可以用于正电极,该正电极可以在设备2500和2600的循环期间经受氧还原和氧析出。在这种情况下,反电极是负电极,其中可以包含硫。
在一些实例中,如在设备2500和2600中使用的天然存在的水电极在该设备运作期间流动。在一个实例中,该流动电极可以在设备运作期间泵送。在另一个实例中,该流动电极可以由于天然存在的事件而流动,这些事件包括但不限于降雨、溪流或江河入海、水下泉涌、潮汐流动和/或波浪作用。
在一些实例中,设备2500和2600可以使用水流来让水基电极材料流到该设备的电极室。在一个实例中,电极室是该设备(例如2510和2610)的正电极。
在一些实例中,设备2500和2600可以使用水流来让水基电极材料流到电极室,同时使用该水流来泵送或循环设备2500和2600的第二电极。该第二电极可以是包含硫的负电极。另外,该第二电极可以包括含有多硫化物和/或固体金属硫化物的水溶液。
在一些实例中,设备2500和2600可以使用潮汐流动或波浪作用来填充贮存器,该贮存器随后在重力作用下让水基电极材料流到电极室(例如2510和2610)。
在设备2500和2600中使用海水可能有几个好处。例如,与高碱性情况下的电池单元电压相比,可以实现更高的电池单元电压,同时避免了像在酸性情况下那样对使用ph分离陶瓷膜的需要。此外,海洋包括化学组成恒定的海水电极,包括恒定的na+浓度,以及几乎“无限”的海水阴极电解液供应。因此,该电池的容量和能量不受阴极电解液的限制。该容量和能量反而可能受硫阳极的限制。另外,阴极电解液侧通常不会出现明显的ph值波动和相关联的电压饱和。最后,该方法可以在方便的电压范围内运作,以避免cl2气体产生,这与先前提出的产生cl2的海水电池不同。由于cl2/s电池单元的ocv为约1.85v,而使用海水的o2/s电池单元的ocv为约1.2v,因此将电池单元的充电电压保持为低于1.85v可以避免cl2气体产生。
鉴于上述电化学设备的种种技术优点,估计该设备的实际成本也是有启发性的。储存的化学成本(针对阴极电解液和阳极电解液的组合以美元/千瓦时给出)可以轻易地由电池单元电压、起始部件的成本以及溶质浓度算出。尽管水溶液中的多硫化物溶解度可以高达12m硫浓度,但稳定性问题(参见下文)可能将实际容量限制为低于根据反应2a+s→a2s(其中a为li或na)的硫完全还原的理论可能值。然而,即使硫还原的范围较为有限,也可以实现格外低的化学成本,同时达到比许多以前的流动电池高的能量密度。
表2和表3分别示出了具有5mli或na和5ms的阴极电解液和阳极电解液的能量密度和成本计算值。如果实现了全部的理论硫容量,则酸性阴极电解液和碱性阴极电解液的能量密度分别为125wh/l和58wh/l。对于酸性阴极电解液和碱性阴极电解液,单独将s浓度增至10m可以分别将上界提高至约150wh/l和70wh/l。如果循环仅限于硫理论容量的25%,则对应于li2s2-li2s4orna2s2-na2s4溶液体系内的运作,能量密度分别为63wh/l和29wh/l。对于钠-硫化学体系,在该活性浓度范围(5m至10m硫)内,成本低得不可思议,为0.35美元/千瓦时至1.60美元/千瓦时(在使用酸性阴极电解液的情况下,具体取决于可用容量),这似乎是任何已知可充电电池的最低化学成本。相比之下,锂离子活性材料的化学成本在25美元/千瓦时至100美元/千瓦时的范围内,而最广泛研究的流动电池钒氧化还原流动电池(vrfb),它的化学成本在34美元/千瓦时至162美元/千瓦时的范围内,具体取决于钒的价格。在这种方法中使用锂-硫化学体系,成本是使用钠时的四倍以上,在相同的活性硫浓度范围内为2美元/千瓦时至6.40美元/千瓦时(在使用酸性阴极电解液的情况下);与现有的流动电池相比,该范围的下限可能仍有吸引力。
表2.取阴极电解液和阳极电解液的总体积,空气呼吸式硫水溶液电池的化学能量密度(wh/l)。我们假设这是一个电荷平衡的电池单元,其中碱性离子含量等于在所指定形态范围内的硫中所储存的电荷。
表3.具有5m工作离子(na+或li+)和5m指定形态范围内的总硫的空气呼吸式硫水溶液电池的化学成本、罐成本和能量成本。在计算c能量时,εsys,d、εq,rt、εv,d如文本中所指定,分别取0.94、1和0.82。
由于阴极电解液和阳极电解液都可以是流体,所以电化学电偶适用于流动电池架构,其中电力叠堆和化学储存容量可以独立地确定大小,以满足期望的能量电力比。在这样的架构中,可以通过调整电力叠堆的尺寸,使其仅与满足最大电力要求所必需的尺寸一样大,来尽可能减小该电力叠堆在系统成本中所占的比重。正如稍后详细讨论的那样,使用来自流动电池的最近技术经济分析的指导原则,可以估计,本申请中讨论的电化学储存系统可能具有引人注目的性能和成本属性,这些性能和成本属性与目前成本最低的储能技术phs和caes非常相似。
流动电池凭借其设计允许独立地调节电力和能量,这些流动电池具有类似于抽水储能(phs)和地下压缩空气储能(caes)的成本结构。对于phs和caes来说,电力成本(例如美元/千瓦)主要由发电涡轮机和相关联装备的成本决定;而对于流动电池来说,电力成本主要是发电叠堆的成本。能量成本(例如美元/千瓦时)在phs和caes的情况下主要由储存贮存器的尺寸决定,在流动电池的情况下主要由化学储存成本决定。在系统水平,能量成本(美元/千瓦时)是电力成本(美元/千瓦)与总储存持续时间(小时)的比率,总储存持续时间由储存贮存器或储罐的充电容量限定。
图27示出了几种储能技术的安装成本与储存持续时间的函数关系。使用na和li这两种化学物质的本发明空气呼吸式硫水溶液流动电池方法的曲线分别以绿色和灰色示出。恒定电力成本曲线表明,电力叠堆在较短的储存持续时间内占据系统成本的主导地位,而在较长的持续时间内,成本渐渐接近化学组分的成本加上储罐成本。假设na和s这两者的浓度都为5m,且硫在对应于理论容量25%的形态范围s22-至s42-内循环。本发明流动电池的na和li这两种型式的化学成本用虚线示出。空气呼吸式硫水溶液技术的预计成本有利地与抽水储能(phs)和地下压缩空气储能(caes)的预计成本相当,同时能量密度还提高了几倍,而且不像phs和caes那样受到位置的制约。
对于锂离子,图27所示的带表示ev电池组2030的预计成本的范围。考虑到相比流动电池,锂离子电池设计中的功率能量比相对不灵活,锂离子成本被绘制为与储存持续时间无关。需注意,现有phs安装设施的成本已根据通货膨胀进行了调整;这一修正很重要,否则phs的成本可能被显著低估,对于美国最老的那些工厂来说,调整倍数大于5。
图27示出,空气呼吸式硫水溶液流动电池的预计成本范围与phs和caes的预计成本范围在绝对值与对能量/电力比的依赖性这两方面都相似。成本在短持续时间内由电力叠堆的成本支配,而在长持续时间内,随着持续时间增加而下降,渐渐接近能量成本,对于当前的方法来说,该能量成本是化学成本加上储罐补贴0.15美元/升。对于钠化学成本,假设该电池包含酸性硫酸盐阴极电解液,na和s的浓度各自为5m,且硫在理论容量的25%(s22-至s42-)内循环。这产生了1.56美元/千瓦时的化学成本(水平的绿色虚线)。如果作为替代假定硫在完整的理论容量(s2-至s0)内循环,则化学成本进一步降低至前所未有的0.39美元/千瓦时,且系统水平的能量成本降低至2.06美元/千瓦时。
li化学物质在理论容量25%内循环的类似结果以灰色阴影示出。考虑到电池单元电压(v)、面积比电阻(asr,ω·m2)、放电期间的系统效率和放电期间的电压效率,电力成本体现在反应器部件的成本(美元/平方米)和反应器的电力性能(kw/m2)。对于具有相对高asr的隔板的实验室规模电池单元组件,假设高生产量下的陶瓷膜成本为100美元/平方米,则na基化学物质的反应器成本为约2300美元/千瓦(详见下面的表4和表5)。因此,图27中包括上界,为2500美元/千瓦。然而,类似叠堆技术随时间推移实现的低电力成本表明,在当前方法中降低叠堆的电力成本具有相当大的潜力。图27中的下界55美元/千瓦,是美国能源部预计的氢燃料电池单元的叠堆成本,假定这些电池单元使用了贵金属催化剂和nafiontm型膜。估计使用质子交换膜的含水流动电池未来的反应器成本甚至更低,为39.3美元/千瓦。
很明显,随着储存持续时间增加,能量成本低的储存技术(phs、caes和本发明的流动电池)将获得优势。图27示出了不到约10小时的持续时间内,多种技术可以基于能量成本进行竞争,这些技术可以基于这里未示出的其他因素来区分,诸如能量密度和高充电/放电率下的往返效率(该往返效率是影响热管理成本的一个因素)。持续时间不到10小时之前,phs和caes一直具有成本优势,但持续时间超过10小时之后,空气呼吸式硫水溶液流动电池便提供了一种新的低成本选择。即使电力成本高达2500美元/千瓦(在当前的实验室规模下),预计的系统成本仍几乎可与图27中的长持续时间caes案例研究竞争,其中100至300小时的储存时间被认为是使单个风电场的输出完全平滑并产生基载电力所必需的。
然而,可再生发电通常不会“陷于困境”,通过聚集多个风电场或太阳能电场,并通过以互连基础设施为代价混合可再生资源,可以使间歇性发电平滑。尽管如此,将风能、太阳能和电化学储存资源结合用于大区电网(pjm互联,31.5gw)的详细成本最小化模型已经表明,随着储存成本降低,通过在更长的持续时间内集成存储,获得了更低的电力成本。例如,成本最小化时的储存持续时间从锂离子电池(钛酸锂化学物质)的9小时,增加到钢罐中储存有气态氢的燃料电池单元/电解槽系统(单独的罐的成本为41至102美元/千瓦时)的72小时。因此,由于太阳能和风能的发电量与基于化石燃料的发电量成比例增长,所以预期储存持续时间长的体系将变得越来越重要。
根据本发明的在长持续时间内储存电力的一种方法是提供如本文所述的一种或多种电化学设备,其中在充电期间(例如,使用诸如风能电源或太阳能电源之类的可再生电源),充电期间在阴极电解液中产生的氧简单地排放到大气中,而阳极电解液中产生的多硫化物从电化学电池单元的阳极电解液室被泵送到储罐中。可再生能源因此以多硫化物的形式储存。在放电循环期间,储存的多硫化物可以循环流动回到阳极电解液室,并氧化回硫形式。阳极电解液储罐的尺寸以及电化学电池单元的数量和尺寸可以适应于特定应用的特定储能要求。
然而,由于存在多条路径来降低电力成本,所以按这种方法描述的方法无需局限于长持续时间储存。与之前开发的燃料电池单元和流动电池一样,通过使用导电率较高且成本较低的膜、减少使用贵金属催化剂以及改善叠堆设计,可以增大功率密度并且降低材料成本。在电力成本为500美元/千瓦的情况下,目前的方法在为期一天的体系中与地下caes相比有成本竞争力,而在500美元/千瓦的情况下,在时间短于10小时的体系中与phs相比有成本竞争力。
对本文所述设备成本的更详细分析如下。硫化学物质具有理论容量高(约1670ah/kg)和材料成本低(约0.12s/kg)这两个优点。结合这两个参数评估材料性能的一种方式为每个储存电荷的成本(cpsc),
表1列出了常用的电活性材料,连同其批发价、理论容量和每个储存电荷的成本。可以看出,硫的每个储存电荷的成本是所示电活性材料中最低的(0.12美元/千安时),这些电活性材料包括我们已知的成本最低的电极。对于本发明的方法,如果电池单元在部分充电或完全充电的状态下组装,则na2s可以用作阳极电解液化合物。该化合物的每个储存电荷的成本是列出材料中倒数第二低的,为0.87美元/千安时。
本文所述电池化学物质的理论能量密度可以如下计算:在阴极电解液中,可以使用5m的工作离子浓度cc,其中工作离子为na+或li+。na2so4和li2so4在40℃时的溶解度分别为约3.1m和2.8m,分别对应于6.2m和5.6m的工作离子。在阳极电解液中,可以假定氧化还原反应在s42-和s22-之间、或s0和s2-之间发生,且总硫浓度为5m,分别相当于ca=2.5me-和10me-。电池单元电压(u)取1.4v(这是使用酸性阴极电解液时的放电电压)或0.65v(这是使用碱性阴极电解液时的放电电压)。法拉第常数(f)为96,485c/mol。化学能量密度(e,wh/l)通过用阴极电解液和阳极电解液的组合体积将容量和电压的乘积归一化来获得:
表2汇总了化学能量密度的结果。
空气呼吸式硫水溶液电池的能量成本(c能量,美元/千瓦时)使用以下公式计算:
其中c化学是化学总成本(美元/千瓦时);c罐是罐成本(美元/千瓦时);εsys,d是放电期间的系统效率,用于说明泵送、加热和/或冷却时的电力转换效率;εq,rt是往返库仑效率;εv,d是放电期间电池单元的电压效率。c化学结合了用如表2所示的空气呼吸式硫水溶液电池的理论能量密度(kwh/l)归一化的所有化学品的成本(美元/升)。
可以进一步假定,电池单元是使用表3中列出的化学品和对应的浓度在0%soc下组装的。添加过量的0.1m碱金属盐(na2so4或li2so4),以避免在充电即将结束时发生传质限制,从而确保5m的工作离子(na+或li+)可被完全利用。假定电解液总体积的10%被溶质占据,则将水的成本(尽管最小)考虑进去。na2so4、li2so4、h2so4、naoh、lioh、na2s和s的批发价在www.alibaba.com上从金牌供应商处获得。li2s的价格估计是na2s价格的5倍。c罐是从参考文献(2)采纳的、用如表s2所示的理论能量密度(kwh/l)归一化的罐批发价(美元/升)。在分母中,εsys,d取参考文献(2)中建议的常数0.94;假设不存在物质交换或副反应,则εq,rt取1。需注意,我们没有观察到使用陶瓷单离子导体的任何物质交换,也没有观察到除了氧和sx2-之外的任何其他氧化还原反应。当针对orr包括0.25v的活化过电位时,εv,d取理论最大放电效率(1.4-0.25)/1.4=82.1%。表3列出了具有不同的工作离子(na+或li+)和不同的硫形态范围
空气呼吸式硫水溶液电池的电力成本(c电力,美元/千瓦)使用以下公式计算:
其中ca是每单位面积的反应器部件组合成本(美元/平方米);r是电池单元的总面积比电阻(asr)(ω·m2);εsys,d是放电期间的系统效率,用于说明泵送、加热和/或冷却时的电力转换效率;u是电池单元的开路电压(v);εv,d是放电期间电池单元的电压效率。
表4列出了具有对应的参考值/来源的反应器部件成本。假定铂族金属(pgm)催化剂(pt+iro2)的负载量为0.15mg/cm2。总ca估计为221.4美元/平方米;需注意,在阴极处使用了两个钛电极。可以假设asr的促成因素包括隔板的总和(隔板的体电阻+电荷转移电阻)与电极反应(orr+sx2-氧化)。对于nasicon和lisicon,在膜厚度为150μm时,估计总r分别为28.2ω·m2和97.0ω.m2。表5列出了具有对应的参考值/来源的r详细计算结果。在分母中,εsys,d取常数0.94;如实验观察到的酸性阴极电解液电池单元的u为1.4v。如能量成本计算中所示,εv,d取相同的理论最大放电电压效率82.1%。需注意,通过以εv,d=0.5运行该电池单元可以获得较低的电力成本,这等于以较高的能量成本为代价,在理论峰值功率密度下运作该电池单元。
对于空气呼吸式硫水溶液流动电池,安装成本根据darling的技术经济分析(但作出了如下所示的改变)计算得出:
其中包括能量成本(c能量,美元/千瓦时)、电力成本(c电力,美元/千瓦)、工厂配套设施成本(cbop,美元/千瓦)、储存持续时间(td,小时)、系统安装成本调整系数(f安装,安装成本/装备成本),以及“附加成本”(cadd,美元/千瓦)。术语cbop考虑了运行流动电池系统所需的附件的成本,这些附件包括加热/冷却装备、充电状态管理和电源管理电子器件,以及泵。术语cadd考虑了安装该储能系统的其他成本因素,诸如销售、管理、折旧、保修、研发、利润率等。对于cbop和cadd,我们分别使用202.5美元/千瓦和87.5美元/千瓦,这两个值被视为其他水性氧化还原流动电池对应的平均上界值和下界值(95%置信度)。通过平均6个现有vrfb系统的安装成本调整系数(f安装),估计系统安装成本为20.5%。这可能是被谨慎地过高估计的百分数,因为根据流动电池技术的详细数据,流动电池的安装成本在总装备成本的4%至20.5%之间。
vfrb的经济性以前已经详细研究过。这里,安装成本用制成表6的下界成本因素和上界成本因素计算。
对于锂离子,图27所示的带表示ev电池组2030的预计成本的范围。考虑到相比流动电池,锂离子电池设计中的功率能量比相对不灵活,为简单起见,我们将锂离子成本绘制为与储存持续时间无关。
由于现有的phs安装设施可能已经运作长达50年,为了更准确地比较,每个phs设施的成本都根据从安装年份到2015年美元的通货膨胀进行了调整。需注意,如果没有这一修正,则对于图27中的数据集,phs的当前成本并未完全呈现,只有实际成本的5.9。这项分析只包括美国的phs设施,而且只包括仅通过泵送而产生储存容量的那些设施,泵送与从河流流动获益大不相同,后者增大了储存容量和持续时间,并造成人为的低能量成本。
表4.在本次工作中制造验证概念用空气呼吸式硫水溶液流动电池时所涉及的反应器部件的估计成本。
表5.使用nasicon或lisicon隔板的电池单元的估计面积比电阻。
表6.安装vrfb的能量成本因素。
表7.phs的储存容量和安装成本。
表8.caes的储存容量和安装成本。
尽管本文已经描述和展示了本发明的各种实施方案,但是本领域的普通技术人员将轻易地设想出多种其他的装置和/或结构来执行所述功能并且/或者获得所述结果和/或本文所述优点中的一者或多者,而且这些变化和/或修改中的每一者都被认为是在本文所述的本发明实施方案的范围之内。更一般地说,本领域的技术人员将轻易地理解,本文所述的所有参数、尺寸、材料和构造都意在是示例性的,并且实际的参数、尺寸、材料和/或构造将取决于使用本发明教导内容的一个或多个具体应用。本领域的技术人员使用不超出常规实验的手段就将认识到、或能够探知本文所述的本发明具体实施方案的许多等同方案。因此,应当理解,前述实施方案仅以举例的方式提供,并且在所附权利要求及其等同物的范围之内,可以按照除了已具体地描述和要求权利的方式之外的方式实践本发明的实施方案。本公开中的本发明实施方案涉及本文所述的每个单独的特征、系统、制品、材料、试剂盒和/或方法。此外,两个或更多个此类特征、系统、制品、材料、试剂盒和/或方法的任意组合在此类特征、系统、制品、材料、试剂盒和/或方法不相互抵触的情况下,都包括在本公开的本发明范围之内。
本发明的各种概念都可以体现为一种或多种方法,这些方法的实例已经提供过。作为该方法的一部分执行的动作能够以任何适当的方式排序。因此,可以构造出其中的动作以不同于所展示顺序的顺序执行的多个实施方案,这些实施方案可以包括同时执行某些动作,即使在说明性实施方案中这些动作被示出为相继进行的动作。
如本文所限定和使用的所有定义,应当理解为优于字典定义、以引用方式并入的文档中的定义和/或所限定术语的平常含义。
除非明确相反地指示,否则如本文在说明书中以及在权利要求中所用的不定冠词“一个/种”应当理解为意味着“至少一个/种”。
如本文在说明书中以及在权利要求中所用的短语“和/或”,应当理解为意味着这样结合的要素(也就是在某些情况下结合存在、而在其他情况下分开存在的要素)中的“任一者或两者”。以“和/或”列出的多个要素应当以同样的方式来解释,即,这样结合的要素中的“一者或多者”。可以任选地存在除了“和/或”句式具体标识的要素之外的其他要素,不管这些其他要素是与具体标识的那些要素相关还是不相关。因此,作为非限制性实例,当结合诸如“包括”之类的开放式用语使用时,提到“a和/或b”在一个实施方案中可以仅指a(任选地包括除b之外的要素);在另一个实施方案中可以仅指b(任选地包括除a之外的要素);在又一个实施方案中可以既指a又指b(任选地包括其他要素);等等。
如本文在说明书中以及在权利要求中所用的“或”,应当理解为具有与如上文定义的“和/或”相同的含义。例如,在分隔清单中的各项时,“或”或者“和/或”应当解读为具有包容性,即,包括多个要素或要素清单中的至少一项、不过也可包括其中的多于一项,并且任选地包括附加的未列出的项。只有明确相反指示的术语,诸如“……中只有一个”,或在权利要求中使用时的术语“由……组成”,才将指代只包括多个要素或要素清单中的一个要素。一般来说,如本文所用的术语“或”只有在以排他性的术语(诸如“任一个”、“之一”或“只有一个”)作为前缀时,才应当解读为指示排他性的备选项(即,“一个或另一个,但不能两者兼有”)。在权利要求中使用时,“主要由……组成”应当具有如在专利法领域中所使用的普通含义。
如本文在说明书中以及在权利要求中所用,提及一个或多个要素的清单时的短语“至少一个”应当理解为意味着选自该要素清单中的任意一个或多个要素中的至少一个要素,而不必包括在该要素清单之内具体列出的每一个要素,并且不排除该要素清单中的要素的任意组合。该定义还允许可以任选地存在短语“至少一个”所指代的、该要素列表之内具体标识的要素之外的要素,不管这些要素是与具体标识的那些要素相关还是不相关。因此,作为非限制性实例,“a和b中的至少一者”(或等同地“a或b中的至少一者”,或等同地“a和/或b中的至少一者“)在一个实施方案中可以指至少一个、任选地包括多于一个a,而没有b存在(且任选地包括除b之外的要素);在另一个实施方案中可以指至少一个、任选地包括多于一个b,而没有a存在(且任选地包括除a之外的要素);在又一个实施方案中可以指至少一个、任选地包括多于一个a,以及至少一个、任选地包括多于一个b(且任选地包括其他要素);等等。
在权利要求中以及上述说明书中,所有过渡词诸如“包括”、“包含”、“承载”、“具有”、“含有”、”涉及”、“持有”、“由……构成”都应当理解为是开放式的,即意味着包括但不限于此。只有过渡词“由……组成”和“主要由……组成”才应当分别是如美国专利局专利审查程序手册第2111.03节中所规定的封闭式过渡词或半封闭式过渡词。
- 还没有人留言评论。精彩留言会获得点赞!