运动场用结缕草组织培养快速繁殖的方法与流程
本发明属于生物技术领域,具体涉及一种运动场用结缕草组织培养快速繁殖的方法。
背景技术:
结缕草(Zoysia japonica Steud)属于禾本科,是一种多年生的暖季型草坪草,其具有抗旱、抗病和耐粗放管理等优良的特点;在暖季型草坪草中抗寒性最强,由于其具有很强的耐践踏能力及其恢复能力强的特点,被广泛应用于运动场草坪。但与冷季型草坪草比较,他的绿期相对较短,在改进其绿期方面,利用传统的育种手段已经无法从根本上解决此问题;随着分子育种技术的发展,利用遗传转化技术为解决此问题提供了可能;一个高效的组织培养体系是遗传转化体系的核心,而组织培养体系受到物种的基因型限制,不同的基因型品种对结缕草的组织培养体系具有很大的影响。本发明使用的是结缕草Compadre品种,此品种是从美国HANCOCK种子公司引种而来的优质草种,目前在国内得到很好的适应,但目前尚未有关Compadre组织培养体系建立的报道。
目前已有一些有关结缕草其它品种的组织培养体系的报道,1989年,Al-Khayri等人利用种子作为外植体,首次建立了结缕草组织培养体系,Asano 1989;Asano et al.1996;Poeaim et al.2004;Xun Wang et al.2010等利用不同结缕草品种建立了组织培养体系,但有一点是公认的,不同的基因型结缕草品种的组织培养体系的配方,生长周期、愈伤诱导率和再生率存在很大的区别。Compadre作为一种优质的品种,具有优质的色泽、抗旱、抗病和耐粗放管理等优良特性,在美国的运动场已经得到广泛的应用;自2009年引种到国内,在北京地区也得到良好的适应;但其也具备结缕草普遍具有的缺陷,就是绿期相对较短,目前结缕草Compadre缺乏一套高效的组织培养体系,本发明以此为目的,以此为利用遗传转化技术解决结缕草Compadre绿期短的问题奠定基础。
技术实现要素:
本发明的目的就在于克服现有技术存在的缺点和不足,提供一种运动场用结缕草组织培养快速繁殖的方法。
本发明采用的技术方案如下:
通过种子无菌处理,愈伤诱导,芽的分化,生根的培养和植物生长调节剂的选择,探索结缕草Compadre在组织培养过程的各种条件,首次建立了结缕草Compadre的组织培养体系,为利用遗传转化技术改良结缕草Compadre奠定基础。
具体地说,本方法包括以下步骤:
①外植体选取与消毒;
②改良培养基的配备;
③愈伤诱导;
④愈伤继代;
⑤芽分化;
⑥生根培养;
⑦炼苗与移栽;
对培养基的改良方法如下:
对MS培养基进行改良,配方为:在基础的MS培养基中加入pvp40和酸水解酪蛋白,其他组分均无变化;pvp-40的浓度为0.1-1mg/L,酸水解酪蛋白浓度为0.15-0.5mg/L;
配备用于愈伤诱导的培养基,配方为:在改良的MS培养基的基础上添2,4-D、6-BA、维生素B1和α-酮戊二酸;其中2,4-D的浓度为1-8mg/L,6-BA的浓度为0.1-1mg/L,维生素B1的浓度为1-10mg/L,α-酮戊二酸的浓度为50-600mg/L;
配备用于愈伤继代的培养基,配方为:在改良的MS培养基的基础上添加2,4-D、6-BA、TDZ、维生素B1和α-酮戊二酸;其中2,4-D的浓度为1-8mg/L,6-BA的浓度为0.1-1mg/L,TDZ的浓度为0.01-0.1mg/L,维生素B1的浓度为1-10mg/L,α-酮戊二酸的浓度为50-600mg/L;
配备芽分化的培养基,配方为:在改良的MS培养基的基础上添加TDZ、NAA、GA和麦芽糖;其中TDZ的浓度为0.5-3mg/L,NAA的浓度为0.01-0.4mg/L,GA的浓度为0.05-0.5mg/L,麦芽糖的浓度20-40mg/L;
配备生根培养基,配方为:将改良的MS培养基营养元素减半,再添加蔗糖和琼脂;其中蔗糖的浓度为10-30mg/L,琼脂的浓度为8-12mg/L;
所有阶段的培养环境为:光照为40-80μE/m2/s,温度为26-28℃,培养基的pH为5.6-6.0。
本发明具有下列优点和积极效果:
①利用本发明所述的培养基配方和利用种子作为外植体,首次建立了结缕草Compadre组织培养体系,其中愈伤诱导率为75.2%,胚性愈伤率为60.2%,芽的分化率为58.3%,生根率为95.3%,组培苗移入土中成活率为98.3%;
②从种子诱导愈伤到获得体外植株,总周期为135天,高效建立了利用组织培养的方法来实现结缕草Compadre快速繁殖的体系,其中大部分指标均高于其他同类结缕草品种;
③以此为利用遗传转化技术来解决结缕草绿期短的问题奠定了基础,更好地推动了运动场草坪事业的发展。
附图说明
图1是本方法的流程图。
具体实施方式
下面结合具体实施例,对本发明作进一步详细的阐述,但本发明的实施方式并不局限于实施例表示的范围。
一、优选
1、改良的MS培养基中的pvp40为0.5mg/L,酸水解酪蛋白为0.25mg/L;
2、所述用于愈伤诱导培养基2,4-D的浓度为5mg/L,6-BA的浓度为0.2mg/L,维生素B1的浓度为5mg/L,α-酮戊二酸的浓度为120mg/L;
3、所述用于愈伤继代培养基2,4-D的浓度为5mg/L,6-BA的浓度为0.2mg/L,TD的浓度为0.05mg/L,维生素B1的浓度为5mg/L,α-酮戊二酸的浓度为120mg/L;
4、在所述用于芽分化培养基中,TDZ的浓度为1.2mg/L,NAA的浓度为0.05mg/L,GA的浓度为0.1mg/L,麦芽糖的浓度为30mg/L;
5、在所述用于生根培养基中,1/2MS营养元素更适合生根,蔗糖的浓度为10mg/L,琼脂的浓度为9g/L;
6、在所述用于结缕草Compadre最适合的组织培养条件为,光照为60μE/m2/s,温度为28℃,pH为5.8。
二、实施例
1、实施例1
本方法包括以下步骤:
①外植体挑选与灭菌
A、选取子粒饱满的结缕草Compadre种子作为外植体;
B、用70%酒精灭菌2min,先对种子进行表面消毒,消毒完用蒸馏水清洗3次;
C、用40%的次氯酸钠(有效Cl为10%)灭菌45min,加入0.1mL吐温20,并放在磁力搅拌器上进行搅拌,时间到后,在超净工作台上用500mL的无菌水进行清洗,再加入50mL无菌水放入4℃冰箱中低温春化24h;
D、在超净工作台上将春化过的种子放在无菌滤纸上吹干;
②对基础MS培养基进行改良
在基础的MS培养基中加入pvp40和酸水解酪蛋白,其中pvp40浓度为0.2mg/L,酸水解酪蛋白的浓度为0.15mg/L,其他成分不变;
③愈伤诱导
将步骤①中灭菌的种子,播种到愈伤诱导培养基中,大约50颗/皿,用锡纸包裹,放置在温度为28±1℃条件下进行暗培养,培养20-23天,有愈伤长出;
所述用于愈伤诱导培养基的配方为:在改良的MS培养基的基础上添加2,4-D、6-BA、维生素B1和α-酮戊二酸;其中2,4-D的浓度为2mg/L,6-BA的浓度为0.1mg/L,维生素B1的浓度为2mg/L,α-酮戊二酸的浓度为50mg/L,除以上另外加入蔗糖的量为30g/L,植物凝胶为3g/L,培养基的pH为5.6;
④愈伤继代培养
将步骤③培养30-35天诱导出来的愈伤进行拔芽继代培养,挑选出比较大的愈伤,将种壳和芽拔掉,将白色絮状的愈伤放入到继代培养基中,大约35-40颗/皿,每隔2周继代一次,继代3-4次的愈伤可以用于下一步实验;继代培养的条件为:温度为28±1℃暗培养;所述用于愈伤继代培养基的配方为:改良的MS培养基的基础上添加2,4-D、6-BA、TDZ、维生素B1和α-酮戊二酸;其中2,4-D的浓度为2mg/L,6-BA的浓度为0.1mg/L,维生素B1的浓度为2mg/L,TDZ的浓度为0.05mg/L,α-酮戊二酸的浓度为50mg/L,除以上另外加入蔗糖的量为30g/L,琼脂为8g/L,培养基的pH为5.6;
⑤芽分化
将步骤④继代3次以上的愈伤挑选出来放入芽的分化培养基中进行芽的分化,尽量挑选出个比较大的和有些浅绿色的愈伤;芽分化培养的条件为:光照强度为40μE/m2/s,温度为28±1℃,16h光照,8h黑暗;所述用于芽的分化培养基的配方为:改良的MS培养基的基础上添加TDZ、NAA、GA和麦芽糖,其中TDZ的浓度为0.5mg/L,NAA的浓度为0.02mg/L,GA的浓度为0.05mg/L,麦芽糖的浓度为20mg/L,除以上之外,另外加入8g/L琼脂,pH为5.6;
⑥生根培养
将步骤⑤生长到10㎝以上的不定芽挑选出来放入到生根培养基上进行生根培养,培养15-20天,将会有根长出来,生根培养的条件为:光照强度为40μE/m2/s,温度为28±1℃,16h光照,8h黑暗;所述用于生根培养的配方为:将改良的MS培养基营养元素减半,再添加蔗糖和琼脂;其中蔗糖的浓度为10mg/L,琼脂的浓度为9g/L,pH为5.6;
⑦炼苗与移栽
打开瓶盖,将步骤⑥生长有足够根的组培苗炼苗24h,然后移入到土中,放在光照为40μE/m2/s,温度为28±1℃的温室中成长,所述的土的配比为:草炭:蛭石:珍珠岩=1:1:1。
2、实施例2
本方法包括以下步骤:
①外植体挑选与灭菌
A、选取子粒饱满的结缕草Compadre种子作为外植体;
B、用70%酒精灭菌2min,先对种子进行表面消毒,2min后,用蒸馏水清洗3次;
C、用40%的次氯酸钠(有效Cl为10%)灭菌45min,加入0.1mL吐温20,并放在磁力搅拌器上进行搅拌,时间到后,在超净工作台上用500mL的无菌水进行清洗,再加入50mL无菌水放入4℃冰箱中低温春化24h;
D、在超净工作台上将春化过的种子放在无菌滤纸上吹干;
②对基础MS培养基进行改良
在基础的MS培养基中加入pvp40和酸水解酪蛋白,其中pvp40浓度为0.5mg/L,酸水解酪蛋白浓度为0.25mg/L,其他成分不变;
③愈伤诱导
将步骤①灭菌的种子,播种到愈伤诱导培养基中,大约50颗/皿,用锡纸包裹,放置在温度为28±1℃条件下进行暗培养,培养20-23天,有愈伤长出;所述用于愈伤诱导培养基的配方为:改良的MS培养基的基础上添加2,4-D、6-BA、维生素B1和α-酮戊二酸;其中2,4-D的浓度为5mg/L,6-BA的浓度为0.2mg/L,维生素B1的浓度为5mg/L,α-酮戊二酸的浓度为120mg/L,除以上另外加入蔗糖的量为30g/L,植物凝胶为3g/L,培养基的pH为5.8;
④愈伤继代培养
将步骤③培养30-35天诱导出来的愈伤进行拔芽继代培养,挑选出比较大的愈伤,将种壳和芽拔掉,将白色絮状的愈伤放入到继代培养基中,大约35-40颗/皿,每隔2周继代一次,继代3-4次的愈伤可以用于下一步实验,继代培养的条件为:温度为28±1℃暗培养;所述用于愈伤继代培养基的配方为:改良的MS培养基的基础上添加2,4-D、6-BA、TDZ、维生素B1和α-酮戊二酸;其中2,4-D的浓度为5mg/L,6-BA的浓度为0.2mg/L,维生素B1的浓度为5mg/L,TDZ的浓度为0.05mg/L,α-酮戊二酸的浓度为120mg/L,除以上另外加入蔗糖的量为30g/L,琼脂为8g/L,培养基的pH为5.8;
⑤芽的分化
将步骤④继代3次以上的愈伤挑选出来放入芽的分化培养基中进行芽的分化,尽量挑选出,个数较大的,有些浅绿色的愈伤;芽分化培养的条件为:光照强度为60μE/m2/s,温度为28±1℃,16h光照,8h黑暗;所述用于芽的分化培养基的配方为:改良的MS培养基的基础上添加TDZ、NAA、GA和麦芽糖,其中TDZ的浓度为1.2mg/L,NAA的浓度为0.05mg/L,GA的浓度为0.1mg/L,麦芽糖的浓度为30mg/L,除以上之外,另外加入8g/L琼脂,pH为5.8;
⑥生根培养
将步骤⑤生长到10㎝以上的不定芽挑选出来放入到生根培养基上进行生根培养,培养15-20天,将会有根长出来,生根培养的条件为:光照强度为60μE/m2/s,温度为28±1℃,16h光照,8h黑暗;所述用于生根培养的配方为:将改良的MS培养基营养元素减半,再添加蔗糖和琼脂;其中蔗糖的浓度为20mg/L,琼脂的浓度为10g/L,pH为5.8;
⑦炼苗与移栽:
打开瓶盖,将步骤⑥生长有足够根的组培苗炼苗24h,然后移入到土中,放在光照为60μE/m2/s,温度为28±1℃的温室中成长,所述的土的配比为:草炭:蛭石:珍珠岩=1:1:1。
3、实施例3
本方法包括以下步骤:
①外植体挑选与灭菌
A、选取子粒饱满的结缕草Compadre种子作为外植体;
B、用70%酒精灭菌2min,先对种子进行表面消毒2min后,用蒸馏水清洗3次;
C、用40%的次氯酸钠(有效Cl为10%)灭菌45min,加入0.1mL吐温20,并放在磁力搅拌器上进行搅拌,时间到了之后,在超净工作台上用500mL的无菌水进行清洗,再加入50mL无菌水放入4℃冰箱中低温春化24h;
D、在超净工作台上将春化过的种子放在无菌滤纸上吹干;
②对基础MS培养基进行改良
在基础的MS培养基中加入pvp40和酸水解酪蛋白,其中pvp40浓度为1mg/L,酸水解酪蛋白浓度为0.5mg/L,其他成分不变。
③愈伤诱导:
将步骤①灭菌的种子,播种到愈伤诱导培养基中,大约50颗/皿,用锡纸包裹,放置在温度为28±1℃条件下进行暗培养,培养20-23天,有愈伤长出,所述用于愈伤诱导培养基的配方为:改良的MS培养基的基础上添加2,4-D、6-BA、维生素B1和α-酮戊二酸;其中2,4-D的浓度为8mg/L,6-BA的浓度为0.9mg/L,维生素B1的浓度为10mg/L,α-酮戊二酸的浓度为450mg/L,除以上另外加入蔗糖的量为30g/L,植物凝胶为3g/L,培养基的pH为6.0;
④愈伤继代培养
将步骤③培养30-35天诱导出来的愈伤进行拔芽继代培养,挑选出个数较大的愈伤,将种壳和芽拔掉,将白色絮状的愈伤放入到继代培养基中,大约35-40颗/皿,每隔2周继代一次,继代3-4次的愈伤可以用于下一步实验;继代培养的条件为:温度为28±1℃暗培养;所述用于愈伤继代培养基的配方为:改良的MS培养基的基础上添加2,4-D、6-BA、TDZ、维生素B1和α-酮戊二酸;其中2,4-D的浓度为8mg/L,6-BA的浓度为0.9mg/L,维生素B1的浓度为10mg/L,TDZ的浓度为0.05mg/L,α-酮戊二酸的浓度为450mg/L,除以上另外加入蔗糖的量为30g/L,琼脂为8g/L,培养基的pH为6.0;
⑤芽分化
将步骤④继代3次以上的愈伤挑选出来放入芽的分化培养基中进行芽的分化,尽量挑选出个数较大的,有些浅绿色的愈伤;芽分化培养的条件为:光照强度为80μE/m2/s,温度为28±1℃,16h光照,8h黑暗;所述用于芽的分化培养基的配方为:改良的MS培养基的基础上添加TDZ、NAA、GA和麦芽糖,其中TDZ的浓度为2.5mg/L,NAA的浓度为0.2mg/L,GA的浓度为0.35mg/L,麦芽糖的浓度为40mg/L,除以上之外,另外加入8g/L琼脂,pH为6.0;
⑥生根培养
将步骤⑤生长到10㎝以上的不定芽挑选出来放入到生根培养基上进行生根培养,培养15-20天,将会有根长出来;生根培养的条件为:光照强度为80μE/m2/s,温度为28±1℃,16h光照,8h黑暗;所述用于生根培养的配方为:将改良的MS培养基营养元素减半,再添加蔗糖和琼脂;其中蔗糖的浓度为30mg/L,琼脂的浓度为12g/L,pH为6.0;
⑦炼苗与移栽:
打开瓶盖,将步骤⑥生长有足够根的组培苗炼苗24h,然后移入到土中,放在光照为80μE/m2/s,温度为28±1℃的温室中成长,所述的土的配比为:草炭:蛭石:珍珠岩=1:1:1。
三、实施例对比
1、实施例1与实施例2对比
区别在于愈伤诱导培养基、继代培养基、芽的分化培养基、生根培养基中,除都使用改良的基础培养基相同外,其在营养成分,植物生长调节剂有加入的量上的不同,培养的环境条件也有较大的改变。
结果显示,实施例1的愈伤诱导率为60.3%,胚性愈伤率为48.2%,芽的分化率为44.6%,生根率为96.7%,组培苗移入土中成活率为97.5%,从种子诱导愈伤到获得体外的植株,总周期为150天;实施例2的愈伤诱导率为75.2%,胚性愈伤率为60.2%,芽的分化率为58.3%,生根率为95.3%,组培苗移入土中成活率为98.3%,从种子诱导愈伤到获得体外植株,总周期为135天;由此分析得出,实施例1的生根率要优于实施例2,但综合各项指标分析,实施例2总体效果要优于实施例1,实施例2组织培养体系要优于实施例1。
2、实施例3与实施例2对比
区别在于愈伤诱导培养基、继代培养基、芽的分化培养基、生根培养基中,除使用改良的基础培养基相同外,其在营养成分,植物生长调节剂有加入的量上的不同,培养的环境条件也有较大的改变,结果显示,实施例3愈伤诱导率为65.3%,胚性愈伤率为52.3%,芽的分化率为50.4%,生根率为89.4%,组培苗移入土中成活率为97.8%,从种子诱导愈伤到获得体外植株,总周期为160天;实施例2的愈伤诱导率为75.2%,胚性愈伤率为60.2%,芽的分化率为58.3%,生根率为95.3%,组培苗移入土中成活率为98.3%,从种子诱导愈伤到获得体外植株,总周期为135天;由此分析得出,实施例2的各项指标均高于实施例3,实施例2的组织培养体系要优于实施例3。
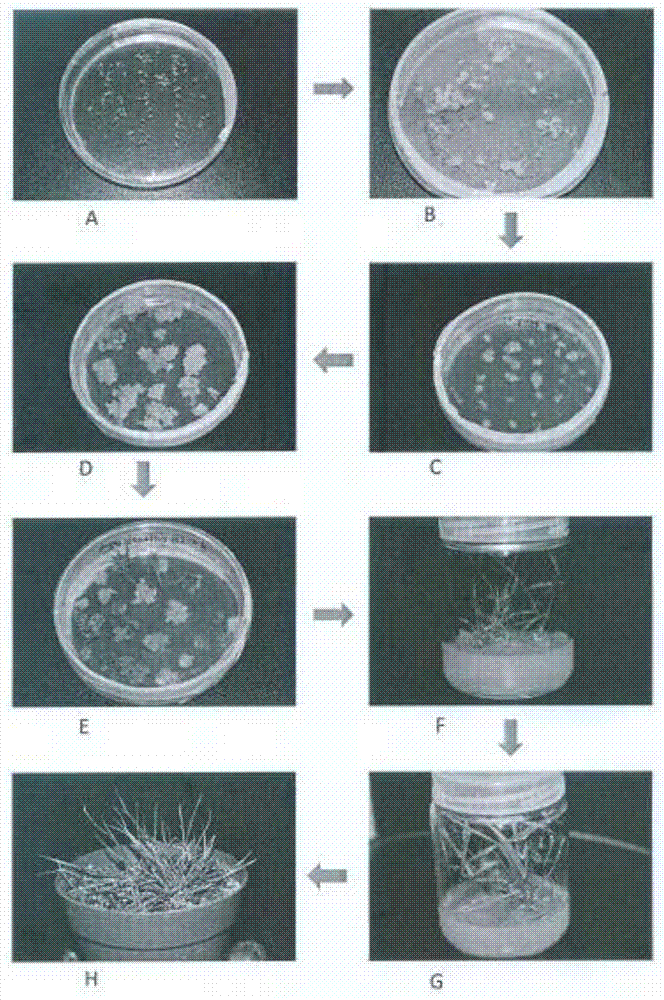
四、本方法的流程
如图1,实施例2的流程如下:
①将灭菌的种子播种于愈伤诱导培养基中-A;
②在愈伤诱导培养基诱导20天-B;
③将愈伤拔芽后第1次继代-C;
④将愈伤继代3次-D;
⑤将愈伤放入到芽分化培养基中诱芽25天-E;
⑥将10㎝以上的芽放入生根培养基上进行生根-F;
⑦生根培养基生根20天-G;
⑧将组培苗移入土中生长15天-H。
- 还没有人留言评论。精彩留言会获得点赞!