生物膜去除方法与流程
本申请要求于2017年11月16日提交的美国临时申请第62/587,112号的优先权,并且是2016年5月10日提交的美国专利申请号15/035,633(2014年11月11日提交的pct/au2014/001039的国家阶段申请)的部分接续案,上述申请的全部公开内容通过引用并入本文。本发明涉及一种用于从表面去除干燥表面生物膜的方法。
背景技术:
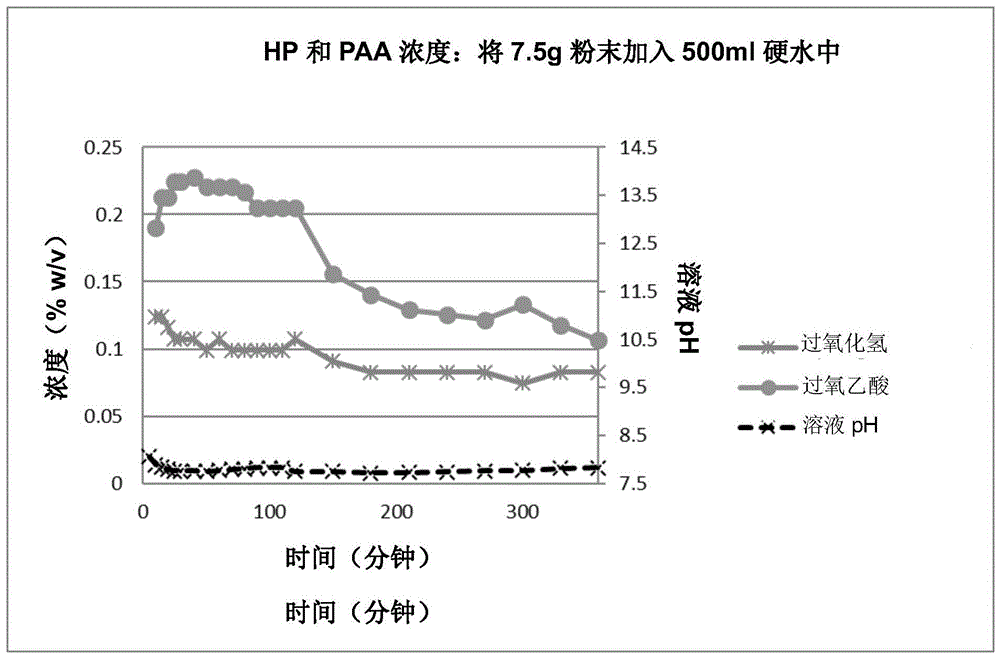
:一般来说,生物膜由附着到表面上并包裹在其自身合成的水合聚合物基质中的微生物组成。基质由多糖、蛋白质和核酸组成,其中多糖、蛋白质和核酸统称为“胞外聚合物”(eps)。eps基质使生物膜中的细胞粘附在一起,是形成复杂的三维附着群落的关键要素。整个生物膜中散布着水通道,用于交换养分、代谢产物和废弃产物。几乎在任何有水的地方都会形成生物膜。这些场所包含地上和地下、矿物和金属(包含医疗植入材料)上、以及有机表面(诸如,植物和体组织)上的无机天然材料和无机人造材料。生物膜生长表面可以作为能源、有机碳源,或者仅作为支撑材料。生物膜环境的一个共同特征是其会周期性或持续性地充满水分。一个常见示例是生物膜牙菌斑,这是牙齿表面形成的粘滑的细菌堆积层。类似地,经常在河流和溪流的岩石上发现的粘滑层也是由生物膜形成。在所有的人类微生物感染中,生物膜是导致其中大部分的原因所在。医院(院内)感染是美国第四大死亡原因,其中每年发生200万例(约占美国住院患者的10%),导致每年增加的医疗费用超过50亿美元。大约60-70%的医院感染与某种类型的植入式医疗器械有关。据估计,仅在美国,每年就使用超过500万种医疗器械或植入物。在大多数(如果不是全部)此类器械上均已观察到微生物感染,包含:人工心脏瓣膜、整形外科植入物、血管内导管、人造心脏、左心室辅助设备、心脏起搏器、血管假体、脑脊液分流器、导尿管、眼内假体和隐形眼镜、以及宫内避孕器。直到最近,人们才普遍认识到生物膜需要湿润或潮湿的环境才能产生。通常认为干燥的表面不会形成细菌生物膜。然而,vickery等人(参考文献1)的一项研究表明,在通常干燥的表面上也可以发现生物膜。这些生物膜被发现含有多种细菌,包括假单胞菌(pseudomonasspp.)、金黄色葡萄球菌(staphylococcusaureus)、粪肠球菌(enterococcusfaecium)等。在这项研究中,vickery首先在一间医院退役的重症监护室(icu)中用中性清洁剂进行最终消毒,接着用500ppm氯进行消毒,然后进行破坏性取样。消毒后,以无菌的方式将设备和家具从患者区域和共同使用区域中取出。然后根据所采样的材料,使用无菌手套、镊子、钳子、剪刀或手术刀刀片对取出的物品进行破坏性采样。在每种样品之间更换手套和仪器。然后将样品放入无菌容器中,运送到实验室。诸如无菌供应试剂盒之类的小物品被原封不动地运送到实验室;诸如床垫和门之类的较大物品则取出部分,放入无菌容器中。运送到实验室后,使用无菌技术将这些较大物品进一步切成小块。通过扫描电子显微镜(sem)对样品进行检查。在检查的6个样品中,在5个上发现了生物膜。4个样品中主要是球菌样细菌包裹在大量eps中,帘子中的样品明显带有“串状”脱水eps。在6个样品中,有4个样品的细菌在马血琼脂平板上生长,这表明存在可培养微生物。从软百叶帘的拉绳和帘子中取出的样品经sem处理显示生物膜呈阳性,也滋生了耐甲氧西林金黄色葡萄球菌(mrsa)。在干燥条件下存放12个月后,对这些样品重新进行检查,结果显示仍然存在活菌(参考文献2)。其中多数样品仍表明存在耐药菌,诸如mrsa、耐万古霉素肠球菌(vre)、产生超广谱β内酰胺酶(esbl)的微生物等。在whiteley等人(参考文献3)在一项研究中进一步提供了这样的事实,即医院环境中存在这些干燥表面生物膜,这表明这些生物膜可以充当这些耐药生物的储库,因此在普遍存在的院内感染中起着一定的作用。在whiteley等人的研究中,使用atp擦取确定潜在干燥表面生物膜的位置,并通过微生物培养确定耐药菌的存在。在一项尚未发表的进一步的研究中,能够证明在icu环境中干燥表面生物膜中发现的微生物与从感染了多重耐药菌(mro)的患者中分离出的分离株密切相关。根据假设(参见参考文献1),在发生表面凝结的地方会形成干燥表面生物膜,从而产生水薄膜;或者icu中相对湿度足够高的地方,会在icu表面形成生物膜。一旦形成,eps将保护细菌免于干燥,使其更难去除。根据进一步的假设,即使是强效清洁,多重耐药菌也会以生物膜的形式继续存在于环境中。尽管清洁剂能够良好地去除患者的污垢和浮游细菌,但对生物膜的去除效果却较差,导致目前的清洁方案效率低下。在环境高接触表面上形成干燥表面生物膜的另一个潜在途径可能是,各种体液(汗液、唾液、血液)产生的蛋白质溶液沉积到环境表面上,导致形成机会性生物膜的微生物进行早期定植。重复接触高接触表面可以间歇地为干燥表面生物膜提供营养。在发现干燥表面生物膜(dsbf)之后,almatroudi等人开发了实验室模型(参考文献4;并入本文作为参考)。根据astme2562(参见参考文献5)中所述标准方法,通常在cdc生物膜反应器中生长正常的潮湿表面生物膜。almatroudi修改了astme2562中用于产生干燥表面生物膜的方法,其中在样品样片暴露于生长培养基之间延长脱水时间。通过这种方式,almatroudi的方法尝试复制被认为是干燥表面生物膜生长的条件,即,将表面暴露于偶然性水性营养(清洁化学品、生物流体等),然后进行长时间的干燥。检查模型的干燥表面生物膜,将其与从干燥环境表面回收的那些干燥表面生物膜进行比较,结果表明二者具有相似的形态和组成。还发现两种模型和环境干燥表面生物膜均与常规潮湿表面生物膜不同。首先,虽然常规生物膜eps(即在正常潮湿环境中发现的eps)往往主要由多糖形成,但干燥表面生物膜(dsbf)的eps的明显更加富含蛋白质。其次,虽然众所周知,常规潮湿表面生物膜为生物膜内埋细菌形成了非常好的保护环境,可以保护内埋细菌免受杀菌剂(诸如消毒剂、抗菌药物等)的影响,但干燥表面生物膜似乎明显更具保护性。例如,almatroudi等人还证明,干燥表面膜中的生物对氯处理的耐受性显然更高。金黄色葡萄球菌干燥表面生物膜在暴露于含有20,000ppm有效氯的次氯酸钠溶液后,仍显示存活(参考文献6)。类似地,也已证明,对干燥表面生物膜进行干热处理(最高达121℃,持续20分钟)后,对干燥表面生物膜中内埋细菌产生了极小的影响,细菌数仅减少了2log10,而浮游培养物和水合生物膜的细菌数分别减少了8log10和7log10。进一步表明,在121℃高压灭菌长达30分钟后,可以回收到活菌(参考文献7)。在最近尚未发表的对金黄色葡萄球菌形成的各种形式生物膜的蛋白质组学研究中,观察到与浮游菌相比,形成不同生物膜时上调的蛋白质存在显著差异(参见表1和图4)。各种形式的生物膜之间蛋白质组成的差异有可能对观察结果作出解释,还报道了对杀菌剂(诸如氯)、温度和干燥状态长期保存的耐受性差异。表1:金黄色葡萄球菌(staphylococcusaureus)各种生物膜的蛋白质组学研究不同蛋白质数量专有或共同生物膜类型52专有3天潮湿生物膜(3dwb)33专有12天潮湿生物膜(12dwb)26专有12天干燥生物膜(12ddb)15共同3dwb+12dwb7共同3dwb+12ddb38共同12dwb+12ddb47共同3dwb+12dwb+12ddb因此,很明显,在参考文献1、2、3、4、6和7中描述的干燥表面生物膜代表了迄今为止都无法确定的诸多细菌的表面定植机制;而且与已广泛确定的潮湿生物膜相比,干燥表面生物膜为其内埋细菌提供了增强式保护,使这些细菌能够耐受干燥、杀菌剂、甚至是极端温度。医疗机构中存在的干燥表面生物膜显然还作为致病性、耐药性微生物的储库,增加了医院感染的风险。考虑到干燥表面生物膜内微生物的抗性不断增加,显然需要一种从受污染表面去除干燥表面生物膜并杀灭内埋细菌的方式。显然,医疗机构中目前采用的标准方法对干燥表面生物膜是无效的,这可以通过最终清洁后仍回收到活的mro进行证明。出乎意料地发现,基于使用前溶解于水中的粉末制剂的消毒产品已被证明能够有效破坏干燥表面生物膜内细菌,以及基本上有效去除干燥表面生物膜上存在的蛋白质。技术实现要素:本文所述是从环境表面(地板、墙壁等)以及非关键医疗器械(诸如床架、输液泵支架、输液泵键盘等)中去除干燥表面生物膜的方法。根据本发明,提供了一种用于从表面去除干燥表面生物膜的方法,该方法包括:(i)将粉末基组合物溶解于水中,其中,所述粉末基组合物包括:a)过氧化氢源b)乙酰基供体c)酸化剂,和d)润湿剂(ii)使溶液产生生物杀灭有效浓度的过氧乙酸;(iii)使被干燥表面生物膜污染的表面与过氧乙酸溶液接触一段时间;以及(iv)去除所述溶液。在本说明书(包含权利要求书)中使用了术语“包括”、“包含”或“含有”,这些应被解释为具体说明存在所述特征、整数、步骤或部件,但不排除存在一个或多个其他特征、整数、步骤或部件、或其组合的情况。术语“生物杀灭有效”应理解为是指一种物质将有效杀死、灭活或驱走活的或复制的生物,包含孢子、细菌、真菌、病毒、酵母和霉菌。本文所述的组合物的溶液作为杀孢子剂特别有效。本文所述的组合物的溶液还可以有效杀灭各种类病毒,特别是诸如hiv,甲型、乙型和丙型肝炎之类的血源性病毒。即使在全血中,本发明还对诸如丝状病毒(例如,埃博拉病毒、马尔堡病毒)和沙粒病毒(拉沙病毒)之类的其他病毒种类存在活性。过氧乙酸不会被过氧化氢酶灭活,这一事实使得该组合物特别可用于杀灭后面这些引起出血热的病毒种类。附图说明图1示出了在自来水中溶解本文所述的组合物后过氧化氢和过氧乙酸的浓度随时间变化的图。图2示出了在自来水中溶解不同重量的本文所述组合物后过氧乙酸的浓度随时间变化的图。图3示出了在本文所述组合物小袋的各种样品在溶解于自来水中10分钟、20分钟和30分钟时产生的过氧乙酸(paa)浓度的图。图4示出了列出在金黄色葡萄球菌的各种生物膜中不同上调蛋白质的数量差异的维恩图。图5示出了使用不同清洁产品去除潮湿生物膜的结晶紫测定结果图6示出了在干净和脏污状态下从根据实施例9的消毒剂(chlorclean和二氯异氰尿酸钠(sdic))中得到的对数减少值。图7示出了根据实施例9的消毒剂(1000ppm氯(次氯酸钠)和1000ppm氯(sdic))从干燥表面去除蛋白质的情况。图8示出了针对浮游性金黄色葡萄球菌的一系列消毒剂的细菌减少情况。图9示出了针对由金黄色葡萄球菌形成的干燥表面生物膜的一系列消毒剂的细菌减少情况。具体实施方式出乎意料地发现,申请人在较早的美国申请第15/035,633(‘633)号中描述的消毒组合物可以用作干燥表面生物膜去除剂。us15/035,633(其内容通过引用并入本文)描述了一种组合物,该组合物在溶解于溶剂中后,产生一种包括过氧乙酸和过氧化氢的生物杀灭有效的消毒剂溶液。该组合物包括一种对所形成的过氧乙酸产生视觉指示的体系。该指示通过染料提供,该染料会在存在过氧乙酸的情况下迅速漂白,同时基本上不受存在的过氧化氢的影响。可以掺入任选的第二染料,其中第二染料基本上不会被过氧乙酸或过氧化氢漂白。优选地,‘633的组合物以粉末的形式提供。优选地,将‘633的组合物溶解于水中。当’633的组合物以粉末形式存在时,还可以含有流动调节剂和润湿剂。流动调节剂用于防止粉末在分散和溶解到溶剂中之前发生结块;润湿剂有助于快速分散和溶解乙酰基源,优选地在室温下进行分散和溶解。‘633的组合物还可以包装到可溶性小袋中。其中,将整个小袋和内容物放入溶剂(优选水)中以产生消毒剂,从而减轻职业性暴露于潜在有害的粉末前体的风险。在‘633的一个优选实施方案中,提供了一种组合物,该组合物包括过氧化氢源、乙酰基供体、酸化剂和第一染料,该第一染料在存在过氧乙酸的情况下被漂白,但不会在存在过氧化氢的情况下被漂白。在另一个实施方案中,‘633的组合物中还可以包含基本上耐漂白的第二染料。在‘633的一个特别优选的实施方案中,第一染料是一种在存在生物杀灭浓度的过氧乙酸的情况下被漂白的染料,第二染料是一种在存在生物杀灭浓度的过氧乙酸的情况下数小时后被漂白的染料。溶液中存在的第一染料可以用作视觉指示,表明该溶液尚未达到所需的过氧乙酸杀菌浓度。一旦由第一染料形成的颜色被消除,就会留下因第二染料形成的颜色,从而实现美观着色。当‘633的组合物为粉末形式时,将其溶解于溶剂(优选水)中,形成含过氧乙酸的溶液。‘633的组合物还可以任选地含有润湿剂、多价螯合剂和螯合剂、以及其他成分,诸如耐漂白香料、缓蚀剂、粉末流动改性剂、流变改性剂等。‘633的组合物是通过将各种成分组合在一起制备而成。在一个优选实施方案中,‘633的组合物为粉末形式。在一个备选实施方案中,‘633的组合物能够以试剂盒的形式存在,其中过氧化氢源((a)部分)与乙酰基源和过氧乙酸可漂白的染料((b)、(c)部分)的混合物分开保存。在使用中,将过氧化氢源与乙酰基源/过氧乙酸可漂白的染料混合物在溶液中混合。在使用中,将‘633的组合物溶解于溶剂中,产生广谱消毒剂,该消毒剂对孢子、细菌、病毒、酵母和霉菌有效。消毒剂对形成孢子的细菌(诸如艰难梭菌,clostridiumdifficile)特别有效。该消毒剂可以用于表面(包含硬表面)消毒和仪器消毒。出乎意料地发现,‘633中描述的消毒组合物可以用作干燥表面生物膜去除剂。当覆有干燥表面生物膜的表面与通过溶解‘633中示教的组合物产生的过氧乙酸溶液接触时,观察到活菌显著减少,基本上去除了通常与干燥表面生物膜相关的蛋白质。该观察结果更明显的是,被证实能够去除正常潮湿表面生物膜的清洁剂溶液,几乎无法去除干燥表面生物膜(参见实施例10)。在该筛选试验中,还观察到氯基消毒剂在干净状态下也能有效去除干燥表面生物膜。然而,进一步的测试表明,存在的有机蛋白质污垢使氯迅速失活,因此杀菌作用很小或者几乎没有杀菌作用(参见图6)。还观察到,与‘633的溶液相比,氯基消毒剂从干燥表面生物膜覆盖的表面去除的蛋白质更少(参见图7)。这些观察结果与从退役的医院重症监护室取出的样品上发现的干燥表面生物膜的观察结果一致,即使在最终用氯基消毒剂清洗后也是如此(参见参考文献1)。‘633文件中所述的消毒组合物是粉末基制剂,包含过氧化氢供体、乙酰基供体、酸化剂、湿润剂、以及可选的成分(诸如,另外的多价螯合剂和香料)。‘633的组合物还包含过氧乙酸(paa)可漂白的染料,用作指示剂指示何时产生生物杀灭活性浓度的过氧乙酸。为了避免混淆,将过氧乙酸的生物杀灭活性浓度定义为高于1300ppm的过氧乙酸浓度。尽管‘633的教导涉及含有指示剂体系(其包括过氧乙酸可漂白的染料)的产生过氧乙酸的组合物,但是本领域普通技术人员将认识到,该指示剂无论是否存在都不会影响产生过氧乙酸的组合物的生物杀灭性能。本发明涉及一种用于从表面去除干燥表面生物膜的方法。根据本发明,提供了一种用于从表面去除干燥表面生物膜的方法,该方法包括:(i)将粉末基组合物溶解于水中,其中,该粉末基组合物包括:a)过氧化氢源b)乙酰基供体c)酸化剂,和d)润湿剂(ii)使溶液产生生物杀灭有效浓度的过氧乙酸;(iii)使被干燥表面生物膜污染的表面与过氧乙酸溶液接触一段时间;以及(iv)去除溶液。在其他优选实施方案中,粉末基制剂可以为片剂形式。在这种情况下,该组合物还可以包含崩解剂。在‘633的实施例16中,给出了片剂制剂的实施例。通常,本发明方法中使用的‘633的组合物含有以下成分:过氧化氢源可以用于‘633的组合物和本发明中的过氧化氢源的示例包括但不限于:过硼酸钠、过碳酸钠、过氧化脲、聚维酮-过氧化氢、过氧化钙及其组合。如果要使用双组份产品,也可以使用过氧化氢水溶液的稀释溶液作为过氧化氢源。在这种情况下,过氧化氢溶液应优选含有少于8%的过氧化氢,因此不属于“5.1类危险品”的分类。过氧化氢的稀释溶液还可以含有其他稳定成分,诸如1-羟基亚乙基-1,1,-二膦酸(商品名dequest2010);或其他强效螯合添加剂,诸如乙二胺四乙酸(edta)。可选地,过氧化物溶液可以含有ph缓冲剂。乙酰基供体可以用于‘633的组合物和本发明中的乙酰基供体的示例包括但不限于:四乙酰基乙二胺(taed)、n-乙酰基己内酰胺、n-乙酰基琥珀酰亚胺、n-乙酰基邻苯二甲酰亚胺、n-乙酰基马来酰亚胺、五乙酰基葡萄糖、八乙酰基蔗糖、乙酰基水杨酸、四乙酰基甘油及其组合。优选地,该乙酰基供体为固体。除非另有说明,否则该乙酰基供体应理解为未涂覆的材料。优选的乙酰基供体为taed,更特别地为微米级的taed,诸如可购自warwickchemicals(英国)的b675。酸化剂可以用于‘633的组合物和本发明中的酸化剂的示例包括但不限于:柠檬酸、柠檬酸一钠、柠檬酸二钠、酒石酸、酒石酸一钠、氨基磺酸、硫酸氢钠、磷酸一钠、草酸、苯甲酸、苯磺酸、甲苯磺酸及其组合。优选地,该酸化剂为固体。过氧乙酸可漂白的染料“第一染料”是过氧乙酸可漂白的染料。可以用于‘633的组合物和本发明中的过氧乙酸可漂白的染料的示例包含:苋菜红(染料索引号16185)、胭脂红(染料索引号16255)、日落黄(染料索引号15985)、任何其他1-芳基偶氮-2-羟基萘基染料及其组合。优选地,过氧乙酸可漂白的染料在存在过氧乙酸而不是过氧化氢的情况下被相对快速地漂白。“相对快速”是指染料的颜色在约10分钟内被漂白。当溶液中的过氧乙酸可漂白的染料产生的颜色被基本上清除时,过氧乙酸在溶液中已达到生物杀灭有效浓度。“基本上清除”是指溶液中由过氧乙酸可漂白的染料产生的颜色被全部或几乎全部清除。在本发明使用的‘633的组合物的一个优选实施方案中,第一染料是苋菜红(染料索引号16185),第二染料是燃料索引号酸性蓝182。令人惊讶地是,在该实施方案中,发现苋菜红仅通过过氧乙酸快速漂白,同时相对耐受过氧化氢的漂白。这是一个特别出乎意料的发现,因为苋菜红在市售粉末基清洁剂virkon(一款由antecltd生产和销售的产品)中被用作指示剂。对于virkon,只要存在苋菜红所致红色染色,virkon溶液就仍然具有杀菌活性。根据virkon产品手册,“virkon1%溶液可稳定存在7天,但当粉红色褪色时应将其丢弃”。virkon由单过硫酸钾、氯化钠、氨基磺酸和其他成分(诸如表面活性剂、香料和苋菜红)的混合物组成。根据antec制定的背景文件,在溶解于水中后,virkon粉末混合物会发生haber-willstatter反应,产生包含单过氧硫酸钾、氯、n-氯氨基磺酸、次氯酸的杀菌剂混合物。该文件继续指出,virkon含有“一种粉红色染料(苋菜红色,eec编号123)。除了获得美观性,这还具有非常高的实用性,用于指示virkon溶液是否有效。在氧化形式下呈粉红色,但是当溶液开始失去活性时,会恢复成无色还原形式。如果颜色开始褪色,必须始终更换virkon溶液”。换言之,苋菜红所致粉红染色会在存在活性氧化杀菌剂时存在,这种颜色会在氧化性杀菌剂耗尽时发生褪色。相反,在‘633中,消毒剂溶液的颜色耗尽表明已达到过氧乙酸的生物杀灭有效浓度。基本上耐漂白的染料在本发明所使用的‘633的组合物可以可选地包含的第二染料是基本上耐漂白的染料。已经认识到,过氧乙酸将能够漂白大多数染料。因此,所述“基本上耐漂白的”染料是指该染料能够在室温下为过氧乙酸/过氧化氢溶液赋予颜色至少2小时,优选约4-6小时。可以用于‘633的组合物和本发明中的基本上耐漂白的染料的示例包括但不限于:酸性蓝182、酸性蓝80、直接蓝86、酸性绿25(染料索引号61570)及其组合。在本发明使用的‘633的组合物的一个特别优选的实施方案中,第一染料为苋菜红(染料索引号16185),第二染料是染料索引号酸性蓝182。在该实施方案中,在组合物溶解时,溶液的颜色是由苋菜红产生的红色。这种红色大约在5-7分钟内清除,此时过氧乙酸的浓度达到生物杀灭有效浓度,剩下由酸性蓝182产生的蓝色。蓝色具有美观性,同时还有一个好处,即在对表面或物体进行消毒时使溶液更加可见。润湿剂当本发明中使用的‘633的组合物为粉末制剂时,组合物中可以包含润湿剂,以便于在初始稀释时将乙酰基源分散到溶液中,从而有助于其溶解。润湿剂优选由能够降低溶剂(优选水)的表面张力、从而使乙酰基源润湿并分散的固体表面活性剂组成。优选地,乙酰基源是taed,并且在没有润湿剂的情况下,高度微粉级taed(诸如b675)往往将会漂浮在溶剂表面,因此溶解缓慢,导致过氧乙酸产生缓慢。可以在本发明的组合物中使用的合适的润湿剂的示例包括但不限于:十二烷基硫酸钠、烷基苯磺酸钠、普朗尼克pe6800、hyamine1620等及其组合。ph缓冲剂可选的,本发明使用的‘633的组合物中可以包含ph缓冲剂,用于减少ph随时间的变化。由于从乙酰基源(优选taed)形成过氧乙酸需要ph值等于或高于过氧乙酸的pka(8.2),因此溶液的ph值应缓冲在8.00至9.00之间,优选在8.00至8.40之间。可以包含在本发明的组合物中的合适的ph缓冲剂包括但不限于:磷酸盐、硼酸盐、碳酸氢盐、taps(3-{[三(羟甲基)甲基]氨基}丙烷磺酸)、bicine(n,n-双(2-(羟乙基)甘氨酸)、tris(三(羟甲基)甲基胺)、tricine(n-三(羟甲基)甲基甘氨酸)及其组合。多价螯合剂可选的,本发明使用的‘633的组合物可以包含能够络合金属离子(诸如,钙离子和镁离子)的成分,从而消除因使用硬水以及金属离子(诸如,铁离子、锰离子、铜离子等)带来的任何不良影响,这些金属离子能够催化过氧化物的分解,也可能存在于自来水中。可以用于本发明的组合物中的螯合剂和多价螯合剂的示例包括但不限于:柠檬酸钠、柠檬酸、磷酸、三聚磷酸钠、edta、nta等及其组合。流动改性剂如果是粉末制剂,可以添加流动改性剂,以改善本发明使用的‘633的组合物的流动特性。如果粉末预期以单剂量包装(例如,单个小袋或水溶袋)供应,这将特别有用,因为良好的粉末流动性将允许对混合粉末进行准确定量然后添加到各个包装中。可以在‘633的组合物和本发明中使用的粉末流动改性剂的示例包括但不限于:气相法二氧化硅、沉淀法二氧化硅、微粉化聚乙二醇6000、微粉化乳糖、滑石粉、硬脂酸镁及其组合。在优选实施例中,流动改性剂是亲水性气相法二氧化硅,例如aerosil200(evonikindustries)。使用沉淀法二氧化硅(诸如tixosil38)也可以很好地改善流动性。但沉淀法二氧化硅并非优选,因为与气相法二氧化硅相比,沉淀法二氧化硅的颗粒较大,会在最终消毒剂溶液中会产生浓雾。香料可选地,本发明使用的‘633的组合物还可以包含香料以掩盖过氧乙酸的气味。优选地,所用香料对过氧化氢和过氧乙酸稳定。在本发明方法中使用的‘633的组合物的一个优选实施方案中,乙酰基供体是taed,过氧化氢源是过碳酸钠,第一染料是苋菜红,并且该组合物为粉末制剂,然后溶解于水中。在环境温度下,将粉末制剂与自来水进行初始混合后,苋菜红染料快速溶解,未溶解taed悬浮起来,从而形成浑浊的深红色溶液。在大约5-10分钟的过程中,taed溶解到水中;随着taed与过碳酸钠溶解后产生的过氧化氢发生反应,生成过氧乙酸,将红色清除。大约7-10分钟后,溶液将变澄清,所有红色染色被清除。在另一个优选的实施方案中,本发明方法中使用的‘633的组合物中还可以包含基本上耐漂白的第二染料。优选地,基本上耐漂白的染料与苋菜红一起在4-6小时的过程中进行漂白。优选地,缓慢漂白的第二染料是染料索引号酸性蓝182。实施例实施例1染料预混料:将78.00gtaedb675(warwickchemicals)、17.00g苋菜红染料和5.00g染料索引号酸性蓝182染料的混合物混合,然后使用研杵和研钵一起研磨,得到棕褐色均质粉末。混合后,在使用前将染料预混料掺合物保存在密封良好的容器中。将54.55gtaedb675、1.00g染料-taed预混料、1.32g十二烷基硫酸钠粉末和0.60gaerosil200(购自evonik的亲水性气相法二氧化硅)混合在一起,过125微米的筛,去除并打碎所有聚集的材料。过筛后,继续混合,形成均质粉末。向过筛后的材料中加入0.49gedta四钠、28.00g无水柠檬酸、99.32g过碳酸钠、15.50g三聚磷酸钠和1.80g无水磷酸一钠。然后将粉末充分混合,形成自由流动的均质粉末。粉末掺合物的全部组分以及每种成分的功能在表2中示出。据发现,只需要向粉末掺合物中加入aerosil200的taed重量的1%。这等于掺合物总重量的0.3%。以这个水平,aerosil在最终消毒剂溶液中只会产生非常轻微的雾。表2将7.50g粉末掺合物溶解在500ml含340ppmcaco3的人造硬水(根据sop编号:mb-22-00:《消毒剂样品制备标准操作程序》,由美国环境保护局农药项目办公室发布,以下简称aoac硬水)中,制备消毒剂。在室温下搅拌该溶液。观察到苋菜红所致红色在5-7分钟左右清除,留下蓝色溶液。10分钟后,以固定间隔取10ml等分样片,并记录ph值。滴定等分样片,确定过氧化氢和过氧乙酸的浓度。从图1可以看出,过氧乙酸的浓度迅速增加,在20分钟左右达到最大值。在这之后,观察到过氧乙酸的浓度在数个小时内缓慢下降。有趣的是,如果增加水中溶解的粉末的浓度,同时过氧乙酸最高浓度如预期那样增加,还观察到其分解速率也在升高(参见图1)。还观察到,每种粉末浓度的过氧乙酸在20分钟标记处达到最大浓度。实施例2使用来自实施例1的不同浓度的粉末掺合物,在aoac硬水制备4种消毒剂溶液,搅拌20分钟。取等分样片,滴定确定过氧化氢和过氧乙酸的浓度;同时在5%的马血清中,用生芽孢梭状芽孢杆菌(clostridiumsporogenes)(atcc3584)繁殖体和孢子形式的悬浮液接种其他等分样片。使将该微生物暴露3、5和10分钟。每个样品进行三次重复测试,每个样品在每个时间点的活菌减少量均大于6log。表3所示所用溶液的浓度、过氧化氢和过氧乙酸的浓度、以及记录的对数减少值。表3实施例3取7.50g实施例1的粉末掺合物,将其加入500ml自来水中,然后在室温下搅拌。记录红色被清除的时间,然后取5ml等分样片进行滴定。20分钟后,取出另外的5ml等分样片,进行滴定。从表4中可以看到,在7-8分钟之间去除了苋菜红所产生的颜色,此时的过氧乙酸含量为0.14-0.16%。表4从表3中可以看到,含有至少1.35%(1349ppm)过氧乙酸的溶液表现出杀孢子活性。因此,可以安全地假设,苋菜红所产生的颜色一旦被清除,过氧乙酸的含量将高于该杀孢子活性浓度。实施例4取不同重量的实施例1的粉末掺混物,加入到500ml自来水中,然后在室温下搅拌。每种溶液的红色被清除的时间在表5中示出。表5实施例5取一定量的实施例1的粉末掺混物,装入由热封型pva水溶性膜制成的单独小袋中。制备小袋时,将两片50微米厚的pva膜(宽4.65cm,长8cm)热封在一起,形成信封状小袋;将大约8.2g的粉末分配到每个小袋中;然后密封敞开的一侧,得到填充后的完成袋。然后,取一个小袋,添加到搅拌量的自来水(500ml)中。观察到小袋在水中起皱,然后爆开,将所含粉末释放到水中,得到深红色溶液。大约8分钟后,红色被清除,留下淡蓝色溶液,并带有淡淡的过氧乙酸的味道。在10分钟和20分钟时,取等分样片的所得溶液,滴定确定过氧化氢和过氧乙酸的含量。表6示出了对小袋初始生产过程的评估。表7示出了对溶解在500ml自来水中的数个样品小袋中过氧乙酸生成量的评估结果。表6平均袋重8.29标准偏差0.514%rsd6.2最大重量9.59最小重量7.48样品量70表7实施例6取一定量的根据实施例1的粉末掺混物,装入由热封型pet-纸-铝-pp层压材料制备的单独的小袋中。制备小袋时,对一片6cm宽的层压材料进行热封处理,形成圆柱形管;然后密封整个管形成棒状物,接着经由螺旋定量器将粉末掺合物装入其中。然后,密封填充管的开口端,得到棒状包装。发现每个棒状包装的平均毛重为8.88g,标准偏差为0.27(参见表8)。发现包装材料的重量为0.88g,因此粉末的平均净重为8.00g。表8平均袋重8.88标准偏差0.27%rsd3.06最大重量9.66最小重量8.13样品量500为了证明混合的均质性,从生产过程的各个部分取样品小袋,并将其添加到500ml的自来水中。然后,确定每种溶液在10、20和30分钟时的过氧化氢含量和过氧乙酸含量。从图3中可以看出,过氧化氢和过氧乙酸在10分钟时的含量发生很大变化;根据发现,其含量取决于搅拌速度等。在某些情况下,观察到溶液在10分钟标记处仍为红色(由图3中字母r指示),而且这些溶液都与低含量过氧乙酸相关。应当注意,到20分钟时,过氧化氢和过氧乙酸的浓度变化大幅减小。该实施例证实,该染料体系能够作为有效指示是否存在生物杀灭有效浓度过氧乙酸的指示剂。通过将7.50g根据表9的粉末掺合物添加到500mlaoac硬水中,然后在aoac硬表面载体测试991.47、48和49中,测试其对与表面结合微生物的生物杀灭活性,其中,在5%马血清中测试对铜绿假单胞菌(pseudomonasaeruginosa)、金黄色葡萄球菌和霍乱沙门氏菌(salmonellacholeraesuis)的生物杀灭活性。修改了测试方法,其中使用5分钟的接触时间而不是规定的10分钟接触时间。表9也可以修改粉末制剂,以生产能够在溶解于水中时产生过氧乙酸的片剂。优选地,将促进片剂崩解的方式并入片剂制剂中。由于生产片剂时需要进行压缩,因此这也有助于促使片剂较慢溶解。发现使用聚nvp基崩解剂(诸如,disintex200,isptechnologiesinc)不切实际,因为交联聚合物会强烈吸附染料,导致最终溶液中的颗粒材料被高度染色。使片剂崩解的优选方式是,将另外的碳酸钠以及另外的酸化剂一起并入制剂中。在一个更优选的实施方案中,使用氨基磺酸作为酸化剂,因为其pka小于2。如果使用柠檬酸作为片剂制剂中的酸化剂,那么,溶液的ph值一旦达到6左右(由于柠檬酸的第三个pka),气体形成以及之后片剂崩解都会减慢。实施例7将各种成分混合在一起,产生均质混合物,得到生产根据表10的粉末掺合物。为了获得充足的片剂制剂,不对混合物进行过筛,而且注意不要缩小苏打灰、过碳酸钠和氨基磺酸的粒度。表10taed13.54过碳酸钠37.15氨基磺酸30.82重质苏打灰18.06十二烷基硫酸钠0.23edta四钠0.15苋菜红0.038染料索引号酸性蓝1820.011混合后,使用配有20mm模具的单冲压片机将材料压片,得到平均重量为3.72g的片剂。片剂的平均厚度为9.1mm,厚度与重量之比为0.41。然后将两片总重量为8.34g的片剂溶于200ml自来水中。在室温下搅拌25分钟,然后取出三个10ml等分样片,进行滴定。发现过氧化氢和过氧乙酸的平均浓度分别为0.293%和0.258%。另取一片,将其溶解于aoac硬水中,然后使用bsen1276(1997)的方法在20℃下在5%马血清中测试其对艰难梭菌的抗菌活性。观察到的所得对数减少值在表11中示。表11实施例8:模型干燥表面生物膜样品的制备根据参考文献4中almatroudi等人描述的方法,在样片表面产生干燥表面生物膜。在经过彻底清洁、刷洗和蒸汽灭菌(121℃,20分钟)的cdc生物膜反应器(biosurfacetechnologiescorp,美国博兹曼)中,在24个可移动的无菌pyrex样片上生长金黄色葡萄球菌atcc25923生物膜。将半脱水生物膜以间歇式生长周期生长12天。在此期间,在表12所述的室温(22-25℃)下交替供应5%胰蛋白胨大豆肉汤(tsb)并延长脱水阶段;在每个间歇生长阶段结束时,从生物膜反应器中去除tsb。生物膜发生器位于装有空调的实验室中。使用水族馆空气泵,以3l/min的空气流速将过滤除菌的室内空气(平均相对湿度为66%)泵入介质表面。在第一间歇生长阶段开始时,接种约108个金黄色葡萄球菌菌落形成单位(cfu),开始形成生物膜。在间歇生长阶段,所有生物膜都在35℃下在5%tsb中生长,然后挡板以130rpm/min的速度进行旋转产生湍流,进行剪切。表12阶段培养条件累计时间15%tsb中8小时间歇生长阶段,然后脱水48小时96小时25%tsb中6小时间歇生长阶段,然后脱水66小时168小时35%tsb中6小时间歇生长阶段,然后脱水42小时216小时45%tsb中6小时间歇生长阶段,然后脱水66小时288小时生物膜生长后,将固定有生物膜包覆样片的杆件从发生器中取出,然后放置在1升磷酸盐缓冲盐水(pbs)中5分钟。然后,取出每个杆件上的三个样片,将其放入50mlpbs中另外清洗两次,然后再放入单独的无菌bijou容器中。在超声浴(soniclean,jmr,澳大利亚)中,对随机选择的样片超声处理5分钟,然后在4ml培养基中剧烈振荡2分钟,接着依次进行10倍稀释和平板计数,以此确定每个样片的cfu数量。实施例9:过氧乙酸(paa)基消毒剂小袋含有8.5g与实施例1相似的消毒剂粉末组合物。消毒剂粉末包括过氧化氢源(过碳酸钠)和乙酰基源(四乙酰基乙二胺(taed))的掺合物,以及酸化剂(柠檬酸)和多价螯合剂(磷酸一钠、三聚磷酸钠)以及过氧乙酸可漂白的染料(苋菜红)。配方在表13中列出。表13成分%w/w功能过碳酸钠49.18过氧化氢供体taedb67527.39乙酰基供体柠檬酸13.86酸化剂三聚磷酸钠7.67多价螯合剂磷酸钠0.89ph调节剂十二烷基硫酸钠0.65润湿剂四钠edta0.24螯合剂苋菜红0.08paa可漂白着色剂酸性蓝1820.03耐paa着色剂将小袋加如500ml水中,在室温下搅拌10-15分钟,之后清除由过氧乙酸可漂白的染料形成的染色。此时,溶液中将含有1500至2000ppm的过氧乙酸,以及约1000-1300ppm的过氧化氢。根据发现,所得溶液在溶解后约8小时内对多种细菌、病毒、孢子和真菌具有活性。实施例10:使用toc评估干燥表面生物膜的去除的初步筛选研究。在初步筛选研究中,通过评估总有机碳(toc),对一系列清洁产品的干燥表面生物膜去除功效进行评估。评估的产品及其使用浓度在表14中示出。表14fabrisan作为地毯除污剂销售。其成分包含柠檬酸钠、十二烷基硫酸钠和茶树油。该制剂基于美国专利第5610189号的实施例3。matrix为市售潮湿表面生物膜去除剂。该制剂基于澳大利亚专利第au2001275599b2号。vickery等人(参考文献8和参考文献9)、ren等人(参考文献10)和fang等人(参考文献11)已经对其对普通(潮湿)生物膜的功效进行了介绍。ren和fang的参考文献中使用intercept进行,其中,intercept的配方与matrix相同,由medivatorsinc.在whiteleycorporation的授权下生产。zipstrip是一种地板剥离剂,用于去除乙烯基地板上的聚合物密封剂。该制剂包含表面活性剂、丁二醇和乙醇胺的高碱性溶液。phensol是一种酚类消毒剂,包括邻苯基苯酚和苄基氯苯酚与(c10-16)烷基苯磺酸的钠盐的掺合物。每种清洁溶液均按照标签说明进行稀释,如表14中所示。如实施例8所述,在pyrex玻璃样片上生长12天干燥表面生物膜。然后,在25ml的每种测试产品溶液中,放入包覆干燥表面生物膜的三个样片。还将三张样片放入25mlmilliq水中,作为阴性对照。使用1m氢氧化钠溶液作为阳性对照。制备每种样品,每种测试两次。还制备了使新鲜干净的样片暴露于测试产品的空白样片,以评估有机材料(诸如表面活性剂)对样片的粘附性,并进行分析。在暴露于测试产品溶液所需的时间后,在25mlmilli-q水中冲洗样片两次。然后使用shimadzu-5000atoc分析仪,测量每个样片上的总有机碳。将根据清洁后生物膜包覆样片上的残留碳得出的toc减去空白样片上发现的toc,计算出清洁后所有残留生物膜的toc。结果在表15中列出。相对于阴性对照(milli-q水),计算出因括号中所示生物膜而残留的toc百分比。表15从这项筛选研究中,可以清楚地看到,被证明能够有效去除普通潮湿表面生物膜的产品(即,matrix),没有对干燥表面生物膜表现出相同程度的功效。除1m氢氧化钠溶液外,两种最有效的清洁溶液是实施例9和氯。实施例11对实施例9和matrix(该产品已被证实能够去除潮湿表面生物膜)的潮湿生物膜去除功效进行评估。根据goeres等人的方法(参考文献12),在cdc生物膜反应器中,在改良型杆件支撑的塑料砖上生长潮湿的金黄色葡萄球菌生物膜48小时。然后将塑料砖放入含有matrix(用水以1:25进行稀释)、实施例9(水溶液浓度为17g/l)和milli-q水的falcon管中。将塑料砖在清洁溶液中浸泡10分钟。10分钟后,取出塑料砖,用milli-q水清洗两次,然后放入40ml0.3%结晶紫溶液(生物膜染色剂)中。然后,使塑料砖在结晶紫溶液中静置90分钟。90分钟后,取出塑料砖,在milli-q水中清洗3次,持续1分钟。然后,刮擦清洗后的塑料砖,用5ml95%乙醇洗脱到28ml小瓶中,然后封闭小瓶,静置过夜,以洗脱所吸附的结晶紫。接下来,经由分光光度计读取溶液的吸光度。表16清洁产品吸光度实施例90.128matrix0.120milli-q水0.191从表16中可以看出,基于结晶紫所致的较低吸光度,确定matrix去除了塑料砖上大部分的生物膜。实施例12实施例9和matrix的蛋白质去除功效的证明过程如下:根据实施例8的方法在pet样片上生长12天生物膜。然后,取出含有生物膜包覆样片的棒;如实施例8中所述,用milli-q水将任何松散结合的生物膜洗掉。接下来,将一根固定了三个干燥表面生物膜包覆的样片的棒放入30ml实施例9的溶液(17g/l)中10分钟。将第二根棒放入30mlmatrix溶液(1:50稀释)中,将第三根棒放入30mlmilli-q水中,作为阳性对照。对另外一根固定了3个未包覆的样片的棒进行灭菌处理,并用作阴性对照。10分钟后,将每根棒放入30ml1m氢氧化钠溶液中,洗脱掉所有剩余蛋白质。然后从每种溶液取出等分试样,使用微型bca测试试剂盒(sigmaaldrich)进行二喹啉甲酸(bca)测定,对蛋白质进行测试。为了进行bca测定,制备一系列牛血清白蛋白标准溶液以产生标准曲线。然后,每种bca标准溶液取1ml,从清洁溶液中取1ml等分试样,全部用1mlbca工作溶液处理。其中,该bca工作溶液的制备方法如下:在烧杯中混合50ml二喹啉甲酸(sigmaaldrich,分类号b9643),加入1ml4%硫酸铜(ii)溶液(sigmaaldrich,分类号c2284)。然后,将样品在60℃下孵育60分钟,并使用分光光度计读取562nm波长处的吸光度(参见表17)。表17可以看出,在对12天干燥表面生物膜进行测试时,实施例9的蛋白质减少量明显比matrix的更高。实施例13使用实施例9、1000ppm次氯酸钠溶液和chlorclean,评估其从包覆了12天干燥表面生物膜的样片中清除蛋白质的功效,如实施例11所述。其中,chlorclean是一种由己二酸和甲苯磺酸钠配制的二异氰脲酸钠(sdic)片剂,作为2合1医院级消毒剂销售,其中通过使用helixsolutions(canningvalesouth,西澳大利亚)获得清洁剂的作用。两种氯溶液均显示出1000ppm的有效氯。在该测试中,使用的接触时间为10分钟。计算阳性对照(milli-q水)的减少百分比。从表18中可以看出,实施例9的蛋白质减少率最高。还观察到,chlorclean(一种以2合1清洁/消毒产品形式销售的sdic片剂)比次氯酸钠溶液更加有效。表18被测清洁剂蛋白质减少率1000ppm氯(次氯酸钠)11.501000ppm氯(chlorclean片)39.26样品9(17g/l)63.65实施例14为了确定清洁产品中存在的清洁剂部分是否是造成次氯酸钠和专有chlorclean片剂之间性能差异的原因,重复进行实施例13的方法。其中,使用二异氰脲酸钠溶液仅对次氯酸钠溶液进行替换,获得1000ppm的有效氯。表19被测清洁剂减少率1000ppm氯(sdic)17.651000ppm氯(chlorclean片剂)13.12样品9(17g/l)64.69这里值得注意的是,缩短接触时间会明显降低chlorclean的降低。尽管接触时间不同,但是观察到,使用实施例9观察到的蛋白质减少量基本相同。实施例15使用实施例9、chlorclean片剂和通用sdic片剂,在干净状态下评估对12天干燥表面生物膜的细菌减少量。将每种测试产品溶解在水中。根据实施例8制备覆有12天干燥表面生物膜的样片。每种测试溶液取2ml,与2ml水一起先后加入到组织培养板的孔中。接触5分钟后,从消毒剂溶液中取出样片;用30ml磷酸盐缓冲盐水漂洗两次,持续5秒;然后放入装有2ml中和剂溶液的5ml管中,该中和剂溶液包括6%吐温80+1%硫代硫酸钠+5%牛血清+10%牛血清白蛋白。将管超声处理20分钟,然后涡旋处理2分钟。然后连续进行10倍稀释,并将100ul的纯溶液、10-1倍稀释液、10-2倍稀释液、10-3倍稀释液和10-4倍稀释液涂抹在马血琼脂板上。将板在37℃下孵育过夜,然后计数。对未暴露于消毒剂的对照样片进行类似处理,以便计算对数减少量。从表20中可以看出,根据实施例9的消毒剂的生物膜对数减少量最大。表20对数减少值中和剂对照实施例96.5560.0437chlorclean(1000ppm氯)4.4110.017sdic(1000ppm氯)6.550.045实施例16使用实施例9、chlorclean片剂和通用sdic片剂,在脏污状态下评估对12天干燥表面生物膜的细菌减少量。将每种测试产品溶解在含有340ppmcaco3的人造硬水中,向其中加入5%牛犊血清。根据实施例8制备覆有12天干燥表面生物膜的样片。每种测试溶液取2ml,与2ml加入了5%的牛犊血清的硬水一起,先后加入到组织培养板的孔中。接触5分钟后,从消毒剂溶液中取出样片;用30ml磷酸盐缓冲盐水漂洗两次,持续5秒;然后放入装有2ml中和剂溶液的5ml管中,该中和剂溶液包括6%吐温80+1%硫代硫酸钠+5%牛血清+10%牛血清白蛋白。将管超声处理20分钟,然后涡旋处理2分钟。然后连续进行10倍稀释,并将100ul的纯溶液、10-1倍稀释液、10-2倍稀释液、10-3倍稀释液和10-4倍稀释液涂抹在马血琼脂板上。将板在37℃下孵育过夜,然后计数。对未暴露于消毒剂的对照样片进行类似处理,以便计算对数减少量。从表21中可以看出,根据实施例9的消毒剂的对数减少量基本上等于在干净条件下看到的对数减少量(参见表20)。还观察到,两种氯片剂基本上都没有使细菌呈对数减少,这表明蛋白质类污垢完全中和了氯消毒剂。表21对数减少值中和剂对照实施例96.5310.010chlorclean(1000ppm氯)0.0020.005sdic(1000ppm氯)0.0070.018实施例17在该实施例中,针对浮游性金黄色葡萄球菌对根据实施例9的消毒剂进行测试,然后与两种商购的氧化性消毒剂chlorclean和oxivirtb(diverseyaustraliaptyltd,澳大利亚新南威尔士州士美菲路)进行比较。其中,oxivirtb是一种即用型溶液,通过将0.5%过氧化氢与其他专有成分一起配制而成。除了这些商业产品,还测试了一些通用等效产品。其中包括:proxitane(solvayinterox,澳大利亚新南威尔士州博坦尼);一种含有27%过氧化氢、7.5%乙酸和5%过氧乙酸的过氧化氢-乙酸-过氧乙酸平衡溶液;非配制型sdic片剂(redoxchemicals,澳大利亚新南威尔士州明托),其在溶解于10升水中时释放出1000ppm的氯;和6%过氧化氢溶液(goldcross,biotechpharmaceuticalsptyltd,澳大利亚维多利亚州北拉弗顿)。选择这些通用产品是为了与配制产品中的活性成分进行匹配,从而评估产品配方的作用。在适用的情况下,使用人工硬水稀释消毒剂产品。该人工硬水的制备方法如下:将0.304g无水cacl2和0.065g无水mgcl2溶解在蒸馏水,制成一升硬水。表22示出了被测产品,以及试样中活性物质的浓度。表22在不存在污垢的情况下试验消毒剂功效时,将1ml试验消毒剂与1ml硬水混合,然后立即加入10μl含有约109个浮游细菌的胰蛋白胨大豆肉汤(tsb),接触时间为5分钟。然后加入1ml中和剂(1%硫代硫酸钠、6%吐温80、5%bcs和10%bsa的pbs缓冲液)。在存在污垢的情况下试验消毒剂功效时,将1ml试验消毒剂与1ml5%牛犊血清在硬水中混合,然后立即加入10μl含有约109个浮游细菌的胰蛋白胨大豆肉汤(tsb),接触时间为5分钟。加入1ml中和剂之前。然后加入1ml中和剂(1%硫代硫酸钠、6%tween80、5%bcs和10%bsa的pbs缓冲液)对这些消毒剂体系进行浮游性金黄色葡萄球菌的测试表明,在没有有机污垢的情况下,每种消毒体系都能达到7log10的减少量。然而,在脏污状态下进行测试时,仅实施例9保留了其全部功效。从图8中可以看出,由于存在有机污垢,导致两种含氯消毒剂和过氧化氢完全失活。然而,oxivirtb确实表现出一定的活性(0.67log10)。值得注意的是,在这项研究中,oxivirtb使用5分钟接触时间进行测试,而其制造商建议与细菌的接触时间为10分钟。实施例18在存在和不存在生物污垢的情况下,测定了表22中所示的试验消毒剂杀死金黄色葡萄球菌的干燥表面生物膜内的生物的功效。每种状态均进行5次重复测试,并以5分钟的接触时间确定残留细菌数(菌落形成单位cfu)。在不存在污垢的情况下,将1ml试验消毒剂与1ml硬水混合,然后立即添加生物膜包覆的样片,接触5分钟,对消毒剂功效进行测试。然后加入1ml中和剂(1%硫代硫酸钠、6%吐温80、5%bcs和10%bsa的pbs缓冲液)。在存在污垢的情况下,将1ml试验消毒剂与1ml5%牛犊血清硬水混合物混合,然后立即添加生物膜包覆的样片,接触5分钟,对消毒剂功效进行测试。对阳性对照(生物膜覆盖的样片)和阴性对照(干净无菌的样片)进行如上所述的相同处理,但使用硬水代替试验消毒剂。向试验混合物中加入1ml中和剂(1ml消毒剂加1ml污垢或硬水),然后立即添加生物膜覆盖的样片,反应5分钟。以此确认加入1ml中和剂后是否会使消毒剂活性完全失活。在80khz下对对照样片和试验样片超声处理20分钟,然后连续进行10倍稀释,在37℃下平板培养过夜。以此确定残留生物膜的活性,并确定cpu。结果阳性对照样片的平均值为2.6x106cfu/样片。在不存在生物污垢且接触时间为5分钟的情况下,观察到实施例9的减少量为6.42log10,而稀释的proxitane样品的减少量仅为2.04log10。含氯消毒剂sdic和chlorclean得到的生物膜活性减少量分别为2.85log10和2.82log10。在干净和脏污状态下,发现oxivir得到的减少量约为1log10,而非配制型过氧化氢的得到的减少量基本为0log10。在脏污状态下(即,在存在有机污垢的情况下),实施例9得到的减少量同样达6.42log10。在存在污垢的情况下,sdic和chlorclean消毒剂的功效均大幅下降,减少量分别为0.03log10和0.02log10。oxivirtb功效同样下降,使对生物膜活性的减少量为0.24log10(参见图9)。结论根据实施例9的消毒剂溶液,以及另外两种配制型商购消毒剂体系,每种体系均含有氧化性杀菌剂以及其他成分(诸如,例如表面活性剂)。将配制型消毒剂与通用等效产品进行比较,评估添加的专有成分对消毒剂功效的影响,从而确定是否仅由活性成分完成生物膜的去除,或者专有成分是否与活性成分协同作用。在该研究中,实施例9性能出众,能够在存在或不存在污垢的情况下使干燥表面生物膜完全失活。配制型含氯产品chlorclean和非配制型sidc片剂性能次之,但与实施例9相比,二者杀灭的生物膜细菌大幅减少(3log10),而且仅在不存在污垢的情况下才有效。之前的研究表明,生物膜的表面层会消耗诸如次氯酸盐之类的化学物质,导致在消毒剂可以渗透到更深层之前耗尽中和能力(参见参考文献13),使传统的水合生物膜比浮游细胞更加耐受这些消毒剂。然而,一项次氯酸盐对干燥表面生物膜的功效的研究发现,这种半脱水生物膜比传统水合生物膜更加耐受次氯酸盐(参见参考文献6)。与含氯或含过氧乙酸和过氧化氢的消毒剂相比,即使在不存在污垢的情况下,含过氧化氢的消毒剂杀灭的生物膜细菌也要少得多。oxivirtb杀灭了大约1log10的生物膜细菌,而过氧化氢溶液则不起作用。然而,值得注意的是,oxivir制造商建议的杀菌接触时间为10分钟,而不是研究中使用的5分钟,这可以解释其性能为何较低。然而,考虑到干燥医院表面的清洁方式,即使是5分钟的接触时间也可能过长。大多数消毒剂没有残留作用,仅在潮湿的情况下才会保持活性。实施例9(配制型添加剂)和稀释的proxitane(无添加剂)之间的杀灭率差异表明,实施例9对dsb的活性不仅受活性成分(过氧化氢和过氧乙酸)的影响,还受其他因素的影响,诸如添加的表面活性剂或赋形剂、螯合剂或其溶液的ph值。表面活性剂可以增强活性成分向生物膜中的扩散(由于溶液表面张力下降,因此改善了生物膜表面的润湿性)。在不存在有机污垢的情况下,所有这些被测消毒剂都可以杀灭7log10的浮游微生物,因此增强扩散可能会使生物膜杀灭率升高。螯合剂可以络合硬水中存在的所有钙离子和镁离子,以及自来水中常常存在的任何其他干扰性金属离子(诸如,铁离子、锰离子),因此提高消毒剂在硬水中的性能。参考文献1.vickeryk,devaa,jacombsa,allanj,valentep,gosbellib,“重症监护室进行临床表面最终清洁后仍存在含有多抗性活性菌的生物膜”(presenceofbiofilmcontainingviablemultiresistantorganismsdespiteterminalcleaningonclinicalsurfacesinanintensivecareunit),《医院感染杂志》,(2012)80,第52-55页2.huh,johanik,gosbellib,jacombsas,almatroudia,whiteleygs,devaak,jensens,vickeryk,“重症监护病室环境表面被生物膜中耐多药细菌污染:常规培养、焦磷酸测序、扫描电子显微镜和共聚焦激光显微镜的综合结果”(intensivecareunitenvironmentalsurfacesarecontaminatedbymultidrug-resistantbacteriainbiofilms:combinedresultsofconventionalculture,pyrosequencing,scanningelectronmicroscopy,andconfocallasermicroscopy);《医院感染杂志》,(2015)91,第35-44页3.whiteleygs,knightjl,derrycw,jensenso,vickeryk,gosbellib,“繁忙重症监护室中有害病菌定位的初步研究”(apilotstudyintolocatingthebadbugsinabusyintensivecareunit),《美国感染控制杂志》,(2015)43,第1270-1275页4.almatroudia,huh,devaa,gosbellib,jacombsa,jensenso,whiteleyg,glasbeyt,vickeryk,“新型干燥表面生物膜模型:一种检测医院消毒程序功效的基本工具”(anewdrysurfacebiofilmmodel:anessentialtoolforefficacytestingofhospitaldecontaminationprocedures);(2015),117,第171-176页5.“使用cdc生物膜反应器对高剪切连续流下生长的铜绿假单胞菌生物膜进行定量的标准测试方法”(standardtestmethodforquantificationofpseudomonasaeruginosabiofilmgrownwithhighshearandcontinuousflowusingcdcbiofilmreactor)。astme2562-12,国际astm,西康舍霍肯市6.almatroudia,gosbellib,huh,jensenso,espedidoba,tahirs,glasbeyto,leggep,whiteleyg,devaa,vickeryk,“次氯酸钠无法杀灭金黄色葡萄球菌干燥表面生物膜:对感染控制的影响”,《医院感染杂志》,(2016),93,第263-270页7.almatroudia,tahirs,huh,chowdhuryd,gosbellib,jensenso,whiteleygs,devaak,glasbeyt,vickeryk,“金黄色葡萄球菌干燥表面生物膜比传统水合生物膜对热处理的耐受性更高”(staphylococcusaureusdrysurfacebiofilmsaremoreresistanttoheattreatmentthantraditionalhydratedbiofilms),《医院感染杂志》(2018),98,第161-167页8.vickeryk,pajkosa,cossarty,“从内窥镜上去除生物膜:清洁剂效率评价”(removalofbiofilmfromendoscopes:evaluationofdetergentefficiency),《美国感染控制杂志》(2004),32,第170-176页9.vickeryk,ngoqd,zouj,cossartye,“多个污染、清洁剂清洗和消毒循环对内窥镜管中生物膜形成的影响”(theeffectofmultiplecyclesofcontamination,detergentwashing,anddisinfectiononthedevelopmentofbiofilminendoscopetubing);《美国感染控制杂志》(2009),37,第470-475页10.renw,shengx,huangx,zhif,caiw,“清洁剂和接触时间对从柔性内窥镜去除生物膜的评估”(evaluationofdetergentsandcontacttimeonbiofilmremovalfromflexibleendoscopes),《美国感染控制杂志》(2013),41,第e89-e92页11.yingfang,zheshen,lanli,yongcao,li-yinggu,qinggu,xiao-qizhong,chao-huiyu,you-mingli,“胃肠道内窥镜细菌生物膜清洁的功效研究”(astudyoftheefficacyofbacterialbiofilmcleanoutforgastrointestinalendoscopes),《世界胃肠病学杂志》(2010),16,第1019-1024页12.goeresdm,loetterlelr,hamiltonma,murgar,kirbydw,donlanrm,“实验室方法生长生物膜的统计评估”(statisticalassessmentofalaboratorymethodforgrowingbiofilms),《微生物学》(2005)151,第757-762页13.chenx,psstewart,“反应扩散相互作用对氯渗透进入人工生物膜的限制”(chlorinepenetrationintoartificialbiofilmislimitedbyareaction-diffusioninteraction),《环境科学与技术》1996;30:第2078-83页当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1