适于植入后扩张的外科心脏瓣膜的制作方法与工艺
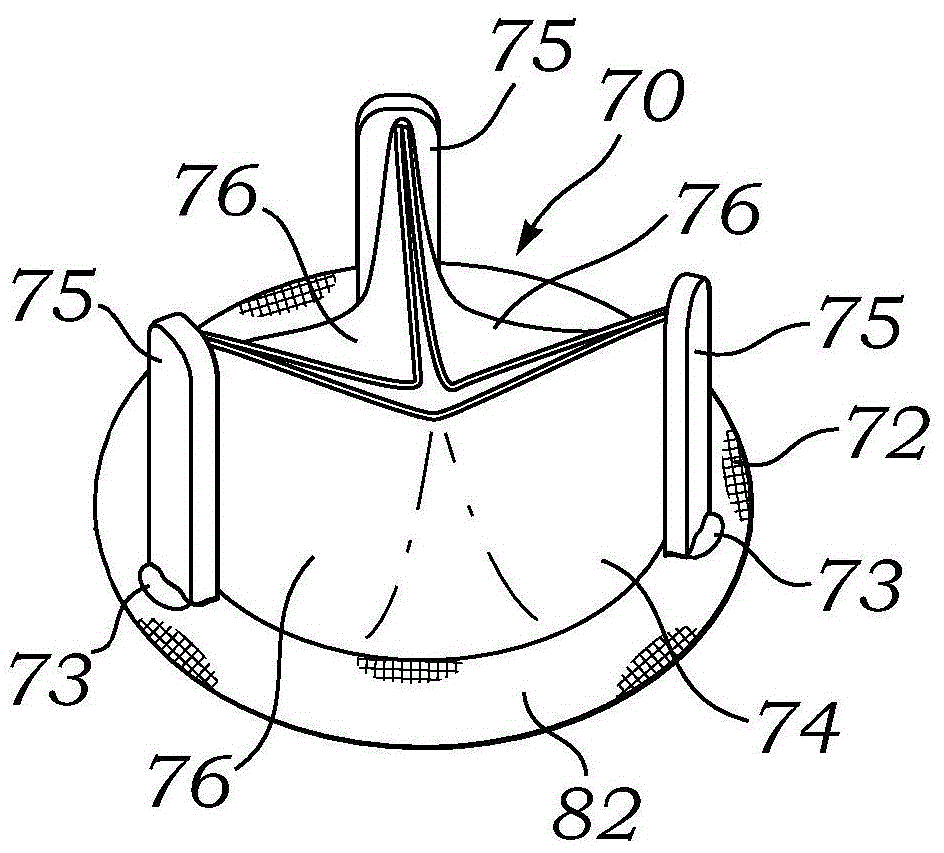
适于植入后扩张的外科心脏瓣膜相关申请本申请根据35U.S.C.§119要求享有2012年12月31日提交的美国临时申请序号61/748,022的优先权。本申请还涉及2008年9月19日提交的美国专利申请序号12/234,559,其标题为“ProstheticHeartValveConfiguredtoReceiveaPercutaneousProstheticHeartValveImplantation”;并且涉及2008年9月19日提交的美国专利申请序号12/234,580,其标题为“AnnuloplastyRingConfiguredtoReceiveaPercutaneousProstheticHeartValveImplantation”,其全部内容被明确引入本文作为参考。发明领域本发明涉及用于心脏瓣膜置换的外科心脏瓣膜,更具体地涉及改造现存外科心脏瓣膜的构造,以使其能够接收其中的可扩张假体心脏瓣膜。发明背景心脏是具有四个泵送室的中空肌肉器官,该四个泵送室被如下四个心脏瓣膜隔开:主动脉瓣、二尖瓣(mitral或bicuspid)、三尖瓣和肺瓣。心脏瓣膜由被称为环面的致密纤维环和附接至环面的小叶或尖突组成。心脏瓣膜疾病是广泛分布的病症,其中心脏瓣膜中的一个或多个不能正常工作。患病的心脏瓣膜可被分类成狭窄——其中瓣膜不充分打开以使血液通过瓣膜充足正向流动,和/或机能不全——其中瓣膜不完全闭合,导致在瓣膜闭合时血液通过瓣膜过度反向流动。瓣膜疾病可导致严重虚弱,甚至若得不到治疗会是致命的。不同的外科技术可用于置换或修复患病或损坏的瓣膜。在传统瓣膜置换手术中,一般将损坏的小叶切除,并将环面塑形以接收置换假体瓣膜。假体心脏瓣膜一般包括支持结构(如框架、环和/或支架),其中布置瓣膜组装件。支持结构通常是刚性的,并且可由不同生物相容性材料形成,包括金属、塑料、陶瓷等。已知两种主要类型的“常规”心脏瓣膜置换或假体。一种是机械型心脏瓣膜,其采用球和笼安排或由基体结构支持的枢转机械闭合来提供单向血液流动,如Stobie等的美国专利号6,143,025和Brendzel等的美国专利号6,719,790所示,其全部内容被明确引入本文作为参考。另一种是组织型或“生物假体”瓣膜,其具有由基体结构支持并且突出到流动流(flowstream)中的挠性小叶,该挠性小叶的作用非常类似于天然人心脏瓣膜的小叶,并且模拟其天然挠曲作用以彼此接合和确保单程血液流动。在组织型瓣膜中,完全异种移植物瓣膜(例如,猪)或多种异种移植小叶(例如,牛心包)可提供阻液表面。已提出合成小叶,因此术语“挠性小叶瓣膜”同时指代天然和人造“组织型”瓣膜。在一般的组织型瓣膜中,两个或更多个挠性小叶被安置在外周支持结构内,该外周支持结构通常包括沿流出方向延伸的接柱或接合处,以模拟天然环面中的天然纤维接合处。金属或聚合物“支持框架”,有时被称为“线材”(wireform)或“支架”,具有多个(一般三个)大半径尖突,该尖突支持挠性小叶(即,完全异种移植物瓣膜或三个单独小叶)的尖突区域。每对相邻尖突的端部略微渐近地汇合,以形成终止于末端的直立接合处,其分别沿与弓形尖突相反的方向延伸并且具有相对较小半径。通常将瓣膜部件与一种或多种生物相容性织物(例如,Dacron)覆盖物组装,并在外周支持结构的流入端上提供织物覆盖的缝合环。挠性小叶瓣膜构造的一个实例示于Huynh等的美国专利号6,585,766(2003年7月1日授权),其中图1的分解视图示例了小叶子组装件52任一侧上的织物覆盖的线材54和织物覆盖的支持支架56。美国专利号6,585,766的全部内容被引入本文作为参考。瓣膜和相关组装件/系统的其他实例可在下列中找到:美国专利号4,084,268,1978年4月18日授权;美国专利号7,137,184,2006年11月21日授权;美国专利号8,308,798,2009年12月10日提交;美国专利号8,348,998,2010年6月23日提交;和美国专利公开号2012/0065729,2011年6月23日提交;其全部内容均被引入本文作为参考。有时可产生完整瓣膜置换的需求,在此之前患者已经进行了相同瓣膜的较早瓣膜置换。例如,被成功植入以置换天然瓣膜的假体心脏瓣膜本身在被最初植入后多年可受到损坏和/或磨损和撕裂。直接在在前植入的假体心脏瓣膜内植入假体心脏瓣膜可能是不实际的,部分原因是新假体心脏瓣膜(包括支持结构和瓣膜组装件)必须位于在前植入的心脏瓣膜的环面内,而传统假体心脏瓣膜可能没有被配置以易于以如下方式接收这样的瓣膜内瓣膜植入:提供新瓣膜固定座,同时还在新瓣膜内具有足够大的环面来支持通过其中的适当血液流动。在旧瓣膜内植入新瓣膜的问题已经得到了一定的关注。具体地,下列公开了针对瓣膜内瓣膜系统的不同解决方案:美国专利公开号2010/0076548,2008年9月19日提交的;和美国专利公开号2011/0264207,2011年7月7日提交。尽管在瓣膜内瓣膜领域取得了一定的进步,但仍需要可适当地置换受损心脏瓣膜的假体心脏瓣膜,如这样的假体瓣膜:其被配置以通过外科植入置换天然瓣膜,而且能够实现以后在其中布置可扩张置换假体心脏瓣膜,而无流量损失。本发明符合这样的需求。发明概述本发明是假体心脏瓣膜,其被配置以在其中接收假体心脏瓣膜,如导管布置(经导管)的假体心脏瓣膜。在一个实施方式中,假体心脏瓣膜具有支持结构,该支持结构在被布置到患者的天然心脏瓣膜环面中置换天然心脏瓣膜(或置换另一假体心脏瓣膜)时基本上抵抗径向压缩(并且可基本上抵抗径向扩张),但被配置为可径向扩张的,和/或转变成大体上扩张的和/或可扩张的构型,从而在其中接收假体心脏瓣膜,如经皮递送的假体心脏瓣膜。抵抗扩张至扩张/可扩张的转变可通过使抗扩张支持结构受到外向力如扩张力来实现,该外向力可由用于布置置换假体瓣膜的扩张球囊提供。在一个重要方面,本申请公开了对现有外科瓣膜的具体改造,该改造能够实现制造商快速生产适合瓣膜内瓣膜(瓣中瓣,valve-in-valve,ViV)程序的瓣膜。具体地,本申请考虑更新或改造现有商品外科瓣膜内的部件,以能够实现植入后扩张。优选的实施方式是适于植入后扩张并且具有流入端和流出端的假体心脏瓣膜。瓣膜包括内部结构支持支架,其包括大致圆形的复合带,该复合带具有直立接合柱并且包括外带,外带围绕并且附接至内带,内带限定接合柱。支架限定植入物圆周,其在普通生理应用中基本上不可压缩并且具有第一直径。外带围绕其外周具有至少一个可扩张的区段,其允许在从支持支架内施加基本上大于普通生理应用相关力的外向扩张力时支持支架从第一直径扩张至大于第一直径的第二直径。支架支持多个挠性小叶,该挠性小叶被配置以确保单程血液流动通过其中。一方面,外带包括单个可扩张区段,其位于其中一个尖突或其中一个通过交叠自由端形成的接合处。外带的每一个交叠自由端可包括至少一个彼此定位(对齐,套准,register)的孔,并且穿过该定位孔的缝线使自由端保持对齐,但被配置以在支持支架受到外向扩张力时断裂。可选地,外带的交叠自由端包括交错的翼片,其彼此啮合以保持自由端对齐,并且允许支持环有限扩张。翼片可具有球状头部,该球状头部通过较细杆连接至自由端。再进一步,外带的交叠自由端可一个在另一个外侧交叠,并且套筒将其围绕以保持自由端对齐。沿每个自由端可提供圆周槽,该圆周槽在支持支架处于第一未扩张构型时宽于套筒延伸,并且允许流体在套筒限定的腔内流动。在一种方式下,外带的交叠自由端位于内带的其中一个接合柱下方,并且内带在这个接合柱的流入边缘处进一步包括槽口以促进其径向扩张。再进一步,外带的交叠自由端每一个可包括至少一个定位孔,并且通过该定位孔的聚合物元件保持自由端对齐,但被配置以在支持支架受到外向扩张力时断裂。在不同的实施方式中,可扩张区段在一个自由端上包括至少一个翼片,该翼片围绕另一个自由端弯折。可选地,可扩张区段在一个自由端上包括至少一个翼片,该翼片穿过另一个自由端中的槽突出。期望地,内带是单个聚合物带,并且外带是单个金属带。可扩张区段可包括一连串相互连接的撑杆,该撑杆通过铰链样连接方式首尾连接,形成具有基本上菱形单元(孔,cell)的Z字形手风琴样结构。可选地,可扩张区段包括通过可塑性扩张撑杆形成的基本上蛇状结构。在一种方式下,假体心脏瓣膜是两部分瓣膜,其中多个挠性小叶安置在可拆卸框架上,该可拆卸框架偶联至支持支架的接合柱处。瓣膜可进一步包括布料覆盖物,其围绕支持支架并且促进小叶外周边缘沿支持支架流出边缘的附接。在支持支架上可提供植入后从体外可视的独特标识符,该标识符鉴定支持支架是可扩张的。可生物降解带可被布置与结构支架同心并且紧密接触,可生物降解带被配置以提供在植入后支持支架扩张的阻力,该阻力由于该带在身体中降解而随时间流逝减弱。假体心脏瓣膜进一步可具有可径向扩张的流入支架,其被固定于支持支架的流入端并且从支持支架的流入端突出,其中可径向扩张的流入支架具有一定强度,需要预定的扩张力来从压缩状态转换至扩张状态,并且其中可生物降解带被配置以在预定的扩张力施加于可径向扩张的流入支架时提供支持支架扩张的阻力。假体心脏瓣膜结构可在扩张前是大体上刚性的,并且可被配置以在受到外向力时变成大体上非刚性的,甚至大体上弹性的。弹性可有助于将经皮引入的假体瓣膜纳入当前假体瓣膜结构中。假体心脏瓣膜结构可被配置以抵抗径向压缩,但允许在受到径向扩张力,可能甚至相对小的径向扩张力时径向扩张。假体瓣膜可最初利用不同外科技术(例如,传统开胸、微创、经皮等)被布置在患者的瓣膜环面中,以修正心脏瓣膜功能。如果心脏瓣膜功能在布置假体瓣膜后进一步衰退,则可在在前布置的假体瓣膜内布置新的置换假体瓣膜,而无需切除在前布置的假体瓣膜。在在前布置的假体瓣膜内的置换假体瓣膜的布置可在距在前布置的假体瓣膜的最初布置很长时间后进行。因此本发明的假体瓣膜被配置以在长时间后布置在患者体内,以接收甚至改善相同瓣膜环面内的置换假体瓣膜的布置。在本发明的实施方式中,假体瓣膜是带支架的生物假体瓣膜,其被配置以在患者的环面内动态地扩张和收缩。环面的动态运动可能够实现瓣膜打开以在峰值要求时期扩张,和减少环限制从而增加流量。扩张还可减少可能的较高梯度相关的小叶应力。扩张还可允许以后在带支架的生物假体瓣膜内布置可扩张的假体瓣膜。在这种实施方式中,假体瓣膜可具有设定的最小半径,假体瓣膜不会在该最小半径之下径向压缩。假体瓣膜可具有设定的最大半径,假体瓣膜不会超过该最大半径径向扩张,即使受到一般在用于递送和布置可球囊式扩张的、可经皮递送的带支架假体心脏瓣膜的球囊导管中可见的上至6atm范围的径向扩张力。在本发明的实施方式中,假体瓣膜具有复合材料支持结构,其具有大体上刚性和/或抗扩张的部分和基本上挠性和/或可拉伸的部分。假体瓣膜可包括可塑性变形的材料,其被配置以保持假体瓣膜支持结构处于大体上刚性和/或抗扩张的形状,用于布置。可塑性变形的材料可被配置以在受到扩张力时打破或塑性变形和不再保持大体上刚性和/或抗扩张构型的支持结构。支持结构可形成连续的回路,并且可包括可弹性变形的材料,其被配置以在支持结构已通过扩张球囊或其他机械扩张器扩张后提供关于连续回路的张力。根据本发明的实施方式修复患者的心脏功能的方法可包括:提供假体心脏瓣膜,其被配置以在植入时具有大体上刚性和/或抗扩张的支持结构,而且被配置以在扩张时呈现大体上扩张的构型;和在心脏瓣膜环面中植入假体心脏瓣膜。方法还可包括在在前布置的心脏瓣膜和心脏瓣膜环面内布置可扩张的假体心脏瓣膜。在在前布置的假体瓣膜和心脏瓣膜环面内布置可扩张的假体心脏瓣膜可包括扩张在前布置的假体瓣膜,以使在前布置的假体瓣膜呈现大体上扩张的形状。扩张在前布置的假体心脏瓣膜可包括利用扩张球囊,如当前用于扩张天然心脏瓣膜的类型,其可在在前布置的假体心脏瓣膜内被驱动并且扩张至预期压力和/或直径。一般而言,用于扩张天然瓣膜的扩张球囊由大体上无弹性的材料形成,以在膨胀时提供大体上固定(即,预设)的外径。一旦这种球囊膨胀至其完全固定的直径,其不会显著进一步扩张(在破裂前),即使其中增加额外的体积/压力。膨胀这种球囊的一般压力在1和12个大气压之间,更优选1和8个大气压之间,并且这种球囊的预设膨胀外径大约为18至33毫米。扩张球囊可扩张至足以使球囊充分膨胀至其预期直径和使在前布置的假体心脏瓣膜扩张(dilate和expand)的预期压力(例如,1-12个大气压)。一般的外科植入的假体心脏瓣膜会耐受如大多数扩张球囊提供的几个大气压的扩张压力,没有扩张和/或变成弹性的。相比之下,本文描述的假体心脏瓣膜被配置以在受到扩张球囊或其他机械扩张器提供的充足压力时变成扩张的和/或大体上弹性的。如果利用充足压力使扩张球囊扩张至扩张外径——大于本发明假体心脏瓣膜的内径,则假体心脏瓣膜将直径扩大和/或变成弹性的。在一个实施方式中,扩张球囊配置有预设膨胀外径,其比在前布置的假体心脏瓣膜的内径大例如2至3mm、或10-20%或更多。作为实例,如果本发明的在前布置的假体心脏瓣膜具有23mm的内径,则具有24-27mm膨胀直径的扩张球囊可在该假体心脏瓣膜内膨胀,以使其扩张和/或变成弹性的。根据本发明不同实施方式的假体心脏瓣膜可被配置以在扩张前是大体上刚性的,但在受到充足扩张压力时变成扩张的和/或弹性的。例如,假体心脏瓣膜可被配置以耐受可在心跳时发生的天然存在的扩张压力,但在受到预期压力(例如,来自扩张球囊)时变成扩张的和/或弹性的,如1个大气压、2个大气压、3个大气压、4个大气压、5个大气压、或6个大气压、或上至12个大气压的压力,取决于具体应用。在本发明的一个具体实施方式中,假体心脏瓣膜具有流入端和流出端,具有未扩张构型和扩张构型。支持结构限定圆周,并且在假体心脏瓣膜处于未扩张构型时具有较小内径和在假体心脏瓣膜处于第二扩张构型时具有较大内径。支持结构在假体心脏瓣膜处于未扩张构型时刚性地抵抗内向压缩。瓣膜部分被支持结构支持,并且包括多个小叶。当假体心脏瓣膜处于未扩张构型时,每个小叶被配置以接合相邻小叶,从而允许血液流过假体心脏瓣膜,但阻止血液沿相反方向流过假体心脏瓣膜。支持结构可具有第一支持部分,其基本上围绕支持结构的圆周并且包括聚合物材料。第一支持部分可形成聚合物材料的单个一体组装件,并且可具有弱化部分,其被配置以在支持结构受到充足扩张力时在结构上失效。支持结构可具有第二支持部分,其基本上围绕支持结构的圆周并且由金属形成,如钴-铬或不锈钢。第二支持部分可具有弱化部分,其被配置以在支持结构受到导致第一支持部分的弱化部分失效的相同扩张力时在结构上失效。该扩张力可以是2个大气压或更多。第一支持部分和第二支持部分可在围绕支持结构圆周的多个点处固定在一起。第一支持部分弱化部分和第二支持部分弱化部分可围绕支持结构的圆周彼此相邻定位,或可围绕支持结构的圆周彼此间隔。第一支持部分的弱化部分可包括第一支持部分的薄化区,第二支持部分弱化部分可包括第二支持部分上的焊点。第二支持部分弱化部分可包括在第二支持部分中的两个开口,并且缝线穿过这两个开口。第一支持部分可包括聚酯,第二支持部分可包括金属如钴-铬(Co-Cr)合金。假体心脏瓣膜根据本发明可进一步具有另外的支持部分,位于假体心脏瓣膜流入端处的支持部分的形式,并且该第三支持部分被配置以在受到本身不足以致使主支持结构扩张的扩张力时径向扩张成基本上张开的形状。该第三支持部分可位于整个瓣膜部分的上游。第一支持部分可包括一件式聚合物结构,其限定沿假体心脏瓣膜纵长延伸的3个聚合物接合支持器,还限定围绕假体心脏瓣膜圆周延伸的3个聚合物弯曲连接处,其中每个弯曲连接处连接两个相邻的接合支持器,并且其中第二支持器部分包括一件式金属结构,其包括围绕假体心脏瓣膜圆周地延伸的3个金属弯曲连接处,其中这3个金属弯曲连接处位置抵靠3个聚合物接合支持器并且径向上处于3个聚合物接合支持器外侧。在本发明的进一步实施方式中,假体心脏瓣膜具有流入端和流出端,并且具有第一未扩张构型和第二扩张构型。瓣膜可具有支持结构,其包括多个接合支持器,并且瓣膜扩张部分在相邻接合支持器之间圆周地延伸。扩张部分可防止支持结构在假体心脏瓣膜处于未扩张构型时压缩,但允许支持结构在假体心脏瓣膜受到大于2个大气压的扩张力时从第一直径径向扩张至第二直径。在扩张构型下,假体心脏瓣膜的小叶(在扩张前已接合以控制血液流动)可不充分接合,或根本不接合。因此,小叶(扩张后)可允许大量血液沿双方向流动。因此在扩张后小叶在控制血液流动上很大程度上无效。因此将通过布置在现有的(并且现扩张的)假体瓣膜的孔口内的、新植入的假体瓣膜来控制血液流动。根据本发明的支持结构的扩张部分可具有由金属撑杆形成的基本上蛇状的结构,其中金属撑杆具有端部以及侧面,其中相邻金属撑杆以首尾构型连接,其中在未扩张构型下金属撑杆被并排布置,其中相邻金属撑杆的侧面接触相邻金属撑杆的侧面。由于当前的和设计的经皮递送的/径向可扩张的假体心脏瓣膜相对较薄,本文描述的假体心脏瓣膜所需的径向扩张量不必大于1至5毫米,其中2至3毫米较为一般用于本文的实施方式。例如,约2至3毫米的径向扩张可足以提供在现有的并且扩张的假体瓣膜内充分布置新经皮假体瓣膜的空间,其中新布置的经皮假体瓣膜的孔口与原来布置的(并且现在扩张的)假体瓣膜的孔口(扩张前)具有相同尺寸。本发明实施方式的内径/孔径(扩张前和扩张后)的非限制性实例包括:15mm扩张至17或18mm;17mm扩张至19或20mm;19mm扩张至21或22mm;22mm扩张至24或25mm;25mm扩张至28mm;27mm扩张至30mm;30mm扩张至33mm。根据本发明的实施方式的瓣膜和支持器可具体地被配置以抵抗径向扩张,直到受到指定压力,在此指定压力以上可发生径向扩张。例如,1atm或更大(例如,1至6atm);2atm或更大(例如,2至6atm);3atm或更大(例如,3至6atm);4atm或更大(例如,4至6atm);5atm或更大(例如,5至6atm);或6atm或更大的指定压力可足以引起径向扩张。引起根据本发明实施方式的瓣膜结构扩张的球囊膨胀压力可在1个大气压上至10个大气压或还更高的范围内。然而,实际情况是此范围的下端点可能更加理想。很多球囊具有6至8个大气压的最大额定压力(其以上可有胀破危险),并且因此可期望根据本发明的装置在受到低于球囊最大额定压力的压力下扩张。因此,根据本发明的装置可被配置以在球囊充气至4至5atm之间的压力如4.5atm时径向扩张。根据本发明的装置可被配置以在受到这种指定扩张压力时扩张,但仅扩张选定量(例如,2至3毫米)——使得即使压力增加到明显超过指定扩张压力,也会阻止进一步的径向扩张。注意,上文提出的扩张球囊膨胀直径和膨胀压力、以及假体心脏瓣膜变得扩张和/或弹性的压力是作为实例,并且具有其他压力和直径的球囊或其他机械扩张器、和被配置以在受到其他压力和扩张球囊直径时改变形状和/或扩张和/或变得弹性的假体心脏瓣膜的应用也在本发明的范围内。本发明的其他特征和优势将通过下文详细描述结合附图而显而易见,附图通过实例示例了本发明的原理。附图简述图1显示根据本发明的实施方式的布置在心脏中的假体心脏瓣膜;图2A-2C分别显示根据本发明实施方式的假体心脏瓣膜的透视图、顶视图和侧视图;图2D显示图2A-2C的假体心脏瓣膜在假体心脏瓣膜已扩张后的顶视图;图3A-3B分别显示根据本发明实施方式的假体心脏瓣膜在扩张前的顶视图和侧视图;图3C-3D分别显示图3A-3B的支持结构在假体心脏瓣膜支持结构已扩张后的顶视图和侧视图;图4A-4B分别显示根据本发明实施方式的假体心脏瓣膜支持结构在扩张前和扩张后的侧视图;图5A-5D是具有内部结构带的示例性现有技术假体心脏瓣膜的透视图和分解视图;图6A-6B、7A-7B和8A-8B是图5A所示的能够实现心脏瓣膜在植入后扩张的现有技术假体心脏瓣膜的置换结构带的不同实施方式的组装透视图和分解视图;图9A-9B是可替换到图5A的现有技术假体心脏瓣膜中以实现其植入后扩张的结构带的可选组合的组装透视图和分解视图;图10是用于替换到图5A的现有技术假体心脏瓣膜中的再进一步可选的模塑结构带的透视图;图11A显示根据本发明实施方式的假体心脏瓣膜支持带的侧视图;图11B和11C分别显示具有使自由端固定在一起的缝线(一个或多个)的图11A的假体心脏瓣膜支持带的侧视图和透视图(特写);图11D显示具有自由端固定在一起的可选构型的图11A的支持带的放大侧视图;图11E显示与图11A的支持带一起使用的另一假体心脏瓣膜支持带的侧视图;图11F显示通过将图11A的第一假体心脏瓣膜支持带和图11E的第二假体心脏瓣膜支持带固定到复合材料结构中形成的假体心脏瓣膜结构的侧视图;图11G-11J显示图11A-11F所示第一和第二假体心脏瓣膜支持带的改动;图11K-11N显示第一假体心脏瓣膜支持带的进一步改动;图12A和12B是适于植入后扩张、具有交叠的自由端、并且翼片彼此啮合的另一示例性假体心脏瓣膜支持带的透视图,图12C和12D分别是收缩和扩张构型下的交叠自由端的放大视图;图13A和13B是适于植入后扩张、也具有交叠的自由端、交叠的自由端被摩擦套筒固定在一起的另一假体心脏瓣膜支持带的透视图,图13C显示交叠自由端的扩张;图14A和14B分别显示根据本发明实施方式的假体心脏瓣膜支持结构的顶视图和侧视图;图14C和14D显示具有如图14A和14B的支持结构、并且球囊导管扩张可扩张裙但不扩张主要支持结构部分的假体心脏瓣膜的侧视图;图14E和14F分别显示图14A和14B的假体心脏瓣膜支持结构在球囊导管已使主要支持结构部分径向扩张成扩张构型后的顶视图和侧视图;图15是具有内部结构带组合的示例性假体心脏瓣膜的分解透视图,该内部结构带组合允许植入后扩张,并且还包括在植入后生物降解的加固带;图15A是组装的图15的假体心脏瓣膜在球囊扩张锚定裙的步骤期间的立视图,图15B是在扩张第一瓣膜同时在其中植入二次心脏瓣膜的植入后程序期间的假体心脏瓣膜的剖视图;图16A和16B显示根据本发明实施方式的可扩张假体心脏瓣膜的透视图和顶视图,其中可经皮递送的可扩张假体心脏瓣膜支架径向扩张;图16C显示现有技术不可扩张假体心脏瓣膜的顶视图,其中可经皮递送的可扩张假体心脏瓣膜支架径向扩张;图17A是另一市售的现有技术外科假体心脏瓣膜的透视图,图17B是其内部支持支架的透视图;图18A-18D是图17B的内部支持支架的改造的透视图,其将能够实现图17A的心脏瓣膜在植入后扩张;图19A是另一市售的现有技术外科假体心脏瓣膜的透视图,其外部具有生物假体组织小叶,图19B是其内部支持支架的透视图;图20A-20D是图19B的内部支持支架的改造的透视图,其将能够实现图19A的心脏瓣膜在植入后扩张;图21A是另一市售的现有技术外科假体心脏瓣膜的透视图,其具有两个可拆卸部件,图21B是这两个部件的透视图,其偶联在一起形成功能性假体心脏瓣膜;图22A-22C是图21B的内部支持支架的改造的透视图,其能够实现图21A的两部分心脏瓣膜的基体元件在植入后扩张;图23A显示根据本发明实施方式的可扩张假体心脏瓣膜布置导管,其被配置用于可扩张假体心脏瓣膜布置;图23B显示根据本发明实施方式的图23A的可扩张假体心脏瓣膜布置导管,其定位于患者心脏瓣膜环面中的在前布置的假体心脏瓣膜内;图23C显示根据本发明实施方式的图23A的可扩张假体心脏瓣膜布置导管,其扩张在前布置的假体心脏瓣膜并在其中布置可扩张假体心脏瓣膜;图23D显示根据本发明实施方式的图23A的可扩张假体心脏瓣膜布置导管,其正从患者撤出;图24A显示根据本发明实施方式的可扩张假体心脏瓣膜布置导管,其被配置用于扩张在前布置的假体心脏瓣膜和用于布置可扩张的假体心脏瓣膜;图24B显示根据本发明实施方式的图24A的可扩张假体心脏瓣膜布置导管,其中扩张球囊定位于心脏瓣膜环面中的在前布置的假体心脏瓣膜内;图24C显示根据本发明实施方式的图24A的可扩张假体心脏瓣膜布置导管,其扩张在前布置的假体心脏瓣膜;图24D显示根据本发明实施方式的图24A的可扩张假体心脏瓣膜布置导管,其中扩张球囊在在前布置的假体心脏瓣膜扩张后紧缩;图25A和25B分别是示例性管状适配框架的透视图和平面顶视图,其具有倒钩,该倒钩可用于在前植入的瓣膜和新植入的可扩张瓣膜之间,增强其间的锚定,图25C是其一个撑杆区段的分离;图26是可选的管状适配框架的一部分的透视图,其具有水平定向的倒钩;和图27A-27C示意性地示例在首先在在前植入的假体心脏瓣膜内扩张的可扩张管状适配框架内的二次可扩张瓣膜的植入。优选实施方式详述本文描述的假体心脏瓣膜均包括内部(意为并入瓣膜本身,与之相对的是补充元件)支架或框架,其大体上是管状形状并且限定血液从流入端流至流出端所经过的流动孔口区域。可选地,内部支架的形状可以是卵形、椭圆形、不规则形、或任何其他预期形状。瓣膜包括挠性小叶,其选择性地允许流体流过。因此,流动孔口区域通过小叶的移动而可选地打开和闭合。如本文所述,根据本发明的装置和方法所使用的假体心脏瓣膜可包括多种不同的构型,如具有一个或多个组织小叶的假体心脏瓣膜、具有聚合物小叶的合成心脏瓣膜、和大体上被配置以置换天然或在前植入的假体心脏瓣膜的任何心脏瓣膜。即,本文描述的假体心脏瓣膜大体上可用于置换主动脉瓣、二尖瓣、三尖瓣、或肺瓣,而且可用作静脉瓣。这些置换假体心脏瓣膜还可用于功能性地置换无支架生物假体心脏瓣膜。本文公开的不同内部支架具有“可扩张区段”,其能够实现支架扩张。这可通过可扩张区段破裂、塑性拉伸、或弹性伸长来进行。因此,“可扩张区段”意为支架上能够实现其直径放大的位置,如在支架内的球囊膨胀时。实例包括可断裂的薄弱点、断裂或拉伸的薄化区、弹性或塑性伸长的手风琴样结构、通过可断元件如缝线或焊点保持在一起的支架的断裂、和各种其他手段。因此术语“可扩张区段”包括这些可选项中的每一项。参考图1,显示心脏12中的根据本发明的假体心脏瓣膜10。心脏12具有四个房室,被称为右心房14、右心室16、左心房18和左心室20。现将对如从患者正面观看显示的心脏12的大体解剖结构进行描述,作为背景。心脏12具有肌肉外壁22,并且房间隔24划分右心房14和左心房18,和肌肉室间隔26划分右心室16和左心室20。心脏12的底端是心尖28。血液流动通过上腔静脉30和下腔静脉32进入心脏12的右心房14。三尖瓣34——具有三个小叶36,控制右心房14和右心室16之间的血液流动。在血液从右心室16通过肺瓣膜38泵送至肺动脉40(其分支成通向肺(未显示)的动脉)时三尖瓣34闭合。其后,三尖瓣34打开以用来自右心房14的血液再填充右心室16。三尖瓣34的小叶36的下部和自由边缘42通过三尖瓣腱索44连接至右心室16中的乳头肌46,以控制三尖瓣34的活动。在离开肺后,新氧合的血液流动通过肺静脉48,并进入心脏12的左心房18。正常心脏中的二尖瓣控制左心房18和左心室20之间的血液流动。注意,在此图中,天然二尖瓣已被假体心脏瓣膜10置换,因此其是假体二尖瓣50。在血液从左心室20喷射到主动脉52中的心室收缩期间假体二尖瓣50闭合。其后,假体二尖瓣50打开以用来自左心房18的血液再填充左心室20。左心室20的血液通过由心脏壁22和肌肉室间隔26的肌肉系统产生的动力被泵送通过主动脉瓣膜62进入主动脉52,主动脉52分支成通向身体各个部分的动脉。在显示的具体实施方式中,假体心脏瓣膜10被布置以置换天然二尖瓣,更具体地被固定(通过例如缝线)在二尖瓣环面64邻近和周围处。根据具体应用——包括植入假体心脏瓣膜10的方法,具体天然瓣膜(主动脉瓣、二尖瓣、三尖瓣等)和/或其相关结构的部分或全部可在植入假体心脏瓣膜10之前或期间被全部或部分去除,或者天然瓣膜和/或部分或全部相关结构可只是被就地留置,将假体心脏瓣膜10安装在天然瓣膜上。例如,天然二尖瓣一般具有两个小叶(前叶和后叶),其下部和自由边缘通过二尖瓣腱索连接至左心室20中的乳头肌60,以控制二尖瓣的活动。这些结构(即,二尖瓣小叶、腱索)没有全部显示在图1中,因为在该具体实施方式中,天然二尖瓣和很多相关结构(腱索等)在植入假体心脏瓣膜10之前或期间已被去除。然而,在很多假体瓣膜植入中,外科医生选择保留很多腱索等,即使在切除天然瓣膜时。虽然图1显示了假体二尖瓣,但注意,本文描述的发明可应用于被配置以置换任何心脏瓣膜,包括主动脉瓣、二尖瓣、三尖瓣和肺瓣的假体瓣膜(和其系统和方法)。图2A-2C显示根据本发明实施方式的假体心脏瓣膜70,其中假体心脏瓣膜70包括支持框架72和瓣膜结构74。在显示的具体实施方式中,瓣膜结构74包括三个心脏瓣膜小叶76。假体心脏瓣膜70的瓣膜孔口80具有内径78a,血液可通过瓣膜孔口80沿一个方向流动,但瓣膜小叶76将阻止相反方向的血液流动。支持框架72大体上是刚性和/或抗扩张的,从而保持瓣膜孔口80的具体形状(在本实施方式中是大体上圆形的)和直径78a,而且保持各个瓣膜小叶76适当对齐,从而使瓣膜结构74适当地闭合和打开。该具体支持框架72还包括接合支持器或接柱75,其协助支持瓣膜小叶76的自由边缘。在优选的构造中,每个瓣膜小叶76沿尖突(cusp)边缘附接至周围的支持框架72并且沿相邻接合柱75而上。在图2A-2C显示的具体实施方式中,支持框架72限定大体上刚性和/或抗扩张的环82,其围绕瓣膜70并限定大体上圆形的瓣膜孔口80,但其他形状也在本发明的范围内——取决于具体应用(包括诸如待置换的具体天然瓣膜等情况)。该具体假体心脏瓣膜70包括可视化标记73(如辐射不透标记等),其在本实施方式中处于支持框架72上并且对应于环82和接合柱75(因此对应于接合处),其可有助于在假体心脏瓣膜70的瓣膜孔口80内适当地安置在后布置的可扩张假体心脏瓣膜。当图2A-2C的假体心脏瓣膜70受到扩张力(如来自扩张球囊,其可提供1至12个大气压、或更通常地1和8个大气压的压力)时,假体心脏瓣膜将有些扩张。支持框架72将从图2A-2C的大体上刚性和/或抗扩张的构型转变成图2D显示的大体上非刚性和扩张的构型。注意,环82——大体上是刚性和/或抗扩张的——现大体上扩张,因此瓣膜孔口80已被扩大至较大内径78b。较大内径78b被配置以在其中接收可扩张假体心脏瓣膜。整体结果是图2D的“扩张后”假体心脏瓣膜70具有大体上较大内径的圆形开口78b。实际内径将取决于具体应用,包括具体患者的心脏的方方面面(例如,天然瓣膜和/或环面直径等)。作为实例,二尖瓣的扩张前内径78a可以在22-30mm之间,或主动脉瓣膜的扩张前内径78a可以在18-28mm之间。扩张后内径78b将较大,更具体地大到足以在其中容纳可扩张假体瓣膜的外径。在利用可扩张假体心脏瓣膜置换/修复在前布置的假体心脏瓣膜的一些程序中,可期望可扩张假体心脏瓣膜的布置(扩张)内径(和相应的可扩张假体心脏瓣膜孔口面积)大约等于或甚至大于在前布置的假体心脏瓣膜70的扩张前内径78a(和相应的扩张前假体瓣膜孔口面积)。内径/孔口面积之间的这种一致性或其提高可有效用于保持适当的血液流动,使得可扩张假体心脏瓣膜提供与在前布置的假体心脏瓣膜提供的血液流动相同的或提高的血液流动。注意,术语“瓣膜孔口面积”指代在瓣膜部分处于完全打开构型时(例如,瓣膜小叶处于其完全打开构型,使得有效孔口面积处于其最大尺寸)的瓣膜孔口面积。例如,EdwardsLifesciences拥有外径分别为23和26mm的SapienTM可扩张假体心脏瓣膜,其分别具有约22和25mm的相应内径。因此,(此前布置的)假体心脏瓣膜的扩张后内径78b可大约为23和26mm(分别),以容纳这种可扩张假体心脏瓣膜。这相应于扩张后内径78b比扩张前内径78a大大约10至20%。因此,本发明的实施方式包括这样的假体心脏瓣膜:扩张后内径78b为扩张前内径78a的约10、15、或20%、或5-25%、10-20%、或13-17%之间。注意,本发明不限于上述扩张前后内径之间的差值。例如,可存在这样的应用:其中可需要远更小和/或远更大的扩张后内径。在一些情况下,可扩张假体心脏瓣膜的外径仅略微大于其内径,从而需要在前布置的假体心脏瓣膜内径较少扩张以容纳可扩张假体心脏瓣膜。在其他情况下,可扩张假体心脏瓣膜的外径可远大于其内径,使得需要在前布置的假体心脏瓣膜内径较多扩张以容纳可扩张假体心脏瓣膜。还可存在这样的应用:其中可期望布置内径小于或大于(此前布置的和扩张前的)假体心脏瓣膜所提供的内径的可扩张假体心脏瓣膜。注意,取决于具体实施方式,假体心脏瓣膜70可在经历扩张如来自球囊扩张导管或其他机械扩张器的扩张后恢复其扩张前内径78a。然而,扩张已使“扩张后”假体心脏瓣膜70成为大体上非刚性和/或扩张友好的构型,因此在将可扩张(例如,球囊式扩张、自扩张等)假体心脏瓣膜布置在假体心脏瓣膜70的瓣膜孔口80内时,相对容易迫使“扩张后”的假体心脏瓣膜70具有较大直径(如78b)。图3A-3D显示根据本发明的支持结构90的进一步实施方式,其中扩张部分通过一连串相互连接的撑杆92形成,该撑杆92通过铰链样连接处94首尾连接,形成具有基本上菱形单元96的Z字形手风琴样结构。在非扩张(扩张前)的构型下(图3A和3B中显示),基本上菱形的单元96处于最大高度98和最小宽度100,并且结构90限定最小尺寸的内径102。在扩张(扩张后)的构型下(图3C和3D中显示),相互连接的撑杆92已在铰链样连接处94旋转,因此基本上菱形单元96已斜向拉伸并且处于最小高度98和最大宽度100。扩张的结构90限定最大尺寸的内径102。支持结构90被期望是可塑性扩张的,从而最初在植入后和在受到正常解剖学扩张压力时抵抗扩张。到了在具有支持结构90的假体瓣膜内植入置换瓣膜时,外向球囊或其他机械扩张器的力致使相互连接的撑杆92的塑性变形,一般在铰链样连接处94。球囊或机械扩张力可通过植入在后瓣膜产生,或者在后植入的瓣膜的扩张可同时扩张支持结构90。图4A-4B显示根据本发明的支持结构110的进一步实施方式,其中扩张部分111在接合支持器113之间延伸。扩张部分111由大体上Z字形或正弦结构112形成,该大体上Z字形或正弦结构112由以蛇状格局固定在峰116处的一连串区段114形成。在图4A的非扩张(扩张前)构型下,Z字形区段114紧密压缩在一起,相邻峰116之间具有最小距离118(并且甚至可具有彼此边对边接触的相邻区段114,从而防止结构内向压缩至较小直径)。在这种构型下,支持结构110将具有最小的(未扩张的)直径。在图4B的扩张(扩张后)构型下,正弦/Z字形被牵拉成压缩较少的构型,相邻峰116和区段114彼此相隔,相邻峰116之间具有最大距离118,并且支持结构110具有最大直径。在本发明的实施方式中,如图3A-4B显示,该结构的几何和材料可被配置以使一定负荷(例如,上至1或2或甚至3个大气压的压缩和/或扩张压力)将保持材料处于其弹性区间,使得其可在受到在正常心搏周期下经历的相对小的压缩和/或扩张负荷时稍微扩张和/或压缩,但一旦这种负荷被移除就恢复其原始形状。该结构的几何和材料可被配置从而在达到一定负荷(如2、3、4、5、或6个大气压)后将发生伴有永久径向扩张的塑性变形。具有这种塑性变形下,单独的元件可“停工”,因此阻止结构的进一步径向扩张。大体上,本文的不同瓣膜支持结构被配置以通过来自支持结构内部的、大于正常施用相关力——即,与心搏周期过程中天然环面的活动相关的力——的外向扩张力,在植入后扩张。本申请公开了现有外科瓣膜的具体改造,其能够实现制造厂快速生产适应瓣膜内瓣膜(ViV)程序的瓣膜。具体地,本申请考虑翻新或改造现有外科瓣膜内的部件,以能够实现植入后扩张。这不仅转换任何经过验证的外科瓣膜以用于ViV程序,而且还减少设计和制造劳动。图5A-5D是在流动轴线132周围定向的示例性现有技术假体心脏瓣膜130的透视图和分解视图。心脏瓣膜130包括多个(一般三个)挠性小叶134,其被波状线材136以及结构支架138部分地支持。线材136可由适当弹性的金属形成,如Co-Cr-Ni合金,例如ElgiloyTM,同时结构支架138可以是金属、塑料、或两者组合。如图5B可见,相邻小叶134的外部翼片140在所谓瓣膜接合处(沿流动轴线132在流出方向突出)围绕部分结构支架138。软密封或缝合环142环绕假体心脏瓣膜130的流入端,并且一般用于将瓣膜固定至天然环面,如利用缝线。线材136和结构支架138在图中可视,但通常被聚酯织物覆盖,以有助于组装和减少植入后的直接血液暴露。图5C和5D显示组装和分解视角下的内部结构支架138。虽然图5A和5B中所示的假体心脏瓣膜130的一般特征可用于多种不同的假体心脏瓣膜,但示例的结构支架138是用于具体心脏瓣膜的结构支架;也就是说,由EdwardsLifesciencesofIrvine,CA制造的心包瓣。例如,PerimountTM系的利用心包小叶134的心脏瓣膜具有与图5C和5D十分相似的内部支架138的特征。具体地,支架138包括两个同心带——围绕内带145的外带144——的组装件。带144、145的径向尺寸与轴向尺寸相比相对较薄,并且两者具有一致的围绕圆周轴向上下起伏的下边缘。外带144呈现在三个向下弯曲的谷之间的三个截短峰,同时内带145具有大体上相同的形状,而且在接合柱146处向上延伸。向下弯曲的谷一般被称为尖突148,如图5C可见。在示例性PerimountTM瓣膜中,外带144是金属的,并且由弯折成大体上圆形并且在150处焊接的金属长条形成。相比之下,内带145由生物相容性聚合物如聚酯(PET)或DelrinTM形成,其可模塑并且也可形成条和弯折环并且被焊接(未显示)。外带和内带144、145均具有一连串通孔的特征,该通孔彼此定位使得组装件可被缝合在一起,如图5C示意性示例。内带145的线材136和接合柱146为瓣膜接合处提供挠性,其有助于减少对小叶134的生物假体材料的应力。然而,被缝合环142环绕的瓣膜130的流入端或基体包括结构支架138的相对刚性的圆形部分。金属外带和塑形内带144、145的组合展示了瓣膜的相对尺寸稳定的圆周基体,这有益于常规使用。然而,结构支架138的、为外科瓣膜提供良好稳定性的相同特征抵抗瓣膜的植入后扩张。因此,本申请考虑结构支架138的多种改造,以有助于其扩张。图6A-6B、7A-7B和8A-8B是图5A所示的能够实现心脏瓣膜在实施后扩张的现有技术假体外科心脏瓣膜130的置换结构带的三个不同实施方式的透视图、组装视图和分解视图。改造图5A的瓣膜130的结构带以扩张的一个优点是该带有些圆周地从小叶134解耦。即,当瓣膜扩张时,小叶134的外周边缘实质上保持未拉伸,因为其附接至线材136,线材136通过接合处末端的铰接作用同时扩张。因此,小叶134不需被显著拉伸以扩张瓣膜,可能致使瓣膜更容易扩张,特别是在小叶钙化并且不顺从扩张的情况下。因此,期望地,本申请实施无需显著拉伸小叶就可扩张的瓣膜。在第一实施方式中,图6A-6B示例结构支架154,其包括内带156同心地定位在外带158内。内带156和外带158的形状与图5C-5D中的相应带144、145所示相同。在与现有技术的相对刚性带相比之下,两个带156、158经改造能够实现在植入后扩张。在此实施方式中,内带156具有多个断点(breakpoint)如槽口160,该断点围绕圆周形成,使该点处的带的横截面面积减少至相对小量,该点处的带可通过从内部施加充足的外向扩张力而断裂或拉伸。例如,用于在外科瓣膜内扩张二次假体瓣膜的球囊可提供充足的外向力,导致内带156在槽口160处断裂或拉伸。内带156的材料可相对脆性,使得过度张力引起槽口160断裂,或该材料可较具延性,允许槽口160以太妃糖方式塑性拉伸。在示例的实施方式中,围绕带156在其每个尖突的中心处有三个均匀间隔的槽口160。另外,外带158包括多个手风琴样部分162,该手风琴样部分162大体上围绕其尖突部分延伸,并且在带的截短峰处被小板164分隔。板164能够实现外带158在围绕内带156的固定节点处固定,如通过利用通孔,该通孔定位以使缝线通过。组合结构支架154的扩张最终使内带154在槽口160中的一个或多个处断裂或拉伸,由于手风琴样部分162而能进一步扩张组装件。这些部分162期望地由在扩张后呈现较大形状的可塑性扩张材料形成,如不锈钢,但取决于应用带158的瓣膜的其他方面,其可只是挠性的。部分162显示为在其中间角处连接的重复菱形撑杆。图7A-7B和8A-8B是在外部支架内利用可选的可扩张区段相似地构造的。例如,图7A-7B示例结构支架166,其包括内带168——同心地定位在外带170内。内带166具有槽口,以允许其通过外向扩张而断开或拉伸。外带168具有可扩张区段的特征,可扩张区段包括多个连接的六角形撑杆。尖突中部六角形174略微长于其余六角形,使得尖突中部和接合处之间发生较大扩张。再一次,具有通孔的板176定位在每两个可扩张区段之间的接合处,并且提供将内带166锚定至外带168的点。图8A-8B中的结构支架178具有相似的内带180和改造的外带182,该外带182具有Z字形撑杆,形成可扩张区段184。再一次,处于外带182的接合处的小板186提供固定节点,如需,用于连接至内带180。图9A-9B示例可选的结构支架190,其可被替换到图5A的现有技术假体心脏瓣膜130中,以实现其植入后扩张。支架190包括如前所述的内带192和同心外带194。内带192具有直立接合处195和多个尖突的特征,每一个具有多个可扩张区段196。外带194具有尖突,其具有居中的可扩张区段198;和截短接合处200,其形状匹配内带192的接合处195的部分。可扩张区段196沿内带192的尖突布置,从而相对于外带194的实体壁部分定位。以这种方式,如图9A所示的组合的带192、194不具有穿过其中的孔,除了在接合处的对齐缝线孔201处。在示例的实施方式中,这两个带上的可扩张区段196、198各包括一对弯折撑杆,该弯折撑杆连接相邻实体壁部分的上角和下角——穿过其之间的间隙。这两个撑杆轴向地相向弯折,并且在外向力施加于各个带时将笔直延伸穿过间隙,从而增加带直径。再一次,材料可以是可塑性变形的,从而在扩张时呈现新形状,或可以只是弹性的并且允许扩张。而且,其中一个带可以是可塑性变形的,如不锈钢,另一个是塑性的,其仅随同金属带扩张并且具有一定少量缩退。图10是再进一步可选的模塑的结构支架202,用于替换到图5A的现有技术假体心脏瓣膜130中。在此实施方式中,外“带”204同心地围绕内“带”206,这两个带实际上被模塑在一起并且不可分离。支架202的连续流入(下)端包括上述交替的尖突和接合处,并且这两个“带”204、206在尖突中点处具有上槽口和下槽口208,从而能够实现支架通过外向力断裂或拉伸和扩张。更具体地,支架202的槽口208处的横截面足够大以在外科瓣膜中正常使用期间保持瓣膜形状,但又足够小以容易断裂——在例如球囊在瓣膜(支架202是其一部分)内扩张时。通孔210期望被沿支架接合处提供,以允许连接至周围的结构,如小叶、线材、或缝合环。再一次应注意,本文公开的各种可扩张区段可替换到任何所示支架或支架带中。例如,图10中的槽口208可被任何公开的可扩张区段代替,如图9B所示可扩张区段196、198的弯折撑杆。而且,虽然槽口208显示在支架202各尖突的中部,但仅可提供一个断点,如下文所示,或槽口208可位于尖突中部以外的其他位置。读者将理解多种构型和组合都可以。图11A-11F显示由内带或第一带242和外带或第二带244形成的假体心脏瓣膜的另一复合材料支持支架240。参考图11A-11B,第一带242包括单个一体件的材料,其形成本上圆形支持结构——具有3个弯曲区段246,该弯曲区段246连接在接合点248。其中一个弯曲的区段246其中部具有断开250,并且在断开250的任一侧的自由端254中钻有孔252。如图11B和11C所示,在组装时,自由端254通过缝线256如丝制4-0缝线接合在一起,缝线256穿过孔252并且固定在结节258中。注意,结节258可在第一支持结构的径向外部上形成,以有助于保持其光滑内表面。图11D显示可选构型的自由端254固定在一起的图11A的外支持带242的放大侧视图。具体地,每个自由端254具有一连串孔252,如示例三个,该孔252对齐另一个自由端的相同数量的孔。一定长度的缝线256或其他这种细丝可交错穿过孔252,如以“图8”构型,然后在结节258处打结。在测试中,图11D的安排产生约2.58atm的平均断裂压力,其范围在2.25至3atm之间。缝线/孔组合在第一带242上形成弱化点,其中在支持部分受到扩张力时缝线256将在支持部分的其余部分失效前断开。注意,其他技术和组装件可用于形成弱化部分,如焊点、薄化部分、和其他方法,如本文关于其他实施方式公开的那些。在图11A-11B显示的这个具体实施方式中,第一带242期望地由金属形成,如不锈钢或钴-铬(Co-Cr)。图11E显示根据本发明实施方式的第二支持带244。支持带244包括单个一体件材料,如聚合物,例如聚酯,形成基本上圆形支持结构——具有3个弯曲的区段260,连接在接合支持器262处。其中一个弯曲的区段260具有薄化部分264,以形成弱化部分,在受到充足扩张力时该弱化部分将在结构其余部分前失效。注意,形成弱化部分的其他方法也在本发明的范围内,如利用点焊、声波焊、缝线、和/或薄化/弱化区域。图11F显示通过将第一假体心脏瓣膜支持带242和第二假体心脏瓣膜支持带244固定到复合材料结构中而形成的复合材料假体心脏瓣膜支持支架240。支持部分242、244可通过多种技术被固定在一起,如焊接、粘合剂等。在显示的具体实施方式中,支持部分242、244通过接合点248邻近的缝线272和支持部分242、244的接合支持器262被固定在一起。注意,在此具体实施方式中,第一支持带242同心地定位在第二支持带244内,并且第二带244的弱化区域264定位在缝线256邻近、第一带242的交叠端254上,从而在第二支持带244和第一支持带242由于扩张而断开时,各个断开将位于围绕支持支架240圆周的相同位置处。在可选的实施方式中,弱化区域264可圆周地从缝线256和交叠端254移位,如围绕圆周离开从几度至完全相反(即,180度)的任意位置。第二支持带244的弱化区域264可圆周地从缝线256/交叠端254移位,但仍位于同一对接合柱262之间——缝线256、交叠端254位于该对接合柱之间。注意,第一和第二支持带242、244中的一者或两者可具有多个弱化区域,其被设计以在受到充足径向压力时失效。例如,第一支持带242可具有缝线256和交叠端254形式的单个弱化区域,并且第二支持带244具有多个弱化区域264(如3个不同的弱化区域,其中一个弱化区域位于每对接合处接柱262之间)。第一和第二支持部分的弱化区域偏置可提高该结构扩张后的结构完整性。图11G-11J显示图11A-11F所示的第一和第二假体心脏瓣膜支持带的改动,其中外带或第一带265包括上述波状尖突266和截短接合处267,并且由单个元件形成,该单个元件具有两个邻近其中一个接合处而非处于尖突的自由端268a、268b。当定位到内带或第二带269时,可利用缝线270将定位的接合处区域固定在一起,如通过利用对齐孔形成复合材料支架271,如图11J所示。在组装到假体心脏瓣膜如图5A的瓣膜130中后,支架271最初为瓣膜提供良好圆周支持,并且抵抗来自天然心搏周期力的压缩或扩张。在将来某个时间,如果瓣膜需要置换,则可将球囊或其他机械扩张器驱动至环面并插入瓣膜内限定的孔口。最后,具有自由端268a、268b的瓣膜接合处的缝线270将通过球囊的外向扩张力断开,允许瓣膜扩张。优选地,内带269由对球囊力具有相对较小阻力的聚合物制成,并且最终将拉伸甚至断裂。为促进这个过程,一个或多个小槽口272,如图11I所示,可被提供在内带269接合处的底部边缘。将断点定位在其中一个接合处具有这样的增益:允许瓣膜扩张,而不过多改变接合柱的圆周间距。即,在具有相隔120°的三个接柱(和三个小叶)的瓣膜中,例如,外带265的下部尖突266将略微滑开,内带269的尖突部分也是,但直立接柱将实质上保持在相同位置。扩张量不大到使结构扭曲,因此一次瓣膜的直立接柱将保持相隔120°,从而不干扰二次瓣膜工作或影响瓣膜窦(在主动脉瓣膜中)移动和促进流动的能力。图11J显示与缝线270联用的将两个带265、269固定在一起的不同缝合法(相对于例如图11F所示的更稳固的“Y-缝合法”)。取而代之,缝线270仅循环穿过对齐孔和围绕两带265、269的下边缘,以形成“I-缝合法”。这有助于组合支架271的扩张,因为缝线270允许两带265、269的相对移动/枢转。在测试中,图11J的I-缝合法安排产生约3.08atm的平均断裂压力,其范围在2.75至3.5atm之间。图11G-11J还示例外带265,其被改造以在植入后在身体中容易辨认。如其他部分述及,本文公开的一个有利构型是略微改造现有商品外科假体心脏瓣膜以可扩张,这减少了开发成本以及大体上限制了新组装件程序的需要。然而,可期望在植入后数年向外科医生提供简单且明确的、具体瓣膜具有扩张能力的指示。因此,可略微改造一般金属带265以具有在外部成像技术(例如,X射线、CT扫描、荧光透视、经胸超声心动描记(TTE)、或经食管超声心动描记(TEE))下可见的、表示其类型的唯一独特特征。在图11G-11J中,外带265具有在截短接合处267的峰处形成的小下陷或凹陷,其区别于常规的凸峰,如在图5A-5D的现有技术瓣膜中的带144的接合处所示的那些。这样的变化充分利用接合处区域的外带265的相对大的表面积,而不影响瓣膜功能。现有技术中用于外带265的具体金属是Cr-CO合金,其在成像中容易看到,因此带上的可辨认形状或格局可指示扩张能力。用于辨认带265可扩张的其他实施方式,与不可扩张的“常规”带相反,利用通过外部成像技术高度可见的缝线270。例如,缝线270可以是辐射不透的。另一可能性是利用元素钽作为标记,作为带265上的斑点标记、与其或与瓣膜另一部分连接的丝线、或类似物。钽高度惰性而且辐射不透,并且可被点焊至金属带265以指示瓣膜顺序或类型。再进一步的实施方式是用辐射不透的化合物形成瓣膜的可渗透元件,如添加硫酸钡至环绕带265的缝合环。考虑各种其他标记策略。图11K-11M显示第一假体心脏瓣膜支持带265上的进一步改动。图11K中的改造的外带265'包括处于其中一个尖突266'的两个自由端,其保持与若干环绕式翼片(未编号)对齐。最初相对于带轴线轴向延伸的一个自由端的翼片可在组装期间围绕另一个自由端弯折。一个或另一个自由端上的槽口或肩结构阻止带265'压缩,但该安排允许扩张,如利用瓣膜内的扩张力。在测试中,图11K中的交叠翼片构型产生约3.17atm的平均断裂压力,其范围在1至5atm之间。图11L显示另一改造的外带265”,其自由端在尖突266”处交叠;一个在另一个内侧径向滑动。代替挠性套筒,如下面图13A-13B中,缝线环绕多次,例如四次,以保持两自由端对齐。此外,小翼片(未编号)从各自由端径向向外延伸,以呈现阻止带压缩,但翼片定位并且成角以使其不会过分干扰带265”的扩张。在测试断开强度时,图11L的构型产生约3.0atm的平均断裂压力,其范围在2至4.25atm之间。图11M示例再进一步可选的带265”',其在尖突266”'处具有交叠的自由端。内自由端的小翼片向外穿过外自由端中的相似尺寸的槽,如同皮带扣。翼片可被塑形成类似于箭头,以提供勉强意义上的锁和阻止其从槽脱离。再一次,这限制了两自由端沿能够实现带扩张但阻止压缩的一个方向的相对移动。图11M中的皮带扣结构的断开强度在约6.5至8atm之间。最后,图11N显示再进一步外带265””的接合处部分,其具有聚合物铆钉,其中插塞部件A和插孔法兰B通过对齐孔固定。铆钉A/B可扣合在一起,或通过加热或超声焊接而熔融。一个改动是穿过对齐孔并且啮合带的两自由端(通过压模该端部、粘合剂或螺纹)的聚合物销或螺杆。分离端部和扩张带265””所需的力取决于所用聚合物类型。另外一种替代形式是形成可生物降解材料的铆钉A/B,其将使带在植入后保持在一起一段时期,然后溶解,能够容易实现带265””的扩张。再进一步,其中一个孔的材料可机械地变形成另一个孔,如通过压模,以提供一定干扰,该干扰在扩张力需要时可被克服。当然,这些结构的组合也是可以的,如组合皮带扣翼片/槽和环绕式翼片。现参考图12A-12D,显示再进一步可选的第一带或外带273,其可与本文公开的不同可扩张心脏瓣膜中的任一种联用。带273具有两个自由端274a、274b,其在带的其中一个尖突的区域中交叠。自由端274a、274b包括交错翼片275,其允许两个端部彼此滑开。在示例的实施方式中,一个自由端274a具有一对翼片275,其包围另一个自由端274b上的单个翼片。各翼片期望地包括扩大的头部和较细的杆,其中头部径向交叠并且啮合在具体外向扩张处。因此自由端274a、274b阻止带273收缩并且允许其有限扩张。扩张需要相对低的力以导致自由端274a、274b彼此相对滑动,并且带273期望地通过弱化尖突偶联于内带,如图11E中在244处所示。图12C和12D是收缩和扩张构型的交叠自由端274a、274b的放大视图,尽管应理解在扩张构型下这两端可完全分离。相同的交错结构可被提供于全部三个尖突或接合处,尽管尖突区域很适合该结构。在测试断开强度时,图12A-12B中的交错翼片产生约0.8atm的平均断裂压力,其范围在0.5至1.0atm之间。此外,交错翼片275的示例实施方式不应被认为有限制性,其他方式也是可以的。例如,一个自由端274a可具有三叉样翼片,其中两个外部叉在另一个自由端274b的一侧延伸,而第三个中间叉指向另一侧。这允许扩张但阻止收缩。可选地,自由端274a、274b的轴向边缘而非圆周端上的特征可被塑形以彼此啮合,从而允许扩张但阻止收缩。图12A-12B中的带273还被改造,从而在植入后通过外部成像容易在身体中辨认。具体地,弓形上凸槽(未编号)显示在各接合处,刚好在用于组装带273和内带(未显示)的孔上方。再一次,这种容易辨认的孔格局允许外科医生设计置换手术,以容易知道瓣膜内瓣膜程序是一种可能性。最后,图13A-13显示另一“滑动”啮合,其中第一带或外带276包括两个彼此相对滑动的交叠自由端277a、277b。自由端277a、277b的形状基本上为矩形,并且一个位于另一个径向内部并抵靠于其。套筒278包围自由端277a、277b,并将其径向固定在一起。套筒278期望地包括聚酯(例如,PET)收缩包装管,或可以是弹性材料,如硅胶,并且显示透明以示例配合的自由端277a、277b。参考图13C的放大图,这两个自由端277a、277b可滑开预定距离,同时仍在交叠。挠性套筒278提供最少量摩擦,但大体上只用于保持自由端277a、277b对齐。自由端277a、277b各进一步包括圆周定向的槽279,其未到达末端并且提供流体流动的路径。如图13A和13B所示,槽279从套筒278向外延伸更远,使得流体可始终进入套筒内的空间。在储存期间,槽279允许流体在交叠的自由端277a、277b之间流动,以允许灭菌。在测试断开强度时,图13A-13B的套筒构型产生约1.2atm的平均断裂压力,其范围在0.5至2.0atm之间。在具有上述铆钉A/B时,套筒278可以可生物降解,以使两自由端277a、277b在植入后保持对齐一段时间,然后降解以使带276容易扩张。图13A-13B中的带276显示再进一步辨认利用外部成像可视的特点,和表示其可扩张。具体地,三孔格局被提供在各接合处。再一次,这允许外科医生设计置换手术,以快速确认瓣膜内瓣膜程序是一种可能性。图14A和14B显示“混合”假体心脏瓣膜280的进一步实施方式,其中上方支持支架284(如图11E中的复合材料支架240)接合下方框架结构286。下方框架结构286在径向上弱于上方支持结构284,并且被配置以在受到径向扩张压力(如图14C所示的导管球囊288提供的径向扩张压力)时张开,如图14B所示。在显示的实施方式中(并且在图14C-14D中更清楚可见),下方框架结构286被裙材料290覆盖。假体心脏瓣膜280包括瓣膜小叶(未显示)以控制血液流动。假体心脏瓣膜还具有缝合环292以及张开的下方框架结构286/裙290,以协助使假体心脏瓣膜280落座在预期位置处(例如,患者的天然瓣膜环面)。关于在患者体内最初布置假体心脏瓣膜280(其中上方支持结构284处于未扩张构型)的详细内容被述及于美国专利号8,308,798,2009年12月10日提交;美国专利号8,348,998,2010年6月23日提交;和美国专利公开号2012/0065729,2011年6月23日提交;其内容被明确引入本文作为参考。假体心脏瓣膜280是“混合”的,在于上方部分类似于常规外科瓣膜构造,具有相对稳定的直径,不意图被压缩或扩张,而下方框架结构286是可扩张的,以有助于锚定瓣膜就位。一种以这种方式构造的具体商品假体心脏瓣膜是联合来自EdwardsLifesciencesofIrvine,CA的EdwardsIntuityTM瓣膜系统一起销售的假体心脏瓣膜。EdwardsIntuityTM瓣膜系统包括“混合”瓣膜,其实质上包含具有不锈钢下方框架结构的外科PerimountTM瓣膜。如述,上文关于图5A-5D描述的瓣膜部件实质上与EdwardsLifesciences销售的PerimountTM外科心包瓣膜相同,因此图6-14示例的改造能够将现有外科瓣膜转化成能够在植入后扩张的外科瓣膜。事实上,本申请的一个尤其有益的方面是公开了对现有商品外科瓣膜的具体改造,其能够在植入后扩张。因此,本申请考虑翻新或改造现有外科瓣膜内的部件,从而能够实现在植入后扩张。图14A-14F的“混合”瓣膜实施方式的一个关键特征是下方框架结构286将在受到不足以导致上方支持结构284径向扩张的扩张压力时张开,使得使用者可将假体心脏瓣膜280布置在患者体内。例如,导管球囊288可用于实现所需的下方框架结构286的张开,同时仍保留上方支持结构284的非扩张属性,从而保持瓣膜小叶开放,如图14A-14B所示。如果假体心脏瓣膜280将要失效或需要在将来置换,可将球囊导管引入患者,并且可将足以径向扩张上方支持结构284(例如,通过导致在设计的弱化区域296处失效)而且高于张开下方框架结构286所需的压力(如3个大气压或更大)的压力施加于假体心脏瓣膜280。随着导致的扩张,如图14E和14F显示,整个假体心脏瓣膜280——包括上方支持部分284和下方框架结构286——径向扩张,从而扩大瓣膜孔口294,以在其中容纳新的导管递送的假体心脏瓣膜。注意,扩张后,下方框架结构286可具有极少(如有)张开,相反,沿其长度具有大体上恒定的直径。还要注意,在另一实施方式中,球囊288可被特殊塑形(如相关的美国专利公开号2012/0065729的图38-40所示),因此可被定位以向下方框架结构286施加径向扩张压力,同时几乎不或不向上方支持结构施加径向扩张压力。在这种实施方式中,特殊塑形的仅径向扩张下方框架结构(例如,在最初植入假体心脏瓣膜280期间)的球囊可被定位以仅向下方支持部分施加压力。然后,特殊形状球囊被扩张至预期压力,如4-5个大气压,并且该压力被施加以扩张下方支持部分,但不施加于上方支持部分。之后当期望径向扩张上方支持结构(例如,在期望在现有瓣膜内布置新瓣膜时)时,可利用明显更长并且圆柱形的球囊来扩张上方和下方结构。例如,可将圆柱形球囊定位在上方和下方结构内,并且使其膨胀至4和5个大气压之间,因此径向扩张上方和下方结构。通过如下植入“混合”类型的假体心脏瓣膜,如图14A-14E中的280处显示:将其驱动到环面的位置,然后膨胀球囊或其他机械扩张器以导致下方框架结构286向外张开。虽然意图上方支持支架284保持具有恒定直径和只在以后在其中直接植入第二瓣膜时如需要时扩张,但传统圆柱形球囊的使用可能会无意地扩张或扭曲上方支架并且可能导致瓣膜故障。因此,本申请考虑暂时加固带,以防止由于最初球囊扩张对上方支架造成的任何不利效果,下文将进行说明。图15是示例性“混合”假体心脏瓣膜300的分解透视图,其具有允许植入后扩张的内部结构带组合302,并且还包括在植入后生物降解的加固带304。心脏瓣膜300的主要结构部件包括与连续波状丝线框架312连接并且被其支持的多个挠性小叶310,结构带组合302包括内带314和外带316、加固带304、和适于在植入后扩张的下方框架结构318或锚定裙。为清楚起见未显示各种布料覆盖物和界面,但其一般连同缝线一起使用,以将各部分固定在一起。再一次,挠性小叶310可以是单独小叶如牛心包小叶、或单个生物假体结构如猪瓣膜的组合。下方框架结构318优选是可弹性扩张的,如由不锈钢制成,在某种构型下也可以是自扩张的。结构带组合302期望地适于实现植入后扩张,非常类似于上述实施方式,如图6-8。事实上,示例内带314和外带316与图6A-6B所示那些相同,尽管可采用可扩张的带组合中的任一种。当将部件组装成瓣膜300时,其将类似于图14A-14F所示的瓣膜280,并且如图15A所示,图15A显示球囊扩张锚定裙步骤期间的瓣膜。再一次,这实质上与EdwardsIntuityTM瓣膜系统中的心脏瓣膜相同。除允许植入后扩张的改造外,新瓣膜300还具有可生物降解加固带304的特征。可使带304充分薄,并且形状与外带316相同,从而在完工产品中几乎注意不到。此外,通常被包括在外科植入物中的各种可生物降解的材料是已知的,因此不会引入任何问题材料。例如,应用接受的可生物降解聚合物包括聚乙醇酸交酯(PGA)、PGA/聚交酯(PLA)、PDS-聚二烷酮(PDS)、聚已酸内酯(PCL)、聚(二恶烷酮)和PGA/三亚甲基碳酸酯(TMC)。因此,改造的瓣膜300相对于EdwardsIntuityTM瓣膜系统的瓣膜包括相对小的形状系数变化。如述,图15A示例从解剖结构分离的混合瓣膜300,但显示处于植入环面如主动脉环面的时刻。瓣膜300在管状轴330如插管或导管的远端上递送。虽然未显示,可利用瓣膜支托使瓣膜300偶联至轴330。利用扩张元件332,如球囊,来扩张锚定裙或下方框架结构318,抵靠周围解剖结构。例如,可使框架结构318扩张至张开形状,其大体上共形于左心室中的、主动脉环面正下方的瓣下地貌。再一次,框架结构318期望地可塑性扩张,如由不锈钢制成,并且保持其张开形状。可选地,框架结构318可以是可自扩张的,如由镍钛诺制成,其在释放后向外扩展,并且可对周围组织施加外向偏压。而且,框架结构318可提供固定瓣膜就位的唯一方式,或其可补充有环绕瓣膜300的密封环333平均分布的少量缝线、夹子、或类似物。在任何情况下,由于消除了仅使用缝线时的上至20个结节打结步骤,植入过程的时间相对于现有外科植入大幅减少。瓣膜300的功能部分限定孔口直径d,其由于结构带组合302而相对稳定,并且意图使瓣膜无问题地工作多年。然而,如述,有时瓣膜300产生多种问题,如钙化——降低其效率。这个过程可花费数十年,但最终可必须再一次手术来修理瓣膜。改造的瓣膜300被设计以能够实现在其孔口中直接扩张置换瓣膜,该扩张拓宽了瓣膜300,而无需将其外植。因此图15B显示在植入后其中植入二次心脏瓣膜334的程序期间假体心脏瓣膜300的剖视图。二次心脏瓣膜334一般在球囊导管336的具有球囊的远端上递送,环绕球囊折压着二次瓣膜的可塑性扩张支架340。这种类型的一种具体瓣膜是EdwardsLifesciences销售的SapienTM瓣膜。如果一次瓣膜300被植入于主动脉环面中,则显示的递送是逆行的——一般采用经股进入程序,尽管也考虑顺行的经顶程序,在这种情况下递送导管336将显示从相反端进入瓣膜300。这种瓣膜也被称为“经导管”瓣膜,因为其一般在导管的端部上被引入。球囊338扩张力的强度足以不仅向外扩张二次瓣膜334以接触一次瓣膜300的内侧,而且向外扩张一次瓣膜。如参考图15所述,加固带304随时间降解,也许在植入后6个月至1年后。因此,内部结构带组合302保持维持瓣膜300的圆形形状。由于结构带组合302的可扩张特征,球囊338可使其向外扩张至较大直径D,如图15B所示。另外,如本文其他部分所述,本申请公开的任何结构带构型可被利用或改造,以作为具体结构带组合302来应用。优选地,二次瓣膜334扩张至具有与一次瓣膜300的原始孔口直径d匹配的孔口直径,这可意为一次瓣膜的外向扩张总量为2-4mm,等同于2mm增量的一个或两个瓣膜尺寸。优选地,二次瓣膜334限定的流动孔口至少等于一次瓣膜300的流动孔口,从而避免流动能力的任何下降。可塑性扩张的支架340期望地足够稳固以维持一次瓣膜300打开,不管瓣膜或周围环面生成任何退缩力。图16A-16C显示通过在假体心脏瓣膜402、408内径向扩张而布置的可扩张的经导管心脏瓣膜框架/支架400。(虽然在实际实践中将布置完整经导管心脏瓣膜,而非只是支架,但基于可视化目的仅经导管瓣膜支架400显示在图16A-16C中。)在图16A-16B中,经导管心脏瓣膜支架400被固定在本发明的假体心脏瓣膜402的环面404内。如在图16B中最清楚显示,支架400具有良好的形状,并且中央孔口404具有相对大的直径406以确保其中的良好血液流动。这种较大直径孔口通过本发明的假体心脏瓣膜402的扩张来实现。相比之下,如图16C所示,如果原来植入的假体心脏瓣膜408不可径向扩张,其将比图16B的可扩张的实施方式的情况具有更少内部空间来容纳支架400。因此,在图16C的现有技术实施方式中,在后安装的经导管瓣膜的支架400将不能扩张至大直径,并且中央孔口404将具有明显较小的直径406,并且血液流动相应减少。图17A是另一市售的现有技术外科假体心脏瓣膜440的透视图。心脏瓣膜440的主要部件包括内部聚合物支架442——在图17B中独立显示、多个挠性小叶444——一般是全猪瓣膜、和下方缝合环446——用于将瓣膜固定至环面。部件一般覆盖有织物,并且在制造过程中被缝合在一起。这种具体瓣膜440由MedtronicInc.ofMinneapolis,MN销售,其商品名为HancockITM或HancockIITM和MosaicTM和MosaicUltraTM。内部聚合物支架442提供瓣膜440的主要结构骨架,并且包括薄壁管状元件——其中下方圆形带448围绕支架外周延伸、和多个直立接合柱450。如其他常规瓣膜,具有三个接合柱450,每个支持两个相邻小叶的边缘。支架442的聚合物材料挠性充足以能使接合柱450在心动周期期间略微内外挠曲,这使一定应力从小叶444解除。然而,常规支架,如聚合物支架442,被设计以为瓣膜440保持尺寸稳定性,因此充分坚固,使得其不能被球囊扩张。事实上,HancockII心脏瓣膜包括嵌入的钛环(未显示),该钛环进一步增加其扩张阻力。因此,现有技术瓣膜440在其失效时必须被外植,从而能够引入置换瓣膜。为避免这种情况,本申请考虑对聚合物支架442的多种改造,该改造能够使其被球囊扩张,使得瓣膜440无需外植。因此,图18A-18D是图17B的内部支持支架442的、能够实现图17A的心脏瓣膜440在植入后扩张的改造的透视图。这些实施方式均消除了嵌入HancockIITM瓣膜的钛环,但仍可使用围绕支架外周的不连续的分段环。为清楚起见,给予图18A-18D的四个不同实施方式中的相似元件相同编号。在图18A中,内部支持支架452与现有技术支持支架442基本上相同,但包括位于下方圆形带部分456的尖突中部区域的槽口454。“尖突中部”位置在直立接合柱458中间。这些槽口454处的带部分456的横截面面积的减少因此产生薄弱点,该薄弱点将在二次假体心脏瓣膜在一次瓣膜内扩张时失效。如上所述,支持支架442的材料可相对脆性,使得过度张力导致槽口454断裂,或该材料可更具延性,允许槽口454以太妃糖方式塑性拉伸。生物相容性聚合物的各种制剂已知具有这些不同的物理性质。图18B显示内部支持支架460,其在下方圆形带部分456的尖突中部位置处配置有可扩张区段462。在示例的实施方式中,可扩张区段462类似于上文关于图9A-9B描述的可扩张区段196、198。更具体地,可扩张区段462期望地包括一对弯折撑杆,该弯折撑杆对连接相邻实体壁部分的上角和下角(穿过其之间的间隙)。两个撑杆轴向地相向弯折,并且在外向力施加于各个带时变直以笔直延伸穿过间隙,从而增加带直径。该材料可以是可塑性变形的,从而在扩张时呈现新形状,或可只是弹性的,从而允许扩张。图18C示例进一步的支持支架464,其沿着下方圆形带部分456的各尖突部分具有两个可扩张区段466。各接合柱458之间两个可扩张区段466的提供能够实现支架464较大外向扩张,或只是围绕较大圆周跨度分配扩张。最后,图18D显示支持支架468,其下方圆形带部分456中具有可扩张区段470,该可扩张区段470包括一连串菱形撑杆,类似于图6A-6B的实施方式中所示的手风琴样部分162。事实上,图6-8显示的任何可扩张区段都可以替换可扩张区段470。再一次,支架468的材料可以是可塑性扩张的,或可以是与现有技术支架442相同的聚合物材料,其中可扩张区段470仅允许其在植入后扩张。此外,联合图18A-18D公开的任一种支架实施方式,并且事实上联合本文公开的另一种支架实施方式,可生物降解的加固带,如参考图15显示的加固带,可被包括用于在植入后最初的支持。这种加固带将在最初组织共生(overgrowth)时期保持瓣膜的尺寸稳定性,其后,改造的支架将为瓣膜提供充足结构支持,即使其现可通过球囊或其他这种扩张器来扩张。图19A是另一市售的现有技术外科假体心脏瓣膜472的透视图,其外部上具有生物假体组织小叶474。支持小叶474的内部支持支架476显示在图19B的部分拆解视图中。心脏瓣膜472还包括缝合环478和不同的织物覆盖物,以协助将部件缝合在一起。这种瓣膜作为TrifectaTM带支架组织瓣膜被St.JudeMedical,Inc.ofSt.Paul,MN销售。TrifectaTM瓣膜中的内部支持支架476由抗疲劳高强度钛合金形成。在组装过程中,通过如下形成支架476:激光切割,电抛光,然后用织物覆盖支架,附接至缝合环478,然后小叶474。接合柱479中的钛支架476可略微挠性,但坚固地抵抗径向扩张。这是对于外科瓣膜如TrifectaTM瓣膜是优点,因为其提供良好的尺寸稳定性。然而,如果瓣膜功能恶化并且必须置换瓣膜,必须先将其从身体切除,然后才可植入二次瓣膜。因此,本申请公开了改造Trifecta瓣膜的支架476以允许其在植入后扩张的解决方案。这时应注意,指代心脏瓣膜的内部结构支持的术语“支架”是技术术语,代表大体上对瓣膜小叶提供圆周或环支持的任何结构元件。有时这种元件被称为框架,或简称为支持元件,并且应理解术语支架包括多种构型,无论如何命名。图20A-20D是能够实现图19A的TrifectaTM瓣膜在植入后扩张的、图19B的内部支持支架476的改造的透视图。在图20A中,改造支架480具有位于各尖突区域中部的三个打孔线482的特征。具有改造支架480的瓣膜的外向扩张将导致支架在打孔线482中的一个或多个处断裂,因此允许二次瓣膜在一次瓣膜内扩张。在图20B中,围绕改造支架486的外周提供一连串可扩张区段484,从而能够实现植入后扩张。TrifectaTM瓣膜支架476和图20A-20D中显示的改造支架,通过下部圆形带488的框架形成,该下部圆形带488通过多个轴向撑杆492在结构上连接于上部波状带490。例如,在各尖突区域的中点有三个轴向撑杆492a,并且轴向撑杆492b位于直立接合柱494侧面。上部波状带490限定三个直立接合柱494,在三个向下弧形尖突之间。期望地,有三个单独的可扩张区段484位于下部圆形带488中的各对轴向撑杆492b之间和外侧,如图20B所示。换句话说,可扩张区段484集中在接合柱494下方,并且围绕支架486外周短距离延伸。施加于具有改造支架486的瓣膜的外向扩张力将导致可扩张区段484外拉,而且将使接合柱494处的波状带490向外弯折,如移动箭头所示。虽然未显示,各可扩张区段484上方的波状带490也可以是可扩张的。这种构型有助于保持瓣膜在其有效期内的结构完整性,但仍在以后某个时间提供扩张能力。现参考图20C和20D,改造支架496、498包括围绕其外周的槽口,该槽口提供弱化或断裂点,从而能够在植入后扩张支架。在图20C中,在尖突中点处提供三个槽口500,下带488和上带490大体上在此汇合。可选地,图20D中的支架498包括三个槽口502,其位于下带488中并且接合柱494下方。因此包含支架498的瓣膜的扩张将导致一个或多个槽口502断裂和支架接合柱扩张,如移动箭头所示。图21A显示再进一步市售的现有技术外科假体心脏瓣膜504,其具有两个可拆卸部件——瓣膜小叶子组装件505和对接或基体元件506。图21B显示这两个部件偶联在一起以形成功能性假体心脏瓣膜504。这些附图代表VitalityTM或VXiTM两件式心脏瓣膜系统,由ValveXchange,Inc.ofGreenwoodVillage,CO销售。瓣膜小叶子组装件505包括多个挠性小叶507,其被安置于框架,该框架包括位于接合处区域的连接件508。基体元件506主要包括管状支架509,该管状支架509具有直立接合处510。VitalityTM瓣膜中的管状支架509是生物相容性聚合物。小叶子组装件505的连接件508包括用于配合直立接合处510上的相应结构从而形成如图21B所示的最终的两件式瓣膜组装件504的结构。该系统被设计以首先植入基体元件506——如通过将其在环面处缝合就位,然后驱动小叶子组装件505就位,和偶联连接件508与接合处510。在将来,如果瓣膜504变得机能不全或功能减少,可在基体元件506保持就位的同时移除小叶子组装件505并用新组装件将其置换。然而,虽然这种构型无需切除完整瓣膜,但去除原始小叶子组装件505和连接新组装件的程序相对复杂。取而代之,本申请考虑改造基体元件506,以使其能够在植入后通过经股或经顶推送的二次可扩张的心脏瓣膜来扩张。图22A-22C示例能够实现图21A的两部分心脏瓣膜504的基体元件506在植入后扩张的、图21B的内部支持支架509的若干改造。例如,图22A显示改造的支架511,其包括一个或多个(显示两个)环形加固细丝512,该环形加固细丝512嵌入支架材料并且环绕其下部。在大约尖突中部位置提供支架511的三个可生物降解壁区段513。最初,支架511功能与现有技术基体元件506的支架509相同,并且在最初组织向内生长期间具有充足圆周强度以保持尺寸稳定性。在体内一定时间后,壁区段513降解,但加固细丝512的存在保持支架511的环状。如果小叶子组装件开始磨损,则可驱动二次可扩张假体瓣膜在两件式瓣膜内就位,并使其向外扩张,由此细丝512将断裂,允许支架511扩张。这无需去除小叶子组装件。图22B示例另一种改造支架514,其形状与原始支架509几乎相同,并且由相同材料制成。在尖突中点,支架514包括弱化区域515,其中壁的径向厚度逐渐减少至允许其在支架内的球囊扩张后破裂或拉伸的量级。支架514的聚合物材料可相对脆性,以使弱化区域515断裂,或材料可具有延性,允许弱化区域515塑性拉伸。再一次,这提供小叶子组装件整个寿命内的良好尺寸稳定性,但允许在两件式瓣膜内引入二次可扩张瓣膜,而非置换小叶子组装件。最后,图22C显示的可选支架516包括位于尖突区域的三个可生物降解的索区段517。更具体地,索区段517从支架516的接合处到其在尖突中点的最大轴向尺寸越来越大幅地变细,以形成微笑形状。支架516和索区段517的整体形状与现有技术支架509相同。然而,在体内一定时间后,索区段517降解,留下相对小横截面尖突桥来连接支架516的接合处,该相对小横截面尖突桥容易在其中扩张球囊的膨胀后断裂或拉伸。再一次,取决于支架516的聚合物材料的性质,尖突桥将断裂或塑性拉伸。因此,当小叶子组装件恶化时,可将二次可扩张瓣膜引入两件式瓣膜内并扩张,在这个过程中支架516断开。注意,对上文引用的实施方式有很多改动,包括不同实施方式的多种组合,其全部在本发明的范围内。一个实施方式的区段可与其他实施方式的可扩张部分组合。而且,具体支持结构可具有上述可扩张部分的任意组合。图23A显示可扩张假体心脏瓣膜布置导管520,其被配置用于(现有)假体心脏瓣膜扩张和(置换)可扩张假体心脏瓣膜布置。布置导管520具有伸长主体522、近端524和远端526。近端524包括手柄528。远端526包括扩张球囊530,其上安置可扩张假体瓣膜532。在显示的具体实施方式中,可扩张假体瓣膜532包括支架534。远端526还可包括一个或多个辐射不透标记533或类似可视性标记以在利用荧光透视或其他观察技术时提高患者体内的装置可视性。图23B-23D显示可扩张假体心脏瓣膜532在已在前布置有假体心脏瓣膜518的心脏瓣膜环面536内的布置。在前布置的假体心脏瓣膜518可利用任何方法布置,包括本领域当前已知的方法,如传统(开胸)手术、微创(例如,关键孔)手术和经皮手术。根据具体应用,在前布置的假体心脏瓣膜518可在如图23B-23D所示布置可扩张假体心脏瓣膜532前数年、数日、数小时或前夕被布置在患者体内。图23B显示图23A的可扩张假体心脏瓣膜布置导管520,其中远端526被驱动使得扩张球囊530和可扩张假体心脏瓣膜532位于患者心脏540中的在前布置的假体心脏瓣膜518内。如在前布置的假体心脏瓣膜518的横截面所示,显示大体上刚性和/或抗扩张的支持框架538。在图23B显示的具体实施方式中,布置导管520已在引导丝542上驱动,该引导丝542被伸到患者的心脏540和在前布置的假体心脏瓣膜518中,然后再将布置导管520驱动到患者体内。注意,引导丝542的使用是任选的。另外或代替引导丝,也可使用其他引导装置。例如,可使用引导导管,其中将引导导管伸到患者体内预期位置,然后在引导导管内部将布置导管驱动到患者体内,直到布置导管的远端从引导导管的远侧开口伸出。也可在无任何类型的引导丝或引导导管的情况下使用布置导管,使得布置导管被独自引导到预期治疗位置中。如图23C所示,在扩张球囊530和可扩张假体心脏瓣膜532在心脏瓣膜环面534和在前布置的假体心脏瓣膜518内适当定位后,使扩张球囊530扩张。扩张球囊530的扩张迫使支架534向外扩张,并且迫使在前布置的假体心脏瓣膜518的小叶544抵靠心脏瓣膜环面536。使扩张球囊530扩张的力还使在前布置的假体心脏瓣膜518和心脏瓣膜环面536扩张,迫使在前布置的假体心脏瓣膜518的支持框架538扩张。在图23D中,扩张球囊530紧缩或直径减少,并且新的可扩张假体瓣膜532被布置在心脏瓣膜环面536和在前布置的假体心脏瓣膜518中,而且被支架534固定就位。来自扩张支架532的外向压力,连同来自心脏瓣膜环面536和来自在前布置的假体心脏瓣膜518的任何弹性部分(如核、带和/或覆盖物)或来自在前布置的假体心脏瓣膜小叶544的内向压力,组合以使新的可扩张假体瓣膜532稳固地落座在心脏瓣膜环面536和在前布置的假体心脏瓣膜518中的预期位置。然后可将具有扩张球囊530的布置导管520从心脏540撤出,留下新的可扩张假体心脏瓣膜532处于患者体内并且在前布置的假体心脏瓣膜518内的布置位置。在本发明的进一步实施方式中,在与可扩张假体心脏瓣膜532的布置分离的步骤中扩张在前布置的假体心脏瓣膜518。图24A显示可扩张假体心脏瓣膜布置导管520,其被配置用于利用两个单独的球囊(更具体地,远侧球囊530a和近侧球囊530b)进行的、在前布置的假体心脏瓣膜扩张和可扩张假体心脏瓣膜布置(展开,deployment)。远侧球囊530a被配置以布置位于远侧球囊530a上的新的可扩张假体瓣膜532,而近侧球囊530b被配置用于扩张在前布置的假体心脏瓣膜518。图24B-24D显示利用近侧球囊530b的在前布置的假体心脏瓣膜518和瓣膜环面536的扩张。在图24B中,布置导管520已前进到心脏530中,并且远侧球囊530a(其上具有可扩张假体瓣膜532)前进越过在前布置的假体心脏瓣膜518,并且近侧球囊530b位于在前布置的假体心脏瓣膜518和瓣膜环面536内。膨胀或扩张近侧球囊530b,如图24C所示,从而扩张在前布置的假体心脏瓣膜518和瓣膜环面536。使在前布置的假体心脏瓣膜518的支持框架538扩张和/或呈现大体上非刚性的构型,类似于之前关于上文在图24C中讨论的扩张所讨论的变化。在在前布置的假体心脏瓣膜518扩张后,使近侧球囊530b紧缩或直径减少,如图24D所示。然后可将布置导管520从患者撤出,直到近侧球囊530b处于在前布置的假体心脏瓣膜518近侧并且远侧球囊530a位于在前布置的假体心脏瓣膜518内。远侧球囊530a将以与图23B中关于球囊530所示类似的方式位于在前布置的假体心脏瓣膜518内。然后使远侧球囊530a扩张,以与图23B-23D中所讨论和显示的方式实质上相同方式布置可扩张假体瓣膜532。远侧球囊530a将用于布置新的可扩张假体瓣膜532,并且也可用于进一步扩张在前布置的假体心脏瓣膜518和/或天然瓣膜环面536。注意,在可选的实施方式中,利用两个单独的导管来扩张在前植入的假体瓣膜。第一球囊导管是传统扩张导管,其被驱动到患者体内在前布置的心脏瓣膜内的位置处。将第一球囊导管的球囊扩张至足以扩张(径向扩张)在前植入的假体瓣膜的预期压力(例如,4-5atm)。然后将第一球囊导管从患者撤出,并将第二球囊导管(如图23A-23D所示的第二球囊导管)以及其上的球囊和新的可扩张假体心脏瓣膜驱动到患者体内,扩张球囊以在在前植入的(并且现扩张的)假体心脏瓣膜内布置新的可扩张假体心脏瓣膜,并且将第二球囊导管从患者撤出。注意,可扩张假体瓣膜可以是自扩张型,在这种情况下布置导管可不具有扩张球囊,如图23A–23D和24A-24D所示。此外,这种自扩张型假体心脏瓣膜可在有或无在前布置的假体心脏瓣膜的之前扩张的情况下被布置。例如,自扩张型假体心脏瓣膜可提供充足的外向径向力,以扩张在前布置的假体心脏瓣膜和/或保持现已扩张的在前布置的假体心脏瓣膜处于扩张构型,从而为扩张构型的自扩张型假体心脏瓣膜提供充足空间。为使瓣膜内瓣膜程序成功,一次外科瓣膜的内径和二次可扩张瓣膜的外径之间需要干涉配合或一些其他锚定形式。在这两个瓣膜之间无充分锚定的情况下,二次瓣膜可由于施加于瓣膜的闭合流体压力而轴向迁移。这在大尺寸的可扩张的瓣膜,例如29mm,在29mm或更大外科瓣膜内布置(展开)时尤为重要。通过这种组合,可能没有足够的摩擦以在一次瓣膜内固定二次瓣膜。因此,本申请考虑使改进的适配框架位于这两个瓣膜之间,以确保锚定良好。图25A和25B分别是示例性管状适配框架600的透视图和平面顶视图,其具有倒钩602,该倒钩602增强新植入的可扩张的瓣膜对在前植入的瓣膜的锚定。在示例的实施方式中,上端604是流出端,而下端606是流入端。如述,适配框架600被驱动到体内,并且在扩张二次可扩张瓣膜前向外扩张以接触一次外科瓣膜。倒钩602有助于提供稳定性和迁移阻力。在优选的实施方式中,存在向内和向外朝向的倒钩602,如下文描述。在图25A显示的实施方式中,适配框架600包括可扩张的撑杆栅格,其可采用多种构型。例如,撑杆可包括一连串大体上轴向定向的蛇状区段612,一个单独显示在图25C中,具有连接至相邻区段612的自由端614和中间顶点615。蛇状区段612的组装件限定处于两端604、606和两端604、606之间的连接点的圆周行列。在示例的实施方式中,两端604、606之间的适配框架600的主体中的相邻轴向定向区段612之间有四行连接点。当然,蛇状区段612中的曲线间距和总长度可被调节,以使连接点的行数可改变。显示的示例性实施方式具有24个单独的蛇状区段612,其具有两行每行12个上倒钩602a和两行每行12个下倒钩602b。图25A显示外向定向的倒钩602a,其从流出端604的连接点以及从相邻行的连接点延伸。各倒钩602a包括线性区段,其从相应连接点朝向具有小向外弯曲自由端的流入端606延伸。意图外向定向的倒钩602a与周围外科瓣膜的小叶和接合柱接合。相反,多个内向定向的倒钩602b从流入端606的连接点以及从相邻行的连接点延伸。意图内向定向的倒钩602b与二次可扩张瓣膜的框架撑杆接合。再一次,各倒钩602b包括线性区段,其从具有小内向弯曲自由端的相应连接点延伸,但此时倒钩朝向流出端604。以这种方式,倒钩不延伸越过流出或流入端604、606。然而,任选地,提供一连串内向定向的倒钩602c,其从流出或流入端604、606中的一者或两者延伸。例如,显示多个倒钩602c,其从流入端606上的相隔连接点(共六个)延伸。处于602c的这种额外行的倒钩期望地处于二次可扩张瓣膜底部下方,并且在主动脉植入的情况下将充当“安全停止器”,以防止二次瓣膜迁移到左心室中。应理解,管状框架600本身可在这两个瓣膜之间提供充足摩擦,使得倒钩不是必需的。如果使用倒钩,则其可以内向定向、外向定向、或两者。可在一端提供内向定向的倒钩,和在另一端提供外向定向的倒钩,如图25A所示,或其可遍及框架600散布。在优选的实施方式中,在框架600的流入端提供内向定向的倒钩,和在流出端提供外向定向的倒钩。图26是流出端604邻近的可选的管状适配框架620和流出端604的一部分,该流出端604具有多个水平定向而非垂直定向的倒钩。沿第一圆周方向(向左)定向的第一连串倒钩622从流出端604邻近的撑杆之间的那行连接点延伸。沿相反圆周方向(向右)定向的第二连串倒钩624从远离流出端604的下一行连接点延伸。再一次,处于622、624的这些倒钩可具有,该自由端向内或向外弯曲,但期望地在流出端604邻近向外弯曲。管状适配框架600可被覆盖在织布中,以有助于防止血液通过蛇状撑杆之间限定的开放单元渗漏。优选地,使用摩擦系数高的织布。另外,在内侧或外侧上也可使用绒型织布,以进一步有助于防止渗漏。另一可能性是将管状框架600包覆在软质聚合物如硅酮中,使得金属撑杆被覆盖,以减少血液相互作用和潜在地增加保留因数。管状适配框架600的壁厚和直径可因一次外科瓣膜和二次可扩张瓣膜的特定组合而异。例如,如果在29mm外科瓣膜内植入29毫米可扩张瓣膜,则壁厚可以为约0.5mm,并且框架扩张状态的外径为约28mm。关于置于31mm外科瓣膜内的29mm二次可扩张瓣膜,壁厚可增加至约1.0mm,并且扩张状态的框架600具有约30mm的外径。图27A-27C示意性地示例适配框架600用于在前植入的或一次假体心脏瓣膜650和二次可扩张瓣膜652之间的顺序。图27A显示一次心脏瓣膜650被植入主动脉环面AA。在示例的实施方式中,显示心脏瓣膜650是由EdwardsLifesciencesofIrvine,CA制造的改造的PerimountTM瓣膜,但其只是多种其他外科瓣膜的代表,如本文其他部分说明。外科瓣膜650被改造以能够实现在植入后扩张。瓣膜650一般包括缝合环654,缝线(未显示)穿过其中以使瓣膜固定至环面AA。球囊导管660以逆行方式从升主动脉向下延伸,直到其上具有适配框架600的球囊662正好位于瓣膜650内。显示适配框架600的轴向高度长于瓣膜650的实际高度,虽然较短的框架也可有效使用。图27B示例球囊662的外向扩张,导致管状适配框架600相应扩张,进而使外科瓣膜650向外扩张。在优选的实施方式中,球囊662的扩张量级足以导致外科瓣膜650向外扩张,直到适配框架600的内径至少与外科瓣膜原内径同大。更优选地,球囊662使框架600向外扩张,使得框架内径大于外科瓣膜原内径,从而能够随后扩张其所在的二次瓣膜并且以孔口尺寸与原瓣膜相同告终。最后,图27C显示已经向外扩张至与管状框架600内表面亲密接触后的二次可扩张瓣膜652。这有效地将框架600夹在两个瓣膜之间,产生另外的界面和增强的保留力,和减少迁移可能性。这对于较大尺寸的外科瓣膜尤其有用。再一次,扩张瓣膜652限定的孔口期望地至少与外科瓣膜650的原内径同大。二次瓣膜652可如示利用球囊670扩张,或通过机械扩张器扩张。可选地,二次瓣膜652可以是自扩张型,其中适配框架600是可塑性扩张的,从而提供稳固的力保持一次外科瓣膜650处于其扩张构型。自扩张型二次瓣膜652因此亲密接触管状框架600,并且其间的摩擦接触可通过上文关于图25-26描述的倒钩补充。有利地,适配框架600可折压成相对小的直径,并通过小导管递送。基于较小的轮廓,适配框架600及其递送系统可被整合到现有二次瓣膜递送导管系统中。在这种情况下,可驱动整个递送系统以对齐适配框架600与现有外科瓣膜650,布置框架600,然后利用该递送系统驱动和在框架内布置二次可扩张瓣膜652。这一切减少程序时间。如述,框架600可以是可塑性扩张的,如不锈钢或钴-铬合金,或自扩张的,如镍钛诺。在后一情况下,一连串环和绳可用于框架600的远端,以在其被推出导管时控制扩张。然而,可使框架600的外向弹簧力相对较低,因为其稍后将被二次瓣膜652夹住,在这种情况下框架不具有很大的“跳”出导管的倾向。自扩张型适配框架600甚至可由适当的聚合物制成,因为弹簧常数要求相对较低。虽然已参考具体实施方式对本发明进行描述,但要理解可进行不同变动和另外的改动,并且其元件可被等同形式替换,而没有脱离本发明的范围或其发明思路。另外,可进行很多种改造以使具体情况或装置适应本发明的教导,而没有脱离其实质范围。因此,本发明意图不限于本文公开的具体实施方式,相反本发明将包括所有落入所附权利要求范围的实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1