逆转肿瘤多药耐药的基因组合物‑h‑R3/PAMAMG5/GCSsiRNA及其应用的制作方法与工艺
逆转肿瘤多药耐药的基因组合物-h-R3/PAMAMG5/GCSsiRNA及其应用技术领域本发明涉及生物技术领域,尤其涉及一种逆转肿瘤多药耐药的基因组合物-h-R3/PAMAMG5/GCSsiRNA及其应用。
背景技术:
多药耐药(multidrugresistance,MDR)是指肿瘤细胞对一种抗肿瘤药物出现耐药性的同时,对结构和作用机制不同的多种抗肿瘤药物产生交叉耐药性,从而大大降低了抗肿瘤药物的疗效。MDR形成机制复杂,肿瘤细胞可以通过不同途径导致MDR的产生。肿瘤细胞多药耐药的产生成为目前肿瘤化疗失败的一个主要原因,据美国癌症协会估计,90%以上肿瘤患者死于不同程度的耐药。因此,如何成功逆转肿瘤多药耐药也已成为目前肿瘤治疗领域中亟待解决的重要问题[vanVlerkenetal.,2008]。GCS基因(Glucosylceramidesynthase,葡萄糖神经酰胺合成酶)近来被发现其高表达与肿瘤MDR密切相关。GCS是一种葡萄糖转移酶,参与神经酰胺的代谢,可催化UDP-glucose上的糖基转运到神经酰胺生成葡萄糖神经酰胺(glucosylceramide,GlcCer),使细胞逃避神经酰胺介导的凋亡作用而产生MDR。神经酰胺是鞘脂类代谢的主要分子,在诱导细胞凋亡中起着重要作用,是介导细胞凋亡的第二信使,它在多种信号转导过程中发挥广泛的作用,其糖基化代谢产物GlcCer是细胞合成其他鞘糖脂的前体物质,它与肿瘤细胞的生物学行为密切相关,不仅维持着细胞的正常结构功能,还参与了细胞增殖、分化及肿瘤细胞的多药耐药。GCS为神经酰胺糖基化的限速酶,具有底物特异性,对MDR的产生有重要作用。抑制GCS延缓神经酰胺糖基化,增加细胞内神经酰胺的含量已成为逆转MDR的有效策略。随着肿瘤细胞MDR分子机制研究的不断深入,克服MDR的方法研究也取得了较大进展,目前研究较多的是化学合成抑制剂和基因治疗。化学合成的抑制剂能够增加肿瘤细胞对化疗药物的敏感性,但这些药物在临床应用中特异性不高、毒副作用严重,难以达到逆转MDR的有效血浆浓度,并且肿瘤细胞也可以对这些药物产生耐药性,其临床应用受到限制。目前逆转肿瘤多药耐药的基因治疗方法主要集中在:1)抑制P-gp药泵功能(Linetal,2003);2)干扰MDR相关基因的表达,如MDR1基因的反义寡聚脱氧核糖核酸(AOD),MDR1和MRP基因的反义RNA联合抑制,切割MDR1mRNA的核酶(Stuartetal2000;Wangetal,2003;Hueskeretal,2002);3)针对MDR1基因调节的基因治疗(Efferthetal,2001);4)mdr1/siRNA的RNA干扰(Hannonetal,2002;Yagueetal,2004)。与反义寡核苷酸、反义RNA和人工转录因子相比,siRNA的应用前景最好,其它均存在体内特异性不强、转染效率和稳定表达不足等问题。尽管siRNA相比于反义寡核苷酸、反义RNA等具有较好的应用前景,但具有核酸和小分子化合物的双重特性的siRNA,其本身的亲水性和阴离子特性使其很难通过细胞膜,而且由于易被核酸酶(RNase)降解导致其具有稳定性差、半衰期短、转染效率低等特点。因此应用siRNA分子的关键是如何使其有效地穿过细胞膜,进入细胞质中的RNAi通路。而且将siRNA分子导入生物体内治疗疾病更为复杂,除了细胞膜障碍外,还要克服靶细胞的选择性、体内siRNA分子的稳定性、动态平衡的机制以及对非靶细胞的毒性等问题。因此,siRNA是否能够有效递送是其能否应用于临床的关键,设计和合成安全、高效、靶向的siRNA递送载体已经成为目前siRNA药物研究的重要方向。新型树枝状高分子聚酰胺-胺(PAMAM),以其独特的分子结构和表面性质,成为了治疗性基因载体研究的热点。以末端为胺基的PAMAM树枝状大分子为例,它在生理pH条件下具有很好的溶解性,其正电性的特征可以实现更多数量基因的运载,而且体系稳定,能够保护目的基因不受体内血浆或组织细胞中各种酶的破坏,因而可以实现体内的有效转染[Proc.Natl.Acad.Sci.USA,93:4897-4902]。但PAMAM作为基因递送载体在体内应用尚存在以下几个问题需要解决:1)转染效率相对较低;2)在体内环境下,PAMAM可以非特异性的结合大量的负电大分子和红细胞,影响转染效率并且发生溶血现象;3)如何实现PAMAM纳米基因递送系统的靶向性。为了解决上述问题,目前研究多直接在PAMAM分子上进行修饰,如在PAMAM表面修饰鸟氨酸等残基[IntJPharm,2010,392:294–303],增强PAMAM分子表面正电性以增强转染效率,但此方法在增强过多正电性的同时,也提高了细胞毒性;另一方面,对PAMAM表面修饰PEG[Nanotechnology,2009,20:105-103],以提高生物相容性,减少非特异性的结合血浆中的负电大分子和红细胞,另外,在PEG末端修饰特定蛋白如乳铁蛋白[Biomaterials,2008,29(2):238-246],以实现组织靶向性,但PEG的修饰增加了PAMAM分子和DNA分子结合的空间位阻,降低了转染效率。表皮生长因子受体(EpidermalGrowthFactorReceptor,EGFR)是一种具有酪氨酸激酶活性的生长因子受体,在正常细胞表达率低,而在多种肿瘤如肺癌、大肠癌、肾癌和头颈部鳞癌等多种肿瘤细胞中存在过度表达。EGFR信号通路在癌症的发生发展中起着重要作用,EGFR的异常表达常与恶性肿瘤的特征如细胞增殖、免疫逃避、转移复发、肿瘤血管形成以及化疗抗拒、不良预后等相关,为以EGFR为靶点的肿瘤治疗和针对EGFR信号转导通路的信号转导干预治疗提供了理论基础和实验依据。目前以EGFR为靶点的肿瘤治疗方式中单克隆抗体为常见治疗方法,EGFR单克隆抗体与内源性配体竞争结合EGFR,通过抑制酪氨酸激酶的激活、促进EGFR内化等作用产生抗肿瘤效应,也可与抗癌药物或毒素相偶联,从而达到特异性抑制肿瘤生长的目的。例如,尼妥珠单克隆抗体(Nimotuzumab,h-R3)为抗人EGFR人源化单克隆抗体(mAb),具有人源性、高选择性和半衰期长的特点,能够竞争性抑制内源性配体与EGFR的结合,抑制EGFR的酪氨酸激酶活性,阻断由EGFR介导的下游信号转导通路。体内外研究表明,h-R3有抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,抑制肿瘤血管生成以增加放化疗敏感性的作用[ExpertRevAnticancerTher,2003,3(3):367-380;LungCancer,2013,79(3)270-275]。
技术实现要素:
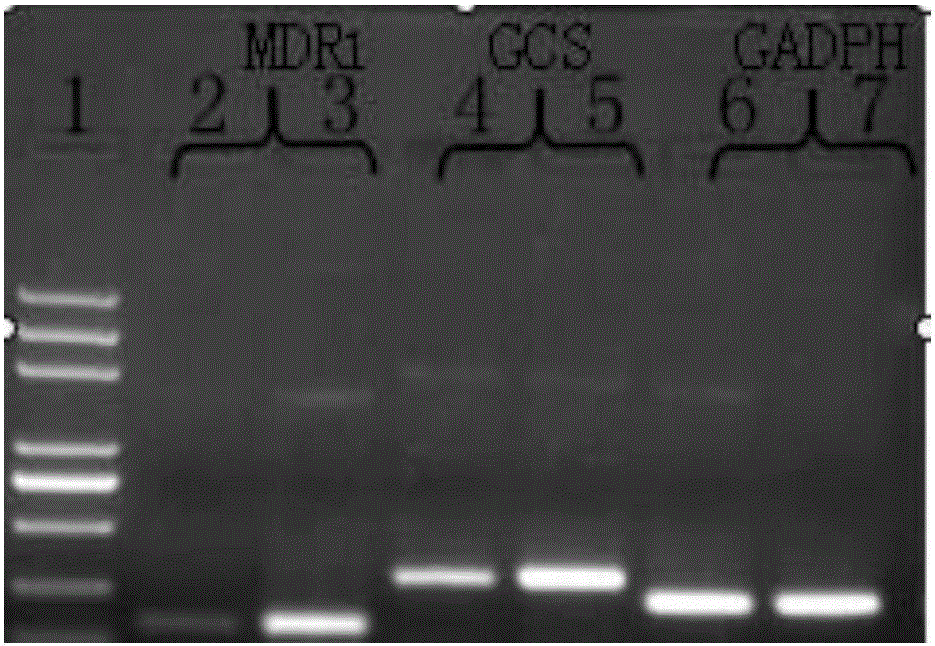
本发明的一个目的是提供一种用于抗肿瘤多药耐药的组合物。本发明提供的组合物,由末端带有氨基的聚酰胺-胺树枝状聚合物、尼妥珠单抗h-R3和GCSsiRNA复合制成。GCSsiRNA,购自圣克鲁斯生物技术(上海)有限公司,由siRNA-A、siRNA-B、siRNA-C三种siRNA组成,siRNA-A由如下两条单链组成,正义链CAAGAAGGCAACUGACAAAtt(序列1);反义链为UUUGUCAGUUGCCUUCUUGtt(序列2);siRNA-B由如下两条单链组成,正义链GAACUUCACAUCCAAGAUAtt(序列3);反义链为UAUCUUGGAUGUGAAGUUCtt(序列4);siRNA-C由如下两条单链组成,正义链CAGUUUCAAUCCAGAAUGAtt(序列5);反义链为UCAUUCUGGAUUGAAACUGtt(序列6)。上述的组合物中,所述聚酰胺-胺树枝状聚合物的数均分子量为28824.81。上述的组合物中,所述聚酰胺-胺树枝状聚合物与所述GCSsiRNA的氮/磷比为1:1-40:1。上述的组合物中,所述聚酰胺-胺树枝状聚合物与所述GCSsiRNA的氮/磷比为20:1。上述的组合物中,所述尼妥珠单抗h-R3与所述GCSsiRNA的质量比为0.05:1-5:1。上述的组合物中,所述尼妥珠单抗h-R3与所述GCSsiRNA的质量比为0.05:1、0.1:1或0.5:1。本发明的另一个目的是提供一种制备上述的抗肿瘤多药耐药组合物的方法。本发明提供的方法,包括如下步骤:将末端为氨基的聚酰胺-胺树枝状聚合物的水溶液与GCSsiRNA混合后,孵育条件下自组装形成聚酰胺-胺树枝状聚合物与GCSsiRNA的组合物;再将所述聚酰胺-胺树枝状聚合物与GCSsiRNA的组合物中加入到尼妥珠单抗h-R3中,孵育条件下自组装形成聚酰胺-胺树枝状聚合物、尼妥珠单抗h-R3和GCSsiRNA的组合物,即得到所述的抗肿瘤多药耐药基因组合物。上述的组合物在制备逆转肿瘤细胞多药耐药产品中的应用或在制备抗肿瘤细胞多药耐药产品中的应用也是本发明保护的范围。上述应用中,所述肿瘤细胞为多药耐药肿瘤细胞,所述多药耐药肿瘤细胞具体为MCF-7/ADR;所述产品为药物。上述的组合物在靶向运输核酸或制备靶向运输核酸产品中的应用也是本发明保护的范围,在本发明中的核酸为GCSsiRNA。本发明的实验证明,本发明具有以下优点:1)以EGFR为靶点,通过自组装的方法形成尼妥珠单抗h-R3修饰的PAMAM载体作为基因递送载体,利用h-R3与肿瘤细胞EGFR介导的内吞作用,提高PAMAM载体对肿瘤细胞的靶向性,从而将针对GCS基因的小干扰RNA成功递送到细胞内,实现目的基因GCSsiRNA的沉默,进一步增加化疗药物的敏感性;2)通过单克隆抗体h-R3对PAMAM的修饰,可降低PAMAM载体过强的正电荷强度,有利于降低细胞毒性和溶血现象的发生;3)采用自组装方法制备h-R3/PAMAMG5/GCSsiRNA组合物,与化学合成相比,分子自组装方法可更方便、灵活的对体系进行修饰,并且保持配体的生物活性。附图说明图1为WesternBlot法检测敏感细胞MCF-7与耐药细胞MCF-7/ADR中GCS蛋白的表达。图2为PCR检测敏感细胞MCF-7与耐药细胞MCF-7/ADR中GCS蛋白的表达。图3为不同氮/磷比(N/P比)的PAMAMG5/GCSsiRNA的凝胶电泳阻滞图。图4为不同h-R3修饰量对h-R3/PAMAMG5/GCSsiRNA复合物凝胶阻滞结果的影响。图5为PCR检测MCF-7/ADR细胞经h-R3/PAMAMG5/GCSsiRNA复合物转染后GCS基因的表达图6为PCR检测MCF-7/ADR细胞经h-R3/PAMAMG5/GCSsiRNA复合物转染后MDR1基因的表达图7为PCR检测MCF-7/ADR细胞经h-R3/PAMAMG5/GCSsiRNA复合物转染后细胞凋亡相关因子bcl-2的表达图8为PCR检测MCF-7/ADR细胞经h-R3/PAMAMG5/GCSsiRNA复合物转染后细胞凋亡相关因子caspase-3的表达图9为WesternBlot法检测MCF-7/ADR细胞经h-R3/PAMAMG5/GCSsiRNA复合物和EGF/PAMAMG5/GCSsiRNA复合物转染后GCS蛋白的表达图10为WesternBlot法检测MCF-7/ADR细胞经h-R3/PAMAMG5/GCSsiRNA复合物和EGF/PAMAMG5/GCSsiRNA复合物转染后P糖蛋白的表达具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。聚酰胺-胺树枝状聚合物(PAMAM):末端带有氨基,以乙二胺为核,5.0代,(购自Sigma-Aldrich,货号:536709,规格5g,数均分子量为28824.81);采用旋转蒸发仪抽真空,去掉甲醇溶剂,获得PAMAMG5,再用PBS缓冲液(pH7.4)溶解,制备成10mg/mL储存液于4℃备用。尼妥珠单抗(Nimotuzumab,h-R3):购自百泰生物药业有限公司。多药耐药基因(GCS)小干扰RNA(GCSsiRNA又称为UGCGsiRNA):购自圣克鲁斯生物技术(上海)有限公司,sc-45404由siRNA-A、siRNA-B、siRNA-C三种siRNA组成,siRNA-A由如下两条单链组成,正义链CAAGAAGGCAACUGACAAAtt;反义链为UUUGUCAGUUGCCUUCUUGtt;siRNA-B由如下两条单链组成,正义链GAACUUCACAUCCAAGAUAtt;反义链为UAUCUUGGAUGUGAAGUUCtt;siRNA-C由如下两条单链组成,正义链CAGUUUCAAUCCAGAAUGAtt;反义链为UCAUUCUGGAUUGAAACUGtt;耐药细胞株(MCF-7/ADR):购自中国医学科学院基础医学研究所细胞中心首先采用蛋白质印迹法(WesternBlot,WB)检测耐药细胞MCF-7/ADR中GCS的表达,并与敏感细胞MCF-7(购自中国医学科学院基础医学研究所细胞中心)进行比较。结果如图1所示,1为MCF-7细胞、2为MCF-7/ADR细胞;由结果可知GCS在耐药细胞株MCF-7/ADR中的表达明显高于在敏感细胞株MCF-7中的表达。进一步采用PCR检测转录水平上敏感细胞和耐药细胞中GCS表达的差异,结果如图2所示,1:Marker;2:MCF-7中的MDR1;3:MCF-7/ADR中的MDR1;4:MCF-7中的GCS;5:MCF-7/ADR中的GCS;6:MCF-7中的GAPDH;7:MCF-7/ADR中的GAPDH;表明在MCF-7和MCF-7/Adr细胞株中,不仅GCS的表达存在差异,多药耐药蛋白MDR1的表达也存在差异。实施例1、制备h-R3/PAMAMG5/GCSsiRNA复合物及其表征一、PAMAMG5/GCSsiRNA复合物首先将上述制成的PAMAMG5(数均分子量为28824.81)10mg/mL储存液溶解于消毒蒸馏水中,振荡混匀,配制成1mg/mL的工作溶液,4℃储存备用。转染前取1.0μgGCSsiRNA置于EP管中,分别加入0.7μL、1.4μL、3.5μL、7μL、14μL、21μL、28μL浓度为1mg/mL的PAMAMG5工作溶液,再加入opti-MEM培养基(购自invitrogen,产品目录号为11058-021)500uL,混匀后置室温孵育30min形成PAMAMG5/GCSsiRNA复合物。形成的PAMAMG5/GCSsiRNA复合物中,PAMAM与GCSsiRNA的氮/磷比分别为1:1、2:1、5:1、10:1、20:1、30:1、40:1。将上述制备的PAMAMG5/GCSsiRNA复合物采用琼脂糖凝胶电泳阻滞实验证明PAMAM与GCSsiRNA的复合情况以及稳定性。所检测的PAMAMG5/GCSsiRNA复合物中,PAMAM与GCSsiRNA的氮/磷比分别为1:1、2:1、5:1、10:1、20:1、30:1、40:1。具体方法如下:称取适量琼脂糖,加入1×TAE溶液,加热溶解,配制1%琼脂糖凝胶溶液,室温冷却至约50℃,加入1μL溴化乙锭溶液(500μg/ml)插入DNA染色,灌胶,加样,120V电泳30min左右,紫外透射仪观察并拍照。新鲜配制所需转染复合物,1%琼脂糖凝胶电泳鉴定包封效果。结果如图3所示,泳道1为裸GCSsiRNA;泳道2-8为氮/磷比分别为1,2,5,10,20,30,40;泳道9为RNAMarker,结果显示siRNA在没有与PAMAM完全结合时(泳道2-5),能够出现正常电泳条带;当N/P比为20(泳道6)时,PAMAM-siRNA能够完全阻滞其包裹的siRNA的电泳,使其滞留在点样孔附近,无法电泳出正常电泳条带,表明N/P达到20时,能够形成稳定的PAMAM-siRNA。二、h-R3/PAMAMG5/GCSsiRNA复合物将尼妥珠单抗(Nimotuzumab,h-R3)用PBS缓冲液(pH7.4,NaCl8.0g,KCl0.2g,NaH2PO4·H2O1.56g,KH2PO40.20g,蒸馏水定容至1000ml),配制成浓度为1mg/mL的单抗溶液,向100μL氮/磷比为20的PAMAMG5/GCSsiRNA复合物加入不同体积的浓度为1mg/mL的单抗溶液,混匀后置室温孵育30min形成h-R3/PAMAMG5/GCSsiRNA复合物。形成h-R3/PAMAMG5/GCSsiRNA复合物中,h-R3与GCSsiRNA的质量比分别为0.05:1、0.1:1、0.5:1、1:1、2:1、5:1,PAMAMG5与GCSsiRNA的氮/磷比为20:1。将上述制备的h-R3/PAMAMG5/GCSsiRNA复合物采用琼脂糖凝胶电泳阻滞实验证明PAMAM与GCSsiRNA的复合情况以及稳定性,所检测的h-R3/PAMAMG5/GCSsiRNA复合物中,PAMAM与GCSsiRNA的氮/磷比为20:1;h-R3与GCSsiRNA的质量比分别为0.05,0.1,0.5,1,2,5。方法同上。h-R3/PAMAMG5/GCSsiRNA三元复合物的琼脂糖凝胶电泳阻滞实验结果如图4所示,泳道1为裸GCSsiRNA;泳道2-7为PAMAMG5与GCSsiRNA氮/磷比为20:1、且h-R3与GCSsiRNA的质量比分别为0.05,0.1,0.5,1,2,5的h-R3/PAMAMG5/GCSsiRNA复合物;泳道8为Marker),从图中可见,当h-R3与GCSsiRNA的质量比为0.05、0.1、0.5时,无裸siRNA条带,此时形成的h-R3/PAMAMG5/GCSsiRNA复合物是稳定的,可以有效包裹GCSsiRNA。因此,结合上述结论,h-R3/PAMAMG5/GCSsiRNA复合物,PAMAM与DNA的氮/磷比为20:1,且h-R3与GCSsiRNA的质量比为0.05、0.1、0.5,为最佳反应组合物。实施例2、h-R3/PAMAMG5/GCSsiRNA复合物体在抑制肿瘤细胞多耐药中的应用一、转录水平上检测h-R3/PAMAMG5/GCSsiRNA复合物转染后耐药基因以及相关凋亡基因的表达1、h-R3/PAMAMG5/GCSsiRNA复合物体转染后耐药基因表达量检测1)GCS基因将h-R3/PAMAMG5/GCSsiRNA复合物(PAMAM与DNA的氮/磷比为20:1,且h-R3与GCSsiRNA的质量比为0.5)转染进入耐药细胞MCF-7/ADR,利用RT-PCR法检测转染后细胞中GCS基因表达量的变化。引物序列为:GCSforCCTTTCCTCTCCCCACCTTCCTCTGCSreGGTTTCAGAAGAGAGACACCTGGG以GAPDH作为内参基因。结果如图5所示,1:Marker;2:未转染MCF-7/ADR中的GCS;3:转染后MCF-7/Adr中的GCS;4:未转染MCF-7/ADR中的GAPDH;5:转染后MCF-7/Adr中的GAPDH,看出,该复合物转染后耐药细胞MCF-7/ADR中GCS基因的表达明显降低。2)多药耐药基因MDR1同时对多药耐药基因MDR1进行检测,引物序列为:MDR1forATATCAGCAGCCCACATCATMDR1reGAAGCACTGGGATGTCCGGT以GAPDH作为内参基因。结果如图6所示,1:未转染MCF-7/Adr中的GAPDH;2:转染后MCF-7/Adr中的GAPDH;3:未转染MCF-7/Adr中的MDR1;4:转染后MCF-7/Adr中的MDR1;5:Marker,从条带3和4的亮度上可以看出,条带4(转染后MCF-7/Adr中的MDR1)的亮度明显弱于条带3(未转染MCF-7/Adr中的MDR1),说明耐药细胞经h-R3/PAMAMG5/GCSsiRNA复合物转染后MDR1的表达降低。h-R3/PAMAMG5/GCSsiRNA复合物转染后,耐药细胞中MDR1的表达也有一定下调。这些结果说明h-R3/PAMAM能够介导GCSsiRNA进入耐药细胞中,对GCS基因进行沉默干扰,同时对多药耐药基因MDR1的表达也有一定的抑制作用。2、对凋亡相关基因bcl-2和caspase-3的检测同时对凋亡相关基因bcl-2和caspase-3的检测bcl-2的引物序列为:bcl-2forTGCTGAAGATTGATGGGATCbcl-2reTGCATTCTTGGACGAGGGcaspase-3的引物序列为:caspase-3forTGTGGCATTGAGACAGACcaspase-3reGAGGGAAATACAGTACCAAATA图7为PCR检测MCF-7/ADR细胞经h-R3/PAMAM/GCSsiRNA复合物转染后细胞凋亡相关因子bcl-2的表达,其中,1:Marker;2:未转染MCF-7/Adr中的bcl-2;3:转染后MCF-7/Adr中的bcl-2;4:未转染MCF-7/Adr中的GAPDH;5:转染后MCF-7/Adr中的GAPDH;图8为PCR检测MCF-7/ADR细胞经h-R3/PAMAM/GCSsiRNA复合物转染后细胞凋亡相关因子caspase-3的表达,其中1:Marker;2:未转染MCF-7/Adr中的caspase-3;3:转染后MCF-7/Adr中的caspase-3;4:未处理MCF-7/Adr中的GAPDH;5:处理后MCF-7/Adr中的GAPDH;可以看出,h-R3/PAMAMG5/GCSsiRNA复合物转染后,耐药细胞中bcl-2和caspase-3的表达也有一定程度的下调,从而进一步验证GCS基因的沉默会促进肿瘤细胞的凋亡。二、翻译水平上检测h-R3/PAMAMG5/GCSsiRNA复合物转染后耐药相关蛋白的以及相关凋亡基因的表达为了进一步验证h-R3修饰的PAMAMG5复合物能够有效地将GCSsiRNA递送到耐药细胞并且发挥功效,在下面的实施例中增加了对照实验,即采用EGF修饰的PAMAMG5复合物携载GCSsiRNA进行实验。1)GCS蛋白将h-R3/PAMAMG5/GCSsiRNA复合物(PAMAM与DNA的氮/磷比为20:1,且h-R3与GCSsiRNA的质量比为0.5)以及对照复合物EGF/PAMAMG5/GCSsiRNA复合物(制备方法类似,PAMAM与DNA的氮/磷比为20:1,且EGF与GCSsiRNA的质量比为2)分别转染进入耐药细胞MCF-7/ADR,利用WesternBlot法检测转染后细胞中GCS蛋白表达量的变化,同时设定内参GAPDH。具体方法如下:收集状态较好的MCF-7/ADR细胞(细胞计数,一般107个左右),使之保持细胞数目相同,进行离心(1100rpm离心7min),得到细胞沉淀,之后按照蛋白提取试剂盒进行蛋白提取。首先用PBS洗涤细胞沉淀2-3次,根据细胞沉淀的多少加入细胞裂解液,加之前要在细胞裂解液中加入5%的蛋白酶抑制剂,冰上静置30min,测定蛋白浓度,加入LoadingBuffer,沸水浴煮10min,-20℃保存备用。之后进行WesternBlotting检测。结果如图9所示,A:h-R3/PAMAMG5/GCSsiRNA组;B:EGF/PAMAMG5/GCSsiRNA组;条带1:未经复合物处理的MCF-7/ADR细胞;条带2:经复合物处理的MCF-7/ADR细胞。从图中条带的亮度可以看出,经两组复合物转染后MCF-7/ADR细胞中的GCS蛋白表达量均有所下降,h-R3/PAMAMG5/GCSsiRNA组GCS蛋白下调的更为明显。这个结果表明相比于EGF修饰的PAMAMG5/GCSsiRNA复合物,尼妥珠单抗h-R3修饰后复合物的转染效率更高,进入耐药肿瘤细胞后沉默效果更好。2)P糖蛋白同时对耐药相关蛋白P糖蛋白进行检测,具体方法同1)。结果如图10所示,A:h-R3/PAMAMG5/GCSsiRNA组;B:EGF/PAMAMG5/GCSsiRNA组;条带1:未经复合物处理的MCF-7/ADR细胞;条带2:经复合物处理的MCF-7/ADR细胞。从图中条带的亮度可以看出,经两组复合物转染后MCF-7/ADR细胞中的P蛋白表达量均有所下降,h-R3/PAMAMG5/GCSsiRNA组P蛋白下调的更为明显。这个结果进一步表明相比于EGF修饰的PAMAMG5/GCSsiRNA复合物,尼妥珠单抗h-R3修饰后复合物的转染效率更高,进入耐药肿瘤细胞后沉默效果更好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 肿瘤耐药膜表面标志蛋白及其作为抗耐药肿瘤药物靶蛋白的用途的制作方法
- 肿瘤耐药标志物基因及其作为抗耐药肿瘤药物设计的靶点的用途的制作方法
- 可逆转肿瘤多药耐药的中西药微乳共传递系统、其制备方法及其在制备抗肿瘤药物中的应用的制作方法
- 一种抗耐药肿瘤的靶向制剂、制备方法及应用的制作方法
- 千金子素1在制备肿瘤多药耐药逆转剂方面的应用的制作方法
- 联苯双酯作为肿瘤多药耐药逆转剂的新用途的制作方法
- hBex1基因在制备肿瘤细胞多药耐药逆转剂中的应用的制作方法
- 补骨脂逆转肿瘤多药耐药活性成分及其制备方法和应用的制作方法
- 姜黄素在制备肿瘤多药耐药预防剂中的用途的制作方法
- 一种同载肿瘤耐药逆转剂和细胞毒药物的抗癌缓释注射剂的制作方法
- 一种用于检测牛源大肠杆菌喹诺酮耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测肉鸡沙门氏菌环丙沙星耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测大肠埃希菌氧氟沙星耐药基因的分子标记及其应用的制造方法与工艺
- 检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法与制造工艺
- 幽门螺旋杆菌及其耐药基因突变检测试剂盒和检测方法与制造工艺
- 一种糖肽类抗生素耐药基因检测试剂盒的制造方法与工艺
- 用于检测产AmpC酶的三种细菌耐药基因的LAMP引物组合及其应用的制造方法与工艺
- 环介导等温扩增多重耐药基因oqxAB的检测引物、检测试剂盒及检测方法与制造工艺
- 一种同时检测多种病原体的三重PCR检测方法与制造工艺
- 四环素耐药基因检测并联探针、基因芯片、试剂盒与检测法的制造方法与工艺
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 盐生草耐盐基因HgS2及其应用的制造方法与工艺
- 一种快速核酸检测肺炎支原体及耐药突变的方法和试剂盒与流程
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测B族链球菌四环素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测粪肠球菌庆大霉素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测葡萄球菌磺胺类药物耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测肉鸡沙门氏菌环丙沙星耐药基因的分子标记及其应用的制造方法与工艺
- 检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法与制造工艺
- 一种检测幽门螺杆菌耐药突变位点的试剂盒和方法与制造工艺
- 一种封闭式病原体检测卡盒的制作方法与工艺
- 检测16种呼吸道病原体的基因芯片检测用试剂盒及方法与流程
- 一种同时检测多种病原体的五重PCR检测方法与流程
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 用于对肉类、植物或植物部分进行病原体检测和病害治理的方法与流程
- 一种用于检测治疗恶性肿瘤的一线药物耐药基因表达量的试剂盒的制造方法与工艺
- 用于检测植物病原体的装置和方法与流程
- 用于检测多种病原体的荧光实时检测方法及应用与流程
- 一种用于检测手足口病相关病原体的LAMP引物组合物及其相关应用的制造方法与工艺
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺