PCSK9疫苗的制造方法与工艺
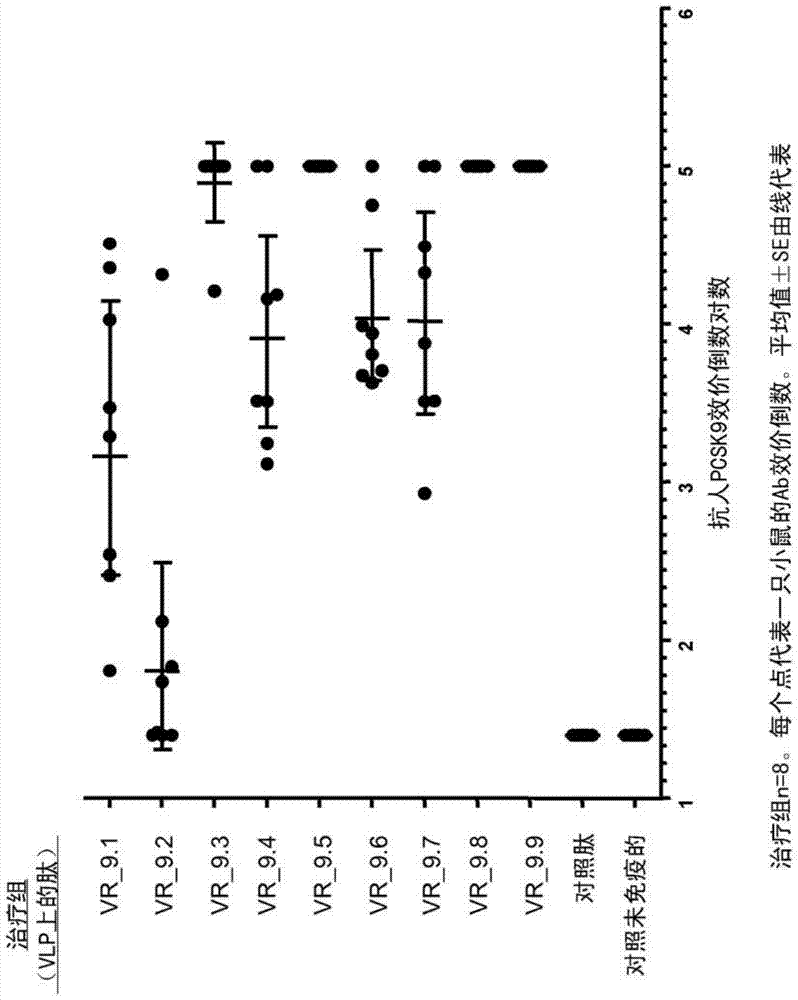
PCSK9疫苗本申请是申请日为2010年8月23日的第201080049440.6号发明名称为“PCSK9疫苗”的中国专利申请的分案申请。发明领域本发明涉及提供新的免疫原,其包含优选与免疫原性载体连接的抗原性PCSK9肽,用于预防、治疗或者减轻PCSK9相关疾病。本发明进一步涉及这些药物、其免疫原性组合物及药物组合物的生产方法以及它们在医药学中的应用。背景前蛋白转换酶(Proproteinconvertase)枯草杆菌蛋白酶-kexin9型(后文称作PCSK9),也称作神经细胞凋亡调节转换酶1(neuralapoptosis-regulatedconvertase1,NARC-I),其是一种蛋白酶K样subtilase,被鉴别为哺乳动物PCSK家族第9个成员,见Seidahetal,2003PNAS100:928-933所述。PCSK9基因位于人染色体1p33-p34.3。PCSK9在能增殖和分化的细胞中表达,包括例如肝细胞、肾间充质细胞、回肠和结肠上皮细胞以及胚胎端脑神经元。PCSK9最初的合成是~72-kDa的无活性酶前体形式或者酶原形式,其在内质网(ER)中经历自身催化、分子内加工以激活其功能性。人PCSK9的基因序列的长度为~22-kb,具有12个外显子,编码692个氨基酸的蛋白质,所述基因序列可见于例如DepositNo.NP_777596.2。人、小鼠和大鼠PCSK9核酸序列已经保藏,参见例如分别为GenBankAccessionNo:AX127530(也称作AX207686)、AX207688和AX207690。人PCSK9是一种分泌蛋白,主要在肾、肝和肠中表达。其具有三个结构域:抑制性前结构域(pro-domain)(第1-152位氨基酸,包括在第1-30位氨基酸的信号序列)、催化结构域(第153-448位氨基酸)以及长度为210个残基的富含半胱氨酸残基的C末端结构域(第449-692位氨基酸)。PCSK9作为酶原被合成,在内质网中经历在前结构域与催化结构域之间的自身催化裂解。所述前结构域在裂解后保持与成熟蛋白质结合,分泌复合物。富含半胱氨酸的结构域可能发挥与其它弗林蛋白酶/Kexin/枯草杆菌蛋白酶样丝氨酸蛋白酶的P-(加工)结构域相似的作用,其似乎是激活的蛋白酶的折叠和调节所必需的。PCSK9中的突变与血浆中低密度脂蛋白胆固醇(LDL-c)的异常水平相关(Hortonetal.,2006Trends.Biochem.Sci.32(2):71-77)。PCSK9在肝细胞和神经元细胞的分化中起作用(Seidahetal,如前),在胚胎肝中高表达,且明显参与胆固醇稳态。鉴别有效治疗心血管疾病的化合物和/或药剂是高度期望的。在临床实验中已经证实LDL胆固醇水平的降低与冠状动脉病症的比率直接相关,见Lawetal,2003BMJ326:1423-1427。此外,近来已经示出血浆LDL胆固醇水平中等程度终生降低与冠状动脉病症发生率的实质降低实质相关,见Cohenetal,如前所述。甚至在具有非脂质相关心血管风险因子的高流行性群体中也见到如此状况,见如前所述。因此,很重要的是鉴别可以控制LDL胆固醇水平的治疗剂。因此,很重要的是产生抑制或者拮抗PCSK9活性及PCSK9在各种治疗病症中发挥的相应作用的药物。PCSK9的表达或上调与增高的血浆LDL胆固醇水平相关,PCSK9的抑制或者表达缺失与低LDL胆固醇血浆水平相关。显然,与PCSK9中序列变异相关的较低水平的LDL胆固醇赋予针对冠心病的保护作用,见Cohen,2006N.Engl.J.Med.354:1264-1272。发明概述本发明涉及免疫原,其包含抗原性PCSK9肽及任选存在的免疫原性载体。本发明还涉及产生任选地与免疫原性载体连接的这种抗原性PCSK9肽的方法。本发明还涉及免疫原性组合物,其包含任选地与免疫原性载体连接的这种抗原性PCSK9肽,任选地包含一或多种佐剂,优选一或两种佐剂。本发明另一方面涉及药物组合物,其包含本发明的抗原性PCSK9肽或者其免疫原性组合物,以及涉及这种组合物的医学应用。本发明特别涉及本发明的抗原性PCSK9肽或者其免疫原性组合物或药物组合物用作药物,优选用于治疗、减轻或预防PCSK9相关疾病。本发明特别涉及本发明的抗原性PCSK9肽或者其免疫原性组合物或药物组合物用作药物,优选用于治疗、减轻或预防与胆固醇水平增高相关的疾病。本发明的抗原性PCSK9肽特别适于治疗患有增高的LDL-胆固醇或者与增高的LDL-胆固醇相关的病症的病人或者处于增高的LDL-胆固醇或者与增高的LDL-胆固醇相关的病症的风险中的病人,所述病症如脂质失调(如高脂血症,I型、II型、III型、IV型或者V型高脂血症,继发高甘油三酯血症,高胆固醇血症,家族性高胆固醇血症,黄瘤病,胆固醇乙酰转移酶缺陷)。本发明的抗原性PCSK9肽也适于治疗患有动脉硬化病症(如动脉硬化)、冠状动脉疾病、心血管疾病的病人,以及处于这些病症风险中的病人,例如由于存在一或多个风险因子(如高血压、吸烟、糖尿病、肥胖或者高同型半胱氨酸血症)所致。再一方面,本发明提供了本发明的抗原性PCSK9肽或者其免疫原性组合物或药物组合物在制备治疗阿尔兹海默病的药物中的应用。在一个实施方案中,所述抗原性PCSK9肽或者其免疫原性组合物或药物组合物与另一种药剂一起施用。附图简述图1:与LDL-R(3BPS)的EGF-A结构域结合的人PCSK9的PDB结构,示出PCSK9中的5个肽序列(肽1-5),它们被选择是因为参与这两个蛋白质之间的相互作用。图2:使用明矾加CpG作为佐剂,小鼠用缀合于VLP的肽VR_9.1至VR_9.9免疫,针对全长重组人PCSK9的抗体应答通过在ELISA测定中滴定血清而测量。结果显示为每组6只小鼠每一个的效价倒数,效价倒数测量为给出0.5的光密度读数的血清稀释度。图3:如图2所述的针对全长重组小鼠PCSK9蛋白的抗体应答。图4:在接种小鼠的血清中测量的血浆胆固醇水平(与用于图2和图3中抗体测定相同的样品)。图5:在不同稀释度测试了图2和图4中使用的血浆样品的抑制重组PCSK9和LDL受体的胞外结构域之间的相互作用的能力,由FRET测定测量。图6:在FRET测定中来自肽VR_9.5和VR_9.6免疫接种的血浆样品的稀释度,显示出对PCSK9和LDL受体之间的相互作用的剂量应答性抑制。图7:来自PDB:3BPS的PCSK9(条带(ribbon))和EGF-A(空间填充)的复合物。PCSK9的可能与除EGF-A之外的LDLR结构域相互作用的潜在区域由椭圆形示出。图8:PCSK9(条带)和EGF-A(空间填充)的复合物,显示了相应于肽VR_13/14(A)和VR_15/16(B)和VR_9.5(C)的氨基酸。图9和图10:用肽VR_9.5和VR_9.10至VR_9.16免疫接种的小鼠的血浆抗体应答。针对小鼠PCSK9的抗体通过使用全长小鼠PCSK9蛋白进行的系列血浆稀释液的ELISA测定而测量。显示了每组8只小鼠的个体效价曲线,以来自用未缀合的VLP免疫接种小鼠血浆的ELISA应答作为对照。图11:在用缀合于VLP(使用明矾+/-CpG作为佐剂)或者CRM197(使用TiterMax作为佐剂)的肽VR_9.5或VR_9.10免疫接种的BALB/c和C57BL/6小鼠中诱导的针对全长人PCSK9蛋白的血清抗体应答。针对人PCSK9的抗体通过在ELISA测定中滴定血清而测量。结果显示为对每组8只小鼠的每一个在1.0光密度确定的效价倒数的对数值。图12:在如图11所述免疫接种的BALB/c和C57BL/6小鼠中诱导的针对全长小鼠PCSK9蛋白的血清抗体应答。结果显示为对每组8只小鼠的每一个在0.5光密度确定的效价倒数的对数值。图13:在取自BALB/c免疫接种小鼠的血清样品中测量的总胆固醇水平(与用于图11和12中抗体测定相同的样品)。图14:在取自C57BL/6免疫接种小鼠的血清样品中测量的总胆固醇水平(与用于图11和12中抗体测定相同的样品)。图15:在用明矾加CpG作为佐剂用缀合于VLP的肽VR_9.5或VR_9.17至VR_9.35免疫接种的BALB/c小鼠中诱导的针对全长人PCSK9的抗体应答。针对人PCSK9的抗体通过在ELISA测定中滴定血清而测量。结果显示为对每组8只小鼠的每一个在1.0光密度确定的效价倒数的对数值。图16:在如图15所述免疫接种的BALB/c小鼠中诱导的针对全长小鼠PCSK9的抗体应答。针对小鼠PCSK9的抗体通过在ELISA测定中滴定血清而测量。结果显示为对每组8只小鼠的每一个在0.5光密度确定的效价倒数的对数值。图17:在取自BALB/c免疫接种小鼠的血清样品中测量的总胆固醇水平(与用于图15和16中抗体测定相同的样品)。图18:PCSK9(条带)和EGF-A(空间填充)的复合物,含有功能获得或功能丧失性突变相关的氨基酸序列和/或蛋白质表面暴露表位的PCSK9区域由椭圆形示出。图19:附着有抗原性肽的多价模板的示意图。发明详述本发明的抗原性PCSK9肽本发明涉及免疫原,其包含任选地与免疫原性载体连接的抗原性PCSK9肽。在一个实施方案中,所述抗原性PCSK9肽是PCSK9的包含4-20个氨基酸的一部分,当将其施用给对象时能降低所述对象血液中LDL-胆固醇水平。优选地,所述对象是哺乳动物,优选人。优选地,所述抗原性PCSK9肽能使LDL-胆固醇水平降低至少2%、5%、10%、20%、30%或者50%。在一个实施方案中,所述抗原性PCSK9肽是PCSK9的参与PCSK9与LDL受体相互作用的部分。在一个实施方案中,所述抗原性PCSK9肽是PCSK9的参与PCSK9与LDL受体相互作用的部分,其包含4-20个氨基酸,且当施用给对象时能降低所述对象血液中LDL-胆固醇水平。优选地,所述对象是哺乳动物,优选是人。优选地,所述抗原性PCSK9肽能使LDL-胆固醇水平降低至少2%、5%、10%、20%、30%或者50%。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278、279、280、281、282、283、284、285、286、287、288、289、290、291、292、293、294、295、296、297、298、299、300、301、302、303、304、305、306、307、308、309、310、311、312、330、331、332、333、334、335、336、337、338、339、340、341、342、343、344、345、346、347、348、349、350、351、352、353、354、355、356、357、358、359、360、361、362、363、364、365、366、367、368、369、370、371、372、373、374、375、376、377、378、379、380、381、382、383、384、385、386、387、388、389、390、391、392、393、394、395、396、397、398、420、421、422、423、424、425、426、427、428、429、430、431、432、433、434、435、436、437、438、439、440、441、442、443、444、445、446、447、448、449、450、451、452、453、454、455、456、457、458、459、460、461、462、463、464、465、466、467、468、469、470、471、472、473、474、475、476、477、478、479、480、481、482、483、484、485、486、487、488、489、490、491、492、493、494、495、496、497、498、499、500、501、502、503、504、505、506、507、508、509、510、511、512、513、514、515、516、517、518、519、520、521、522、523、524、525、526、527、528、529、530、531、532、533、534、535、536、537、538、539、540、541、542、543、544、545、546、547、548、549、550、551、552、553、554、555、556、557、558、559、560、561、562、563、564、565、566、567、568、569、570、571、572、573、574、575、576、577、578、579、580、581、582、583、584、585、586、587和588。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:1-312、330-398、421、423、424、426及428-588。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278、279、280、281、282、283、284、285、286、287、288、289、290、291、292、293、294、295、296、297、298、299、300、301、302、303、304、305、306、307、308、309、310、311、312、330、331、332、333、334、335、336、337、338、339、340、341、342、343、344、345、346、347、348、349、350、351、352、353、354、355、356、357、358、359、360、361、362、363、364、365、366、367、368、369、370、371、372、373、374、375、376、377、378、379、380、381、382、383、384、385、386、387、388、389、390、391、392、393、394、395、396、397和398。在一个实施方案中,所述抗原性PCSK9肽是PCSK9的可能参与LDL受体的EGF-A结构域的相互作用的部分。这部分的实例在图1中示出。在一个实施方案中,所述抗原性PCSK9肽是PCSK9的可能参与与LDL受体的结构域EGF-A的相互作用的部分,包含4-20个氨基酸,且当将其施用给对象时能降低所述对象血液中LDL-胆固醇水平。优选地,所述对象是哺乳动物,优选是人。优选地,所述抗原性PCSK9肽能使LDL-胆固醇水平降低至少2%、5%、10%、20%、30%或者50%。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:1所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自:SEQIDNo:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44和45。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:46所示PCSK9片段的5-15个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100和101。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:102所示PCSK9片段的5-14个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145和146。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:147所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180和181。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:182所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225和226。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:330所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:330、331、332、333、334、335、336、337、338、339、340、341、342、343、344、345、346、347、348、349、350、351、352、353、354、355、356、357、358和359。在一优选的实施方案中,所述抗原性PCSK9肽选自SEQIDNo:19、56、63、109、153、165、184、186、187、188、332和424。在一优选的实施方案中,所述抗原性PCSK9肽选自SEQIDNo:19、56、63、109、153和184。在一优选的实施方案中,所述抗原性PCSK9肽选自SEQIDNo:56、184、186、187、188和332。在一最优选的实施方案中,所述抗原性PCSK9肽是SEQIDNo:56所示序列的肽。在更优选的实施方案中,所述抗原性PCSK9肽是SEQIDNo:184或187所示序列的肽。在一最优选的实施方案中,所述抗原性PCSK9肽是SEQIDNo:184所示序列的肽。在一最优选的实施方案中,所述抗原性PCSK9肽是SEQIDNo:332所示序列的肽。在一个实施方案中,所述抗原性PCSK9肽在PCSK9的可能参与与除了EGF-A结构域之外的LDL受体区域相互作用的区域中选择。这部分的实例在图7和8中示出。在一个实施方案中,所述抗原性PCSK9肽是PCSK9的可能参与与除了EGF-A结构域之外的LDL受体区域相互作用的部分,包含4-20个氨基酸,且当将其施用给对象时能降低所述对象血液中LDL-胆固醇水平。优选地,所述对象是哺乳动物,优选是人。优选地,所述抗原性PCSK9肽能使LDL-胆固醇水平降低至少2%、5%、10%、20%、30%或者50%。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:227所示PCSK9片段的5-12个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261和262。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:263所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278、279、280、281、282、283、284、285、286、287、288、289、290、291、292、293、294、295、296、297、298、299、300、301、302、303、304、305、306和307。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:360所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:360、361、362、363、364、365、366、367、368、369、370、371、372、373、374、375、376、377、378、379、380、381、382、383、384、385、386、387、388、389、390、391、392、393、394、395、396、397和398。在一个实施方案中,所述抗原性PCSK9肽在PCSK9前结构域的区域(SEQIDNo:329)中选择。在一个实施方案中,所述抗原性PCSK9肽是PCSK9前结构域的一部分,包含4-20个氨基酸,且当将其施用给对象时能降低所述对象血液中LDL-胆固醇水平。优选地,所述对象是哺乳动物,优选是人。优选地,所述抗原性PCSK9肽能使LDL-胆固醇水平降低至少2%、5%、10%、20%、30%或者50%。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:308、309、310、311和312。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:309所示PCSK9片段的5-12个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:309、429、430、431、432、433、434、435、436、437、438、439、440、441、442、443、444、445、446、447、448、449、450、451、452、453、454、455、456、457、458、459、460、461、462和463。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:508所示PCSK9片段的5-12个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:508、509、510、511、512、513、514、515、516、517、518、519、520、521、522、523、524、525、526、527、528、529、530、531、532、533、534、535、536、537、538、539、540、541、542和543。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:310所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:310、464、465、466、467、468、469、470、471、472、473、474、475、476、477、478、479、480、481、482、483、484、485、486、487、488、489、490、491、492、493、494、495、496、497、498、499、500、501、502、503、504、505、506和507。在一个实施方案中,所述抗原性PCSK9肽是包含SEQIDNo:544所示PCSK9片段的5-13个、优选6-8个连续氨基酸的肽。在一个实施方案中,所述抗原性PCSK9肽选自SEQIDNo:544、545、546、547、548、549、550、551、552、553、554、555、556、557、558、559、560、561、562、563、564、565、566、567、568、569、570、571、572、573、574、575、576、577、578、579、580、581、582、583、584、585、586、587和588。在一优选的实施方案中,所述抗原性PCSK9肽选自SEQIDNo:312、421、422、423、426、427、428、445、482、525和563。在一更优选的实施方案中,所述抗原性PCSK9肽选自SEQIDNo:445、482、525和563。在一最优选的实施方案中,所述抗原性PCSK9肽是SEQIDNo:445所示序列的肽。这种抗原性PCSK9肽可以单独使用或者组合使用,优选当与免疫原性载体结合时,以诱导对象体内自身抗-PCSK9抗体,用以治疗、预防或者减轻PCSK9-相关疾病。本领域技术人员显然已知哪种技术可用于证实某特定构建体是否落入本发明范围内。这种技术包括但不限于在本申请实施例章节描述的技术及下文所述技术。本发明的抗原性PCSK9肽诱导自身抗-PCSK9抗体的能力可以使用本申请实施例3所述测试在小鼠中测量。由本发明抗原性PCSK9肽诱导的自身抗体降低循环血浆胆固醇水平的能力可以使用实施例3所述测试在小鼠中测量。本发明抗原性PCSK9肽诱导的自身抗体抑制PCSK9与LDL受体之间相互作用的能力可以通过使用实施例3所述测试(FRET测定)直接测量,或者通过测量细胞表面LDL受体的上调而间接测量(如相关文献中所述,使用体外细胞系或者通过测量(例如通过Western印迹)抗体表达动物的肝活检组织中的LDL受体水平进行),所述细胞表面LDL受体的上调是阻断PCSK9介导的下调的结果。术语“抗原性PCSK9肽生物学活性”当在本文使用时是指本发明的抗原性PCSK9肽在患者体内诱导自身抗PCSK9抗体的能力。优选地,当将所述抗原性PCSK9肽施用给对象时,其能降低所述对象血液中的LDL-胆固醇水平。优选地,所述对象是哺乳动物,优选是人。优选地,所述抗原性PCSK9肽能使LDL-胆固醇水平降低至少2%、5%、10%、20%、30%或者50%。在一个实施方案中,本发明的抗原性PCSK9肽是这样的大小,由此其模拟选自其中发现天然表位的整个PCSK9结构域的区域。在一特定实施方案中,本发明的抗原性PCSK9肽长度少于100个氨基酸,优选少于75个氨基酸,更优选少于50个氨基酸,甚至更优选少于40个氨基酸。本发明的抗原性PCSK9肽的长度典型为4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或者30个氨基酸,优选4-20个氨基酸,例如6-12个、6-8个或者9-12个氨基酸。本发明抗原性PCSK9肽的具体实例在序列表中提供,包括长度范围为5-17个氨基酸的肽。本发明的抗原性肽包括衍生自哺乳动物PCSK9、优选人PCSK9(SEQIDNo:399)或小鼠PCSK9(SEQIDNo:400)、更优选人PCSK9的一部分的氨基酸序列,这种衍生的PCSK9部分相应于天然发生的PCSK9的氨基酸序列或者相应于变体PCSK9的氨基酸序列,即其中取代、添加或缺失少数氨基酸但基本保留相同免疫学性质的天然发生的PCSK9的氨基酸序列。此外,这种衍生的PCSK9部分可以通过氨基酸、特别是N末端和C末端氨基酸进一步修饰,以使得所述抗原性PCSK9肽是构象限制的和/或使得所述抗原性PCSK9肽在进行适当化学处理后能偶联免疫原性载体。本文揭示的抗原性PCSK9肽涵盖了衍生自PCSK9氨基酸序列的功能活性变体肽,其中一些氨基酸被缺失、插入或者取代,同时基本上不降低其免疫学性质,即这种功能活性变体肽保留实质的抗原性PCSK9肽生物学活性。典型地,这种功能变体肽与选自SEQIDNo:1-312、330-398及420-588的氨基酸序列具有氨基酸序列同源性,优选高度同源。在一个实施方案中,这种功能活性变体肽与选自SEQIDNo:1-312、330-398及420-588的氨基酸序列呈现至少60%、65%、70%、75%、80%、85%、90%或者95%相同性。多肽序列相似性也称作序列相同性典型是使用序列分析软件测量的。蛋白质分析软件使用赋予各种取代、缺失及其它修饰包括保守氨基选取代的相似性测量而匹配相似序列。例如,GCG含有程序如“Gap”和“Bestfit”,其可以使用默认参数确定密切相关多肽如来自不同物种生物体的同源多肽之间或者野生型蛋白质与其突变蛋白之间的序列同源性或者序列相同性。见例如GCGVersion6.1。多肽序列也可以使用利用默认参数或者推荐参数的FASTA进行对比,GCGVersion6.1.FASTA(如FASTA2和FASTA3)中的一个程序提供了查询序列与搜索序列之间最佳重叠区域的排列对比和序列相同性百分比(Pearson,MethodsEnzymol.183:63-98(1990);Pearson,MethodsMol.Biol.132:185-219(2000))。当将本发明的序列与含有大量来自不同生物体的序列的数据库进行对比时,另一种算法是使用默认参数的计算机程序BLAST,特别是blastp或tblastn。见例如Altschuletal.,J.Mol.Biol.215:403-410(1990)、Altschuletal.,NucleicAcidsRes.25:3389-402(1997)所述。功能活性变体包含天然发生的功能活性变体,如等位基因变体和种变体以及可通过例如诱变技术或者通过直接合成方法产生的非天然发生的功能活性变体。功能活性变体与SEQIDNo:1-312、330-398和420-588所示任何肽具有大约如1、2、3、4或5个氨基酸残基不同,且仍保留抗原性PCSK9生物学活性。在这种对比需要排列对比时,以最大同源性排列对比所述序列。变异的位点可以发生在所述肽中的任何位置,只要所述生物学活性与SEQIDNo:1-312、330-398和420-588所示肽基本上相似即可。关于怎样产生表型沉默氨基酸取代的指导在Bowieetal.,Science,247:1306-1310(1990)中提供,其教导有两种主要策略研究氨基酸序列对改变的耐受性。第一种策略采用在进化过程期间通过天然选择的氨基酸取代的耐受性。通过在不同物种中对比氨基酸序列,可以鉴别在物种之间保守的氨基酸位置。这些保守的氨基酸对于蛋白质功能可能是重要的。相反,其中取代已经被天然选择耐受的氨基酸位置表示对于蛋白质功能不是关键的位置。因此,可以修饰耐受氨基酸取代的位置,同时仍保留所述修饰的肽的特异性免疫原性活性。第二种策略使用遗传工程以在克隆的基因的特定位置导入氨基酸改变以鉴别对于蛋白质功能关键的区域。例如,可以使用位点定向诱变或者丙氨酸扫描诱变技术(Cunninghametal.,Science,244:1081-1085(1989))。然后可以检测所得变体肽的特异性抗原性PCSK9生物学活性。根据Bowieetal.所述,这两种策略已经揭示了蛋白质对于氨基酸取代是令人惊奇地耐受。该作者进一步指出哪些氨基酸改变在该蛋白质某些氨基酸位置可能是容许的。例如,最深藏或内部(在蛋白质的三级结构内)的氨基酸残基需要非极性侧链,而少数表面或外部侧链的特征通常是保守的。在蛋白质的氨基酸中导入突变的方法为本领域技术人员熟知。见例如Ausubel(ed.),CurrentProtocolsinMolecularBiology,JohnWileyandSons,Inc.(1994)、T.Maniatis,E.F.FritschandJ.Sambrook,MolecularCloning:ALaboratoryManual,ColdSpringHarborlaboratory,ColdSpringHarbor,N.Y.(1989))所述。突变也可以通过使用可商购试剂盒如QuikChangeTM位点定向诱变试剂盒(Stratagene)或者直接通过肽合成方法导入。通过置换不显著影响抗原性PCSK9肽功能的氨基酸而产生所述抗原性PCSK9肽的功能活性变体可以由本领域技术人员完成。可以在本发明的肽之一中进行的氨基酸取代的类型是保守氨基酸取代。“保守氨基酸取代”是其中氨基酸残基由具有相似化学性质(如电荷或疏水性)的侧链R基团的另一氨基酸残基取代。通常,保守氨基酸取代基本上不改变蛋白质的功能性质。在两或多个氨基酸序列由于保守取代而彼此不同的情况中,序列相同性百分比或者相似性程度可以向上调整以校正取代的保守性质。进行这种调整的方式为本领域技术人员熟知。见例如Pearson,MethodsMol.Biol.243:307-31(1994)。具有相似化学性质侧链的氨基酸组的实例包括:1)脂肪族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;2)脂肪族-羟基侧链:丝氨酸和苏氨酸;3)含有酰胺的侧链:天冬酰胺和谷氨酰胺;4)芳族侧链:苯丙氨酸、酪氨酸和色氨酸;5)碱性侧链:赖氨酸、精氨酸和组氨酸;6)酸性侧链:天冬氨酸和谷氨酸;及7)含硫侧链:半胱氨酸和甲硫氨酸。优选的保守氨基酸取代组是:缬氨酸-亮氨酸-异亮氨酸,苯丙氨酸-酪氨酸,赖氨酸-精氨酸,丙氨酸-缬氨酸,谷氨酸-天冬氨酸,以及天冬酰胺-谷氨酰胺。或者,保守置换是在PAM250log似然矩阵(likelihoodmatrix)中具有正值的任何改变,见Gonnetetal.,Science256:1443-45(1992)揭示。“中等保守”置换是在PAM250log似然矩阵中具有非负值的任何改变。功能活性变体肽也可以通过使用杂交技术分离。简而言之,使用与编码感兴趣肽如SEQIDNo:1-312、330-398和420-588的完整或部分核酸序列具有高度同源性的DNA制备功能活性肽。因此,本发明的抗原性PCSK9肽还包括这样的肽,其与SEQIDNo:1-312、330-398及420-588所示一或多个肽功能等价且由与编码SEQIDNo:1-312、330-398及420-588任一的核酸或者其互补体杂交的核酸分子编码。本领域技术人员可以使用易于获得的密码子表而容易地确定编码本发明肽的核酸序列。如此,这些核酸序列在本文未示出。编码是功能活性变体的肽、多肽或蛋白质的核酸的杂交严格性是例如10%甲酰胺、5×SSPE、1×Denhart’s溶液和1×鲑精DNA(低严格条件)。更优选的条件是25%甲酰胺、5×SSPE、1×Denhart’s溶液和1×鲑精DNA(中等严格条件),更优选的条件是50%甲酰胺、5×SSPE、1×Denhart’s溶液及1×鲑精DNA(高严格条件)。然而,除了上述甲酰胺浓度之外还有一些因素影响杂交严格性,本领域技术人员可适当地选择这些因素实现相似严格性。编码功能活性变体的核酸分子也可以通过基因扩增方法如PCR方法分离,使用编码感兴趣的肽、多肽或者蛋白质如SEQIDNo:1-312、330-398和420-588所示任一肽的核酸分子的一部分作为探针。在本发明的一个实施方案中,本发明的肽衍生自天然来源且分离自哺乳动物如人、灵长类动物、猫、狗、马、小鼠或者大鼠,优选分离自人来源。本发明的肽因此可通过使用标准蛋白质纯化技术分离自细胞或组织来源。或者,本发明的肽可以通过化学合成或者使用重组DNA技术产生。例如,本发明的肽可以通过本领域熟知的固相方法合成。合适的合成可以通过利用T-boc或F-moc程序进行。环肽可以通过固相方法合成,使用本领域熟知的F-moc程序及在完全自动化设备中的聚酰胺树脂进行。或者,本领域技术人员能获知手工进行这些方法必需的实验室程序。关于固相合成方法的技术和程序在SolidPhasePeptideSynthesis:APracticalApproach’byE.AthertonandR.C.Sheppard,publishedbyIRLatOxfordUniversityPress(1989)及’MethodsinMolecularBiology,Vol.35:PeptideSynthesisProtocols(ed.M.W.PenningtonandB.M.Dunn),chapter7,pp91-171byD.Andreauetal中描述。或者,可以使用本领域熟知的技术将编码本发明肽的多核苷酸导入可以在合适的表达系统中表达的表达载体中,随后分离或者纯化感兴趣的表达的肽、多肽或者蛋白质。本领域可获得许多细菌、酵母、植物、哺乳动物和昆虫表达系统,可以使用任何这种表达系统。任选地,编码本发明肽的多核苷酸可以在无细胞翻译系统中翻译。本发明的抗原性PCSK9肽也可以包含由于存在多个基因、可变转录事件、选择性RNA剪接事件及可变翻译和翻译后事件而产生的那些肽。肽可以在这样的系统如培养的细胞中表达,所述系统导致与当所述肽在天然细胞中表达时所存在的基本上相同的翻译后修饰,或者在这样的系统中表达,所述系统导致当在天然细胞中表达时存在的翻译后修饰如糖基化或裂解的改变或丧失。本发明的抗原性PCSK9肽可以作为融合蛋白产生,其含有其它非-PCSK9或非-PCSK9-衍生氨基酸序列,如本文定义的氨基酸接头或者信号序列或者免疫原性载体,以及可用于蛋白质纯化的配体,如谷胱甘肽-S-转移酶、组氨酸标签和葡萄球菌A蛋白。在融合蛋白中可存在一种以上本发明的抗原性PCSK9肽。所述异源多肽可以融合于例如本发明肽的N末端或C末端。本发明的肽也可以作为包含同源氨基酸序列即其它PCSK9或PCSK9-衍生序列的融合蛋白而产生。本发明的抗原性PCSK9肽可以是线性的或者是构象限制的。如本文在提及肽时所用,术语“构象限制的(conformationallyconstrained)”是指这样的肽,其中三维结构在一个空间排列中随着时间而基本上得以保持。构象限制的分子可具有改良的性质,如增加的亲和性、代谢稳定性、膜通透性或者溶解性。此外,预期这种构象限制的肽以与其天然环状构象相似的构象呈递抗原性PCSK9表位,从而诱导抗-PCSK9抗体更易于识别完整的天然自身PCSK9分子或者具有识别自身PCSK9分子的增加的亲和性。构象限制的方法为本领域熟知,包括但不限于桥连和环化。现有技术领域已知在线性肽中导入构象限制的一些方法。例如,在肽的两个相邻氨基酸之间的桥连导致局部构象修饰,其柔性与常规肽相比受限。形成这种桥连的一些可能性包括掺入内酰胺和piperazinones(综述参见Giannisand.Kolter,Angew.Chem.Int.Ed.,1993,32:1244)。如本文在提及肽时所用,术语“环状”是指包括两个非相邻氨基酸或氨基酸类似物之间的分子内键的结构。所述环化可以通过共价或非共价键实现。分子内键包括但不限于主链-主链,侧链-主链,侧链-侧链,侧链-末端基团,末端-末端键。环化方法包括但不限于在肽的N末端残基与C末端残基之间形成酰胺键,在非相邻氨基酸或氨基酸类似物之间形成二硫键,在Lys和Asp/Glu残基侧链之间形成酰胺键,在丝氨酸残基与Asp/Glu残基之间形成酯键,在例如一个氨基酸或其类似物的侧链基团与氨基末端残基的N末端胺之间形成内酰胺键,以及形成赖氨酸正亮氨酸和二酪氨酸键。也可以使用二硫键的碳形式,如乙烯基或乙基键(J.PeptideSc.,2008,14,898-902)以及与适当多取代的亲电子试剂如二-、三-或四卤代烷进行烷化反应(PNAS,2008,105(40),15293-15298;ChemBioChem,2005,6,821-824)。各种修饰的脯氨酸类似物也可用于在肽中掺入构象限制(Zhangetal.,J.MedChem.,1996,39:2738-2744;PfeiferandRobinson,Chem.Comm.,1998,1977-1978)。可用于环化本发明肽的化学方法获得用包括但不限于内酰胺键、腙键、肟键、噻唑烷键、硫醚键或锍键环化的肽。设计构象限制肽的另一方法在US10/114918中描述,该方法是将感兴趣的短氨基酸序列附着于模板,产生环状限制的肽。这种环状肽不仅通过其模板而结构稳定化,并从而呈现出可以模拟天然蛋白质如病毒和寄生虫上或者其自身蛋白质(自体同源哺乳动物蛋白质如PCSK9)上构象表位的三维构象,而且其与线性肽相比对于在血清中的蛋白酶降解更具抗性。US10/114918进一步揭示了构象限制的交联肽的合成方法,通过制备合成氨基酸用于主链偶联至适当位置的氨基酸以稳定肽的超二级结构。交联可以通过正交保护的(2S,3R)-3-氨基脯氨酸残基的伯胺基团与适当位置的谷氨酸侧链羧基基团的酰胺偶联而实现。这种方法已被用于CS蛋白质的构象限制的四肽重复序列的制备,其中至少一个脯氨酸被(2S,3R)-3-氨基脯氨酸置换,以导入侧链羧基,谷氨酸已经掺入以置换丙氨酸。交联策略还包括应用Grubbs闭环复分解反应,以形成设计为模拟α-螺旋构象的stapled肽(Angew.Int.Ed.Engl.,1998,37,3281;JACS,2000,122,5891);使用多功能化糖;使用氨基羧乙基硫色氨酸键(ChemistryEu.J.,2008,24,3404-3409);使用叠氮化物与炔的“click’”反应,其可以作为侧链氨基酸残基掺入或者位于肽序列的主链内(DrugDisc.Today,2003,8(24),1128-1137)。在文献中也已知金属离子通过隔离特定残基如组氨酸(其协同金属阳离子)可稳定线性肽的限制的构象(Angew.Int.Ed.Engl.,2003,42,421)。相似地,用非天然酸功能化线性肽序列及胺功能性或者多胺和多酸功能性也可用于在激活及酰胺键形成之后实现环化结构。根据一个实施方案,所述抗原性PCSK9肽是通过所述抗原性PCSK9肽的两个非相邻氨基酸(例如N末端和C末端氨基酸)的彼此分子内共价键而构象限制的。根据另一实施方案,本发明的抗原性PCSK9肽是通过共价结合支架分子而构象限制的。根据进一步的实施方案,所述抗原性PCSK9肽是简单限制的,即在任一末端(C或N末端)偶联于支架分子或者通过未位于任一末端的另一氨基酸偶联于支架分子。根据另一实施方案,所述抗原性PCSK9肽是双重限制的,即在C末端和N末端均偶联所述支架分子。根据另一实施方案,所述抗原性肽是通过异手性二脯氨酸单位(D-Pro-L-Pro)的模板作用环化而限制的(Spathetal,1998,HelveticaChimicaActa81,p1726-1738)。所述支架(也称作平台)可以是能通过共价键降低所述抗原性PCSK9肽可采取的构象数的任何分子。举例的构象限制支架包括蛋白质和肽,例如脂笼蛋白相关分子,如含有硫氧还蛋白和硫氧还蛋白样蛋白的β-桶,核酸酶(例如RNaseA),蛋白酶(例如胰蛋白酶),蛋白酶抑制剂(例如水蛭蛋白酶抑制剂C),抗体或其结构刚性片段,荧光蛋白如GFP或YFP,食鱼螺毒素,纤连蛋白III型结构域的环状区域,CTL-A4,以及病毒样颗粒(VLP)。其它合适的平台分子包括碳水化合物如琼脂糖。所述平台可以是线性或环状分子,例如是闭合的以形成环。所述平台通常与所述抗原性PCSK9肽是异源的。这种与平台连接的构象限制的肽与线性肽相比被认为对于蛋白酶解更具抗性。根据一个优选的实施方案,所述支架是如本申请中定义的免疫原性载体。在进一步的实施方案中,所述抗原性PCSK9肽在免疫原性载体上被简单限制。在另一实施方案中,所述抗原性PCSK9肽在免疫原性载体上被双重限制。在这种方式中,所述抗原性PCSK9肽形成构象限制的环结构,其经证实是作为细胞内识别分子的特别合适的结构。本发明的抗原性PCSK9肽可以被修饰以便于与平台缀合,例如通过在一或两个末端加入末端半胱氨酸和/或通过加入接头序列如双甘氨酸头或尾加末端半胱氨酸,用赖氨酸作为末端的接头,或者本领域技术人员已知的进行这种功能的任何其它接头。关于这种接头的详细描述在后文揭示。也可以使用生物正交化学(bioorthogonalchemistry)(如上述click反应),其使得全长肽序列与载体偶联,因此避免了任何区域化学(regiochemical)和化学选择性问题。已知且可以使用刚性接头如Jonesetal.Angew.Chem.Int.Ed.2002,41:4241-4244所述接头激发改良的免疫学应答。在进一步的实施方案中,所述抗原性PCSK9肽附着于多价模板,其自身与载体偶联,因此增加抗原的密度(见下文)。所述多价模板可以是适当功能化的聚合物或者寡聚物如(但不限于)寡谷氨酸或者寡壳聚糖(见图19)。本发明的免疫原性载体在本发明的一个实施方案中,本发明的抗原性PCSK9肽与免疫原性载体分子连接,形成进行免疫接种的免疫原,优选其中所述载体分子与天然PCSK9分子不相关。本文所用术语“免疫原性载体”包括具有在宿主动物体内独立激发免疫原性应答性质的那些材料,其能通过肽、多肽或蛋白质中游离羧基、氨基或者羟基与所述免疫原性载体材料上相应基团之间的肽键或酯键的形成而直接共价偶联于所述肽、多肽或者蛋白质,或者通过常规双功能连接基团键合,或者是作为融合蛋白。用于本发明免疫原中的载体的类型为本领域技术人员已知。举例的这种免疫原性载体是:血清白蛋白,如牛血清白蛋白(BSA);球蛋白;甲状腺球蛋白;血红蛋白;血蓝蛋白(特别是匙孔血蓝蛋白[KLH]);聚赖氨酸;聚谷氨酸;赖氨酸-谷氨酸共聚物;含有赖氨酸或鸟氨酸的共聚物;脂质体载体;结核菌素的纯化蛋白质衍生物(PPD);失活的细菌毒素或类毒素,如破伤风或白喉毒素(TT和DT)或者TT的片段C,CRM197(白喉毒素的非毒性但是抗原性等同变体),其它DT点突变体,如CRM176、CRM228、CRM45(UchidaetalJ.Biol.Chem.218;3838-3844,1973);CRM9、CRM45、CRM102、CRM103和CRM107,及由Nicholls和Youle在GeneticallyEngineeredToxins,Ed:Frankel,MaecelDekkerInc,1992所述其它突变;Glu-148缺失或突变为Asp,Gln或Ser和/或Ala158突变为Gly及在US4709017或US4950740中揭示的其它突变;Lys516、Lys526、Phe530和/或Lys534中至少一或多个残基的突变及在US5917017或US6455673中揭示的其它突变;或者在US5843711中揭示的片段,肺炎球菌溶血素(Kuoetal(1995)Infectlmmun63;2706-13),包括以某种方式解毒的ply,例如dPLY-GMBS(WO04081515,PCT/EP2005/010258)或者dPLY-formol,PhtX,包括PhtA、PhtB、PhtD、PhtE(PhtA、PhtB、PhtD或PhtE的序列在WO00/37105或WO00/39299中揭示)以及Pht蛋白融合体,如PhtDE融合蛋白、PhtBE融合蛋白、PhtA-E(WO01/98334,WO03/54007,WO2009/000826),OMPC(脑膜炎球菌外膜蛋白-通常从脑膜炎奈瑟氏菌(N.meningitidis)血清组B中提取-EP0372501),PorB(来自脑膜炎奈瑟氏菌),PD(流感嗜血杆菌(Haemophilusinfluenzae)蛋白D–见例如EP0594610B),或者其免疫学功能等价物,合成肽(EP0378881,EP0427347),热激蛋白(WO93/17712,WO94/03208),百日咳蛋白(WO98/58668,EP0471177),细胞因子,淋巴因子,生长因子或激素(WO91/01146),包含来自不同病原体衍生抗原的多个人CD4+T细胞表位的人工蛋白质(Falugietal(2001)EurJImmunol31;3816-3824),如N19蛋白(Baraldoietal(2004)Infectlmmun72;4884-7),肺炎球菌表面蛋白PspA(WO02/091998),铁吸收蛋白(WO01/72337),艰难梭菌(C.difficile)的毒素A或B(WO00/61761)。在一优选的实施方案中,本发明的免疫原性载体是CRM197。在另一个实施方案中,所述免疫原性载体是病毒样颗粒(VLP),优选重组病毒样颗粒。如本文所用,术语“病毒样颗粒”是指类似于病毒但是经证实是非病原性的结构。通常,病毒样颗粒缺少至少一部分病毒基因组。病毒样颗粒也可以通常通过异源表达而大量产生且是可易于纯化的。本发明的病毒样颗粒可含有与其基因组不同的核酸。本发明的病毒样颗粒的典型及优选的实施方案是病毒壳体,如相应病毒、噬菌体或者RNA-噬菌体的病毒壳体。如本文所用,术语“噬菌体病毒样颗粒”是指这样的病毒样颗粒,其类似噬菌体结构,是非复制性和非感染性的,且缺少至少编码噬菌体复制机构的一或多个基因,及典型也缺少编码使病毒附着于或者进入宿主中的一或多个蛋白质的一或多个基因。然而,这个定义应也涵盖这样的噬菌体病毒样颗粒,其中前述一或多个基因仍存在,但是是失活的,且因此也产生非复制性和非感染性噬菌体病毒样颗粒。从RNA噬菌体外壳蛋白的180个亚基自主装配形成的及任选地含有宿主RNA的壳体结构在本文称作“RNA噬菌体外壳蛋白的VLP”。特定实例是Qbeta、MS2、PP7或AP205外壳蛋白的VLP。例如在Qbeta外壳蛋白的特定情况中,所述VLP可只从QbetaCP亚基装配(通过表达含有例如TAA终止密码子的QbetaCP基因而产生,通过阻抑作用排除较长的A1蛋白的任何表达,见Kozlovska,T.M.,etal.,Intervirology39:9-15(1996)),或者在壳体装配中另外含有A1蛋白亚基。通常限制壳体装配中QbetaA1蛋白相对于QbetaCP的百分比,以保证壳体形成。适合作为本发明免疫原性载体的举例的VLP包括但不限于如下蛋白的VLP,即Qbeta,MS2,PP7,AP205,及其它噬菌体外壳蛋白,如下病毒壳体和核心蛋白,乙型肝炎病毒(Ulrich,etal.,VirusRes.50:141-182(1998)),麻疹病毒(Warnes,etal.,Gene160:173-178(1995)),Sindbis病毒,轮状病毒(美国专利5,071,651和5,374,426),口蹄疫病毒(Twomey,etal.,Vaccine13:1603-1610,(1995)),Norwalk病毒(Jiang,X.,etal.,Science250:1580-1583(1990);Matsui,S.M.,etal.,JClin.Invest.87:1456-1461(1991)),逆转录病毒GAG蛋白(PCT专利申请WO96/30523),逆转录转座子Ty蛋白pl,乙型肝炎病毒的表面蛋白(WO92/11291),人乳头瘤病毒(WO98/15631),人多瘤病毒(SasnauskasK.,etal.,Biol.Chem.380(3):381-386(1999);SasnauskasK.,etal.,Generationofrecombinantvirus-likeparticlesofdifferentpolyomavirusesinyeast.3rdInterationalWorkshop"Virus-likeparticlesasvaccines."Berlin,September26-29(2001)),RNA噬菌体,Ty,fr噬菌体,GA-噬菌体,AP205-噬菌体,及特别是Qbeta-噬菌体,豇豆褪绿斑驳病毒,豇豆花叶病毒,人乳头瘤病毒(HPV),牛乳头瘤病毒,猪细小病毒,细小病毒如B19,猪细小病毒(PPV)和犬细小病毒(CPV),杯状病毒(例如Norwalk病毒,兔出血病病毒[RHDV]),动物嗜肝DNA病毒核心抗原VLP,丝状/杆状植物病毒,包括但不限于烟草花叶病毒(TMV),马铃薯X病毒(PVX),番木瓜花叶病毒(PapMV),苜蓿花叶病毒(AlMV),及石茅高粱花叶病毒(JGMV),昆虫病毒如禽兽棚病毒(FHV)和四病毒,多瘤病毒如鼠多瘤病毒(MPyV),鼠亲肺病毒(MPtV),BK病毒(BKV),以及JC病毒(JCV)。正如本领域技术人员所已知,用作本发明免疫原性载体的VLP不限于任何特定形式。所述颗粒可以是化学合成的或者通过生物方法合成,其可以是天然或者非天然的。例如,这种类型的实施方案包括病毒样颗粒或者其重组形式。在更特别的实施方案中,所述VLP可包含或者由已知形成VLP的任何病毒的重组多肽组成。所述病毒样颗粒可进一步包含或者另外由这种多肽的一或多个片段以及这种多肽的变体组成。多肽的变体与其野生型相应物相比在氨基酸水平具有例如至少80%、85%、90%、95%、97%或者99%相同性。适用于本发明中的变体VLP可衍生自任何生物体,只要其能形成如本文定义的“病毒样颗粒”及可用作“免疫原性载体”即可。本发明优选的VLP包括HBV的壳体蛋白或者表面抗原(分别为HBcAg和HBsAg)或者其重组蛋白或片段,及RNA-噬菌体的外壳蛋白或者其重组蛋白或片段,更优选Qbeta的外壳蛋白或者其重组蛋白或片段。在一个实施方案中,与本发明的抗原性PCSK9肽组合使用的免疫原性载体是HBcAg蛋白。可用于本发明中的举例的HBcAg蛋白可由本领域技术人员容易地确定。例如包括但不限于HBV核心蛋白,如Yuanetal.,(J.Virol.73:10122-10128(1999))所述,及在WO00/198333、WO00/177158、WO00/214478、WO00/32227、WO01/85208、WO02/056905、WO03/024480和WO03/024481中描述。适用于本发明中的HBcAg可衍生自任何生物体,只要其能形成如本文定义的“病毒样颗粒”及可用作“免疫原性载体”即可。可用于本发明中的特别感兴趣的HBcAg变体是其中一或多个天然存在的半胱氨酸残基已经被缺失或取代的那些变体。本领域熟知游离半胱氨酸残基可涉及许多化学副反应中,包括二硫化物置换,与例如在与其它物质的组合治疗中注射的或形成的化学物质或代谢物反应,或者在暴露于UV光时直接氧化反应及与核苷酸反应。因此可以产生毒性加合物,特别是考虑到HBcAg具有结合核酸的强烈倾向的事实。所述毒性加合物因此分布在物种多样性之间,其可单独以低浓度存在,但是当总和在一起时达到毒性水平。见于上述事实,在已经被修饰以除去天然存在的半胱氨酸残基的疫苗组合物中使用HBcAg的一个优势是当抗原或抗原决定簇附着时毒性物质可以结合的位点数目减少或者完全消除。此外,本发明也可以使用加工形式的HBcAg,其缺少乙型肝炎核心抗原前体蛋白的N末端前导序列,特别是当HBcAg是在未发生加工的条件下产生的情况中(例如在细菌系统中表达)。本发明的其它HBcAg变体包括:i)与野生型HBcAg氨基酸序列之一或者其亚部分(subportion)具有至少80%、85%、90%、95%、97%或99%相同性的多肽序列,使用常规的已知计算机程序确定;ii)C-末端截短突变体,包括其中从C末端已经除去1、5、10、15、20、25、30、34或35个氨基酸的突变体;ii)N-末端截短突变体,包括其中从N末端已经除去1、2、5、7、9、10、12、14、15或17个氨基酸的突变体;iii)在N末端和C末端均截短的突变体,包括其中在N末端已经除去1、2、5、7、9、10、12、14、15或17个氨基酸及在C末端已经除去1、5、10、15、20、25、30、34或35个氨基酸的HBcAg。在本发明范围内的其它HBcAg变体蛋白是被修饰以增强外源表位的免疫原性呈递的那些变体,其中缺失一或多个四精氨酸重复,但是其中C末端半胱氨酸被保留(见例如WO01/98333),以及嵌合C末端截短HBcAg,如在WO02/14478、WO03/102165和WO04/053091中描述的那些。在另一个实施方案中,与本发明的抗原性PCSK9肽组合使用的免疫原性载体是HBsAg蛋白。可用于本发明中的HBsAg蛋白可易于由本领域技术人员确定。例如包括但不限于在US5792463、WO02/10416和WO08/020331中描述的HBV表面蛋白。适用于本发明中的HBsAg可衍生自任何生物体,只要其能形成如本文定义的“病毒样颗粒”及可用作“免疫原性载体”即可。在另一实施方案中,与本发明的抗原性PCSK9肽或多肽组合使用的免疫原性载体是Qbeta外壳蛋白。发现Qbeta外壳蛋白当在大肠杆菌中表达时自主装配为壳体(KozlovskaTM.etal.,GENE137:133-137(1993))。获得的壳体或者病毒样颗粒示出二十面噬菌体样壳体结构,直径为25nm及T=3准对称。进一步地,噬菌体Qss的晶体结构已经解决。所述壳体含有外壳蛋白的180个拷贝,其通过二硫键在共价五聚物和六聚物中连接(Golmohammadi,R.etal.,Structure4:5435554(1996)),导致Qbeta外壳蛋白的壳体的显著稳定性。Qbeta壳体蛋白也示出对于有机溶剂和变性剂的非同寻常的抗性。Qbeta外壳蛋白的壳体的高度稳定性是一优势特征,特别是用于本发明哺乳动物和人的免疫和接种中时。可用于本发明中的举例的Qbeta外壳蛋白可易于由本领域技术人员确定。例如在WO02/056905、WO03/024480、WO03/024481(以其全部内容援引加入本文)中已经广泛描述,包括但不限于在PIR数据库中揭示的氨基酸序列,登记号VCBPQbeta是指QbetaCP,登记号AAA16663是指QbetaA1蛋白,及其变体,包括其中N末端甲硫氨酸被裂解的变体蛋白,缺失100、150或180个氨基酸的C末端截短形式的QbetaA1,已经通过缺失或取代除去赖氨酸残基或者通过取代或插入添加赖氨酸残基而修饰的变体蛋白(见例如在WO03/024481中揭示的Qbeta-240、Qbeta-243、Qbeta-250、Qbeta-251和Qbeta-259,所述文献以其全部内容援引加入),以及与上述任何Qbeta核心蛋白显示至少80%、85%、90%、95%、97%或99%相同性的变体。适用于本发明的变体Qbeta外壳蛋白可衍生自任何生物体,只要其能形成如本文定义的“病毒样颗粒”及可用作“免疫原性载体”即可。本发明的抗原性PCSK9肽可以通过化学缀合或者通过遗传工程化融合配偶体的表达而与免疫原性载体偶联。所述偶联非必需是直接偶联,而是可以通过接头序列偶联。更通常地,在抗原性肽融合、缀合或另外附着于免疫原性载体的情况中,典型要在所述抗原性肽的一或两个末端加入间隔或者接头序列。这种接头序列通常包含由细胞的内体或者其它小泡区室的蛋白酶体、蛋白酶识别的序列。在一个实施方案中,本发明的肽作为与免疫原性载体的融合蛋白被表达。所述肽的融合可以通过插入在所述免疫原性载体一级序列中而实现,或者通过与所述免疫原性载体的N或C末端融合而实现。在后文当提及肽与免疫原性载体的融合蛋白时,涵盖与亚基序列任一端的融合或者在所述载体序列内内部插入所述肽。在后文提及融合时,其可以通过所述抗原性肽插入所述载体序列中、用所述抗原性肽取代所述载体的部分序列或者通过组合缺失、取代或插入而实现。当所述免疫原性载体是VLP时,嵌合抗原性肽-VLP亚基通常能自主装配成VLP。展示与其亚基融合的表位的VLP在后文也称作嵌合VLP。例如,EP0421635B描述了嵌合嗜肝DNA病毒核心抗原颗粒在病毒样颗粒中呈递外源肽序列的应用。可以在所述抗原性肽序列任一端加入侧翼氨基酸残基,所述抗原性肽序列与VLP亚基序列的任一端融合或者将这种肽序列内部插入VLP亚基序列中。甘氨酸和丝氨酸残基是在融合的肽加入侧翼序列中特别优选使用的氨基酸。甘氨酸残基赋予另外的柔性,其可以降低外源序列与VLP亚基序列融合的潜在不稳定效应。在本发明一特定实施方案中,所述免疫原性载体是HBcAgVLP。本领域已经描述了所述抗原性肽与HBcAg的N末端的融合蛋白(Neyrinck,S.etal.,NatureMed.5:11571163(1999))或者插入在所谓的主要免疫显性区域(MIR)中(Pumpens,P.andGrens,E.,Intervirology44:98114(2001)),WO01/98333),这些是本发明的特异实施方案。在MIR中有缺失的HBcAg的天然发生的变体也已经有描述(Pumpens,P.andGrens,E.,Intervirology44:98-114(2001)),与N或C末端的融合以及插入在MIR的相应于与野生型HBcAg相比是缺失位点的位置是本发明进一步的实施方案。与C末端的融合也已经有描述(Pumpens,P.andGrens,E.,Intervirology44:98-114(2001))。本领域技术人员将易于发现关于怎样使用传统分子生物学技术构建融合蛋白的指导。本领域已经描述了编码HBcAg和HBcAg融合蛋白及可用于表达HBcAg和HBcAg融合蛋白的载体和质粒(Pumpens,P.and#38;Grens,E.Intervirology44:98-114(2001),Neyrinck,S.etal.,NatureMed.5:1157-1163(1999)),其可用于实施本发明。优化自主装配效力及展示插入在HBcAg的MIR中的表位的一个重要因素是插入位点的选择,以及在插入时从HBcAg序列MIR内缺失的氨基酸数目(Pumpens,P.andGrens,E.,Intervirology44:98-114(2001);EP0421635;美国专利No.6,231,864),或者换句话说,HBcAg的哪些氨基酸用新表位取代。例如,已经描述了用外源表位取代HBcAg氨基酸76-80、79-81、79-80、75-85或者80-81(Pumpens,P.andGrens,E.,Intervirology44:98-114(2001);EP0421635;US6,231,864,WO00/26385)。HBcAg含有长精氨酸尾(Pumpens,P.andGrens,E.,Intervirology44:98-114(2001)),其对于壳体装配不是必须的并且能结合核酸(Pumpens,P.andGrens,E.,Intervirology44:98-114(2001))。包含或者缺少这个精氨酸尾的HBcAg是本发明的两个实施方案。在本发明另一特异实施方案中,所述免疫原性载体是RNA噬菌体优选Qbeta的VLP。RNA噬菌体的主要外壳蛋白当在细菌及特别是在大肠杆菌中表达时自发装配成VLP。本领域已经描述了融合蛋白构建体,其中抗原性肽与截短形式的Qbeta的A1蛋白C末端融合或者插入在所述A1蛋白中(Kozlovska,T.M.,etal.,Intervirology,39:9-15(1996))。所述A1蛋白是通过在UGA终止密码子的抑制作用产生的,长度为329个氨基酸,或者如果考虑到在N末端甲硫氨酸的裂解则为328个氨基酸。在丙氨酸(由QbetaCP基因编码的第二个氨基酸)之前的N末端甲硫氨酸的裂解通常发生在大肠杆菌中,对于Qbeta外壳蛋白的N末端也是这种情况。所述A1基因的一部分,UGA琥珀密码子的3’部分编码所述CP延伸,其长度为195个氨基酸。所述抗原性肽插入在CP延伸的第72与73位之间是本发明进一步的实施方案(Kozlovska,T.M.,etal.,Intervirology39:9-15(1996))。所述抗原性肽融合在C末端截短的QbetaA1蛋白的C末端是本发明进一步优选的实施方案。例如,Kozlovskaetal.,(Intervirology,39:9-15(1996))描述了QbetaA1蛋白质融合,其中所述表位融合在第19位截短的QbetaCP延伸的C末端。如Kozlovskaetal.(Intervirology,39:9-15(1996))所述,展示融合的表位的颗粒的装配典型需要存在A1蛋白-抗原融合体及野生型CP以形成嵌合颗粒。然而,本发明也包括包含病毒样颗粒及从而特别包含RNA噬菌体Qbeta外壳蛋白的VLP(其只是由具有与其融合的抗原性肽的VLP亚基组成)的实施方案。嵌合颗粒的产生可以通过多种方式实现。Kozlovskaetal.,Intervirology,39:9-15(1996)描述了三种方法,这三种方法均可用于实施本发明。在第一种方法中,融合的表位在VLP上的有效展示通过质粒在大肠杆菌菌株中的表达而实现,所述质粒编码在CP与CP延伸之间具有UGA终止密码子的QbetaA1l蛋白融合体,所述大肠杆菌菌株携带编码克隆的UGA阻抑物tRNA的质粒,使得UGA密码子翻译成Trp(pISM3001质粒(SmileyB.K.,etal.,Gene134:33-40(1993)))。在另一种方法中,所述CP基因终止密码子被修饰为UAA,表达A1蛋白-抗原融合体的第二质粒被共转化。所述第二质粒编码不同的抗生素抗性,及复制起点与第一质粒相容。在第三种方法中,CP和A1蛋白-抗原融合体以双顺反子形式编码,与启动子如Trp启动子可操纵地连接,如Kozlovskaetal.,Intervirology,39:9-15(1996)的图1所述。适于抗原或者抗原决定簇的融合的其它VLP在WO03/024481中描述,包括噬菌体fr、RNAphaseMS-2、乳头瘤病毒的壳体蛋白、反转录转座子Ty、酵母以及逆转录病毒样颗粒、HIV2Gag、豇豆花叶病毒、细小病毒VP2VLP、HBsAg(US4,722,840,EP0020416B1)。适于实施本发明的嵌合VLP的实例也包括在Intervirology39:1(1996)中描述的那些。预期用于本发明中的VLP的其它实例是:HPV-1、HPV-6、HPV-11、HPV-16、HPV-18、HPV-33、HPV-45、CRPV、COPV、HIVGAG、烟草花叶病毒、SV-40的病毒样颗粒、多瘤病毒、腺病毒、单纯疱疹病毒、轮状病毒和Norwalk病毒。对于与免疫原性载体偶联或者不偶联的本发明的任何重组表达的抗原性PCSK9肽,编码所述肽或蛋白质的核酸也是本发明的一方面,包含所述核酸的表达载体以及含有所述表达载体的宿主细胞(自主或染色体插入的)也是本发明的一方面。通过将其在上述宿主细胞中表达及从中分离免疫原的重组产生所述肽或蛋白质的方法是本发明的另一方面。全长天然PCSK9分子或者编码其的全长天然DNA序列不包含在本发明内。在另一个实施方案中,本发明的肽使用本领域熟知的技术与免疫原性载体化学偶联。通过单点缀合(例如N末端或C末端点)或者作为锁定的结构(lockeddownstructure),其中肽的两端缀合于免疫原性载体蛋白或者缀合于支架结构如VLP,可以发生缀合以使得肽自由运动。通过本领域技术人员已知的缀合化学发生缀合,如通过半胱氨酸残基、赖氨酸残基或者通常已知作为缀合点的其它羧基部分,如谷氨酸或者天冬氨酸。因此,例如对于直接共价偶联而言,可以利用碳二亚胺、戊二醛或者(N-[y-malcimidobutyryloxy]琥珀酰亚胺酯,利用可商购的异双功能接头如CDA和SPDP(根据厂商指导使用)。肽、特别是环化肽与蛋白质载体通过酰基肼肽衍生物缀合的例子在WO03/092714中描述。在偶联反应之后,所述免疫原可易于通过透析方法、凝胶过滤方法、分级分离方法等分离和纯化。以半胱氨酸残基为末端的肽(优选在环化区域外面有接头)可以通过马来酰亚胺化学与载体蛋白质便利地缀合。当所述免疫原性载体是VLP时,具有相同氨基酸序列或者不同氨基酸序列的一些抗原性肽可以与单一VLP分子偶联,优选获得以定向方式呈递一些抗原决定簇的重复及有序结构,如WO00/32227、WO03/024481、WO02/056905和WO04/007538所述。在优选的实施方案中,所述抗原性PCSK9肽通过化学交联、典型及优选通过使用异双功能交联剂结合VLP。本领域已知一些异双功能交联剂。在一些实施方案中,所述异双功能交联剂含有可与第一附着位点反应的官能团,即与VLP或VLP亚基的赖氨酸残基的侧链氨基基团反应,另一官能团可与优选的第二附着位点反应,即与所述抗原性肽融合的半胱氨酸残基反应,任选地也通过还原用于反应。所述方法的第一个步骤典型被称作衍生化,是VLP与交联剂的反应。这个反应的产物是激活的VLP,也称作激活的载体。在第二个步骤中,使用常规方法如凝胶过滤或者透析方法,未反应的交联剂被除去。在第三个步骤中,所述抗原性肽与激活的VLP反应,这个步骤典型被称作偶联步骤。未反应的抗原性肽可以在第四个步骤中任选地除去,例如通过透析。一些异双功能交联剂为本领域已知。这些包括优选的交联剂SMPH(Pierce)、Sulfo-MBS、Sulfo-EMCS、Sulfo-GMBS、Sulfo-SIAB、Sulfo-SMPB、Sulfo-SMCC、SVSB、SIA及其它交联剂,例如得自PierceChemicalCompany(Rockford,IL,USA)并具有一个与氨基反应的官能团及一个与半胱氨酸残基反应的官能团。上述交联剂均导致硫醚键形成。适用于实施本发明的另一类交联剂特征在于在偶联时在所述抗原性肽与VLP之间导入二硫键。属于这个类别的优选交联剂包括例如SPDP和Sulfo-LC-SPDP(Pierce)。VLP与交联剂的衍生化程度可以通过改变实验条件而影响,所述实验条件如每种反应配偶体的浓度、一种试剂相对于另一种的过量、pH、温度和离子强度。偶联度,即抗原性肽/VLP亚基的量可以通过改变上述实验条件而调节,以符合疫苗的要求。抗原性肽与VLP结合的另一种方法是VLP表面上赖氨酸残基与抗原性肽上半胱氨酸残基的连接。在一些实施方案中,可需要含有半胱氨酸残基作为第二附着位点或者作为其一部分的氨基酸接头与抗原性肽融合以偶联VLP。通常,优选柔性氨基酸接头。所述氨基酸接头的例子选自:(a)CGG;(b)N-末端γ1-接头;(c)N-末端γ3-接头;(d)Ig铰链区;(e)N-末端甘氨酸接头;(f)(G)kC(G)n,n=0-12及k=0-5;(g)N-末端甘氨酸-丝氨酸接头;(h)(G)kC(G)m(S)i(GGGGS)n,n=0-3,k=0-5,m=0-10,i=0-2;(i)GGC;(k)GGC-NH2;(1)C-末端γ1-接头;(m)C-末端γ3-接头;(n)C-末端甘氨酸接头;(o)(G)nC(G)k,n=0-12及k=0-5;(p)C-末端甘氨酸-丝氨酸接头;(q)(G)m(S)t(GGGGS)n(G)oC(G)k,n=0-3,k=0-5,m=0-10,1=0-2及o=0-8。氨基酸接头的进一步实例是免疫球蛋白的铰链区,甘氨酸-丝氨酸接头(GGGGS)n,及甘氨酸接头(G)n,所有均进一步含有半胱氨酸残基作为第二附着位点及任选地含有进一步的甘氨酸残基。所述氨基酸接头的典型优选实例是:N-末端γ1:CGDKTHTSPP,C-末端γ1:DKTHTSPPCG,N-末端γ3:CGGPKPSTPPGSSGGAP,C-末端γ3:PKPSTPPGSSGGAPGGCG,N-末端甘氨酸接头:GCGGGG及C-末端甘氨酸接头:GGGGCG。当疏水性抗原性肽与VLP结合时,特别适用于本发明中的其它氨基酸接头是:对于N末端接头是CGKKGG或CGDEGG,对于C末端接头是GGKKGC和GGEDGC。对于C末端接头,所述末端半胱氨酸任选地是C末端酰胺化的。在本发明的一些实施方案中,在所述肽C末端的GGCG、GGC或GGC-NH2(NH2表示酰胺化)接头或者在N末端的CGG是优选的氨基酸接头。通常,甘氨酸残基被插入在较大(bulky)氨基酸与用作第二附着位点的半胱氨酸之间,以避免在偶联反应中所述较大氨基酸的潜在位阻现象。在本发明的进一步实施方案中,氨基酸接头GGC-NH2与所述抗原性肽的C末端融合。抗原性肽上存在的半胱氨酸残基需要以其还原状态与激活的VLP上的异双功能交联剂反应,即需要利用游离的半胱氨酸或者具有游离巯基的半胱氨酸残基。在作为结合位点的半胱氨酸残基是氧化形式的情况中,例如其形成二硫键,需要用例如DTT、TCEP或者对-巯基乙醇还原这个二硫键。低浓度的还原剂与偶联反应相容,如WO02/05690所述,而较高浓度则抑制偶联反应,如本领域技术人员已知,在这种情况中,在偶联之前需要除去还原剂或者降低其浓度,例如通过透析、凝胶过滤或者反相HPLC进行。通过使用上述方法的异-双功能交联剂使所述抗原性肽与VLP结合,使得所述抗原性肽与VLP以定向方式偶联。使所述抗原性肽与VLP结合的其它方法包括使用碳二亚胺EDC和NHS使所述抗原性肽与VLP交联的方法。在其它方法中,使用同-双功能交联剂如戊二醛、DSGBM[PEO]4、BS3(PierceChemicalCompany,Rockford,IL,USA)或者具有与VLP的胺基或羧基反应的官能团的其它已知的同-双功能交联剂使所述抗原性肽附着于VLP。VLP与抗原性肽结合的其它方法包括其中VLP是生物素化的及所述抗原性肽作为链霉抗生物素蛋白-融合蛋白表达的方法,或者其中抗原性肽与VLP均是生物素化的方法,例如WO00/23955所述。在这种情况中,通过调节抗原性肽与链霉抗生物素蛋白的比率而使所述抗原性肽可以首先结合链霉抗生物素蛋白或者抗生物素蛋白,以便仍有游离结合位点可用于与在下一步骤中加入的VLP结合。或者,所有成分可以在“一锅”反应中混合。可以使用其它配体-受体对作为结合剂以使抗原性肽与VLP结合,其中利用可溶形式的受体和配体,其能与VLP或抗原性肽交联。或者,所述配体或受体可以与抗原性肽融合,由此介导与分别与所述受体或配体化学结合或者融合的VLP的结合。融合也可以通过插入或取代而实现。如果空间排列允许,一或几个抗原分子可以附着于RNA噬菌体外壳蛋白的壳体或VLP的一个亚基,优选通过RNA噬菌体的VLP的暴露的赖氨酸残基进行。RNA噬菌体的外壳蛋白VLP及特别是QP外壳蛋白VLP的一个特异特征因此是每个亚基可以偶联若干抗原。这样可以产生密度抗原阵列。Q外壳蛋白的VLP或者壳体在其表面上展示限定数目的赖氨酸残基,具有限定拓扑结构,即三个赖氨酸残基指向壳体内部并与RNA相互作用,以及四个其它赖氨酸残基暴露于壳体外面。这些限定性质有益于抗原附着于其中赖氨酸残基与RNA相互作用的所述颗粒的外面而不是所述颗粒的内部。其它RNA噬菌体外壳蛋白的VLP在其表面上也具有限定数目的赖氨酸残基以及这些赖氨酸残基的限定拓扑结构。在本发明的进一步实施方案中,第一附着位点是赖氨酸残基和/或第二附着位点包含巯基或者半胱氨酸残基。在本发明的更进一步的实施方案中,第一附着位点是赖氨酸残基,第二附着位点是半胱氨酸残基。在本发明的进一步实施方案中,所述抗原或抗原决定簇通过半胱氨酸残基与RNA噬菌体外壳蛋白VLP的赖氨酸残基结合,特别是与Qbeta外壳蛋白的VLP结合。衍生自RNA噬菌体的VLP的另一优势是其在细菌中的高表达产量,使得可以低成本产生大量材料。此外,VLP作为载体的使用使得可以形成具有可变抗原密度的大型抗原阵列和缀合物。特别地,RNA噬菌体的VLP的使用及从而RNA噬菌体Qbeta外壳蛋白的VLP的使用可以实现非常高的表位密度。根据本发明的一个实施方案,本文揭示的抗原性PCSK9肽与CRM197直接或者通过本文揭示的肽接头之一连接,优选化学交联,以产生免疫原。在一个实施方案中,本文揭示的抗原性PCSK9肽与CRM197通过如本文所述化学交联方式及优选通过使用如上述异双功能交联剂连接。与CRM197一起使用的优选的异双功能交联剂是BAANS(溴乙酸N-羟基琥珀酰亚胺酯)、SMPH(琥珀酰亚氨基-6-[β-马来酰亚氨基丙酰氨基]己酸酯)、Sulfo-MBS、Sulfo-EMCS、Sulfo-GMBS、Sulfo-SIAB、Sulfo-SMPB、Sulfo-SMCC、SVSB、SIA以及得自例如PierceChemicalCompany(Rockford,IL,USA)的其它交联剂。在本发明优选的实施方案中,所述异双功能交联剂是BAANS或SMPH。或者,在本发明中也可以使用适合在所述抗原性肽与CRM197之间导入二硫键的交联剂。属于这个类别的优选交联剂包括例如SPDP和Sulfo-LC-SPDP(Pierce)。在一个具体的实施方案中,当本文揭示的抗原性PCSK9肽序列包含半胱氨酸时,所述抗原性PCSK9肽可以通过所述半胱氨酸直接与CRM197共价连接。在本发明的一些实施方案中,本发明的免疫原性组合物可包含免疫原性缀合物的混合物,即偶联于一或若干个本发明的抗原性PCSK9肽的免疫原性载体。因此,这些免疫原性组合物可以由氨基酸序列不同的免疫原性载体组成。例如,可以制备这样的疫苗组合物,其包含“野生型”VLP和其中一或多个氨基酸残基已经被改变(例如缺失、插入或取代)的修饰的VLP蛋白。或者,可以使用相同免疫原性载体,但是偶联于不同氨基酸序列的抗原性PCSK9肽。本发明因此还涉及产生本发明的免疫原的方法,所述方法包括:i)提供本发明的抗原性PCSK9肽,ii)提供本发明的免疫原性载体,优选VLP,及iii)组合所述抗原性PCSK9肽及所述免疫原性载体。在一个实施方案中,所述组合步骤通过化学交联、优选通过异双功能交联剂进行。在本发明的一个实施方案中,本文揭示的抗原性PCSK9肽与免疫原性载体分子连接。在一个实施方案中,所述免疫原性载体选自本文所述任何免疫原性载体。在另一实施方案中,所述免疫原性载体选自:血清白蛋白,如牛血清白蛋白(BSA),球蛋白,甲状腺球蛋白,血红蛋白,血蓝蛋白(特别是匙孔血蓝蛋白[KLH])以及病毒样颗粒(VLP)。在优选的实施方案中,所述免疫原性载体是白喉类毒素,白喉毒素的CRM197突变体,破伤风类毒素,匙孔血蓝蛋白或者病毒样颗粒(VLP)。在更优选的实施方案中,所述免疫原性载体是DT、CRM197或者VLP,所述VLP选自HBcAgVLP、HBsAgVLP、QbetaVLP、PP7VLP、PPVVLP、Norwalk病毒VLP或者本文揭示的任何变体。在更优选的实施方案中,所述免疫原性载体是噬菌体VLP,如QbetaVLP,选自QbetaCP;QbetaA1,Qbeta-240,Qbeta-243,Qbeta-250,Qbeta-251及Qbeta-259(在WO03/024481中揭示)或者PP7。在另一优选的实施方案中,所述免疫原性载体是CRM197。在一个实施方案中,所述免疫原性载体与本文揭示的抗原性PCSK9肽直接或者通过接头共价连接。在一个实施方案中,所述免疫原性载体通过如本文所述表达融合蛋白与本文揭示的所述抗原性PCSK9肽连接。在另一个实施方案中,所述抗原性PCSK9肽通过如本文所述化学交联方式及优选通过使用异双功能交联剂与免疫原性载体优选VLP连接。本领域已知一些异双功能交联剂。在一些实施方案中,所述异双功能交联剂含有可以与第一附着位点反应的官能团,即与VLP或VLP亚基的赖氨酸残基的侧链氨基反应,以及含有另一个官能团,该官能团可与优选的第二附着位点反应,即与所述抗原性肽融合的半胱氨酸残基反应,所述半胱氨酸残基经还原反应而可用于反应。包含接头的本发明抗原性PCSK9肽在本发明的一个实施方案中,本文揭示的抗原性PCSK9肽进一步包含在其N末端或者在其C末端或者在N和C两个末端的接头,所述接头在化学交联反应中能与所述免疫原性载体的附着位点反应。在一个实施方案中,本文揭示的所述抗原性PCSK9肽进一步包含在其C末端的接头,所述接头化学式为(G)nC、(G)nSC或者(G)nK,优选(G)nC,其中n是选自0、1、2、3、4、5、6、7、8、9和10的整数,优选选自0、1、2、3、4和5,更优选选自0、1、2和3,最优选n是0或1(在n等于0时,该化学式代表半胱氨酸)。优选本文揭示的所述抗原性PCSK9肽进一步包含在其C末端的具有化学式GGGC、GGC、GC或C的接头。在本发明另一实施方案中,本文揭示的所述抗原性PCSK9肽进一步包含在其N末端的接头,所述接头的化学式是C(G)n、CS(G)n或者K(G)n,优选C(G)n,其中n是选自0、1、2、3、4、5、6、7、8、9和10的整数,优选选自0、1、2、3、4和5,更优选选自0、1、2和3,最优选n是0或1(在n等于0时,该化学式代表半胱氨酸)。优选本文揭示的所述抗原性PCSK9肽进一步包含在其N末端的具有化学式CGGG、CGG、CG或C的接头。在另一实施方案中,本文揭示的所述抗原性PCSK9肽进一步包含在其C末端的接头,该接头的化学式是(G)nC、(G)nSC或者(G)nK,优选(G)nC,其中n是选自0、1、2、3、4、5、6、7、8、9和10的整数,优选选自0、1、2、3、4和5,更优选选自0、1、2和3,最优选n是0或1(在n等于0时,该化学式代表半胱氨酸)以及包含在其N末端的接头,该接头的化学式是C(G)n、CS(G)n或者K(G)n,优选C(G)n,其中n是选自0、1、2、3、4、5、6、7、8、9和10的整数,优选0、1、2、3、4和5,更优选0、1、2和3,最优选n是0或1(在n等于0时,该化学式代表半胱氨酸)。优选本文揭示的所述抗原性PCSK9肽进一步包含在其N末端的具有化学式CGGG、CGG、CG或C的接头以及在其C末端的具有化学式GGGC、GGC、GC或C的接头。优选地,本文揭示的所述抗原性PCSK9肽进一步包含在其N末端的半胱氨酸及在其C末端的半胱氨酸。进一步包含这种接头的代表性的抗原性PCSK9肽如SEQIDNO:313、314、315、316、317、322、323、324、325、326、327、328、401、402、403、404、405、406、407、408、409、410、411、412、413、414、415、416、417、418和419所示。进一步包含这种接头的代表性的抗原性PCSK9肽如SEQIDNO:313、314、315、316、317、322、323、324、325、326、327和328所示。优选的包含接头的...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1