基于3D打印制备人工神经导管的方法和人工神经导管与流程
本发明属于医疗器械技术领域,具体地说,是涉及一种基于3D打印制备人工神经导管的方法和人工神经导管。
背景技术:
周围神经损伤是临床常见的四肢严重创伤的原因。
据《科学时报》(2004)报道,在全球每年新增创伤病例中,周围神经损伤病例约占1.5%~4.0%。我国周围神经损伤病例每年新增60万~90万例,其中需要通过神经移植来修复神经的病例约为30万~45万例。周围神经缺损的修复,尤其是长距离缺损的修复,一直是临床上较为棘手的难题。
目前最常用的方法是:利用自体次要神经移植、同种异体神经移植、异种异体神经移植等来桥接修复损伤的主要神经断端,促进受损的神经再生,从而达到一定程度的功能恢复。其中,同种异体神经和异种异体神经移植由于存在一定的免疫反应和传染疾病的风险,而免疫抑制剂的应用会造成机体免疫力低下,导致患者继发肿瘤和感染性疾病的发生,临床应用有一定的困难;因此,自体神经移植由于不存在免疫反应和传染疾病的风险而成为目前周围神经外科领域神经修复的金标准。
然而,自体神经移植的修复方法也存在一定的缺点:自体神经移植需要手术切取移植的神经,造成神经来源有限。并且,还需要牺牲次要神经的功能,造成供区神经瘤、疤痕的形成及感染的风险等,这些缺点限制了其临床应用。
技术实现要素:
本申请提供了一种基于3D打印制备人工神经导管的方法和人工神经导管,解决现有自体神经移植限制临床应用的技术问题。
为解决上述技术问题,本申请采用以下技术方案予以实现:
提出一种基于3D打印制备人工神经导管的方法,包括如下步骤:步骤1:使用蚕丝蛋白制备丝素蛋白溶液;步骤2:基于步骤1制备的丝素蛋白溶液,制备丝素蛋白微球悬浮液;步骤3:在丝素蛋白微球中加载生长因子;步骤4、制备含神经细胞的蚕丝生物墨水;步骤5:使用步骤3制备的加载有生长因子的丝素蛋白微球和PLGA制备复合材料;步骤6:在3D打印机的第一打印喷头中装入步骤4制备的蚕丝生物墨水,在3D打印机的第二打印喷头中装入步骤5制备的复合材料;先控制所述第二打印喷头打印人工神经导管的外管,然后控制所述第一打印喷头打印人工神经导管的多个内管;步骤7:将3D打印的人工神经导管进行细胞培养分化形成神经导管。
进一步的,所述步骤1,具体为:将蚕丝蛋白放置于碳酸钠溶液中脱胶并烘干;用溴化锂水溶液溶解烘干的蚕丝蛋白;将溶解有烘干蚕丝蛋白的溴化锂水溶液透析处理,通过离子交换去除溶液中的溴化锂,离心后获得再生丝素水溶液;将所述再生丝素水溶液置于烘箱中缓慢浓缩,并置于4℃储存。
进一步的,所述步骤2,具体为:将步骤1制备的丝素蛋白溶液与PEG溶液混合并搅拌,搅拌同时滴加乳化剂;将所述丝素蛋白溶液、PEG溶液和乳化剂的混合溶液冷冻48h;将冷冻的混合溶液在室温下融化得到乳白色溶液;将所述乳白色溶液离心,弃掉上清液后,用去离子水洗涤三次,超声后再次离心,弃掉沉淀得到分散性良好的丝素蛋白微球悬浮液;所述PEG溶液的质量体积比为10%-30%,所述丝素蛋白溶液与所述PEG溶液的共混溶液在20℃温度下以100rpm的转速搅拌1分钟;所述乳化剂为Tween-20、Tween-40、Tween-60和/或Tween-80;所述乳化剂与所述丝素蛋白和PEG的混合溶液的体积比为1:3-3:1;所述乳白色溶液以8000rmp的速度离心15分钟;超声时长为15分钟;再次离心的转速为500rmp,时长为15分钟。
进一步的,所述步骤3,具体为:将所述丝素蛋白微球悬浮液置于1毫升的浓度为15微克/毫升的生长因子溶液中,在4℃下孵育24h后,以12000r/min的速度离心3分钟,获取上清液;其中,所述生长因子为NGF、NT-3、NT-4和/或BDNF。
进一步的,所述步骤4,具体为:在磷酸盐缓冲液中加入明胶,搅拌溶解;在搅拌溶解的磷酸盐缓冲液中加入琼脂、蚕丝蛋白溶液、多元醇溶液、神经细胞、载有生长因子的丝素蛋白微球悬浮液,顺时针搅拌至均匀,放置于5℃环境下保存备用;其中,所述神经细胞为雪旺细胞、神经干细胞和/或嗅鞘细胞;所述多元醇溶液为乙二醇溶液、丙三醇溶液和/或丁四醇溶液;所述明胶含量为10%-30%;所述蚕丝蛋白溶液的含量为30%-50%;所述多元醇溶液的含量为0.5%-2%;所述琼脂含量为10%-30%;;所述载有生长因子的丝素蛋白微球悬浮液的含量为1%-5%。
进一步的,所述步骤5,具体为:将步骤3制备的加载有生长因子的丝素蛋白溶液在室温下浇筑成丝素蛋白膜;使用共溶剂将所述丝素蛋白膜与PLGA材料溶解在一起,并在室温下浇筑成复合膜;将所述复合膜在室温下干燥,除去共溶剂,并置于真空干燥箱中抽真空干燥,使共溶剂完全挥发,然后置于4℃环境下备用;其中,所述共溶剂为二氯甲烷、三氯甲烷和/或六氟异丙醇;加载有生长因子的丝素蛋白与PLGA的质量配比为1:10-10:1。
进一步的,所述人工神经导管的外管打印的直径为2mm-10mm,长度为20mm-40mm;所述人工神经导管的内管的个数为多个,每个内管的打印直径为0.1mm-10mm,长度为10mm-30mm;所述外管和所述内管均为多孔结构,孔隙大小为100-300微米。
进一步的,所述步骤1中,所述脱胶过程具体包括:将蚕丝蛋白放入浓度为4.24g/L的碳酸钠水溶液中搅拌煮沸10-50min,然后用去离子水清洗干净;所述溴化锂水溶液的浓度为9.5±0.3mol/L;所述透析处理包括:将所述溶解有蚕丝蛋白的溴化锂水溶液用截留分子量为3500的透析袋浸在去离子水中透析3天,期间每两小时换一次去离子水;所述再生丝素水溶液置于烘箱中缓慢浓缩的浓缩条件为60℃,容器表面用带有小孔的保鲜膜覆盖,缓慢浓缩24h后取出,浓度为10%-30%。
提出一种人工神经导管,包括外管和多个位于所述外管内的内管;由基于3D打印制备人工神经导管的方法制备。所述基于3D打印制备人工神经导管的方法,包括如下步骤:步骤1:使用蚕丝蛋白制备丝素蛋白溶液;步骤2:基于步骤1制备的丝素蛋白溶液,制备丝素蛋白微球悬浮液;步骤3:在丝素蛋白微球中加载生长因子;步骤4、制备含神经细胞的蚕丝生物墨水;步骤5:使用步骤3制备的加载有生长因子的丝素蛋白微球和PLGA制备复合材料;步骤6:在3D打印机的第一打印喷头中装入步骤4制备的蚕丝生物墨水,在3D打印机的第二打印喷头中装入步骤5制备的复合材料;先控制所述第二打印喷头打印人工神经导管的外管,然后控制所述第一打印喷头打印人工神经导管的多个内管;步骤7:将3D打印的人工神经导管进行细胞培养分化形成神经导管。
与现有技术相比,本申请的优点和积极效果是:本申请提出的基于3D打印制备人工神经导管的方法和人工神经导管,采用三维生物打印技术制备具有统一孔径、管中管结构的人工神经导管,外管在三维空间内沿纵向排列形成套管,套管的外部直径可根据实际需要调整,形成一体化的仿生结构更有利于促进神经再生;外管内部为多根中空的内管,内管为神经细胞的附着生长提供了基体,同时为神经轴突结合提供了引导作用,从而加快神经细胞再生速率。外管和内管打印使用不同的打印材料,都具有一定的机械性能,且所用的材料均利于细胞增殖与生长,无毒性,组织相容性良好;内管降解速度较快,不会对神经的再生造成阻碍,外管的降解周期长,可以为再生神经提供力学支撑,同时防止管外结蹄组织入侵而形成瘢痕。
作为打印材料基础的丝素蛋白分子中有独特的疏水、亲水性氨基酸侧链有序排列,亲疏水链段的间隔排列为其提供了自组装的可能, 采用诱导剂、冷冻-解冻等一系列处理方式使丝素蛋白的分子构象发生转变来制备丝素蛋白微球,并加载生长因子,使得载有生长因子的丝素蛋白微球能够达到生长因子的缓慢释放,促进神经细胞的增殖和分化。丝素蛋白作为一种天然生物材料,与多元醇、明胶、琼脂以及神经细胞符合,能够打印出稳定存在的结构,使得细胞存活率高达95%以上。
使用本申请提出的基于3D打印制备人工神经导管的方法制备出的人工神经导管来桥接修复损伤的主要神经断端,能够促进受损的神经再生,从而达到一定程度的功能恢复,无需自体神经移植,解决了现有自体神经移植限制临床应用的技术问题。
结合附图阅读本申请实施方式的详细描述后,本申请的其他特点和优点将变得更加清楚。
附图说明
图1 为本申请提出的基于3D打印制备人工神经导管的方法的流程图;
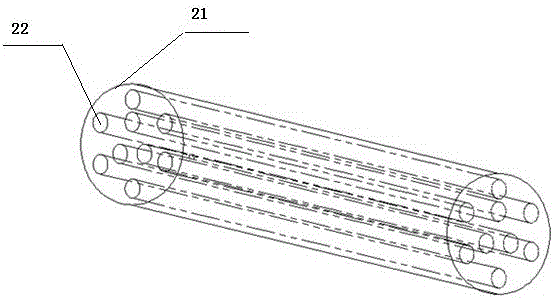
图2为本申请提出的人工神经导管的打印结构图。
具体实施方式
下面结合附图对本申请的具体实施方式作进一步详细地说明。
本申请旨在提供一种基于3D打印制备人工神经导管的方法和人工神经导管,能够通过桥接修复损伤的主要神经断端,促进受损的神经再生,从而达到一定程度的功能恢复,无需自体神经移植,解决现有自体神经移植限制临床应用的技术问题。
理想的组织工程化人工神经应该由特定三维支架结构的可降解神经导管和在支架上有序排列的雪旺细胞(SC)构成,在神经导管内植入含SC的可降解生物膜支架材料,可使神经导管内形成有利于神经再生的微环境。
在天然神经中,轴突在神经内膜管内集结成束是一个重要的结构特点,自体移植神经包含主要由纵向胶原纤维组成的神经内管膜,一方面为轴突生长锥提供基底膜,另一方面也可供其他非神经元细胞贴附并进一步伸长、迁移和成熟。这种在自体移植神经中存在的重要结构,可能是自体神经移植修复神经缺损,尤其是长距离缺损,中能达到更好的神经再生效果和功能重建的主要原因。
基于上述,如图1所示,本申请提出的基于3d 打印制备人工神经导管的方法,包括如下步骤:
步骤S11:使用蚕丝蛋白制备丝素蛋白溶液。
具体的:将蚕丝蛋白放置于碳酸钠溶液中脱胶并烘干;用溴化锂水溶液溶解烘干的蚕丝蛋白;将溶解有烘干蚕丝蛋白的溴化锂水溶液透析处理,通过离子交换去除溶液中的溴化锂,离心后获得再生丝素水溶液;将再生丝素水溶液置于烘箱中缓慢浓缩,并置于4℃储存。
其中,脱胶过程具体包括:将蚕丝蛋白放入浓度为4.24g/L的碳酸钠水溶液中搅拌煮沸10-50min,然后用去离子水清洗干净。
溴化锂水溶液的浓度为9.5±0.3mol/L;透析处理包括:将溶解有蚕丝蛋白的溴化锂水溶液用截留分子量为3500的透析袋浸在去离子水中透析3天,期间每两小时换一次去离子水。
再生丝素水溶液置于烘箱中缓慢浓缩的浓缩条件为60℃,容器表面用带有小孔的保鲜膜覆盖,缓慢浓缩24h后取出,浓度为10%-30%。
步骤S12:基于步骤11制备的丝素蛋白溶液,制备丝素蛋白微球悬浮液。
具体的,将步骤1制备的丝素蛋白溶液与PEG溶液混合并搅拌,搅拌同时滴加乳化剂;将丝素蛋白溶液、PEG溶液和乳化剂的混合溶液冷冻48h;将冷冻的混合溶液在室温下融化得到乳白色溶液;将乳白色溶液离心,弃掉上清液后,用去离子水洗涤三次,超声后再次离心,弃掉沉淀得到分散性良好的丝素蛋白微球悬浮液。
其中,PEG溶液的质量体积比为10%-30%,丝素蛋白溶液与PEG溶液的共混溶液在20℃温度下以100rpm的转速搅拌1分钟;乳化剂为Tween-20、Tween-40、Tween-60和/或Tween-80;乳化剂与丝素蛋白和PEG的混合溶液的体积比为1:3-3:1;乳白色溶液以8000rmp的速度离心15分钟;超声时长为15分钟;再次离心的转速为500rmp,时长为15分钟。
步骤S13:在丝素蛋白微球中加载生长因子。
具体的,将丝素蛋白微球悬浮液置于1毫升的浓度为15微克/毫升的生长因子溶液中,在4℃下孵育24h后,以12000r/min的速度离心3分钟,获取上清液;其中,生长因子为NGF、NT-3、NT-4和/或BDNF。
步骤S14:制备含神经细胞的蚕丝生物墨水。
具体的,在磷酸盐缓冲液中加入明胶,搅拌溶解;在搅拌溶解的磷酸盐缓冲液中加入琼脂、蚕丝蛋白溶液、多元醇溶液、神经细胞、载有生长因子的丝素蛋白微球悬浮液,顺时针搅拌至均匀,放置于5℃环境下保存备用。
其中,神经细胞为雪旺细胞、神经干细胞和/或嗅鞘细胞;多元醇溶液为乙二醇溶液、丙三醇溶液和/或丁四醇溶液;明胶含量为10%-30%;蚕丝蛋白溶液的含量为30%-50%;多元醇溶液的含量为0.5%-2%;琼脂含量为10%-30%;;载有生长因子的丝素蛋白微球悬浮液的含量为1%-5%;磷酸缓冲液的细胞密度为5X10(-6)cells/mL。
步骤S15:使用步骤13制备的加载有生长因子的丝素蛋白微球和PLGA制备复合材料。
具体的,将步骤13制备的加载有生长因子的丝素蛋白溶液在室温下浇筑成丝素蛋白膜;使用共溶剂将丝素蛋白膜与PLGA材料溶解在一起,并在室温下浇筑成复合膜;将复合膜在室温下干燥,除去共溶剂,并置于真空干燥箱中抽真空干燥,使共溶剂完全挥发,然后置于4℃环境下备用。
其中,共溶剂为二氯甲烷、三氯甲烷和/或六氟异丙醇;加载有生长因子的丝素蛋白与PLGA的质量配比为1:10-10:1。
步骤S16:在3D打印机的第一打印喷头中装入步骤14制备的蚕丝生物墨水,在3D打印机的第二打印喷头中装入步骤15制备的复合材料;先控制所述第二打印喷头打印人工神经导管的外管,然后控制所述第一打印喷头打印人工神经导管的多个内管。
这其中,如图2所示,人工神经导管的外管21打印的直径为2mm-10mm,长度为20mm-40mm;人工神经导管的内管22的个数为多个,每个内管的打印直径为0.1mm-10mm,长度为10mm-30mm;外管和内管均为多孔结构,孔隙大小为100-300微米。
步骤S17:将3D打印的人工神经导管进行细胞培养分化形成神经导管。
本申请提出的基于3D打印制备人工神经导管的方法和人工神经导管,采用三维生物打印技术制备具有统一孔径、管中管结构的人工神经导管,外管在三维空间内沿纵向排列形成套管,套管的外部直径可根据实际需要调整,形成一体化的仿生结构更有利于促进神经再生;外管内部为多根中空的内管,内管为神经细胞的附着生长提供了基体,同时为神经轴突结合提供了引导作用,从而加快神经细胞再生速率。外管和内管打印使用不同的打印材料,都具有一定的机械性能,且所用的材料均利于细胞增殖与生长,无毒性,组织相容性良好;内管降解速度较快,不会对神经的再生造成阻碍,外管的降解周期长,可以为再生神经提供力学支撑,同时防止管外结蹄组织入侵而形成瘢痕。
作为打印材料基础的丝素蛋白分子中有独特的疏水、亲水性氨基酸侧链有序排列,亲疏水链段的间隔排列为其提供了自组装的可能, 采用诱导剂、冷冻-解冻等一系列处理方式使丝素蛋白的分子构象发生转变来制备丝素蛋白微球,并加载生长因子,使得载有生长因子的丝素蛋白微球能够达到生长因子的缓慢释放,促进神经细胞的增殖和分化。丝素蛋白作为一种天然生物材料,与多元醇、明胶、琼脂以及神经细胞符合,能够打印出稳定存在的结构,使得细胞存活率高达95%以上。
使用本申请提出的基于3D打印制备人工神经导管的方法制备出的人工神经导管来桥接修复损伤的主要神经断端,能够促进受损的神经再生,从而达到一定程度的功能恢复,无需自体神经移植,解决了现有自体神经移植限制临床应用的技术问题。
基于上述提出的基于3D打印制备人工神经导管的方法,本申请还提出一种人工神经导管,使用所述的基于3D打印制备人工神经导管的方法制备。
下面以一些具体实施例来详细说明如何使用基于3D打印制备人工神经导管的方法来制备人工神经导管。
实施例一
1、丝素蛋白溶液的制备:为了除掉丝素蛋白中的丝胶蛋白,将蚕丝蛋白放置于4.24g/L的碳酸钠溶液中,煮沸20min后,用去离子水洗干净并做烘干处理。用9.3mol/L的溴化锂水溶液溶解蚕丝蛋白,将所得溶液透析处理,通过离子交换去除溶液中的溴化锂,离心后获得新鲜的再生丝素水溶液,将溶液置于烘箱中缓慢浓缩至丝素蛋白溶液的浓度为15%,放置于4°C下储存。
2、丝素蛋白微球悬浮液的制备:将上述丝素蛋白溶液与质量分数为10%的PEG溶液混合,搅拌的同时滴加乳化剂Tween-20,体积比为2:1,然后将混合溶液置于冰箱中冷冻48h,取出后,室温融化得到乳白色溶液。溶液以8000rmp的速度离心15min,弃掉上清液,去离子水洗涤三次,超声15min后以500rmp的速度再次离心15min,弃掉底部沉淀得到分散性良好的丝素蛋白微球悬浮液。
2、生长因子在丝素蛋白微球上的加载:将一定量的丝素蛋白微球置于1mL,15μg/mL的生长因子溶液中,4°C下孵育24h,以12000r/min的速度,离心3min获得上清液。
4、含神经细胞的蚕丝生物墨水的制备:在磷酸盐缓冲液中加入30%的明胶,搅拌溶解,然后加入琼脂30%、蚕丝蛋白溶液38%、多元醇溶液1%,加入雪旺细胞、载有生长因子BDNF的丝素蛋白微球1%,顺时针轻柔的搅拌混合溶液,直至搅拌均匀,放置于5°C条件下保存备用。
5、丝素蛋白与PLGA复合材料的制备:将丝素蛋白溶液在室温下浇筑成膜,选择一种共溶剂将丝素蛋白膜与PLGA材料溶解在一起,质量比为1:5,将共混溶液浇筑成膜后,室温干燥,除去共溶剂,并置于真空干燥箱中抽真空干燥,使溶剂完全挥发掉,4°C下保存备用。
6、人工神经导管的打印:在有双喷头的生物打印机的喷头A中装入(4)所述的生物墨水,在喷头B中装入上述(5)所述的丝素蛋白与PLGA的复合材料。在80°C温度下,喷头B先打印出外管的框架,然后喷头A在37°C的条件下再继续打印内管的构架。导管的直径为10mm,长度为30mm,所述内管的直径为2mm,长度为20mm,内外管均有多孔结构,孔隙大小设置为270μm。
7、将打印好的组织进行细胞培养分化形成神经导管。
本实施例制备的人工神经导管,拉伸强度为5.2MPa,弹性模量为20MPa,完全满足组织工程人工神经导管对力学强度的需求,细胞存活率在第一天为97.6%,在材料打印完成后的第7天和第14天检测到细胞存活率分别为97.0%和95.8%。在细胞培养分化的第14天检测到β-Tubulin增加了一倍。
实施例二
1、丝素蛋白溶液的制备:为了除掉丝素蛋白中的丝胶蛋白,将蚕丝蛋白放置于4.24g/L的碳酸钠溶液中,煮沸30min后,用去离子水洗干净并做烘干处理。用9.3mol/L的溴化锂水溶液溶解蚕丝蛋白,将所得溶液透析处理,通过离子交换去除溶液中的溴化锂,离心后获得新鲜的再生丝素水溶液,将溶液置于烘箱中缓慢浓缩至丝素蛋白溶液的浓度为20%,放置于4°C下储存。
2、丝素蛋白微球悬浮液的制备:将上述丝素蛋白溶液与质量分数为10%的PEG溶液混合,搅拌的同时滴加乳化剂Tween-40,体积比为2:1,然后将混合溶液置于冰箱中冷冻48h,取出后,室温融化得到乳白色溶液。溶液以8000rmp的速度离心15min,弃掉上清液,去离子水洗涤三次,超声15min后以500rmp的速度再次离心15min,弃掉底部沉淀得到分散性良好的丝素蛋白微球悬浮液。
3、生长因子在丝素蛋白微球上的加载:将一定量的丝素蛋白微球置于1mL,15μg/mL的生长因子溶液中,4°C下孵育24h,以12000r/min的速度,离心3min获得上清液。
4、含神经细胞的蚕丝生物墨水的制备:在磷酸盐缓冲液中加入30%的明胶,搅拌溶解,然后加入琼脂20%、蚕丝蛋白溶液48%、多元醇溶液1%,加入雪旺细胞、载有生长因子BDNF的丝素蛋白微球1%,顺时针轻柔的搅拌混合溶液,直至搅拌均匀,放置于5°C条件下保存备用。
5、丝素蛋白与PLGA复合材料的制备:将丝素蛋白溶液在室温下浇筑成膜,选择一种共溶剂将丝素蛋白膜与PLGA材料溶解在一起,质量比为1:7,将共混溶液浇筑成膜后,室温干燥,除去共溶剂,并置于真空干燥箱中抽真空干燥,使溶剂完全挥发掉,4°C下保存备用。
6、人工神经导管的打印:在有双喷头的生物打印机的喷头A中装入(4)所述的生物墨水,在喷头B中装入上述(5)所述的丝素蛋白与PLGA的复合材料。在80°C温度下,喷头B先打印出外管的框架,然后喷头A在37°C的条件下再继续打印内管的构架。导管的直径为10mm,长度为25mm,所述内管的直径为2mm,长度为15mm,内外管均有多孔结构,孔隙大小设置为270μm。
7、将打印好的组织进行细胞培养分化形成神经导管。
本实施例制备的神经导管,拉伸强度为5.8MPa,弹性模量为22MPa,完全满足组织工程人工神经导管对力学强度的需求,细胞存活率在第一天为97.2%,在材料打印完成后的第7天和第14天检测到细胞存活率分别为96.8%和95.4%。在细胞培养分化的第14天检测到β-Tubulin增加了一倍。
实施例三
1、丝素蛋白溶液的制备:为了除掉丝素蛋白中的丝胶蛋白,将蚕丝蛋白放置于4.24g/L的碳酸钠溶液中,煮沸50min后,用去离子水洗干净并做烘干处理。用9.3mol/L的溴化锂水溶液溶解蚕丝蛋白,将所得溶液透析处理,通过离子交换去除溶液中的溴化锂,离心后获得新鲜的再生丝素水溶液,将溶液置于烘箱中缓慢浓缩至丝素蛋白溶液的浓度为25%,放置于4°C下储存。
2、丝素蛋白微球悬浮液的制备:将上述丝素蛋白溶液与质量分数为20%的PEG溶液混合,搅拌的同时滴加乳化剂Tween-60,体积比为2:1,然后将混合溶液置于冰箱中冷冻48h,取出后,室温融化得到乳白色溶液。溶液以8000rmp的速度离心15min,弃掉上清液,去离子水洗涤三次,超声15min后以500rmp的速度再次离心15min,弃掉底部沉淀得到分散性良好的丝素蛋白微球悬浮液。
3、生长因子在丝素蛋白微球上的加载:将一定量的丝素蛋白微球置于1mL,15μg/mL的生长因子溶液中,4°C下孵育24h,以12000r/min的速度,离心3min获得上清液。
4、含神经细胞的蚕丝生物墨水的制备:在磷酸盐缓冲液中加入30%的明胶,搅拌溶解,然后加入琼脂25%、蚕丝蛋白溶液43%、多元醇溶液1%,加入雪旺细胞、载有生长因子BDNF的丝素蛋白微球1%,顺时针轻柔的搅拌混合溶液,直至搅拌均匀,放置于5°C条件下保存备用。
5、丝素蛋白与PLGA复合材料的制备:将丝素蛋白溶液在室温下浇筑成膜,选择一种共溶剂将丝素蛋白膜与PLGA材料溶解在一起,质量比为1:9,将共混溶液浇筑成膜后,室温干燥,除去共溶剂,并置于真空干燥箱中抽真空干燥,使溶剂完全挥发掉,4°C下保存备用。
6、人工神经导管的打印:在有双喷头的生物打印机的喷头A中装入(4)所述的生物墨水,在喷头B中装入上述(5)所述的丝素蛋白与PLGA的复合材料。在80°C温度下,喷头B先打印出外管的框架,然后喷头A在37°C的条件下再继续打印内管的构架。导管的直径为10mm,长度为35mm,所述内管的直径为2mm,长度为20mm,内外管均有多孔结构,孔隙大小设置为300μm。
7、将打印好的组织进行细胞培养分化形成神经导管。
本实施例制备的神经导管,拉伸强度为6.0MPa,弹性模量为25MPa,完全满足组织工程人工神经导管对力学强度的需求,细胞存活率在第一天为97.8%,在材料打印完成后的第7天和第14天检测到细胞存活率分别为97.2%和96.4%。在细胞培养分化的第14天检测到β-Tubulin增加了一倍。
实施例四
1、丝素蛋白溶液的制备:为了除掉丝素蛋白中的丝胶蛋白,将蚕丝蛋白放置于4.24g/L的碳酸钠溶液中,煮沸50min后,用去离子水洗干净并做烘干处理。用9.3mol/L的溴化锂水溶液溶解蚕丝蛋白,将所得溶液透析处理,通过离子交换去除溶液中的溴化锂,离心后获得新鲜的再生丝素水溶液,将溶液置于烘箱中缓慢浓缩至丝素蛋白溶液的浓度为25%,放置于4°C下储存。
2、丝素蛋白微球悬浮液的制备:将上述丝素蛋白溶液与质量分数为20%的PEG溶液混合,搅拌的同时滴加乳化剂Tween-60,体积比为2:1,然后将混合溶液置于冰箱中冷冻48h,取出后,室温融化得到乳白色溶液。溶液以8000rmp的速度离心15min,弃掉上清液,去离子水洗涤三次,超声15min后以500rmp的速度再次离心15min,弃掉底部沉淀得到分散性良好的丝素蛋白微球悬浮液。
3、生长因子在丝素蛋白微球上的加载:将一定量的丝素蛋白微球置于1mL,15μg/mL的生长因子溶液中,4°C下孵育24h,以12000r/min的速度,离心3min获得上清液。
4、含神经细胞的蚕丝生物墨水的制备:在磷酸盐缓冲液中加入30%的明胶,搅拌溶解,然后加入琼脂25%、蚕丝蛋白溶液43%、多元醇溶液1%,加入神经干细胞、载有生长因子NGF的丝素蛋白微球1%,顺时针轻柔的搅拌混合溶液,直至搅拌均匀,放置于5°C条件下保存备用。
5、丝素蛋白与PLGA复合材料的制备:将丝素蛋白溶液在室温下浇筑成膜,选择一种共溶剂将丝素蛋白膜与PLGA材料溶解在一起,质量比为1:9,将共混溶液浇筑成膜后,室温干燥,除去共溶剂,并置于真空干燥箱中抽真空干燥,使溶剂完全挥发掉,4°C下保存备用。
6、人工神经导管的打印:在有双喷头的生物打印机的喷头A中装入(4)所述的生物墨水,在喷头B中装入上述(5)所述的丝素蛋白与PLGA的复合材料。在80°C温度下,喷头B先打印出外管的框架,然后喷头A在37°C的条件下再继续打印内管的构架。导管的直径为10mm,长度为35mm,所述内管的直径为2mm,长度为20mm,内外管均有多孔结构,孔隙大小设置为300μm。
7、将打印好的组织进行细胞培养分化形成神经导管。
本实施例制备的神经导管,拉伸强度为6.2MPa,弹性模量为26MPa,完全满足组织工程人工神经导管对力学强度的需求,细胞存活率在第一天为97.0%,在材料打印完成后的第7天和第14天检测到细胞存活率分别为96.8%和96.0%。在细胞培养分化的第14天检测到β-Tubulin增加了一倍。
应该指出的是,上述说明并非是对本发明的限制,本发明也并不仅限于上述举例,本技术领域的普通技术人员在本发明的实质范围内所做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!