一种ASCs结合POC‑PLA静电纺丝补片复合体及其制备方法和应用与流程
本发明涉及高分子材料和组织工程技术领域,具体地说,是一种新型的脂肪干细胞(Adipose stem cells,ASCs)结合POC-PLA(聚柠檬酸酯-聚乳酸)电纺丝生物补片,修复缺损组织的新方法,及其将该补片和方法在修复胸壁全层缺损中的研究应用。
背景技术:
大面积的全层胸壁缺损重建仍然是困扰整形科、心胸外科的难题,临床上此类手术往往需要心胸外科医生重建封闭胸腔,重建骨性支架,同时软组织的缺损则需要整形外科医生灵活运用合适的皮瓣进行移植修复。目前影响胸壁缺损重建效果的因素还是在于合适的选择胸壁重建的材料。虽然目前临床上有钛板、人工骨、各种补片可供选择,但是尚无一种能完全达到胸壁重建的理想要求。临床前研究正不停寻找新的更接近正常胸壁形态与功能的材料,随着材料学和组织工程学的发展,一种更合适的重建材料势必将更显著地改善此类患者的术后生存质量。一种理想的胸壁替代材料需要有极佳的抗张力和弹性、来源广泛使用方便、具有很好的生物相容性。此外,最佳的材料在术后不会造成组织的粘连,同时能够促进胸壁修补处的组织重塑。
POC是具有极佳弹性的可吸收材料,最初设计用于组织工程小血管的支架材料[J Yang,WA R.,AG A.Novel Citric Acid‐Based Biodegradable Elastomers for Tissue Engineering.Advanced Materials,2004,16(6):511-516]。POC合成过程中对环境的要求不高,甚至在37℃,就可以合成,这使得POC材料可以和药物或者蛋白结合成为复合体。此外还可以根据需要调节力学强度和分解率,固有表面容易被细胞附着。目前文献报导了内皮祖细胞、心肌细胞、成肌细胞、软骨细胞、平滑肌细胞等细胞的体外共培养,各种细胞和POC材料都有很好的相容性[Hidalgo-Bastida LA,Barry JJ,Everitt NM,er al.Cell adhesion and mechanical properties of a flexible scaffold for cardiac tissue engineering.Acta Biomater.2007Jul;3(4):457-62.;MP Prabhakaran,AS Nair,K Dan,et al.Electrospun composite scaffolds containing poly(octanediol-co-citrate)for cardiac tissue engineering&dagger.Biopolymers,2012,97(7):529–538.;Claire G.Jeong,Huina Zhang,Scott J.Hollister.Three-dimensional poly(1,8-octanediol–co-citrate)scaffold pore shape and permeability effects on sub-cutaneous in vivo chondrogenesis using primary chondrocytes.Acta Biomaterialia,2011;505–514.]。
静电纺丝技术就是高分子流体静电雾化这样的一种形式,此时雾化分裂出的物质是聚合物微小射流,可以在干燥的环境内运行相当长的距离,最终固化成纳米级别的聚合物纤维。静电纺丝制成的支架有很好的孔隙率,适合细胞的生长。PLA则是目前临床常用的可降解材料。我们通过POC与PLA等比例混合用,用电纺丝技术制备成具有3D结构的生物膜片用于胸壁重建。
脂肪干细胞是成体间充质干细胞的一种,从脂肪之中获取。它具有向三个胚层分化的能力,可在不同的诱导因子作用下分化为多种细胞,同时可以分泌多种细胞因子[Schaffle A,Buchler C.Concise review:adipose tissue-derived stromal cells—bisic and clinical implications for novel cell-based therapies.Stem Cells,2007,25(4);818-827.]。研究表明脂肪干细胞可以通过多种机制加快创面的愈合,包括旁分泌作用、多向分化能力、促进血管新生等[张元政、邢新、杨超。脂肪来源干细胞修复创面的研究进展。中国美容整形外科杂志。2014,25(12):742-44.]。ASCs表面仅表达非常少量的主要组织兼容性复合物-Ⅰ(Major histocompability complex-Ⅰ,MHC-Ⅰ),而主要组织兼容性复合物-Ⅱ(Major histocompability complex-Ⅱ,MHC-Ⅱ)、CD80、CD86和CD40则不表达[Le Blanc,K.and O.Ringden.Immunosuppression by mesenchymal stem cells and clinical experience.J Intern Med,2007.265(5):509-525.],因此不会激活异体的淋巴免疫反应。ASCs也被证实可以抑制T和B淋巴细胞的活化和增生[Corcione,A.et al.Human mesenchymal stem cells modulate B-cell function.Blood,2006,107:367-72.]。此外,ASCs还能分泌白介素6(Interleukin-6,IL-6)、集落刺激因子(Colony stimulating Factor,CSF)等影响树突状细胞的分化、成熟和功能[Djouad,F.et al.mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin-6dependent mechanism.Stem Cells,2007,25:2025-32.]。可见ASCs有较低的免疫源性,能减轻炎症反应,异种动物使用也不会引起宿主的免疫反应。因此脂肪干细胞的运用对于加速创伤的愈合,减少炎症反应都将为一系列疾病的治疗提供新的方法。
中国专利文献CN 103877622A公开了一种静电纺丝纳米纤维-细胞外基质复合材料及其制备方法和应用,制备方法包括如下步骤:S1.制备生物降解材料的静电纺丝纤维膜,所述生物降解材料为聚己内酯、左旋聚乳酸、聚乳酸-羟基乙酸共聚物;S2.将步骤S1制得的静电纺丝纤维膜平铺在细胞培养容器中,用培养基浸泡,然后接种干细胞,于CO2培养箱中培养5~10天,每隔2~3天更换培养基,接着进行脱细胞处理,最后干燥即可得到静电纺丝纳米纤维-细胞外基质复合材料。
目前尚无文献报道有关ASCs膜片结合POC-PLA补片复合体修复胸壁缺损的研究及应用。
技术实现要素:
本发明的目的在于提供一种新型的生物补片材料,本发明的另一目的在于提供一种修复组织缺损的方法,以及该生物补片材料和方法在胸壁全层缺损中的应用。
本发明的第一方面,提供一种ASCs结合POC-PLA静电纺丝补片复合体,由POC-PLA静电纺丝补片和ASCs细胞膜片组成,所述的POC-PLA静电纺丝补片中POC和PLA的质量比为1:1;所述的ASCs细胞膜片是采用细胞膜片技术将ASCs均匀的种植于POC-PLA静电纺丝补片之上。
本发明的第二方面,提供上述ASCs结合POC-PLA静电纺丝补片复合体的制备方法,包括以下步骤:
A)POC-PLA静电纺丝补片的制备:制备POC预聚体,以三氟乙醇为溶剂,按质量比1:1的配比配制POC预聚体与PLA的溶液,其中PLA质量分数为10%,用上述溶液进行静电纺丝,静电纺丝得到的纤维膜进行固化、灭菌,得到POC-PLA静电纺丝补片;
B)ASCs膜片结合POC-PLA静电纺丝补片复合体的制备:分离培养ASCs,取第3代ASCs制备附着在纤维蛋白薄片上的细胞膜片,将纤维蛋白薄片含细胞膜片一侧向下放于补片之上,在培养箱内37℃下孵育30分钟;轻轻掀去纤维蛋白薄片,取出膜片复合体;将膜片复合体置于细胞培养箱内孵育24小时;取出膜片复合体,用PBS轻轻冲洗去除培养基,得到所述的静电纺丝补片复合体。
优选的,所述的步骤A中POC预聚体的制备方法包括:按摩尔比1:1将柠檬酸和1,8-辛二醇加入到容器中,在氮气保护下,在油浴中加热至160℃,搅拌10min至粉末全部熔融;然后在140℃、常压下聚合约40min,得到预聚体;趁热迅速将预聚体移出,依次加入乙醇溶解预聚体及蒸馏水沉淀出预聚体,反复清洗数次,以完全除去未反应的单体,得到较为纯净的POC预聚体。
优选的,所述的步骤B包括以下步骤:
(1)取分离培养的第3代ASCs,按照传代相同的方法消化细胞后,以1×106接种于温敏培养皿,加入含10%FBS的完全培养基;
(2)细胞恒温培养箱5%CO2,37℃条件下培养;
(3)待细胞融合长满后,吸走温敏培养皿内培养基,加适量PBS湿润细胞膜片。将配套的纤维蛋白薄片轻轻放置于细胞膜片表面,注意不要产生气泡,温敏培养皿置于25℃孵化10分钟;
(4)用无菌镊子轻轻掀起纤维蛋白薄片,镜下观察温敏培养皿是否有残余的细胞;
(5)POC-PLA补片剪裁4×4cm大小,在PBS中浸泡2小时后,将纤维蛋白薄片含细胞膜片一侧向下放于补片之上,加1ml培养基,在培养箱内37℃下孵育30分钟;
(6)轻轻掀去纤维蛋白薄片,取出膜片复合体;
(7)将膜片复合体置于细胞培养箱内孵育24小时;
(8)取出膜片复合体,用PBS轻轻冲洗去除培养基,得到所述的静电纺丝补片复合体。
本发明的第三方面,提供上述ASCs结合POC-PLA静电纺丝补片复合体在制备胸壁缺损重建材料中的应用。
本发明的构思如下:本发明基于ASCs来源广泛,具有向多胚层分化、促进组织修复的能力,与弹性良好的可吸收材料POC-PLA合成生物补片复合体,通过肉眼及镜下的形态学观察,及相关炎症指标和增殖凋亡的检测其生物相容性,并建立动物模型,研究运用此生物补片复合体修复胸壁缺损对机体的影响。
本发明的主要技术方案包括三个部分:
第一部分,rASCs分离与鉴定。我们取兔颈背部的脂肪,采用酶消化法分离出rASCs。在分离的过程中,需要注意的是对消化前期脂肪的预处理,在获取脂肪之后,对脂肪组织充分的冲洗和修剪可以有效提高获取的ASCs纯度。用流式细胞术对上述方法分离成功的ASCs进行细胞表型鉴定,结果表明CD29、CD44、CD90的阳性表达率分别为92%、38%、93.5%(见图1)。证明用酶消化法能非常高效的获得较高纯度的ASCs。
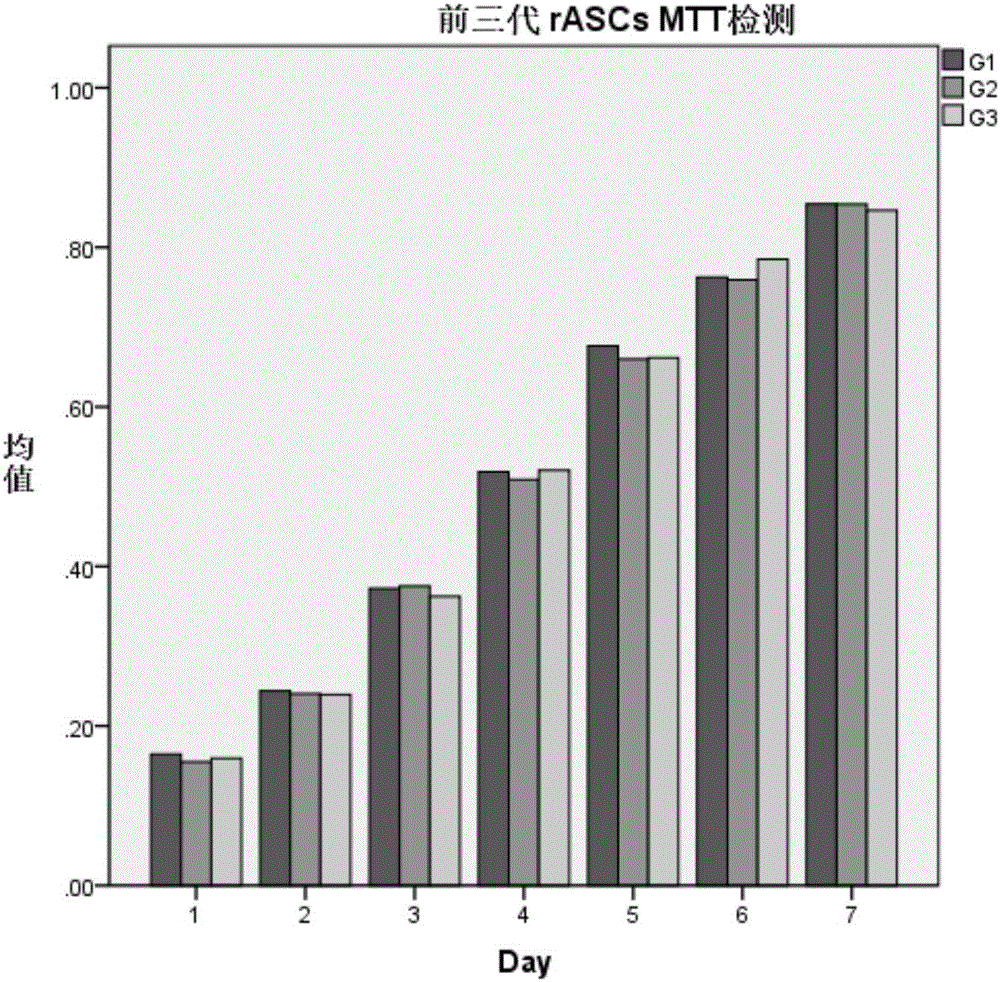
实验中我们发现ASCs的细胞增值能力会随着传代数的增多而渐渐下降,因此在使用rASCs时往往使用代数较低的细胞。我们取第3代rASCs进行了多向分化的检测。可以看到在诱导培养基的作用下,rASCs向软骨、骨和脂肪都有较高的转化率。前三代MTT检测和细胞生长曲线都表明,第3代rASCs细胞活性佳,有很好的干性(见图2)。后续的实验中,我们将取第3代ASCs作为种子细胞进行实验。
第二部分,rASCs膜片结合POC-PLA静电纺丝补片复合体的建立与材料安全性检测。将POC与PLA等比例混合后,静电纺丝形成具有一定力学性能的可降解膜片作为全层胸壁重建的材料(见图3)。在膜片靠近胸腔侧,种植一层脂肪干细胞膜片,防止补片与肺脏之间的粘连。
在补片的力学测试中,相比较目前临床常用的e-PTFE补片,厚度较厚的POC-PLA静电纺丝补片与薄层的e-PTFE补片表现出相似的弹力系数。而通过抗张强度和杨氏模量的比较,可以发现POC-PLA材料较e-PTFE有更好的弹力(见图4)。而在使用静电纺丝技术同样赋予补片很好的三维结构,在电镜扫描的结果中,我们可以看到补片的孔隙直径约在纳米级别。这样的三维孔隙结构使得ASCs能很好的粘附于材料表面。在ASCs细胞种植于材料的24小时内,就能观察到细胞粘附于材料表面。在移植入体内后,我们可见看到补片在体内被组织所包裹,材料内部孔隙可见细胞长入。植入第一周的补片CD31染色就可以看到周边有大量新生的血管,在第四周的组织化学染色我们可以看见更多的血管生成以及长入(见图5)。这些特性能够证明补片能很好的作为支架,参与到组织的重建。
在组织相容性的测试中,我们可以发现,组织移植入的早期存在轻度的异物反应,膜片表面可以看到巨噬细胞的浸润,IL-6、TGFβ与TNFα等指标都显示升高。在早期膜片附近的细胞表现出增强的增殖信号水平,对caspase-3组织化学染色我们可以发现,膜片周边细胞凋亡水平较正常增强,这可能是因为早期的炎症反应所致,TUNEL染色可以看到少量的凋亡细胞。而一个月左右的样本我们可以发现炎症反应已经很轻,增殖与凋亡也接近于正常水平。(见图6、7)
我们比较了使用细胞膜片技术和直接种植细胞于材料表面,结果证明细胞膜片技术能在很短的时间内将大量的ASCs种植于材料之上,形成膜片样结构覆盖材料表面。共培养方式种植ASCs制备时间更长,而且细胞容易形成局部生长的,相比较而言,膜片技术培养的细胞生长更为均匀。(见图8)
综上所述,POC-PLA静电纺丝补片有着极佳力学弹性的可吸收补片。细胞膜片技术则将大量的脂肪干细胞均匀的种植于补片之上。这样形成的补片复合体既有很好的力学弹性,又可以促进机体的重建,减轻炎症反应带来的粘连。下面我们将使用这种补片复合体来重建兔的胸壁全层缺损。
第三部分,rASCs膜片结合POC-PLA电纺丝补片复合体修复兔全层胸壁缺损的研究。我们的动物模型选用新西兰兔。新西兰兔体型相对狭长,胸壁保护胸腔内器官与部分腹腔器官。新西兰兔胸廓面积约5×10cm,参照文献制备模型,缺损部位位于右侧胸壁,面积约3×3cm,按正常成人的胸壁面积换算,约为10×10cm缺损面积,需要使用补片来加固胸壁。(见图9)
我们可以观察到,在一个月的样本中,补片已经被自身组织所包裹,在两个月开始补片慢慢开始裂解,在六个月的样本中,可见补片已经完全吸收完毕,被自身组织所取代(见图10)。组织的力学测试可以看出在8周后弹力系数已经接近正常的胸壁肋间肌的弹性。
成长期的胸壁重建,容易出现胸壁的畸形。在单纯进行肌皮瓣重建的兔子,在8周以上的大体样本上很容易发现胸壁的畸形,包括胸壁塌陷和胸廓移位,这可能跟肌皮瓣萎缩有关。而ePTFE重建和POC-PLA重建在早期均为出现胸廓的异常,24周以后少量的ePTFE重建胸壁出现了轻微的胸骨移位。在早期创面边缘的组织增生减少了创面的面积,但是随着体型增长与胸廓生长速度超过组织增生的量以后,ePTFE又会拉扯胸廓引起胸骨的移位。在POC-PLA材料重建的样本中,均未出现胸壁的畸形和移位。这可能与较轻的炎症反应和自体细胞的重建有关。在连续的观察中可以看到早期炎症细胞的浸润与成纤维细胞的长入,到后期材料边缘有软骨细胞的长入,而表面除了成纤维细胞之外,还可以看到肌纤维样的组织参与了重建。(见图11、12)
在术后效果的评估中,我们把肺功能也引入作为一项重要的评估指标。尽管所有动物均没有出现呼吸衰竭、反式呼吸等并发症,但是进行肺功能的检测还是能够发现差异。单纯进行肌皮瓣重建的兔子肺功能在术后多个时间点的检查中,都表现的最差,FVC、FEF25~75%、0.4秒和0.6秒同期率都显著低于其他组。ePTFE作为临床常用的补片,在术后肺功能的恢复有较好的作用,各项指标都接近正常。单纯的POC-PLA补片术后肺功能的恢复介于单纯皮瓣修复和使用ePTFE补片之间。尽管组织学检测POC-PLA补片修复胸壁进行了较好的重建,但是修补区域较为严重的粘连,可能是导致肺功能减少的原因。结合干细胞的POC-PLA补片复合体在所有组别中肺功能恢复的表现最好。在术后第24周的肺功能检测中,已经接近于正常水平。(见图13)
POC-PLA在体内的降解率较体外更快。在术后4周的样本中,大体可见补片已经局部出现了裂缝;12周的样本中,大部分补片已经出现龟裂;术后24周的样本中,补片已经被分解为小块的碎片。CD31免疫组织化学染色可见补片周边有密集的血管新生,在术后12周可以看见有血管长入补片裂痕间隙之中。复合了干细胞膜片的样本可见到早期的血管密度更高,这可能加速了胸壁重建的速度(见图14)。
ePTFE补片有较好的防粘连效果,粘连评分接近单纯肌皮瓣修复,仅仅在少数样本里发现比较严重的粘连。POC-PLA补片比较容易产生胸膜粘连,在所有的样本中,均存在着不同程度的粘连情况。这种粘连的产生,可能与早期的炎症反应有关。Western Blot以及免疫组化均表现出TGFβ、IL6、TNFα等炎症指标的升高。而在应用干细胞膜片之后,胸膜粘连的状况明显改善,炎症指标也相应的下调。此外,POC-PLA较好的细胞附着性[Hidalgo-Bastida LA,Barry JJ,Everitt NM,et al.Cell adhesion and mechanical properties of a flexible scaffold for cardiac tissue engineering.Acta Biomater.2007 Jul;3(4):457-62.],也可能是造成胸膜粘连的原因之一。干细胞膜片有效的阻止了脏层胸膜与材料早期的直接接触,减少材料对胸腔内气管的吸附。同时干细胞分泌的细胞因子,也可能加速了内皮样细胞和纤维细胞对材料的包裹,减少后期粘连的产生。(图15、16)
本发明优点在于:
本发明采用了弹性体POC材料为主体,加入等比例的PLA,通过静电纺丝技术共纺出具有3D纳米孔隙结构的补片,与ASCs细胞膜片复合构建成补片复合体,POC-PLA制成的补片有良好的生物相容性和可控的力学效应,细胞膜片技术则将大量的脂肪干细胞均匀的种植于补片之上,这样形成的补片复合体既有很好的力学弹性,又可以促进机体的重建,减轻炎症反应带来的粘连,促进胸壁的重构过程。
附图说明
图1.rASCs细胞的表型鉴定。
图2.rASCs MTT检测。
图3.(A)POC-PLA电纺丝补片大体形态。(B)POC-PLA电纺丝补片电镜下形态,放大倍数2000倍。
图4.(A)POC-PLA电纺丝补片降解率(B)POC-PLA电纺丝补片拉伸系数检测。
图5.H&E组织染色(200×)。
图6.SD大鼠免疫组化,从上到下分别为CD68、IL-6、TNFα和TGF-β(200×)。
图7.SD大鼠免疫组化,从上到下分别为Ki67、PCNA、caspase3和TUNEL(200×)。
图8.上排图为细胞与材料种植后混合培养5天后电镜照片,放大倍数从左到右分别为2000 1000 500;下排图为ASCs膜片复合补片细胞培养箱内静置2h后电镜照片,放大倍数从左到右分别为2000×1000×500×。
图9.图全层胸壁缺损模型建立与重建。(A)设计手术切口(B)切开皮肤剥离胸大肌至胸壁(C)切除3×3cm大小胸壁,含2-3根肋骨(D)ePTFE补片封闭胸壁缺口(E)POC-PLA补片封闭胸部缺口(F)胸大肌皮瓣覆盖补片,缝合创面。
图10.兔组织样本H&E染色。
图11.兔组织样本masson染色。
图12.兔组织样本EVG染色。
图13.术后呼吸功能指标,左图为术后FVC,有图为术后FEV0.4/FVC%。
图14.兔组织样本CD31免疫组化染色。
图15.肺粘连解剖所见。
图16.胸膜粘连指数。
图17.POC预聚体反应式,R1、R2、R3和R4为柠檬酸和1,8-辛二醇。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,或按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1:rASCs的分离与鉴定
1、脂肪组织的处理:无菌获取的脂肪组织用PBS冲洗两次,洗去表面残留的脂肪组织、血凝块、红细胞等。然后把脂肪组织呈放在10cm的培养皿中,加入20ml PBS溶液,在室温的条件下处理5-10min,即用眼科剪刀和医用镊子仔细除去残余的真皮、结缔组织、血管等。再次清洗脂肪组织,然后移到一个新的培养皿,用整形剪刀剪成体积1mm3不规则的组织块。
2、I型胶原酶配置:电子天平称取100mgI型胶原酶,溶于100mlDMEM培养基,用0.22um滤器除菌。
3、脂肪组织的酶解:在剪碎成浆糊状的脂肪组织中加入等体积0.1%I型胶原酶,37℃恒温水浴振荡消化50min。
4、离心:消化完全后,加入等量体积的完全培养基(低糖DMEM+10%胎牛血清+1%双抗)中和,500g高速离心10min,取离心后的细胞沉淀层。
5、加入PBS吹打成细胞悬液后,放入离心机1000r/min低速离心,弃上清。此步骤需重复洗涤两次。
6、过滤:加入PBS吹打成细胞悬液后,用70目滤网过滤结缔组织至新离心管,离心后加入完全培养基,制成细胞悬液。
7、细胞悬液用细胞计数板计数,按1.0×105/ml密度接种在培养皿内,标准环境下培养,5%CO2,37℃。
8、24小时后半量更换培养基,弃去未贴壁的细胞。
9、rASCs的培养:当看见培养基颜色发生变化需要进行换液,细胞移液管吸去变色的陈旧培养基,用PBS轻轻冲洗培养皿后加入适量新培养基。
10、rASCs的传代:细胞长至密度80%进行传代,用PBS轻轻冲洗培养皿洗去失活细胞,加入0.25%胰酶消化至细胞半贴壁状态后,加入全培养基终止消化后,轻轻吹打下细胞。移送至离心机以1000r/min低速离心,弃上清。加入PBS吹打成细胞悬液后,放入离心机1000r/min低速离心,弃上清。加入适量全培养基吹打成细胞悬液后移植新培养皿。
本实验中,分离的rASCs细胞使用镜下形态学观察、流式细胞技术和多向诱导分化来鉴定rASCs纯度。
镜下形态学观察,取第三代rASCs置于倒置显微镜下观察细胞外形,注意细胞的形态、大小、细胞核状态等。
实施例2:rASCs膜片结合POC-PLA电纺丝补片复合体的建立
(一)POC-PLA静电纺丝补片制备
POC-PLA静电纺丝补片制备由东华大学材料学院吉亚丽教授、朱蕾完成,制备方法如下:
1、预聚体的制备:
按摩尔比1:1将柠檬酸和1,8-辛二醇加入到三口圆底烧瓶中,在氮气保护下,在油浴中加热至160℃,电动搅拌10min至粉末全部熔融。然后在140℃、常压下聚合约40min,得到具有一定分子量的预聚体。趁热迅速将预聚体移出三口烧瓶,转移至大烧杯中,依次加入乙醇(溶解预聚体)及蒸馏水(沉淀出预聚体),反复清洗数次,以完全除去未反应的单体,可得到较为纯净的POC预聚体。反应式见图17。
2、预聚体的静电纺丝:
以三氟乙醇为溶剂,按质量比1:1的配比配制POC预聚体与PLA的溶液,其中PLA质量分数为10%,用上述溶液进行静电纺丝。纺丝之前,需用磁力搅拌器对溶液进行24小时的充分搅拌,以确保溶解完全。将配制完成的溶液装入5mL塑料注射器中,静置以去除注射器中的气泡,然后将注射器置于推进器之上,针尖部分连接静电发生器的正极,接收装置上包裹铝箔纸,固定轴承处接地,调节针尖与接收器之间的距离。开启推进器电源,设置流速,待针尖内溶液稳定均匀流出后,开启静电发生器电源,调节到合适电压,开始纺丝。纺丝结束后,关闭电源。将静电纺丝所得到的覆盖有纤维膜的铝箔取下,置于真空干燥箱中于一定温度下固化。
3、膜片的灭菌:
膜片采用环氧乙烷消毒法灭菌,将膜片剪成合适形状,与环氧乙烷指示条一同装入密封袋,送入仪器灭菌,指示条变色表示灭菌完成。
(二)rASCs膜片结合POC-PLA静电纺丝补片复合体的制备
1、rASCs的分离和培养:
具体过程见第一部分相应内容。
2、细胞膜片的制备:
(1)取第3代rASCs,按照传代相同的方法消化细胞后,以1×106接种于温敏培养皿,加入含10%FBS的完全培养基。
(2)细胞恒温培养箱5%CO2,37℃条件下培养。
(3)待细胞融合长满后,吸走温敏培养皿内培养基,加适量PBS湿润细胞膜片。将配套的纤维蛋白薄片轻轻放置于细胞膜片表面,注意不要产生气泡,温敏培养皿置于25℃孵化10分钟。
(4)用无菌镊子轻轻掀起纤维蛋白薄片,镜下观察温敏培养皿是否有残余的细胞。
(5)POC-PLA补片剪裁4×4cm大小,在PBS中浸泡2小时后,将纤维蛋白薄片含细胞膜片一侧向下放于补片之上,加1ml培养基,在培养箱内37℃下孵育30分钟。
(6)轻轻掀去纤维蛋白薄片,取出膜片复合体。
(7)将膜片复合体置于细胞培养箱内孵育24小时。
(8)取出膜片复合体,用PBS轻轻冲洗去除培养基。
实施例3:rASCs膜片结合POC-PLA电纺丝补片复合体修复兔全层胸壁缺损
选取健康新西兰兔雌性,兔龄为4~5月,体重为2.5-3kg。构建动物模型。
1、麻醉:完成抓取固定后,用电子秤称取兔体重,把配置好的1%戊巴比妥钠溶液按0.3ml/Kg的用量耳缘静脉注射麻醉兔。
2、固定:将麻醉成功的兔仰卧固定于兔解剖板,四肢固定于固定器,兔充分舒展,暴露整个胸部。
3、备皮:用动物剃毛推剔除胸部的毛,上至下颚,下至肋弓,两侧至侧胸壁近上肢关节处,右侧胸壁手术区域可适量剔除右侧上肢毛,充分暴露手术区。
4、消毒:兔脱毛区域和其下方相应的解剖台区域用碘伏常规消毒3遍,最后用75%酒精消毒1遍脱色。
5、标记铺单:在右侧胸壁第5肋骨与胸骨交界处为起点,沿肋骨做一长约6cm切口线,常规铺单(图9)。
6、气管插管:将兔头部向上抬起,保持气管呈水平状态。使用3.0婴儿气管导管盲视下经兔口腔插入气管,插入深度为12.5±1.5cm。插入到位后,使用注射器向气囊注入1ml空气,观察气囊鼓起。气管导管接小动物呼吸机,维持潮气量12ml/kg,频率50次/min。
7、全层胸壁缺损模型制作:沿切口线切开皮肤,暴露胸大肌,顺着胸大肌肌肉走向切开胸大肌,沿胸壁表面分离胸大肌与深面的胸小肌,充分暴露胸壁。在胸壁表面设计3×3cm大小的创面,创面内含至少2根肋骨。沿标记线切除胸壁,包括肋骨、肋间肌、壁层胸膜等,出血点烧灼止血,形成缺损面积3×3cm的胸壁缺损创面。
8、根据缺损面积,将rASCs膜片结合POC-PLA电纺丝补片复合体剪成约4×4cm大小,注意将补片四角修剪成钝圆。将细胞膜片侧朝向胸腔,用4-0缝线将补片固定于创面相邻的胸骨后缝合补片与创缘,注意严密封闭胸腔,缝合过程中注意不要损伤肺脏。分层缝合伤口。检查胸腔引流无液体和气体流出后,拔除引流管。
9、伤口用酒精消毒,胶布固定纱布包扎。
10、术后6h开始给予饮食。
11、术后常规注射青霉素钠,一天一次,一次40万u,连续7天。
12、每组兔术后7天打开外敷料进行观察,胸壁切口拆线。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!