苯并五元氮杂环基哌嗪衍生物的用途的制作方法
技术领域
本发明涉及苯并五元氮杂环基哌嗪衍生物在制备血管舒张药物中的用途。
背景技术:
目前临床上存在多类可以舒张血管的药物,例如,α1受体阻断剂类药物,包括哌唑嗪、多沙唑嗪、特拉唑嗪等,这些药物有明显的首剂量效应或体位性低血压,从而限制了该类药物在临床上的广泛应用;Ca2+通道阻断剂,现有药物包括氨氯地平、硝苯地平、非洛地平等,这类药物目前在临床上广泛应用,但其同时也存在抑制心脏的风险。
因此,仍然需要开发新的血管舒张药物,以期提高药效,减少耐药性或者使其毒副作用更小,以尽量满足临床上不同患者的需要。
技术实现要素:
本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中:
R1代表被R3单取代或多取代的芳香族基团或脂肪族环状基团,其中
R3为H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6 烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;当R3为多取代基团时,R3独立地选自H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;
A、B分别独立代表CH或N;
R2代表H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;当R2为多取代基团时,R2独立地选自H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;
Y代表任选被1-3个卤素原子取代的饱和或不饱和的含有2-8个碳原子的直链或支链烃基链,其中一个或多个碳任选被选自氧、硫和氮的杂原子替代。
附图说明:
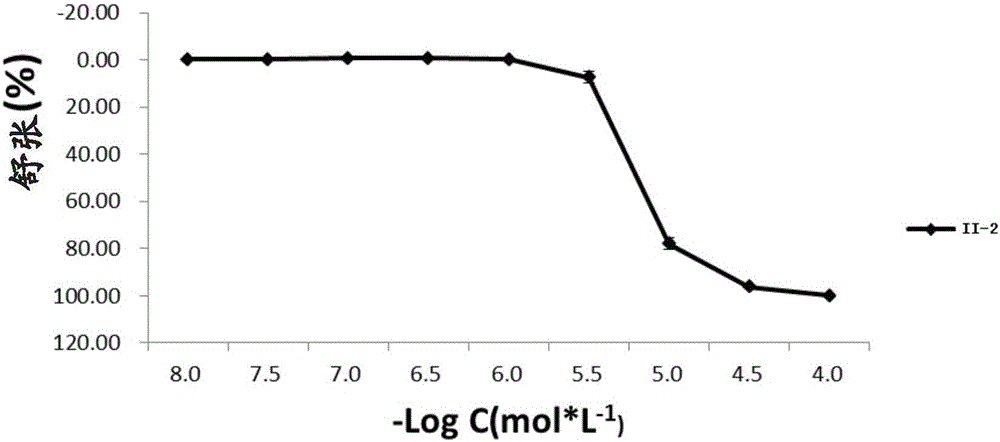
图1为化合物II-2(10-8-10-4mol·L-1)对肾上腺素(10-5mol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图2为化合物II-2(10-8-10-4mol·L-1)对高钾液(60mmol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图3为化合物II-2(3×10-7mol/L)拮抗去甲肾上腺素NA(10-8-10-4mol/L)收缩家兔离体血管的累积浓度效应曲线。
图4为阳性对照多沙唑嗪(10-7mol/L)拮抗去甲肾上腺素NA(10-8-6×10-5mol/L)收缩家兔离体血管的累积浓度效应曲线。
图5为化合物II-2(10-6mol/L)拮抗CaCl2(10-6-10-2mol/L)收缩家兔离体血管的累积浓度效应曲线。
图6为氨氯地平(10-7mol/L)拮抗CaCl2(10-6-10-2mol/L)收缩家兔 离体血管的累积浓度效应曲线。
图7为化合物II-2(3×10-6mol/L)拮抗5-羟色胺(10-7-3×10-4mol/L)收缩家兔离体血管的累积浓度效应曲线。
图8为化合物II-3(10-8-3×10-5mol·L-1)对肾上腺素(10-5mol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图9为化合物II-3(10-8-3×10-5mol·L-1)对高钾液(60mmol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图10为化合物II-31(10-8-10-5mol·L-1)对肾上腺素AD(10-5mol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图11为化合物II-31(3×10-7-3×10-5mol·L-1)对高钾液(60mmol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图12为化合物II-31(3×10-6mol/L)、阳性对照多沙唑嗪(10-7mol/L)拮抗去甲肾上腺素NA(3×10-7-10-4mol/L)收缩家兔离体血管的累积浓度效应曲线。
图13为化合物II-31(10-5mol/L)、氨氯地平(10-7mol/L)拮抗CaCl2(10-5-3×10-1mol/L)收缩家兔离体血管的累积浓度效应曲线。
图14为化合物II-31(3×10-6mol/L)拮抗5-羟色胺(10-8-3×10-4mol/L)收缩家兔离体血管的累积浓度效应曲线。
图15为化合物II-29(10-8-3×10-5mol·L-1)对肾上腺素AD(10-5mol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
图16为化合物II-29(10-7-3×10-5mol·L-1)对高钾液(60mmol·L-1)收缩家兔离体血管舒张作用的累积浓度效应曲线。
具体实施方式
本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中:
R1代表被R3单取代或多取代的芳香族基团或脂肪族环状基团,其中
R3为H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;当R3为多取代基团时,R3独立地选自H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;
A、B分别独立代表CH或N;
R2代表H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;当R2为多取代基团时,R2独立地选自H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;
Y代表任选被1-3个卤素原子取代的饱和或不饱和的含有2-8个碳原子的直链或支链烃基链,其中一个或多个碳任选被选自氧、硫和氮的杂原子替代。
优选地,在本发明式(I)中的R2为在所述苯并五元氮杂环上的单取代或多取代基团,例如R2为单取代、双取代、三取代基团等;R2为苯并五元氮杂环的任意碳原子上连接的基团,例如,当A(或B)为C原子时,则R2也可以与其相连接。
本文使用的术语“芳香族基团”的含义应理解为其中至少一个环为芳香环的C5-12单环烃环或双环烃环,其中一个或多个碳任选被选自氧、硫和氮的杂原子替代。芳香族基团的实例包括芳基和杂芳基,例如苯基、萘基、苯并噻唑基、苯并异噻唑基、苯并噁唑基、苯并异噁唑基、苯 并咪唑基、苯并吡唑基、苯并呋喃基、苯并嘧啶基、苯并吡啶基、喹噁啉基、呋喃基、吡啶基或嘧啶基。
本文使用的术语“脂肪族环状基团”的含义应理解为C4-12单环饱和环烃基或双环饱和环烃基,其中一个或多个碳任选被选自氧、硫和氮的杂原子替代。脂肪族环状基团的实例包括环丁基、环戊基、环己基、环庚基、四氢呋喃基、哌啶基或哌嗪基等。
除非另外具体指出,本文所使用的术语“卤素钟指氟、氯、溴或碘。
本文使用的术语“烷基”包括直链或支链烷基。所述“C1-C6烷基”基团的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、叔戊基、正己基、异己基等。
本文使用的术语“烷氧基”指-O-烷基,其中烷基包括直链或支链烷基。所述“C1-C6烷氧基”基团的实例包括甲氧基、乙氧基、丙氧基、丁氧基、戊氧基和己氧基等。
在一个具体实施方案中,本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中:
R1代表被R3单取代或多取代的芳香族基团或脂肪族环状基团,其中
所述芳香族基团优选为苯基、萘基、杂原子选自N、S、O的苯并五元杂环或六元杂环,或五元或六元不饱和杂环;更优选为苯基、萘基、苯并噻唑基、苯并异噻唑基、苯并噁唑基、苯并异噁唑基、苯并咪唑基、苯并吡唑基、苯并呋喃基、苯并嘧啶基、苯并吡啶基、喹噁啉基、呋喃基、吡啶基或嘧啶基;再更优选为苯基、苯并异噁唑基、苯并异噻唑基、苯并吡唑基、苯并呋喃基、萘基、呋喃基、吡啶基、嘧啶基或喹噁啉基;特别优选为苯基、苯并异噁唑基、苯并异噻唑基、 苯并呋喃基、喹噁啉基或嘧啶基;最优选为苯基;
所述脂肪族环状基团优选为五元或六元饱和环烃基,或杂原子选自N、S、O的五元或六元饱和杂环基;更优选为环戊基、环己基、四氢呋喃基、哌啶基或哌嗪基;再更优选为环己基、哌啶基或哌嗪基;特别优选为环己基;
R3为H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;优选地,R3为H、F、Cl、Br、CN、烷基部分任选被1-3个卤素原子取代的C1-C6烷基或C1-C6烷氧基、CHO、COCH3或COOCH3;更优选地,R3为H、F、Cl、COCH3、烷基部分任选被1-3个卤素原子取代的C1-C4烷基或C1-C4烷氧基;再更优选地,R3为H、F、Cl、CN、CF3、CH3或OCH3;最优选为,R3为H、F、Cl或OCH3;当R3为多取代基团时,R3独立地选自以上所述基团;
A、B分别独立代表CH或N;优选地,A、B均代表N;
R2代表H、卤素、CN、C1-C6烷基、C1-C6烷氧基、CHO、CO(C1-C6烷基)、COO(C1-C6烷基)、NO2、NH2、NH(C1-C6烷基)、SH、S(C1-C6烷基)、-SO(C1-C6烷基)或-SO2(C1-C6烷基),上述基团中烷基部分任选被一个或多个卤素原子取代;优选地,R2为H、F、Cl、Br、CN、NO2、烷基部分任选被1-3个卤素原子取代的C1-C6烷基或C1-C6烷氧基、CHO、COCH3或COOCH3;更优选地,R2为H、F、Cl、CN、CHO、COCH3、COOCH3或者烷基部分任选被1-3个卤素原子取代的C1-C4烷基或C1-C4烷氧基;再更优选地,R2为H、F、Cl、CN、CH3或COOCH3;特别优选地,R2为H、F、Cl或CH3;最优选地,R2为H;当R2为多取代基团时,R2独立地选自以上所述基团;
Y代表任选被1-3个卤素原子取代的饱和或不饱和的含有2-8个碳原子的直链或支链烃基链,其中一个或多个碳任选被选自氧、硫和氮的杂原子替代;优选地,Y为未取代的含2-8个碳的饱和烃基,或者,其中1个碳原子被氧或硫替代的未取代的含2-8个碳的饱和烃基,例如-C1-7亚烷基-O-;更优选Y为亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、 亚庚基、亚辛基、氧基亚甲基、氧基亚乙基、氧基亚丙基、氧基亚丁基、氧基亚戊基、氧基亚己基、氧基亚庚基、亚甲基氧基、亚乙基氧基、亚丙基氧基、亚丁基氧基、亚戊基氧基、亚己基氧基或亚庚基氧基;再更优选地,Y为亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、亚庚基、亚辛基、亚甲基氧基、亚乙基氧基、亚丙基氧基、亚丁基氧基、亚戊基氧基、亚己基氧基或亚庚基氧基;特别优选地,Y为亚丙基、亚丁基或亚丙基氧基;最优选地,Y为亚丁基。
在另一个具体实施方案中,本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中:
R1代表被R3单取代或双取代的芳香族基团或脂肪族环状基团,其中
所述芳香族基团优选为苯基、苯并异噁唑基、苯并呋喃基、苯并异噻唑基、苯并吡喃基或嘧啶基;
所述脂肪族环状基团优选为环己基;
R3为H、F、Cl、CF3、CN、CH3或OCH3;当R3为多取代基团时,R3独立地选自以上所述基团;
A、B分别独立代表CH或N;优选地,A、B均代表N;
R2代表H、F、Cl、或CH3;当R2为多取代基团时,R2独立地选自以上所述基团;
Y代表亚丙基、亚丁基或亚丙基氧基。
在另一个具体实施方案中,本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中:
R1代表被R3单取代或双取代的芳香族基团,其中
所述芳香族基团优选为苯基、苯并异噁唑基或苯并异噻唑基;
R3为H、F、Cl、CF3、CN、CH3或OCH3;当R3为多取代基团时,R3独立地选自以上所述基团;
A、B分别独立代表CH或N;优选地,A、B均代表N;
R2代表H;
Y代表亚丙基或亚丁基。
在又一个具体实施方案中,本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中:
R1代表被R3单取代或双取代的芳香族基团,其中
所述芳香族基团优选为苯基或苯并异噻唑基;
R3为H、Cl或CF3;当R3为多取代基团时,R3独立地选自以上所述基团;
A、B分别独立代表CH或N;优选地,A、B均代表N;
R2代表H;
Y代表亚丁基。
在又一个具体实施方案中,本发明提供了式(I)化合物及其药学上可接受的盐在制备血管舒张药物中的用途:
其中,当A、B均为N时,
R1不为被H或OCH3单取代的苯基,且
R2不为H或OCH3,其中OCH3在所述苯并五元氮杂环上双取代;且
Y不为亚乙基、亚丙基、亚丁基或亚戊基。
在又一个具体实施方案中,本发明的式(I)化合物及其药学上可接受的盐
其中,
R1代表被R3单取代或双取代的苯基或苯并噻唑基,其中
R3为H或Cl;当R3为多取代基团时,R3独立地选自以上所述基团;
A、B分别独立代表C;
R2代表H或CN;
Y代表亚丁基。
所述的苯并五元氮杂环基哌嗪类化合物包括:
I-1 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-2 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-3 1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-4 1-(4-(4-(2-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-5 2-甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-6 6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-7 1-(3-(4-苯基哌嗪-1-基)丙基)-1H-苯并咪唑、
I-8 1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑、
I-9 2-甲基-1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑、
I-10 1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-11 1-(4-(4-(4-甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-12 1-(4-(4-(2-呋喃基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-13 1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-14 1-(4-(4-(2-嘧啶基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-15 1-(4-(4-(1-环己基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-16 1-(4-(4-(1-萘基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-17 1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-18 1-(4-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-19 1-(4-(4-(3-(6-氟苯并异噻唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-20 1-(4-(4-(3-苯并吡唑基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-21 1-(4-(4-(3-(6-氟苯并呋喃基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-22 1-(3-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-23 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-24 1-(4-(4-(3-氯苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-25 6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-IH-苯并咪唑、
I-26 6-氰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-27 6-甲氧羰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-28 2-氯-1-(5-(4-(3-三氟甲基苯基)哌嗪-1-基)戊基)-1H-苯并咪唑、
I-29 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-30 1-(4-(4-(3-氟苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-31 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-32 6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-33 5,6-二甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-34 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噻唑、
I-35 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-36 6-氟-3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-37 6-氟-3-(4-(3-(1H-苯并三氮唑-1-基)丙基)哌嗪-1-基)苯并异噁唑、
I-38 1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-39 1-(3-(4-(3-甲基苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-40 1-(4-(4-(3-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-41 1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-42 1-(5-(4-(3-三氟甲基苯基)哌嗪-1-基)戊基)-1H-苯并三氮唑、
I-43 1-(4-(4-(2-呋喃基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-44 1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-45 1-(4-(4-(2-嘧啶基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-46 1-(4-(4-环己基哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-47 1-(4-(4-(1-萘基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-48 1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-49 1-(4-(4-(3-(6-氟-苯并异噻唑基))哌嗪-1-基)丁基)-1H-苯并三 氮唑、
I-50 1-(4-(4-(3-苯并吡唑基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-51 1-(3-(4-(3-(6-氟-苯并呋喃基))哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-52 1-(4-(4-(3-(6-氟-苯并异噁唑基))哌嗪-1-基)丙氧基)-1H-苯并三氮唑、
I-53 6-氟-1-(4-(4-(3-(6-氟-苯并异噻唑基))哌嗪-1-基)丙氧基)-1H-苯并三氮唑、
I-54 6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-55 6-氰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-56 6-甲氧羰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-57 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-吲哚、
I-58 6-氰基-1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-吲哚、
I-59 1-(3-(4-(3-三氟甲基苯基)哌嗪-1-基)丙基)-1H-苯并吡唑、
I-60 6-氰基-1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并吡唑、
I-61 1-[4-(4-(4-氟)苯基)哌嗪]丁基-1H-吲哚、
1-62 1-[4-环己基哌嗪]丁基-1H-吲哚、
I-63 1-[4-(4-(4-氟)苯基)哌嗪]丁基-5-乙酰基-1H-吲哚、
I-64 1-[4-环己基哌嗪]丁基-5-乙酰基-1H-吲哚、
I-65 1-[3-(4-(2,4-二氟)苯基)哌嗪]丁基-5-乙酰基-1H-吲哚、
I-66 1-[3-(4-(4-甲基)苯基)哌嗪]丙基-1H-吲哚、
I-67 1-[4-(4-(4-氯)苯基)哌嗪]丁基-1H-吲哚、
I-68 1-[4-(4-(2-甲基)苯基)哌嗪]丁基-1H-吲哚、
I-69 1-[4-(4-(3-三氟甲基)苯基)哌嗪]丁基-1H-吲哚、
I-70 1-[3-(4-(4-甲基)苯基)哌嗪]丙基-5-甲氧基-1H-吲哚、
I-71 1-[4-(4-(4-三氟甲氧基)苯基)哌嗪]丁基-5-甲氧基-1H-吲哚、
I-72 1-[4-(4-(3-三氟甲基)苯基)哌嗪]丁基-5-甲氧基-1H-吲哚、
I-73 1-[3-(4-(2-甲基)苯基)哌嗪]丁基-5-甲氧基-1H-吲哚、
I-74 1-[3-(4-(2,4-二氟)苯基)哌嗪]丙基-5-硝基-1H-吲哚、
I-75 1-[4-(4-(4-氯)苯基)哌嗪]丁基-5-硝基-1H-吲哚、
I-76 1-[4-(4-(3-三氟甲基)苯基)哌嗪]丁基-5-硝基-1H-吲哚、
I-77 1-[4-(4-(2-甲氧基)苯基)哌嗪]丁基-5-硝基-1H-吲哚、
I-78 1-[4-(4-(2-甲氧基)苯基)哌嗪]丁基-5-氯-1H-吲哚、
I-79 1-[4-(4-(3-三氟甲基)苯基)哌嗪]丁基-5-氯-1H-吲哚、
I-80 1-[4-(4-(2,4-二氟)苯基)哌嗪]丁基-5-氯-1H-吲哚、
I-81 1-[2-(4-(2,4-二三氟甲氧基)苯基)哌嗪]乙基-5-氯-1H-吲哚、
I-82 1-[2-(4-(2,4-二甲氧基)苯基)哌嗪]乙基-6-硝基-1H-吲哚、
I-83 1-[2-(4-(2,4-二氯)苯基)哌嗪]乙基-6-甲氧基-1H-吲哚。
具体化学结构式如下表所示:
在本发明的具体实施方案中,更优选如下化合物或其药学上可接受的盐:
I-1 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-2 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-3 1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-4 1-(4-(4-(2-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-5 2-甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-6 6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-7 1-(3-(4-苯基哌嗪-1-基)丙基)-1H-苯并咪唑、
I-8 1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑、
I-9 2-甲基-1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑、
I-10 1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-11 1-(4-(4-(4-甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-12 1-(4-(4-(2-呋喃基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-13 1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-14 1-(4-(4-(2-嘧啶基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-15 1-(4-(4-(1-环己基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-16 1-(4-(4-(1-萘基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-17 1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-18 1-(4-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-19 1-(4-(4-(3-(6-氟苯并异噻唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-20 1-(4-(4-(3-苯并吡唑基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-21 1-(4-(4-(3-(6-氟苯并呋喃基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-22 1-(4-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-23 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-24 1-(4-(4-(3-氯苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-25 6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-26 6-氰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-27 6-甲氧羰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H- 苯并咪唑、
I-28 2-氯-1-(5-(4-(3-三氟甲基苯基)哌嗪-1-基)戊基)-1H-苯并咪唑、
I-29 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-30 1-(4-(4-(3-氟苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-31 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-32 6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-33 5,6-二甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-34 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噻唑、
I-35 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-36 6-氟-3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-37 6-氟-3-(4-(3-(1H-苯并三氮唑-1-基)丙基)哌嗪-1-基)苯并异噁唑、
I-38 1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-39 1-(3-(4-(3-甲基苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-40 1-(4-(4-(3-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-41 1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-42 1-(5-(4-(3-三氟甲基苯基)哌嗪-1-基)戊基)-1H-苯并三氮唑、
I-43 1-(4-(4-(2-呋喃基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-44 1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-45 1-(4-(4-(2-嘧啶基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-46 1-(4-(4-环己基哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-47 1-(4-(4-(1-萘基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-48 1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-49 1-(4-(4-(3-(6-氟-苯并异噻唑基))哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-50 1-(4-(4-(3-苯并吡唑基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-51 1-(3-(4-(3-(6-氟-苯并呋喃基)哌嗪-1-基)丙基)-1H-苯并三氮 唑、
I-52 1-(4-(4-(3-(6-氟-苯并异噁唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑、
I-53 6-氟-1-(4-(4-(3-(6-氟-苯并异噻唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑、
I-54 6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-55 6-氰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-56 6-甲氧羰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-57 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-吲哚、
I-58 6-氰基-1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-吲哚、
I-59 1-(3-(4-(3-三氟甲基苯基)哌嗪-1-基)丙基)-1H-苯并吡唑、
I-60 6-氰基-1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并吡唑。
在本发明的具体实施方案中,再更优选如下化合物或其药学上可接受的盐:
I-1 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-2 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-3 1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-4 1-(4-(4-(2-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-5 2-甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-6 6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-8 1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑、
I-13 1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-15 1-(4-(4-(1-环己基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-17 1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-18 1-(4-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-22 1-(4-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丁基)-1H-苯并咪唑、
I-23 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-24 1-(4-(4-(3-氯苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑、
I-25 6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-29 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-30 1-(4-(4-(3-氟苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-31 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-32 6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-34 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噻唑、
I-35 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-36 6-氟-3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-37 6-氟-3-(4-(3-(1H-苯并三氮唑-1-基)丙基)哌嗪-1-基)苯并异噁唑、
I-38 1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-39 1-(3-(4-(3-甲基苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-40 1-(4-(4-(3-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-41 1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-51 1-(3-(4-(3-(6-氟-苯并呋喃基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-52 1-(4-(4-(3-(6-氟-苯并异噁唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑、
I-54 6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-IH-苯并三氮唑、
I-59 1-(3-(4-(3-三氟甲基苯基)哌嗪-1-基)丙基)-IH-苯并吡唑。
在本发明的具体实施方案中,特别优选如下化合物或其药学上可接受的盐:
I-1 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-2 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-3 1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-29 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-30 1-(4-(4-(3-氟苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-31 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-34 3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噻唑、
I-36 6-氟-3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑、
I-37 6-氟-3-(4-(3-(1H-苯并三氮唑-1-基)丙基)哌嗪-1-基)苯并异噁唑、
I-38 1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-39 1-(3-(4-(3-甲基苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑、
I-40 1-(4-(4-(3-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑。
在本发明的具体实施方案中,特别优选如下化合物或其药学上可接受的盐:
I-3 1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑、
I-29 1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-31 1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑、
I-34 3-(4-(4-(IH-苯并三氮唑-I-基)丁基)哌嗪-1-基)苯并异噻唑。
本发明式(I)化合物的药学上可接受的盐优选为盐酸盐、溴氢酸盐、硫酸盐、三氟醋酸盐、甲磺酸盐、酒石酸盐、苹果酸盐、琥珀酸盐、马来酸盐、柠檬酸盐、磷酸盐、乳酸盐、丙酮酸盐、乙酸盐、富马酸盐、草酰乙酸盐、乙磺酸盐、草酸盐、苯磺酸盐或羟乙磺酸盐。本发明所述的药学上可接受的盐优选含结晶水,更优选含0.5-3分子的结晶水。
在本发明用途的具体实施方案中,尤其优选化合物I-2或其药学上可 接受的盐,例如其盐酸盐,即化合物II-2,化学结构如II-2所示。
化合物I-3优选的盐为盐酸盐,即化合物II-3,化学结构如II-3所示。
其中,化合物I-29优选的盐为盐酸盐,即化合物II-29,化学结构如II-29所示。
化合物I-31优选的盐为盐酸盐,即化合物II-31,化学结构如II-31所示。
化合物I-34优选的盐为盐酸盐,即化合物II-34,化学结构如II-34所示。
动物离体试验证明:化合物II-2,能够舒张由肾上腺素和高钾液收 缩的血管平滑肌,其舒张的-logEC50值分别为5.73±0.03和5.34±0.02(如图1、图2所示);化合物II-3,舒张由肾上腺素和高钾液收缩的血管平滑肌的-logEC50值分别为6.01±0.05和5.49±0.05(如图8、图9所示)。
化合物II-2的血管平滑肌舒张作用机制的研究表明,该化合物可竞争性拮抗去甲肾上腺素、钙离子和五羟色胺对血管的收缩作用,可使上述激动剂的量效曲线平行右移,并不降低其最大反应,说明是竞争性拮抗,其拮抗去甲肾上腺素(NA)、钙离子和五羟色胺(5-HT)对血管的收缩作用的PA2值分别为7.37±0.08(多沙唑嗪为7.52±0.04)、5.61±0.04(氨氯地平为6.99±0.05)和5.71±0.08(如图3、图4、图5、图6及图7所示)。结果表明,化合物II-2是通过阻断α1受体、Ca2+离子通道和血管5-HT2A受体来发挥其血管舒张作用的。
动物离体试验证明:化合物II-29,能够舒张由肾上腺素和高钾液收缩的血管平滑肌,其舒张的-logEC50值分别为6.01±0.02和5.64±0.01(如图15、图16所示)。化合物II-31舒张由肾上腺素和高钾液收缩的血管平滑肌的-logEC50值分别为6.19±0.03和5.55±0.03(如图10、图11所示)。
化合物II-31的血管平滑肌舒张作用机制的研究表明,该化合物可竞争性拮抗去甲肾上腺素、钙离子和五羟色胺对血管的收缩作用,可使上述激动剂的量效曲线平行右移,并不降低其最大反应,说明是竞争性拮抗,其拮抗去甲肾上腺素、钙离子和五羟色胺对血管的收缩作用的PA2值分别为6.02±0.13(多沙唑嗪为7.76±0.24)、6.56±0.032(氨氯地平为7.51±0.288)和6.726±0.089(如图12、图13和图14所示)。这些结果表明,化合物II-31也是通过阻断α1受体、Ca2+离子通道和血管5-HT2A受体,来发挥其血管舒张作用的。
化合物II-2在大鼠体内整体试验中,表现出明显的降压作用,其口服吸收良好,毒性小,治疗指数大,骨髓微核实验呈阴性,具有作为新型多靶点血管舒张药物开发的潜在价值。
本发明人发现,本发明所述的式(I)化合物及其药学上可接受的盐具有显著的受试者血管平滑肌舒张作用。本发明所述的式(I)化合物及 其药学上可接受的盐可通过例如α受体拮抗作用(特别是α1受体拮抗作用)实现血管平滑肌舒张作用。除此之外,本发明的式(I)化合物及其药学上可接受的盐也可能作用于其他靶点或途径实现血管平滑肌舒张作用,例如Ca2+通道阻断或拮抗5-HT2A受体拮抗作用。特别优选具有多重靶点作用的本发明化合物,例如化合物I-2或化合物II-2。该多重靶点作用使本发明化合物特别有效用于血管持续病理性收缩或血管平滑肌痉挛相关的疾病,其相对于单一的单靶点药物或多种单靶点药物联用用于所述疾病时,可实现更高药效,或者有效减少耐药性、或者减小不想要的副作用,使得安全性更高。具体来说,多重靶点的作用使得例如可在不完全阻断血管平滑肌的α1受体的同时,通过阻断Ca2+通道和/或5-HT2A受体的协同作用产生良好的降压药效,这使得残存的α1受体仍可参与升压反射,可防止降低体位性低血压的发生;和/或通过阻断Ca2+通道作用,在协同降压的同时,产生抗心肌肥厚、保护血管内皮细胞、抗动脉粥样硬化、抑制血管平滑肌增生、改善脑循环等作用,并通过减慢心率,有效防止心动过速和心悸的发生,防止首剂效应的发生;和/或通过阻断5-HT2A受体作用,产生协同降压的同时,可有效改善阻塞性血管病患者的血流供应,使其适用于伴有动脉粥样硬化、伴有内皮损伤的高血压患者。
由此,本发明式(I)化合物及其药学上可接受的盐可用于预防、缓解或治疗受试者与血管持续病理性收缩或血管痉挛相关的疾病或病症。所述式(I)化合物及其药学上可接受的盐可特别用于预防、缓解或治疗高血压,心力衰竭,心绞痛,冠心病等;用于由血管痉挛引起的脑缺血性疾病,心肌缺血性疾病、休克等;用于肾缺血、由肾血管痉挛引起的肾功能低下和外周血管痉挛性疾病。
本文所述受试者优选哺乳动物,特别优选人。
本发明提供了式(I)化合物或其药学上可接受的盐特别优选用于预防、缓解或治疗例如,高血压、心绞痛、心力衰竭、冠心病、脑缺血以及外周血管痉挛性疾病如血栓闭塞性脉管炎、雷诺氏病等。
本发明式(I)化合物或其药学上可接受的盐可制备成合适的药物组合物形式用于口服给药、肠胃外给药、通过吸入喷雾给药、直肠给药、鼻内给药、舌下给药、颊内给药、透皮给药或经植入给药,所述肠胃外给药包括皮下、皮内、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、病灶 内和颅内注射给药或滴注技术。本发明式(I)化合物或其药学上可接受的盐优选口服给药、舌下给药、静脉内、肌内、皮下注射给药。所述的药物组合物可包含一种或多种常规的可药用载体、助剂或介质,例如:稀释剂、赋形剂如水等;粘合剂如纤维素衍生物、明胶、聚乙烯吡咯烷酮等;填充剂如淀粉等;崩裂剂如碳酸钙、碳酸氢钠;润滑剂如硬脂酸钙或硬脂酸镁等;以及其他辅助剂如香味剂和甜味剂。
包含本发明式(I)化合物或其药学上可接受的盐的所述药物组合物可以是无菌注射剂的形式,例如作为无菌水性或油脂性悬浮液。该悬浮液可根据本领域已知的技术使用合适的分散剂或润湿剂(例如Tween 80)和悬浮剂配制。无菌注射剂也可为在可用于肠胃外给药的无毒稀释剂或溶剂中的无菌注射溶液或悬浮液,例如作为1,3-丁二醇中的溶液。可使用的可用介质和溶剂为甘露醇、水、Ringer′s溶液和等渗氯化钠溶液。此外,无菌的不挥发油常规可用作溶剂或悬浮介质。为此目的,可使用任何温和的不挥发油,包括合成的甘油单酯或甘油二酯。脂肪酸,例如油酸及其甘油酯衍生物可用于可注射制剂中,天然可药用的油也可用于其中,例如橄榄油或蓖麻油,尤其是其聚氧乙烯化形式。所述油溶液或悬浮液还可包含长链醇稀释剂或分散剂(例如描述于Ph.Helv中的那些)或类似的醇。
包含本发明式(I)化合物或其药学上可接受的盐的药物组合物可以任何可口服的剂型口服给药,所述剂型包括但不限于,胶囊剂、片剂、粉剂、颗粒剂和水性悬浮剂和溶液剂。所述剂型是根据药物制剂领域中所熟知的技术而制得。对于口服使用的片剂,通常使用的载体包括乳糖和玉米淀粉。也通常添加润滑剂(例如硬脂酸镁)。对胶囊形式的口服给药,可用的稀释剂包括乳糖和干燥的玉米淀粉。当水性悬浮剂被口服给药时,活性组分可与乳化剂和悬浮剂结合。如果需要,可添加某些甜味剂和/或调味剂和/或着色剂。
包含本发明式(I)化合物或其药学上可接受的盐的药物组合物可通过鼻用气溶剂或吸入给药。这类组合物可根据药物制剂领域中所熟知的技术制备,并且可使用苯甲醇或其他合适的防腐剂、提高生物利用度的吸收促进剂、碳氟化合物和/或本领域已知的其他增溶剂或分散剂,制备为盐水中的溶液。
包含本发明式(I)化合物或其药学上可接受的盐的药物组合物还可以用于直肠给药的栓剂形式给药。所述组合物可通过将本发明化合物与合 适的无刺激的赋形剂混合制得,所述赋形剂在室温下为固体但在直肠温度下为液体,因此在直肠中将溶化以释放活性组分。这类物质包括但不限于,可可脂、蜂蜡和聚乙二醇。
根据麻醉大鼠试验结果推断,本发明式(I)化合物的每日给药剂量应该小于氨氯地平的每日给药剂量。用于舒张血管或高血压的氨氯地平的每日给药剂量为本领域已知,例如10mg/日。本发明式(I)化合物的具体剂量可根据临床实验结果及患者的病情、年龄等由医师决定。
包含本发明式(I)化合物或其药学上可接受的盐的药物组合物可以采用医学领域常规的方法进行制备,其中活性成分的含量为0.1重量%-99.5重量%,这取决于待治疗或预防的病症以及给予所述化合物的受试者的特性。对于所给化合物的剂量方案可由本领域技术人员利用本文公开的内容容易地确定。
在一个具体实施方案中,本发明的化合物式(I)化合物或其药学上可接受的盐可与一种或多种其他活性药物组分联用。该联用药物可以是包含本发明化合物或其药学上可接受的盐和一种或多种其他活性药物组分的单一组合物的形式,或者,该联用药物可为两种或多种单独的组合物的联合形式,其中本发明的化合物包含在一种组合物中,一种或多种其他活性药物组分包含在一种或多种单独的组合物中。可与本发明式(I)化合物或其药学上可接受的盐联用以预防、缓解或治疗受试者与血管持续病理性收缩或血管痉挛相关的疾病或病症的其他活性药物组分例如为其他抗平滑肌痉挛药物,优选自舍曲林、卡托普利、贝那普利、缬沙坦、普萘洛尔、利尿药。
本申请述及的各实施方案,或者不同优选级别的方案除非另有说明均可任意组合。
本发明的化合物可采用如下的方法进行合成:
合成路线1:
其中,R1、R2、A、B如上文定义;n=2-7;X代表其可药用的盐,例如HCl,2HCl,HBr,2HBr,H2SO4,CH3SO3H等。
以取代1H-苯并五元氮杂环为原料,在氢氧化钠水溶液中,与氯烷基溴进行缩合反应,制备N-氯烷基-取代苯并五元氮杂环化合物,再与取代芳基哌嗪进行缩合反应,制备式(I)所示化合物,最后经酸化成盐制备相应的盐,得式(II)化合物。采用上述方法可制备化合物I-1-I-21、I-25-I-51和1-54-I-60及其盐。
合成路线2:
其中,R1、R2、A、B如上文定义;n=2-7;X代表其可药用的盐,例如HCl,2HCl,HBr,2HBr,H2SO4,CH3SO3H等。
取代苯并五元氮杂环-1醇为原料,与氢化钠交换活泼氢得相应的钠盐,再与氯代烷基溴反应得到相应的氯化物,再与取代哌嗪进行缩合反应,制备式(I)所示化合物,最后经酸化成盐制备相应的盐,得式(II)化合物。采用上述方法可制备化合物I-22-24、I-52-53及其盐。
合成通法:N-(4-氯丁基)-取代苯并五元氮杂环化合物的制备
将1H-取代苯并五元氮杂环(0.10mol)溶解于30重量%氢氧化钠 水溶液100ml中,加入4-氯溴丁烷(34.0g,0.10mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析或制备型HPLC分离纯化,得N-(4-氯丁基)-取代苯并五元氮杂环化合物,收率30.0-85.0%。
实施例1
1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-1)的制备
将1H-苯并咪唑(11.8g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得1-(4-氯丁基)-1H-苯并咪唑12.5g,收率60.0%。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入3-三氯苯基哌嗪(5.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-1)6.8g,收率61.4%。ESI-MS[M+H]+:m/z 369.2。
实施例2
1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-2)和1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑盐酸盐(II-2)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应10-20小时。冷却至室温,过滤,滤液经 浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-2)7.6g,收率62.8%。
将化合物(I-2)(6.04g,0.015mol)溶解于80ml乙酸乙酯和8ml乙醇中。冰水浴冷却条件下,滴加3mol/L的氯化氢/乙酸乙酯溶液,调溶液pH=3,升温至50℃搅拌20min,冷却析晶,过滤,干燥,得化合物(II-2)固体5.9g,收率89.7%。ESI-MS[M+H]+:m/z 403.2。
实施例3
1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-3)和1-(4-(4-(2,3-二氯苯基)哌嗪-1-基)丁基)-1H-苯并咪唑盐酸盐(II-3)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入2,3-二氯苯基哌嗪(6.93g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应10-20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-3)7.5g,收率62.0%。
将化合物(I-3)(6.05g,0.015mol)溶解于80ml乙酸乙酯和8ml乙醇中。冰水浴冷却条件下,滴加3mol/L的氯化氢/乙酸乙酯溶液,调溶液pH=3,升温至50℃搅拌20min,冷却析晶,过滤,干燥,得化合物(II-3)固体6.0g,收率90.9%。ESI-MS[M+H]+:m/z 403.1。
实施例4
1-(4-(4-(2-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-4)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入2-甲氧基苯基哌嗪(5.77g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱得化合物(I-4)7.7g,收率70.6%。ESI-MS[M+H]+:m/z 365.2。
实施例5
2-甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-5)的制备
将2-甲基-1H-苯并咪唑(13.2g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得1-(4-氯丁基)-2-甲基-1H-苯并咪唑13.7g,收率61.5%。
将1-(4-氯丁基)-2-甲基-1H-苯并咪唑(8.02g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-5)8.1g,收率64.9%。ESI-MS[M+H]+:m/z417.2。
实施例6
6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-6)的制备
将6-氟-1H-苯并咪唑(13.2g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。按通法进行后处理操作,经中性Al2O3层析分离纯化,得1-(4-氯丁基)-6-氟-1H-苯并咪唑14.2g,收率62.6%。
将1-(4-氯丁基)-6-氟-1H-苯并咪唑(8.16g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-6)8.5g,收率67.4%。ESI-MS[M+H]+:m/z 421.2。
实施例7
1-(3-(4-苯基哌嗪-1-基)丙基)-1H-苯并咪唑(I-7)的制备
将1H-苯并咪唑(11.8g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入3-氯溴丙烷(31.4g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得1-(3-氯丙基)-1H-苯并咪唑12.0g,收率62.0%。
将1-(3-氯丙基)-1H-苯并咪唑(6.98g,0.036mol)溶解于100ml乙腈中,分别加入苯基哌嗪(4.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-7)6.1g,收率63.2%。ESI-MS[M+H]+:m/z 321.2。
实施例8
1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑(I-8)的制备
采用实施例7中的方法制备1-(3-氯丙基)-1H-苯并咪唑。
将1-(3-氯丙基)-1H-苯并咪唑(6.98g,0.036mol)溶解于100ml乙腈中,分别加入3-氟苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-8)6.4g,收率63.1%。ESl-MS[M+H]+:m/z 339.2。
实施例9
2-甲基-1-(3-(4-(3-氟苯基)哌嗪-1-基)丙基)-1H-苯并咪唑(I-9)的制备
将2-甲基-1H-苯并咪唑(13.2g,0.10mol)溶解于20重量%氢氧化钠水溶液200mL中,加入3-氯溴丙烷(31.4g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100mL二氯甲烷萃取,分液,水相加入二氯甲烷100mL萃取,合并有机相,经100mL饱和盐水洗涤,分液,蒸干有机相得油 状物。油状物经中性Al2O3层析分离纯化,得1-(3-氯丙基)-2-甲基-1H-苯并咪唑12.9g,收率62.1%。
将1-(3-氯丙基)-2-甲基-1H-苯并咪唑(7.49g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟苯基哌嗪(4.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-9)6.67g,收率63.1%。ESI-MS[M+H]+:m/z 353.2。
实施例10
1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-10)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入3-氰基苯基哌嗪(5.6g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-10)6.7g,收率62.4%。ESI-MS[M+H]+:m/z 360.2。
实施例11
1-(4-(4-(4-甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-11)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-甲基苯基哌嗪(5.3g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-11)6.4g,收率60.7%。ESI-MS[M+H]+:m/z 349.2。
实施例12
1-(4-(4-(2-呋喃基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-12)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-(2-呋喃基)哌嗪(4.6g,0.03mol),二异丙基乙基 胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-12)6.0g,收率61.5%。ESI-MS[M+H]+:m/z 325.2。
实施例13
1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-13)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-(4-吡啶基)哌嗪(4.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-13)6.3g,收率62.1%。ESI-MS[M+H]+:m/z 336.2。
实施例14
1-(4-(4-(2-嘧啶基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-14)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-(2-嘧啶基)哌嗪(4.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-14)6.1g,收率60.1%。ESI-MS[M+H]+:m/z 337.2。
实施例15
1-(4-(4-(1-环己基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-15)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-(1-环己基)哌嗪(5.1g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-15)6.4g,收率62.9%。ESI-MS[M+H]+:m/z 341.3。
实施例16
1-(4-(4-(1-萘基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-16)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-(1-萘基)哌嗪(6.4g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-16)6.8g,收率59.1%。ESI-MS[M+H]+:m/z 385.2。
实施例17
1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-17)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100ml乙腈中,分别加入4-(2-喹噁啉基)哌嗪(6.4g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应20小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-16)6.9g,收率59.6%。ESI-MS[M+H]+:m/z 387.2。
实施例18
1-(4-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丁基)-1H-苯并咪唑(I-18)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100mL乙腈中,分别加入6-氟-3-(哌嗪-4-基)苯并异噁唑(6.6g,0.05mol)、二异丙基乙基胺(15.5g,0.12mol)、以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经柱层析(中性Al2O3)层析分离纯化,二氯甲烷洗脱,得化合物(I-18)7.7g,收率65.6%。ESI-MS[M+H]+:m/z 394.2。
实施例19
1-(4-(4-(3-(6-氟苯并异噻唑基))哌嗪-1-基)丁基)-1H-苯并咪唑(I-19)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100mL乙腈中,分别加入6-氟-3-(哌嗪-4-基)苯并异噻唑(7.1g,0.05mol)、二异丙基乙基胺(15.5g,0.12mol)、以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经柱层析(中性Al2O3)层析分离纯化,二氯甲烷洗脱,得化合物(I-19)7.9g,收率64.6%。ESI-MS[M+H]+:m/z 410.2。
实施例20
1-(4-(4-(3-苯并吡唑基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-20)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100mL乙腈中,分别加入3-(哌嗪-4-基)苯并吡唑(6.1g,0.05mol)、二异丙基乙基胺(15.5g,0.12mol)、以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经柱层析(中性Al2O3)层析分离纯化,二氯甲烷洗脱,得化合物(I-20)6.9g,收率61.5%。ESI-MS[M+H]+:m/z 375.2。
实施例21
1-(4-(4-(3-(6-氟苯并呋喃基))哌嗪-1-基)丁基)-1H-苯并咪唑(I-21)的制备
采用实施例1中的方法制备1-(4-氯丁基)-1H-苯并咪唑。
将1-(4-氯丁基)-1H-苯并咪唑(7.51g,0.036mol)溶解于100mL乙腈中,分别加入6-氟-3-(哌嗪-4-基)苯并呋喃(6.6g,0.05mol)、二异丙基乙基胺(15.5g,0.12mol)、以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经柱层析(中性Al2O3)层析分离纯化,二氯甲烷洗脱,得化合物(I-21)7.5g,收率63.6%。ESI-MS[M+H]+:m/z 393.2。
实施例22
1-(3-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丙氧基)-1H-苯并咪唑(I-22)的制备
1-(3-氯丙氧基)苯并咪唑的制备
将1-羟基苯并咪唑(0.01mol)溶于10ml NMP中,分批加入50%重量比的钠氢(0.01mol)的固体石蜡混合物,搅拌反应0.5h。同时,将3-氯溴丙烷(0.015mol)、溶解于5mlNMP中,加入上述的溶液中,室温下搅拌反应12h。将反应液倒入50ml水中,乙酸乙酯萃取(3×50mL),合并有机相,经30ml水洗涤,加入无水硫酸镁干燥有机相,过滤,蒸干溶剂,油状物经中性Al2O3层析或制备型HPLC分离纯化,得1-(3-氯丙氧基)苯并咪唑,收率75.0%。
将1-(3-氯丙氧基)苯并咪唑(0.06mol)溶解于150ml乙腈中,分别加入4-(3-(6-氟苯并异噁唑基))哌嗪(0.05mol),二异丙基乙基胺(0.2mol),以及碘化钾(0.05mol),室温下混合搅拌10分钟,然后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得1-(3-(4-(3-(6-氟苯并异噁唑基))哌嗪-1-基)丙氧基)-1H-苯并咪唑(I-22)13.7g,收率69.1%。ESI-MS[M+H]+:m/z 396.2。
实施例23
1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑(I-23)的制备
采用实施例22中的方法制备1-(3-氯丙氧基)苯并咪唑。
将1-(3-氯丙氧基)苯并咪唑(0.06mol)溶解于150ml乙腈中,分别加入4-(3-三氟甲基苯基)哌嗪(0.05mol),二异丙基乙基胺(0.2mol),以及碘化钾(0.05mol),室温下混合搅拌10分钟,然后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑(I-23)13.7g,收率67.9%。ESI-MS[M+H]+:m/z 405.2。
实施例24
1-(4-(4-(3-氯苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑(I-24)的制备
采用实施例22中的方法制备1-(3-氯丙氧基)苯并咪唑。
将1-(3-氯丙氧基)苯并咪唑(0.06mol)溶解于150ml乙腈中,分别加入4-(3-氯苯基)哌嗪(0.05mol),二异丙基乙基胺(0.2mol),以及碘化钾(0.05mol),室温下混合搅拌10分钟,然后升温回流反应 15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得1-(4-(4-(3-氯苯基)哌嗪-1-基)丙氧基)-1H-苯并咪唑(I-24)12.2g,收率66.1%。ESI-MS[M+H]+:m/z371.2。
实施例25
6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-25)的制备
将6-氯-1H-苯并咪唑(15.2g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。按通法进行后处理操作,经中性Al2O3层析分离纯化,得1-(4-氯丁基)-6-氯-1H-苯并咪唑15.1g,收率62.3%。
将1-(4-氯丁基)-6-氯-1H-苯并咪唑(8.71g,0.036m0l)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-25)8.6g,收率65.8%。ESI-MS[M+H]+:m/z 437.2。
实施例26
6-氰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-26)的制备
将6-氰基-1H-苯并咪唑(14.3g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。按通法进行后处理操作,经中性Al2O3层析分离纯化,得1-(4-氯丁基)-6-氰基-1H-苯并咪唑14.7g,收率63.1%。
将1-(4-氯丁基)-6-氰基-1H-苯并咪唑(8.39g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合 溶剂洗脱,得化合物(I-26)8.6g,收率66.9%。ESI-MS[M+H]+:m/z428.2。
实施例27
6-甲氧羰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并咪唑(I-27)的制备
将6-甲氧羰基-1H-苯并咪唑(17.6g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。按通法进行后处理操作,经中性Al2O3层析分离纯化,得1-(4-氯丁基)-6-甲氧羰基-1H-苯并咪唑16.9g,收率63.4%。
将1-(4-氯丁基)-6-甲氧羰基-1H-苯并咪唑(9.58g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-27)8.8g,收率63.7%。ESI-MS[M+H]+:m/z461.2。
实施例28
2-氯-1-(5-(4-(3-三氟甲基苯基)哌嗪-1-基)戊基)-1H-苯并咪唑(I-28)的制备
将2-氯-1H-苯并咪唑(15.2g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入5-氯溴戊烷(36.8g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得1-(5-氯戊基)-2-氯-1H-苯并咪唑16.0g,收率62.5%。
将1-(5-氯戊基)-2-氯-1H-苯并咪唑(9.22g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.91g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩 得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-5)8.8g,收率65.2%。ESI-MS[M+H]+:m/z 451.2。
实施例29
1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-29)的制备
将苯并三氮唑(11.9g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相再加入二氯甲烷100ml萃取,合并有机相,经100ml饱和食盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,二氯甲烷洗脱得1-(4-氯丁基)-1H-苯并三氮唑17.0g,收率81.0%。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-氯苯基哌嗪(5.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-29)7.8g,收率70.3%。
将化合物(I-29)(5.55g,0.015mol)溶解于50ml乙酸乙酯中。冰水浴冷却条件下,滴加浓度3mol/L的氯化氢/乙酸乙酯溶液,至反应溶液pH=2,搅拌10min,过滤,干燥,得化合物(1I-29)固体5.4g,收率88.0%。ESI-MS[M+H]+:m/z 370.1。
实施例30
1-(4-(4-(3-氟苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-30)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-氟苯基哌嗪(5.4g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-30)7.3g,收率68.9%。ESI-MS[M+H]+:m/z 354.2。
实施例31
1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-31) 和1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑盐酸盐(II-31)的制备
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-31)7.8g,收率64.5%。
将化合物(I-31)(6.05g,0.015mol)溶解于50ml乙酸乙酯中。冰水浴冷却条件下,滴加浓度3mol/L的氯化氢/乙酸乙酯溶液,至反应溶液pH=2,搅拌10min,过滤,干燥,得化合物(II-31)固体5.6g,收率84.8%。ESI-MS[M+H]+:m/z 404.2。
实施例32
6-氟-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-32)的制备
将6-氟-1H-苯并三氮唑(13.7g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。按合成通法中的方法进行后处理,经制备型HPLC分离纯化,得1-(4-氯丁基)-6-氟-1H-苯并三氮唑8.9g,收率39.0%。
将1-(4-氯丁基)-6-氟-1H-苯并三氮唑(8.2g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12moi),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-32)8.3g,收率65.7%。ESl-MS[M+H]+:m/z 422.2。
实施例33
5,6-二甲基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-33)的制备
将5,6-二甲基-1H-苯并三氮唑(14.7g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁 基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。按合成通法中的方法进行后处理,经制备型HPLC分离纯化,得1-(4-氯丁基)-5,6-二甲基-1H-苯并三氮唑17.4g,收率73.2%。
将1-(4-氯丁基)-5,6-二甲基-1H-苯并三氮唑(8.56g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al203层析分离纯化,二氯甲烷洗脱,得化合物(I-33)9.1g,收率70.3%。ESI-MS[M+H]+:m/z 432.2。
实施例34
3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噻唑(I-34)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-(哌嗪-1-基)苯并异噻唑(6.58g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-34)8.2g,收率69.6%。
将化合物(I-34)(5.89g,0.015mol)溶解于50ml乙酸乙酯和5ml乙醇中。冰水浴冷却条件下,滴加浓度3mol/L的氯化氢/乙酸乙酯溶液,至反应溶液pH=2,搅拌10min,过滤,干燥,得化合物(II-34)固体5.5g,收率85.5%。ESI-MS[M+H]+:m/z 393.2。
实施例35
3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑(I-35)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-(哌嗪-1-基)苯并异噁唑(6.1g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物, 经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-35)8.0g,收率70.9%。ESI-MS[M+H]+:m/z 377.2。
实施例36
6-氟-3-(4-(4-(1H-苯并三氮唑-1-基)丁基)哌嗪-1-基)苯并异噁唑(I-36)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入6-氟3-(哌嗪-1-基)苯并异噁唑(6.1g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-36)8.3g,收率70.0%。ESI-MS[M+H]+:m/z 395.2。
实施例37
6-氟-3-(4-(3-(1H-苯并三氮唑-1-基)丙基)哌嗪-1-基)苯并异噁唑(I-37)的制备
将苯并三氮唑(11.9g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入3-氯溴丙烷(30.2g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相再加入二氯甲烷100ml萃取,合并有机相,经100ml饱和食盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,二氯甲烷洗脱得1-(3-氯丙基)-1H-苯并三氮唑15.6g,收率80.0%。
将1-(3-氯丙基)-1H-苯并三氮唑(7.02g,0.036mol)溶解于100ml乙腈中,分别加入6-氟-3-(哌嗪-1-基)苯并异噁唑(6.6g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-37)7.9g,收率69.3%。ESI-MS[M+H]+:m/z 380.2。
实施例38
1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑(I-38)的制备
采用实施例37中的方法制备1-(3-氯丙基)-1H-苯并三氮唑。
将1-(3-氯丙基)-1H-苯并三氮唑(7.02g,0.036mol)溶解于100ml乙腈中,分别加入2,3-二氯苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-38)8.2g,收率70.2%。ESI-MS[M+H]+:m/z 389.1。
实施例39
1-(3-(4-(3-甲基苯基)哌嗪-1-基)丙基)-1H-苯并三氮唑(I-39)的制备
采用实施例37中的方法制备1-(3-氯丙基)-1H-苯并三氮唑。
将1-(3-氯丙基)-1H-苯并三氮唑(7.02g,0.036mol)溶解于100ml乙腈中,分别加入3-甲基苯基哌嗪(5.3g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-39)7.5g,收率74.6%。ESI-MS[M+H]+:m/z 335.2。
实施例40
1-(4-(4-(3-甲氧基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-40)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-甲氧基苯基哌嗪(5.8g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-40)7.6g,收率69.4%。ESI-MS[M+H]+:m/z 365.2。
实施例41
1-(4-(4-(3-氰基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-41)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-氰基苯基哌嗪(5.6g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-41)7.6g,收率70.5%。ESI-MS[M+H]+:m/z 360.2。
实施例42
1-(5-(4-(3-三氟甲基苯基)哌嗪-1-基)戊基)-1H-苯并三氮唑(I-42)的制备
将苯并三氮唑(11.9g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入5-氯溴戊烷(36.8g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相再加入二氯甲烷100ml萃取,合并有机相,经100ml饱和食盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,二氯甲烷洗脱得1-(5-氯戊基)-1H-苯并三氮唑15.8g,收率71.0%。
将1-(5-氯戊基)-1H-苯并三氮唑(8.0g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-42)7.7g,收率61.5%。ESI-MS[M+H]+:m/z 417.2。
实施例43
1-(4-(4-(2-呋喃基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-43)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入4-(2-呋喃基)哌嗪(4.6g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-43)7.0g,收率71.3%。ESI-MS[M+H]+:m/z 325.2。
实施例44
1-(4-(4-(4-吡啶基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-44)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入4-(4-吡啶基)哌嗪(4.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-44)6.6g,收率65.3%。ESI-MS[M+H]+:m/z 336.2。
实施例45
1-(4-(4-(2-嘧啶基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-45)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入4-(2-嘧啶基)哌嗪(4.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-45)6.8g,收率67.1%。ESI-MS[M+H]+:m/z 337.2。
实施例46
1-(4-(4-环己基哌嗪-1-基)丁基)-1H-苯并三氮唑(I-46)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入4-(1-环己基)哌嗪(5.1g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-46)6.5g,收率63.7%。ESI-MS[M+H]+:m/z 341.2。
实施例47
1-(4-(4-(1-萘基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-47)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml 乙腈中,分别加入4-(1-萘基)哌嗪(6.4g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-47)6.9g,收率60.1%。ESI-MS[M+H]+:m/z 385.2。
实施例48
1-(4-(4-(2-喹噁啉基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-48)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入4-(2-喹噁啉基)哌嗪(6.4g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-48)7.3g,收率62.7%。ESI-MS[M+H]+:m/z 387.2。
实施例49
1-(4-(4-(3-(6-氟-苯并异噻唑基))哌嗪-1-基)丁基)-1H-苯并三氮唑(I-49)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入6-氟-3-(哌嗪-4-基)苯并异噻唑(6.6g,0.05mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-49)8.2g,收率66.5%。ESI-MS[M+H]+:m/z 410.2。
实施例50
1-(4-(4-(3-苯并吡唑基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-50)的制备
采用实施例29中的方法制备1-(4-氯丁基)-1H-苯并三氮唑。
将1-(4-氯丁基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入3-(哌嗪-4-基)苯并吡唑(6.1g,0.05mol),二异丙 基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-50)7.7g,收率68.2%。ESI-MS[M+H]+:m/z 375.2。
实施例51
1-(3-(4-(3-(6-氟-苯并呋喃基)哌嗪-1-基)丙基)-1H-苯并三氮唑(I-51)的制备
采用实施例37中的方法制备1-(3-氯丙基)-1H-苯并三氮唑。
将1-(3-氯丙基)-1H-苯并三氮唑(7.55g,0.036mol)溶解于100ml乙腈中,分别加入6-氟-3-(哌嗪-4-基)苯并呋喃(6.6g,0.05mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应20h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-51)7.9g,收率69.1%。ESI-MS[M+H]+:m/z 379.2。
实施例52
1-(4-(4-(3-(6-氟-苯并异噁唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑(I-52)的制备
1-(3-氯丙氧基)苯并三氮唑的制备
将1-羟基苯并三氮唑(0.01mol)溶于10ml NMP中,分批加入50%重量比的钠氢(0.01mol)的固体石蜡混合物,搅拌反应0.Sh。同时,将3-氯溴丙烷(0.015mol)、溶解于5mlNMP中,加入上述的溶液中,室温下搅拌反应12h。将反应液倒入50ml水中,乙酸乙酯萃取(3×50mL),合并有机相,经30ml水洗涤,加入无水硫酸镁干燥有机相,过滤,蒸干溶剂,油状物经中性Al2O3层析或制备型HPLC分离纯化,得1-(3-氯丙氧基)苯并三氮唑,收率75.0%。
将1-(3-氯丙氧基)苯并三氮唑(0.06mol)溶解于150ml乙腈中,分别加入4-(3-(6-氟-苯并异噁唑基))哌嗪(0.05mol),二异丙基乙基胺(0.2mol),以及碘化钾(0.05mol),室温下混合搅拌10分钟,然后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得1-(4-(4-(3-(6-氟-苯并异噁唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑(I-52)13.4g,收 率67.6%。ESI-MS[M+H]+:m/z 396.2。
实施例53
6-氟-1-(4-(4-(3-(6-氟-苯并异噻唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑(I-53)的制备
6-氟-1-(2-氯丙氧基)-苯并三氮唑的制备
将6-氟-1-羟基苯并三氮唑(0.01mol)溶于10ml NMP中,分批加入50%重量比的钠氢(0.01mol)的固体石蜡混合物,搅拌反应0.5h。同时,将3-氯溴丙烷(0.015mol)、溶解于5mlNMP中,加入上述的溶液中,室温下搅拌反应12h。将反应液倒入50ml水中,乙酸乙酯萃取(3×50mL),合并有机相,经30ml水洗涤,加入无水硫酸镁干燥有机相,过滤,蒸干溶剂,油状物经中性Al2O3层析或制备型HPLC分离纯化,得6-氟-1-(3-氯丙氧基)苯并三氮唑,收率75.0%。
将6-氟-1-(3-氯丙氧基)苯并三氮唑(0.06mol)溶解于150ml乙腈中,分别加入4-(3-(6-氟-苯并异噻唑基))哌嗪(0.05mol),二异丙基乙基胺(0.2mol),以及碘化钾(0.05mol),室温下混合搅拌10分钟,然后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得6-氟-1-(4-(4-(3-(6-氟-苯并异噻唑基)哌嗪-1-基)丙氧基)-1H-苯并三氮唑(I-53)14.1g,收率65.6%。ESI-MS[M+H]+:m/z 430.1。
实施例54
6-氯-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-54)的制备
将6-氯-苯并三氮唑(15.3g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相再加入二氯甲烷100ml萃取,合并有机相,经100ml饱和食盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,二氯甲烷洗脱得6-氯-1-(4-氯丁基)-1H-苯并三氮唑19.2g,收率79.0%。
将6-氯-1-(4-氯丁基)-1H-苯并三氮唑(8.75g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二 异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-54)8.5g,收率64.7%。ESI-MS[M+H]+:m/z 437.2。
实施例55
6-氰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-55)的制备
将6-氰基-苯并三氮唑(14.4g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相再加入二氯甲烷100ml萃取,合并有机相,经100ml饱和食盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,二氯甲烷洗脱得6-氰基-1-(4-氯丁基)-1H-苯并三氮唑17.8g,收率76.0%。
将6-氰基-1-(4-氯丁基)-1H-苯并三氮唑(8.42g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-55)8.5g,收率66.4%。ESI-MS[M+H]+:m/z 428.2。
实施例56
6-甲氧羰基-1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-苯并三氮唑(I-56)的制备
将6-甲氧羰基-苯并三氮唑(17.7g,0.10mol)溶解于30重量%氢氧化钠水溶液100ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵0.8g,混合搅拌5分钟。反应液缓慢升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相再加入二氯甲烷100ml萃取,合并有机相,经100ml饱和食盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,二氯甲烷洗脱得6-甲氧羰基-1-(4-氯丁基)-1H-苯并三氮唑19.5g,收率73.0%。
将6-甲氧羰基-1-(4-氯丁基)-1H-苯并三氮唑(9.61g,0.036mol)溶 解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),搅拌混合后升温回流反应15h。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷洗脱,得化合物(I-56)8.8g,收率63.4%。ESI-MS[M+H]+:m/z 461.2。
实施例57
1-(4-(4-(3-三氟甲基苯基)哌嗪-1-基)丁基)-1H-吲哚(I-57)的制备
将1H-吲哚(11.7g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得1-(4-氯丁基)-1H-吲哚12.5g,收率60.1%。
将1-(4-氯丁基)-1H-吲哚(7.45g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-57)7.3g,收率60.6%。ESI-MS[M+H]+:m/z 402.2。
实施例58
6-氰基-1-(4-(4-(3-氯苯基)哌嗪-1-基)丁基)-1H-吲哚(I-58)的制备
将6-氰基-1H-吲哚(14.2g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入4-氯溴丁烷(34.3g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得6-氰基-1-(4-氯丁基)-1H-吲哚13.9g,收率60.3%。
将6-氰基-1-(4-氯丁基)-1H-吲哚(8.35g,0.036mol)溶解于100ml 乙腈中,分别加入3-三氯苯基哌嗪(5.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-58)6.9g,收率62.3%。ESI-MS[M+H]+:m/z 393.2。
实施例59
1-(3-(4-(3-三氟甲基苯基)哌嗪-1-基)丙基)-1H-苯并吡唑(I-59)的制备
将1H-苯并吡唑(11.8g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入3-氯溴丙烷(31.2g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得1-(3-氯丙基)-1H-苯并吡唑11.5g,收率59.3%。
将得1-(3-氯丙基)-1H-苯并吡唑(6.98g,0.036mol)溶解于100ml乙腈中,分别加入3-三氟甲基苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-59)7.6g,收率63.1%。ESI-MS[M+H]+:m/z 389.2。
实施例60
6-氰基-1-(3-(4-(2,3-二氯苯基)哌嗪-1-基)丙基)-1H-苯并吡唑(I-60)的制备
将6-氰基-1H-苯并吡唑(14.3g,0.10mol)溶解于20重量%氢氧化钠水溶液200ml中,加入3-氯溴丙烷(31.2g,0.20mol)、四丁基溴化铵1.0g,混合搅拌5分钟,升温至60℃,搅拌反应2小时。冷却至室温,加入100ml二氯甲烷萃取,分液,水相加入二氯甲烷100ml萃取,合并有机相,经100ml饱和盐水洗涤,分液,蒸干有机相得油状物。油状物经中性Al2O3层析分离纯化,得6-氰基-1-(3-氯丙基)-1H-苯并吡唑13.9g,收率63.8%。
将6-氰基-1-(3-氯丙基)-1H-苯并吡唑(7.88g,0.036mol)溶解于100ml乙腈中,分别加入2,3-二氯苯基哌嗪(6.9g,0.03mol),二异丙基乙基胺(15.5g,0.12mol),以及碘化钾(5.0g,0.03mol),室温搅拌10分钟,然后升温回流反应15小时。冷却至室温,过滤,滤液经浓缩得油状物,经中性Al2O3层析分离纯化,二氯甲烷/甲醇混合溶剂洗脱,得化合物(I-60)7.6g,收率61.1%。ESI-MS[M+H]+:m/z 414.1。
实施例61
根据专利申请US20100329978A1中所述的方法,制备得到本发明所述的化合物(I-61至I-65)。
实施例62
根据中国专利申请200610097269.1中所述的方法,制备得到本发明所述的化合物(I-66至I-84)。
实施例63
化合物II-1至II-60对致痉剂引起收缩家兔离体血管平滑肌的舒张作用
1试验动物:
家兔,雌雄兼用,体重2.0-3.0kg,由中国医科大学实验动物中心提供。
2药品与试剂
化合物II-1-II-60,即化合物I-1-I-60的盐酸盐,可依照实施例2(或3或31或34)制备它们的盐(盐酸盐),采用实施例方法自制;
氯化钠(NaCl):购于天津市大茂化学试剂厂,批号:20120413;
氯化钾(KCl):购于天津市大茂化学试剂厂,批号:20111123;
无水硫酸镁(MgSO4):购于天津市大茂化学试剂厂,批号:20101029;
无水氯化钙(CaCl2):购于天津市大茂化学试剂厂,批号:20110314;
碳酸氢钠(NaHCO3):购于天津市大茂化学试剂厂,批号:20120507;
葡萄糖(Glucose):购于天津市大茂化学试剂厂,批号:20120512;
磷酸二氢钾(KH2PO4):购于天津市大茂化学试剂厂产品,批号:20110928;
氯化钠注射液(NaCl):购于沈阳志鹰制药厂,批号:12021001;
盐酸肾上腺素注射液(Epinephrine Hydrochloride Inj ection)规格:1mg/1ml,购于远大医药(中国)有限公司,批号120105;
重酒石酸去甲肾上腺素(Norepinephrine Bitartrate Inj ection)规格2mg/1ml,远大医药(中国)有限公司,批号120304;
3实验仪器
HSS-1(B)型恒温浴槽:成都仪器厂;
RM6240B型多道生理信号采集处理系统:成都仪器厂;
JZJ01型肌肉张力换能器:成都仪器厂;
YPJ01型压力换能器:成都仪器厂;
TG-328A电光分析天平:上海天平仪器厂;
T-500型电子天平:常熟双杰测试仪器厂;
微量移液器:上海荣泰生化工程有限公司;
电热恒温水浴锅:天津市泰斯特仪器有限公司。
4营养液的配制
Krebs-Henseleit(K-H)生理溶液:NaCl 6.92(浓度单位),KCl0.35,MgSO4 0.29,KH2PO4 0.16,CaCl2 0.28,NaHCO3 2.1,Glucose2.0(g/L),pH 7.2。
高钾溶液:将K-H液中去除等摩尔数的NaCl后加入KCl配制成含K+60mmol/L的改良K-H液。
无钙K-H液:将K-H液中的CaCl2除去,加入等摩尔数的KCl,并加入EDTA-2Na+0.1mmol/L,其他成分不变。
无钙高钾液:将高钾液中的CaCl2除去,加入等摩尔数的KCl,并加入EDTA-2Na+0.1mmol/L,其他成分不变的。
化合物II-1-II-60溶液的配制:称取一定质量化合物样品,以蒸馏水为溶剂稀释至系列浓度(10-10-10-3mol/L),备用。
5家兔离体血管平滑肌标本的制备
家兔,将动物击晕后迅速剖开胸腔,剥离出降主动脉,将结缔组织及周围脂肪组织去除后(若进行五羟色胺受体拮抗实验,还应使用光滑的不锈钢钢棒去除内皮细胞),切成3-5mm血管环,然后钢丝钩穿过血管环,一端固定在通气钩上,另一端连于张力换能器上,置于 盛有20ml营养液的浴管中,通过记录仪记录张力变化。浴管内保持温度37±0.5℃,并以每秒1-2个气泡的速度通入混合气体(95%O2+5%CO2)。标本初始负荷1.5g,每20min换一次营养液,平衡2小时,待基线稳定后开始实验。
6具体试验操作及试验结果
6.1化合物II-1至II-60对致痉剂盐酸肾上腺素(AD)引起收缩家兔离体血管平滑肌舒张作用
标本张力稳定后,记录一段波形,向浴管内加入致痉剂盐酸肾上腺素(AD)(10-5mol/L)诱导收缩,当达到最大收缩后,充分冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,再次用同浓度致痉剂诱导收缩。当后一次收缩最大反应与前一次基本一致时,累积加入配制好的化合物II-1-II-60溶液(1×10-8-1×10-3mol/L),记录波形。以化合物II-1-II-60的舒张百分数为纵坐标,最大舒张反应为100%作效应曲线,其中II-2、II-3的舒张作用最明显,其各浓度负对数为横坐标绘制量效曲线见图1和图8。
从图1和8中可见,化合物II-2、II-3对AD致痉剂引起的标本收缩有舒张作用,它对肾上腺素的舒张作用呈现一定的剂量依赖性,其中化合物II-2舒张AD引起的家兔主动脉收缩的-logEC50值为5.73±0.03,化合物II-3舒张AD引起的家兔主动脉收缩的-logEC50值为6.01±0.05。
化合物II-31也表现较明显舒张作用,其各浓度负对数为横坐标绘制量效曲线,见图10;其中II-29也具有明显的舒张作用,其量效曲线见图15。从图10中可看出,化合物II-31对AD致痉剂引起的标本收缩有舒张作用,它对肾上腺素的舒张作用呈现一定的剂量依赖性,化合物II-31舒张AD引起的家兔主动脉收缩的-logEC5o值为6.19±0.03;同样地,化合物II-29对肾上腺素的舒张作用也呈现一定的剂量依赖性,其舒张AD引起的家兔主动脉收缩的-logEC5o值为6.01±0.02。
化合物II-1至II-60对AD收缩家兔离体血管平滑肌的舒张作用如表1所示:
表1化合物II-1-II-60对AD收缩家兔离体血管平滑肌的舒张作用
6.2化合物II-1至II-60对致痉剂高钾溶液引起收缩家兔离体血管平滑肌的舒张作用
标本张力稳定后,记录一段波形,向浴管内加入致痉剂盐酸肾上腺素(AD)(10-5mol/L)诱导收缩,当达到最大收缩后,充分冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,将浴管内K-H液换成高钾液诱导收缩。当后一次收缩最大反应与前一次基本一致时,累积加入配制好的化合物II-1-II-60溶液(1×10-8-1×10-3mol/L),记录波形。以化合物II-1-II-60的舒张百分数为纵坐标,最大舒张反应 为100%作效应曲线。其中II-2、II-3的舒张作用最明显,其各浓度负对数为横坐标绘制量效曲线见图2和图9。
从图2和9中可见,化合物II-2和II-3对高钾液引起的标本收缩有明显舒张作用,它对肾上腺素的舒张作用呈现一定的剂量依赖性,化合物II-2舒张高钾液引起的家兔主动脉收缩的-logEC50值为5.34±0.02,化合物II-3舒张高钾液引起的家兔主动脉收缩的-logEC50值为5.49±0.05。其中化合物II-31表现出较明显的舒张作用,其各浓度负对数为横坐标绘制量效曲线,见图11;其中II-29也具有明显的舒张作用,其量效曲线见图16。从图11中可看出,化合物II-31对高钾液致痉剂引起的标本收缩有舒张作用,它对高钾液的舒张作用呈现一定的剂量依赖性,化合物II-31舒张高钾液引起的家兔主动脉收缩的-logEC50值为5.55±0.03;同样地,化合物II-29对高钾液的舒张作用也呈现一定的剂量依赖性,其舒张高钾液引起的家兔主动脉收缩的-logEC50值为5.64±0.01。
化合物II-1至II-60对致痉剂高钾溶液引起收缩家兔离体血管平滑肌的舒张作用如表2所示:
表2化合物II-1-II-60对高钾溶液收缩家兔离体血管平滑肌的舒张作用
实施例64
化合物II-2对家兔离体血管平滑肌的舒张作用机制研究
1试验动物:
家兔,雌雄兼用,体重2.0-3.0kg,由中国医科大学实验动物中心提供。
2药品与试剂
化合物II-2采用实施例2方法自制;
氯化钠(NaCl):购于天津市大茂化学试剂厂,批号:20120413;
氯化钾(KCl):购于天津市大茂化学试剂厂,批号:20111123;
无水硫酸镁(MgSO4):购于天津市大茂化学试剂厂,批号:20101029;
无水氯化钙(CaCl2):购于天津市大茂化学试剂厂,批号:20110314;
碳酸氢钠(NaHCO3):购于天津市大茂化学试剂厂,批号:20120507;
葡萄糖(Glucose):购于天津市大茂化学试剂厂,批号:20120512;
磷酸二氢钾(KH2PO4):购于天津市大茂化学试剂厂产品,批号:20110928;
氯化钠注射液(NaCl):购于沈阳志鹰制药厂,批号:12021001;
盐酸肾上腺素注射液(Epinephrine Hydrochloride Injection)规格:1mg/1ml,购于远大医药(中国)有限公司,批号120105;
重酒石酸去甲肾上腺素(Norepinephrine Bitartrate Inj ection)规格2mg/1ml,远大医药(中国)有限公司,批号120304;
甲磺酸多沙唑嗪(Doxazosin Mesylate):购于随州佳科医药化工有限公司,批号:20110305;
苯磺酸氨氯地平片(Amlodipine Besylate Tablets):购于辉瑞制药有限公司,规格:5mg/片批号:1205018;盐酸肾上腺素注射液(Epinephrine Hydrochloride Injection)规格:1mg/1ml,购于远大医药(中国)有限公司,批号120105;
(R)-苯肾上腺素盐酸盐((R)-Phenylephrine Hydrochloride),梯希爱(上海)化成工业发展有限公司,批号:GJ01-TESP;
Serotonin Creatinine Sulfate Monohydrate(5-HT),东京化成工业株式会社,批号:AZ01-TBKD;
肝素钠注射液(Heparin sodium):万邦制药规格:2ml/12500单位,批号:101115;
乌来糖(Urethane):中国医药(集团)上海化学试剂公司,批号:C30191228;
乙二胺四乙酸(EDTA),天津市大茂化学试剂厂产品,批号:20050809。
3实验仪器
HSS-1(B)型恒温浴槽:成都仪器厂;
RM6240B型多道生理信号采集处理系统:成都仪器厂;
JZJ01型肌肉张力换能器:成都仪器厂;
YPJ01型压力换能器:成都仪器厂;
TG-328A电光分析天平:上海天平仪器厂;
T-500型电子天平:常熟双杰测试仪器厂;
微量移液器:上海荣泰生化工程有限公司;
电热恒温水浴锅:天津市泰斯特仪器有限公司。
4营养液的配制
Krebs-Henseleit(K-H)生理溶液:NaCl 6.92(浓度单位),KCl0.35,MgSO4 0.29,KH2PO4 0.16,CaCl2 0.28,NaHCO3 2.1,葡萄糖2.0(g/L),pH 7.2。
高钾溶液:将K-H液中去除等摩尔数的NaCl后加入KCl配制成含K+60mmol/L的改良K-H液。
无钙K-H液:将K-H液中的CaCl2除去,加入等摩尔数的KCl,并加入EDTA-2Na+0.1mmol/L,其他成分不变。
无钙高钾液:将高钾液中的CaCl2除去,加入等摩尔数的KCl,并加入EDTA-2Na+0.1mmol/L,其他成分不变的。
化合物II-2溶液的配制:称取一定质量化合物II-2的样品,以蒸馏水为溶剂稀释至系列浓度(10-10-10-4mol/L),备用。
5家兔离体血管平滑肌标本的制备
家兔,将动物击晕后迅速剖开胸腔,剥离出降主动脉,将结缔组织及周围脂肪组织去除后(若进行五羟色胺受体拮抗实验,还应使用光滑的不锈钢钢棒去除内皮细胞),切成3-5mm血管环,然后钢丝钩穿过血管环,一端固定在通气钩上,另一端连于张力换能器上,置于盛有20ml营养液的浴管中,通过记录仪记录张力变化。浴管内保持温度37±0.5℃,并以每秒1-2个气泡的速度通入混合气体(95%O2+5%CO2)。标本初始负荷1.5g,每20min换一次营养液,平衡2小时,待基线稳定后开始实验。
6实验操作及试验结果
6.1化合物II-2对家兔血管平滑肌α受体激动剂的拮抗作用
6.1.1化合物II-2对去甲肾上腺素累积收缩量效曲线的影响
标本张力稳定之后,记录一段波形,向浴管内累积加入去甲肾上腺素(NA)(10-8-10-4mol/L)直至达到最大反应,记录波形。然后用K-H液反复冲洗标本,平衡1h后,加入化合物II-2(3×10-7mol/L),20min后再以同法加入NA。以最大反应为100%,NA收缩百分数为纵坐标,NA各浓度负对数为横坐标绘制量效曲线,加入化合物II-2(3×10-7mol/L)后,如图3所示。
NA量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学t检验后,多数P值<0.01,存在显著性差异。化合物II-2拮抗NA收缩家兔主动脉的PA2值为7.37±0.08;
6.1.2阳性对照药多沙唑嗪对去甲肾上腺素累积收缩量效曲线的影响
标本张力稳定后,记录一段波形,向浴管内加入去甲肾上腺素(NA)(10-8-10-4mol/L)(10-8-3×10-3mol/L)直到达到最大反应,记录波形。然后用K-H液反复冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,加入多沙唑嗪(10-7mol/L),15min后再以同法加入去甲肾上腺素(NA)(10-8-6×10-5mol/L)。以最大反应为100%,NA收缩百分数为纵坐标,NA各浓度负对数为横坐标绘制量效曲线,加入多沙唑嗪(10-7mol/L)后,如图4所示,NA量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,多数P值<0.01,存在显著性差异。阳性药多沙唑嗪拮抗NA收缩家兔主动脉的PA2值为7.52±0.04。
经统计学t检验,化合物II-2与阳性对照药多沙唑嗪对NA的PA2值之间比较,P>0.05,两者之间无显著性差异,说明化合物11-2对α受体激动剂的拮抗作用与多沙唑嗪相近。
6.2化合物II-2对家兔血管平滑肌钙通道(Ca2+)的拮抗作用
6.2.1化合物II-2对CaCl2累积收缩家兔血管浓度效应曲线的影响
标本张力稳定后,用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,然后向浴管内累积加入CaCl2(10-6-10-2mol/L),直到达到最大反应,记录波形。然后用K-H液反复冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,再次用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,同时向浴管中加入化合物II-2(3×10-6mol/L),孵育20min后再以同法累积加入CaCl2(10-6-10-2mol/L),直到达到最大反应,记录波形。以最大反应为100%,CaCl2各浓度时的收缩百分数为纵坐标,CaCl2各浓度负对数为横坐标绘制量效曲线,加入化合物II-2(3×10-6mol/L)后,如图5所示,CaCl2量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,多数P值<0.01,存在显著性差异。化合物II-2拮抗CaCl2收缩家兔主动脉的PA2值为5.61±0.04。
6.2.2阳性对照药氨氯地平对CaCl2累积收缩量效曲线的影响
标本张力稳定后,用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,然后向浴管内累 积加入CaCl2(10-6-10-2mol/L),直到达到最大反应,记录波形。然后用K-H液反复冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,再次用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,同时向浴管中加入氨氯地平(10-7mol/L),孵育15min后再以同法累积加入CaCl2(10-6-10-2mol/L),直到达到最大反应,记录波形。以最大反应为100%,CaCl2各浓度时的收缩百分数为纵坐标,CaCl2各浓度负对数为横坐标绘制量效曲线,加入氨氯地平(3×10-6mol/L)后,如图6所示,CaCl2量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,多数P值<0.01,存在显著性差异。氨氯地平拮抗CaCl2收缩家兔主动脉的PA2值为6.99±0.05。
6.3化合物II-2对家兔血管平滑肌五羟色胺(5-HT)受体激动剂的拮抗作用
标本张力稳定之后,记录一段波形,向浴管内累积加入5-HT(10-7-3×10-4mol/L)直至达到最大反应,记录波形。然后用K-H液反复冲洗标本,平衡1.5h后,加入化合物II-2(3×10-6mol/L),20min后再以同法加入5-HT。以最大反应为100%,5-HT收缩百分数为纵坐标,5-HT各浓度负对数为横坐标绘制量效曲线,加入化合物II-2(3×10-6mol/L)后,如图7所示,5-HT量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,P值<0.01,存在显著性差异。化合物II-2拮抗5-HT收缩家兔主动脉的PA2值5.71±0.08。
实施例65
化合物II-31对家兔离体血管平滑肌的舒张作用机制研究
1.1化合物II-31对家兔血管平滑肌α受体激动剂的拮抗作用
1.1.1化合物II-31对去甲肾上腺素累积收缩量效曲线的影响
标本张力稳定之后,记录一段波形,向浴管内累积加入去甲肾上腺素(NA)(3×10-7-6×10-5mol/L)直至达到最大反应,记录波形。然后用K-H液反复冲洗标本,平衡1h后,加入化合物II-31(3×10-6mol/L),20min后再以同法加入NA(3×10-7-3×10-4mol/L)。以最大反应为100%,NA收缩百分数为纵坐标,NA各浓度负对数为横坐标绘制量效曲线, 加入化合物II-31(3×10-6mol/L)后,如图10所示,NA量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学t检验后,多数P值<0.01,存在显著性差异。化合物II-31拮抗NA收缩家兔主动脉的PA2值为6.02±0.13。
1.1.2阳性对照药多沙唑嗪对去甲肾上腺素累积收缩量效曲线的影响
在上步的基础上用K-H液反复冲洗标本,平衡1h后,加入多沙唑嗪(10-7mol/L),15min后再以同法加入NA。以最大反应为100%,NA收缩百分数为纵坐标,NA(3×10-7-3×10-4mol/L)各浓度负对数为横坐标绘制量效曲线,加入药物多沙唑嗪(10-7mol/L)后,如图12所示,NA量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学t检验后,多数P值<0.01,存在显著性差异。药物多沙唑嗪拮抗NA收缩家兔主动脉的PA2值为7.76±0.24。
经统计学t检验,化合物II-31与阳性对照药多沙唑嗪对NA的PA2值之间比较,P<0.01,两者之间存在非常显著的差异,说明化合物II-31对α受体激动剂的拮抗作用比多沙唑嗪弱。
1.2化合物II-31对家兔血管平滑肌钙通道(Ca2+)的拮抗作用
1.2.1化合物II-31对CaCl2累积收缩家兔血管浓度效应曲线的影响
标本张力稳定后,用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,然后向浴管内累积加入CaCl2(10-5-3×10-2mol/L),直到达到最大反应,记录波形。然后用K-H液反复冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,再次用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,同时向浴管中加入化合物II-31(10-5mol/L),孵育20min后再以同法累积加入CaCl2(10-5-3×10-1mol/L),直到达到最大反应,记录波形。以最大反应为100%,CaCl2各浓度时的收缩百分数为纵坐标,CaCl2各浓度负对数为横坐标绘制量效曲线,加入化合物II-31(10-5mol/L)后,如图13所示,CaCl2量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,多数P值<0.01,存在显著性差异。化合物II-31拮抗CaCl2收缩家兔主动脉的PA2值为6.56±0.032。
1.2.2.阳性对照药氨氯地平对CaCl2累积收缩量效曲线的影响
基于上步的基础上,然后用K-H液反复冲洗标本,每20min换一次K-H液,平衡60min,待基线恢复平稳后,再次用无钙K-H液将标本冲洗3次,并用无钙K-H液孵育40min,加入无钙高钾液使标本去极化20min,同时向浴管中加入氨氯地平(10-7mol/L),孵育15min后再以同法累积加入CaCl2(10-5-3×10-2mol/L),直到达到最大反应,记录波形。以最大反应为100%,CaCl2各浓度时的收缩百分数为纵坐标,CaCl2各浓度负对数为横坐标绘制量效曲线,加入氨氯地平(10-5mol/L)后,如图13所示,CaCl2量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,多数P值<0.01,存在显著性差异。氨氯地平拮抗CaCl2收缩家兔主动脉的PA2值为7.51±0.288。
1.3化合物II-31对家兔血管平滑肌五羟色胺(5-HT)受体激动剂的拮抗作用
标本张力稳定之后,记录一段波形,向浴管内累积加入5-HT(10-8-3×10-4mol/L)直至达到最大反应,记录波形。然后用K-H液反复冲洗标本,平衡1.5h后,加入化合物II-31(3×10-6mol/L),20min后再以同法加入5-HT。以最大反应为100%,5-HT收缩百分数为纵坐标,5-HT各浓度负对数为横坐标绘制量效曲线,加入化合物II-31(3×10-6mol/L)后,如图14所示,5-HT量效曲线明显平行右移,最大反应几乎不变,对各浓度反应百分数进行统计学检验后,P值<0.01,存在显著性差异。化合物II-31拮抗5-HT收缩家兔主动脉的PA2值6.726±0.089。
实施例66
化合物II-2的急性毒性实验
取昆明种小鼠(由中国医科大学试验动物中心提供),雌雄各半,体重18-22g,进行化合物II-2简化几率单位法急性毒性实验,灌胃给药LD50为361.88mg/kg(95%可信限区间为302.96-420.80mg/kg)。
实施例67
化合物II-2的小鼠的骨髓微核实验
取昆明种小鼠(由中国医科大学试验动物中心提供)10只,雌雄 各半,按120mg/kg/天体重灌胃给药化合物II-2。持续给药4天,第5天进行小鼠骨髓微核试验。
阳性对照组,给予环磷酰胺60mg/kg/天;阴性对照组,给予生理盐水0.1ml/10g/天。持续给药4天,第5天进行小鼠骨髓微核试验。
将小鼠断颈处死,迅速剥离出股骨与胸骨,去掉血污和肌肉,减去骨骺,胸骨用止血钳将骨髓挤于预先滴有小牛血清的清洁载玻片上或用小牛血清直接将股骨中的骨髓冲至清洁的载玻片上,混合均匀后推片;随后将推好晾干的骨髓片放进盛有甲醇的染色缸,固定15min,取出晾干,待骨髓片晾干后,用新鲜配制的Giemsa应用液(Giemsa储备液一份加pH 6.8的磷酸盐缓冲液9份),染色10min,细流水冲掉玻片染色液,晾干后在显微镜下观察。
实验结果表明:化合物II-2组1000个嗜多染红细胞中含有微核的嗜多染红细胞占2.0±0.333%o,空白组1000个嗜多染红细胞中含有微核的嗜多染红细胞占1%o,环磷酰胺组1000个嗜多染红细胞中含有微核的嗜多染红细胞占12%o。表明化合物II-2的骨髓微核试验结果为阴性。
实施例68
化合物II-2对SD大鼠血压的影响
将4只SD大鼠经乌拉坦(1.25mg/kg)麻醉,大鼠生命体征平稳后,采用颈总动脉插管方法测定血压。待血压平稳后,将化合物(II-2)按4.0mg/kg体重灌胃给药,观察并记录给药后血压随时间变化情况,实验结果见表3、表4和表5数据。
表3化合物II-2对乌拉坦麻醉大鼠舒张压(DBP,mmHg)的影响(n=4)
注:*表示P值<0.05,**表示P值<0.01
表4化合物II-2对乌拉坦麻醉大鼠的收缩压(SBP,mmHg)的影响(n=4)
注:*表示P值<0.05,**表示P值<0.01
表5化合物II-2对乌拉坦麻醉大鼠的平均动脉压(MAP,mmHg)的影响(n=4)
注:*表示P值<0.05,**表示P值<0.01
实验结果表明:化合物II-2对乌拉坦(1.25mg/kg)麻醉SD大鼠具有明显降压作用,给药3.5小时后可恢复至给药前水平。
综合上述结果表明:离体动物试验中,化合物II-2具有显著的血管平滑肌舒张作用。化合物II-2对肾上腺素α受体的拮抗作用与多沙唑嗪相当,其拮抗去甲肾上腺素NA的PA2值为7.37±0.08,多沙唑嗪拮抗NA的PA2值为7.52±0.04,化合物II-2拮抗CaCl2的PA2值为5.61±0.04,其拮抗5-HT的PA2值为5.71±0.08。大鼠体内整体试验中,化合物II-2表现出明显的降压作用,其口服吸收良好,毒性小,治疗指数大,骨髓微核实验呈阴性,具有作为新型多靶点血管舒张药物,尤其是作为新型降压药物开发的潜在价值。
参考文献
1.[内科学]叶任高陆再英主编,人民卫生出版,2007年4月第6版。
2.[药理学]李端主编,人民卫生出版,2007年8月第6版。
3.Sanders-Bush E,Mayer SE.5-Hydroxytryptamine(serotonin):Receptor agonists and antagonists.
In:Brunton LL.Lazo JS,Parker KL(eds).Goodman&Gilman’s The Pharmacological Basis of Therapeutics(11th ed),Philadelphia:The McGraw-Hill Companies,2006:158
4.Hoyer D,Clarke DE,Fozard JR,et al.Pharmacol ReV,1994,46(2):158
5.Martin GR.5-Hydroxytryptamine receptors.In:The IUPHAR Committee on Receptor Nomenclature and Drug Classification(ed),The IUPHAR Compendium of Receptor Characterization and Classification-,London:IUPHAR Media,1998:p167。
- 还没有人留言评论。精彩留言会获得点赞!
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺
- 一种杂环衍生物及使用该杂环衍生物的有机发光器件的制造方法与工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 一种含氮杂环衍生物及使用该含氮杂环衍生物的有机发光器件的制造方法与工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 苯并吲唑类衍生物及其制备方法、应用与制造工艺
- 一种二苯并环庚烷衍生物的制备方法与制造工艺
- Atropurpuran的苯并咪唑基和吗啉基衍生物组合物用于防治胰腺纤维化的制造方法与工艺
- 一种苯并咪唑衍生物镉配合物及其制备方法和应用
- 一种咪唑并吡啶巯乙酸类衍生物及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 4‑乙烯基苯并环丁烯的合成方法与制造工艺
- 羟基苯并三唑衍生物和/或羟基吲唑衍生物作为塑料材料的阻燃剂的用途以及阻燃塑料材料模塑料的制造方法与工艺
- 扩展的非线性并苯衍生物和它们作为有机半导体的用途的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺