干细胞及其分泌物用于治疗皮肤烧烫伤的新用途的制作方法
本发明涉及生物医药领域。具体地,干细胞及其分泌物用于治疗皮肤烧烫伤的新用途。
背景技术:
皮肤作为人体的最大器官,具有屏障、保护、调节体温和感觉的功能。由于炎症、溃疡、烫伤、烧伤等因素造成的皮肤缺损,严重的可危及生命。
然而,目前针对皮肤损伤的治疗方法及药物仍有待开发。
技术实现要素:
本发明旨在至少在一定程度上解决现有技术中存在的技术问题之一。
需要说明的是,本发明是基于发明人的下列发现而完成的:
目前临床通常采用自体皮瓣或皮肤移植的方法治疗缺损创面,但面临供皮区新的创伤缺陷,以及供皮区来源的不足等问题。此外移植物与移植部位临近的皮肤存在颜色、质地、功能上的差异。
研究发现,干细胞能够产生一种称之为外泌体的囊泡结构。外泌体直径介于30~150nm之间,是一种体积较小的细胞外泌囊泡,并具有脂质双层膜结构。外泌体含有多种细胞特异性蛋白、脂类物质及核酸物质,能够释放信号分子并将其传递给其他细胞,从而改变其生理功能。
有鉴于此,发明人将外泌体作用于受损皮肤,发现受损皮肤的修复速度加快,生理功能有所改善。进一步地,发明人意外地发现,将外泌体、细胞因子及干细胞共同作用于受损皮肤,受损皮肤的修复速度明显快于外泌体单独作用,且生理功能明显改善。
为此,本发明提出了试剂盒在制备药物中的用途。根据本发明的实施例,所述药物用于治疗烧烫伤所致的皮肤缺损,所述试剂盒,包括:第一试剂,所述第一试剂包括外泌体和细胞因子;以及第二试剂,所述第二试剂包括生物支架和干细胞。
发明人将外泌体作用于由烧烫伤所致的受损皮肤,发现受损皮肤的修复速度加快,生理功能有所改善。发明人意外地发现,将外泌体与细胞因子共同作用于受损皮肤,受损皮肤的修复速度明显快于外泌体单独作用,且生理功能明显改善。发明人经过深入研究发现,外泌体可被受损组织处的表皮及真皮细胞所吞噬,外泌体内含物,例如蛋白质、核酸等物质会释放到细胞内发挥其调控作用,同时,细胞因子通过与细胞表面受体相结合,将刺激信号传递至细胞内,会与外泌体协同修复并重构受损组织的再生微环境,调控细胞增殖分化并促进组织再生。此外,试剂盒提供的干细胞能够进行规模化扩增,高效分化为表皮细胞、成纤维细胞、血管内皮细胞等各种类型的皮肤组织细胞,且干细胞增殖分化过程中会产生一些促进因子,有利于受损组织的修复。外泌体、细胞因子和干细胞三者相互协同作用,将加速受损皮肤组织的修复和愈合。另外,生物支架起到固定、支持干细胞生长及促进组织再生的作用。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
本领域技术人员所公知的,“细胞因子”是指由细胞合成、分泌的一类具有广泛生物学活性的小分子量蛋白质或多肽类物质。
还需要说明的是,本发明所使用的术语“干细胞及其分泌物”是指干细胞、细胞因子和外泌体。
根据本发明的实施例,所述试剂盒在制备药物中的用途还可以具有下列附加技术特征:
根据本发明的实施例,所述细胞因子包括下列至少之一:碱性成纤维生长因子;以及表皮生长因子。发明人经过大量实验得到上述细胞因子的较优组合,各细胞因子之间会起到较好的协同作用,修复并重构由烧烫伤所致的受损组织的再生微环境,调控细胞增殖分化。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
根据本发明的实施例,所述试剂盒包括:2~100μg/ml的外泌体;10~50ng/ml的碱性成纤维生长因子;10~50ng/ml的表皮生长因子;生物支架;以及间充质干细胞,所述间充质干细胞以1×105~1×106个细胞/cm2的密度负载于所述生物支架上。在一些实施例中,所述试剂盒包括:2~70μg/ml的外泌体;10~40ng/ml的碱性成纤维生长因子;10~40ng/ml的表皮生长因子;生物支架;以及间充质干细胞,所述间充质干细胞以1.5×105~8×105个细胞/cm2的密度负载于所述生物支架上。在一些实施例中,所述试剂盒包括:2~50μg/ml的外泌体;10~30ng/ml的碱性成纤维生长因子;10~30ng/ml的表皮生长因子;生物支架;以及间充质干细胞,所述间充质干细胞以2×105~6×105个细胞/cm2的密度负载于所述生物支架上。在一些实施例中,所述试剂盒包括:2~20μg/ml的外泌体;10~20ng/ml的碱性成纤维生长因子;以及10~20ng/ml的表皮生长因子,生物支架;以及间充质干细胞,所述间充质干细胞以2×105~6×105个细胞/cm2的密度负载于所述生物支架上。
发明人发现,在此条件下能够使得各细胞因子、外泌体及干细胞协同作用效果较佳,能够快速且有效地修复并重构受损组织的再生微环境,调控细胞增殖分化。干细胞以上述比例负载在生物支架上,既能够保证干细胞的正常生长代谢,也能够使其有效地作用于受损部分,进行增殖分化。若密度过大,细胞之间将竞争性抑制,影响代谢。若密度过小,生物支架的单位面积上干细胞数量较少,增殖分化的细胞无法满足需求。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
需要说明的是,根据本发明的实施例,通过将间充质干细胞接种于与生物支架相接触的培养基中,并孵育,从而使得间充质干细胞负载于生物支架上。上述负载密度是指孵育之前的间充质干细胞的接种量。
根据本发明的实施例,所述试剂盒包括:5μg/ml外泌体;10ng/ml的碱性成纤维生长因子;20ng/ml的表皮生长因子;生物支架;以及间充质干细胞,所述间充质干细胞以5×105个细胞/cm2的密度负载于所述生物支架上。在此条件下能够使得各细胞因子、外泌体及干细胞协同作用效果较佳,能够快速且有效地修复并重构受损组织的再生微环境,调控细胞增殖分化。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
需要说明的是,对于外泌体的获得来源不作严格限定。根据本发明的实施例,外泌体来源于间充质干细胞。发明人发现,外泌体内含物的组成差异是导致不同组织或细胞来源外泌体具备不同生理功能的主要原因。进而,发明人经过大量实验发现,间充质干细胞来源的外泌体对于受损组织的修复能力较强。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
根据本发明的实施例,所述外泌体是通过下列步骤所得到的:将间充质干细胞接种于含有细胞生长培养基的细胞培养皿中,进行培养至所述间充质干细胞处于生长对数期且细胞汇合度达到90%以上,将细胞生长培养基更换为外泌体收集培养基,添加量为6ml/皿,于37℃,5%二氧化碳培养条件下培养细胞48小时,收集培养液;将所述培养液于4℃,300g离心10分钟,收集第一上清液;将所述第一上清液于4℃,2000g离心10分钟,收集第二上清液;将所述第二上清液于4℃,10000g离心30分钟,收集第三上清液;将所述第三上清液于4℃,110000g离心2小时,收集第一沉淀物;用35mlpbs缓冲液重悬所述第一沉淀物,并于4℃,110000g离心2小时,收集第二沉淀物;以及用100~200μlpbs缓冲液重悬所述第二沉淀物,以便得到所述外泌体。根据本发明的具体实施例,所述外泌体收集培养基含有αmem培养基、1%非必需氨基酸、1%谷氨酰胺及1%胰岛素-转铁蛋白-硒复合物。发明人意外地发现,在此条件下所得到的外泌体能够较好地修复并重构受损组织的再生微环境,从而有效调控受损组织表皮细胞、真皮成纤维细胞及干细胞的增殖及分化。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
根据本发明的实施例,所述外泌体及细胞因子是以混合溶液的形式提供的。由此,以便于外泌体和细胞因子协同修复并重构受损组织的再生微环境,调控细胞增殖分化。由此,根据本发明实施例的试剂盒能够有效地促进创面表皮细胞及真皮细胞增殖,加快皮肤损伤的修复及愈合。
根据本发明的实施例,所述混合溶液的溶剂为生理盐水。该溶剂能够有效溶解外泌体及细胞因子,并对皮肤创面无刺激或其他副作用。
根据本发明的实施例,所述干细胞为通用型干细胞,
所述通用型干细胞包括:脂肪源性干细胞、骨髓源性干细胞或脐带源性干细胞,优选脐带源性干细胞,所述生物支架包括:胶原蛋白、蚕丝蛋白或壳聚糖,优选胶原蛋白。
发明人发现,通用型干细胞具有易于提取培养保存、异体免疫原性较低、能够分泌多种修复细胞因子及基质蛋白、多向分化能力,能够在损伤处高效分化为表皮细胞、成纤维细胞、血管内皮细胞等各种类型的皮肤组织细胞,从而加速受损皮肤组织的修复和愈合。优选脐带源性干细胞,以便于获得。
根据本发明的实施例,所述第二试剂是通过包括下列步骤所得到的:将所述干细胞接种于与所述生物支架相接触的培养基中,进行培养,以便得到所述第二试剂。
根据本发明的实施例,所述生物支架是通过包括下列步骤得到的:将胶原蛋白海绵与戊二醛溶液进行预交联,得到预交联产物;将所述预交联产物与醋酸溶液进行交联,得到交联产物;将所述交联产物进行冻干,并将得到的冻干产物进行灭菌,得到灭菌产物;以及将所述灭菌产物浸泡于培养液中,更换所述培养液,直至所述培养液的ph值为7.2,弃去所述培养液,得到所述生物支架。发明人经过大量实验得到上述最优制备生物支架的方法,从而得到生物支架。
根据本发明的实施例,所述第二试剂是通过包括下列步骤得到的:(1)将新鲜牛尾置于75%酒精中浸泡10分钟,再用无菌生理盐水反复冲洗;(2)剥离尾腱,去除肌膜和筋膜,置于无菌平皿中;(3)剪碎尾腱,浸入0.05mol/l醋酸溶液中,4℃振摇48小时;(4)移入粉碎机中粉碎,再放入4℃冰箱进行二次膨胀;(5)24小时后,用200目筛网进行过滤,收集滤液,得到胶原蛋白溶液;(6)在6孔板中,每孔加入5ml所述胶原蛋白溶液,使其平铺在孔板内;(7)将所述孔板在-30℃冰箱预冻6小时,再真空干燥18~24小时,得到胶原海绵;(8)将所述胶原海绵置于10cm培养皿中,向所述培养皿中加入30ml0.25%的戊二醛溶液中进行预交联10分钟,得到预交联产物;(9)向所述预交联产物中加入30ml0.05mol/l醋酸溶液,于4℃交联24小时,得到交联产物;(10)用生理盐水冲洗所述交联产物后进行冻干,并将得到的冻干产物进行灭菌,得到灭菌产物;(11)向所述灭菌产物中加入10ml培养液,于37℃浸泡,每天更换所述培养液,直至所述培养液的ph值为7.2,弃去所述培养液,得到所述生物支架;(12)将所述生物支架平铺于培养皿内,向所述培养皿中加入37℃的培养基,并将装有所述培养基和生物支架的培养皿置于含5%co2的培养箱中,静置30分钟;以及(13)向所述静置后的培养基中按照5×105个细胞/cm2的接种量接种干细胞,在37℃、含5%co2的培养箱中孵育72小时,收集负载所述干细胞的所述生物支架,得到所述第二试剂。由此,培养基中的干细胞能够负载于生物支架上。
胶原蛋白是天然生物材料,广泛存在于脊椎动物的结缔组织、皮肤和肌腱中。胶原本身包含的细胞黏附信号肽序列,可以介导细胞特定的识别,有利于细胞的黏附和生长。而且胶原易于加工,容易获取,又具有抗原性低,降解产物不会引发不良反应的特点。
发明人发现,胶原溶液经冷冻干燥,便可得到多孔的胶原海绵,改变胶原溶液的浓度可控制胶原海绵孔隙的大小。胶原海绵支架中大量的孔隙结构,有利于细胞的长入和创面组织的浸润。由于胶原海绵的力学性能差,易降解,容易过早失去应有的支撑作用,因此在应用时经常须做一些改性处理。例如,采用戊二醛进行化学交联,能够较好的解决机械强度的问题,交联后的胶原膜具有一定的抗撕拉能力。
发明人经过大量实验得到利用牛肌腱胶原作为支架材料,是因为牛腱胶原与人的胶原蛋白同源性最高,可高达98%;而且肌腱中提取的胶原绝大部分是ⅰ型胶原,几乎不存在ⅲ型胶原,因此,不易出现不同批次胶原性质上的差异。
根据本发明的实施例,所述第一试剂密封于喷雾瓶。由此,便于用药及给药剂量控制。根据本发明的另一个实施例,所述第二试剂密封于含co2和无血清培养基的密封容器。在此培养条件下能够维持干细胞的基础代谢及存活。根据本发明的具体实施例,所述第一试剂密封于喷雾瓶,置于-70℃保存,有效期为1个月。根据本申请的另一个具体实施例,所述第二试剂密封于含co2和无血清培养基的密封袋中,置于4℃保存,有效期为24小时。
本发明的药物的给药频率和剂量可以通过多个相关因素被确定,该因素包括要被治疗的疾病类型、给药途径、病人年龄、性别、体重和疾病的严重程度以及作为活性成分的药物类型。根据本发明的一些实施例,日剂量可分为适宜形式的1剂、2剂或多剂,以在整个时间段内以1次、2次或多次给药,只要达到治疗有效量即可。
术语“治疗”用于指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防疾病或其症状而言可以是预防性的,和/或就部分或完全治愈疾病和/或疾病导致的不良作用而言可以是治疗性的。本文使用的“治疗”涵盖哺乳动物、特别是人的疾病,包括:(a)在容易患病但是尚未确诊得病的个体中预防疾病(例如预防皮肤损伤)或病症发生;(b)抑制疾病,例如阻滞疾病发展;或(c)缓解疾病,例如减轻与疾病相关的症状。本文使用的“治疗”涵盖将药物或化合物给予个体以治疗、治愈、缓解、改善、减轻或抑制个体的疾病的任何用药,包括但不限于将含本文所述试剂盒的药物给予有需要的个体。
根据本发明的实施例,本发明的药物可与常规治疗方法和/或疗法相结合使用,或者可与常规治疗方法和/或疗法分开使用。当本发明的药物在采用与其它药物的联合疗法中给药时,它们可序贯地或同时地给予个体。或者,本发明的药物可包含本发明的试剂盒、药学上可接受的载体或药学上可接受的赋形剂以及本领域已知的其它治疗药或预防药的组合。
本领域技术人员能够理解的是,前面针对试剂盒所描述的特征和优点,同样适用于该试剂盒在制备药物中的用途,在此不再赘述。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和强理解,其中:
图1显示了根据本发明一个实施例的放大40倍的间充质干细胞的显微照片;
图2显示了根据本发明一个实施例的间充质干细胞表面标志蛋白表达分析统计图;
图3显示了根据本发明一个实施例的外泌体的透射电镜照片;
图4显示了根据本发明一个实施例的放大10倍的表皮细胞显微照片;
图5显示了根据本发明一个实施例的放大10倍的表皮细胞免疫荧光染色显微照片;
图6显示了根据本发明一个实施例的创面收缩率随时间变化曲线;
图7显示了根据本发明一个实施例的放大100倍的表皮细胞系hacat细胞的显微照片;
图8显示了根据本发明一个实施例的热损伤处理后放大40倍的的hacat细胞的显微照片;
图9显示了根据本发明一个实施例的放大100倍热损伤修复后hacat细胞ki67荧光染色的显微照片;
图10显示了根据本发明一个实施例的放大100倍的成纤维细胞系bj细胞的显微镜照片;
图11显示了根据本发明一个实施例的放大40倍的热损伤处理后的成纤维细胞系bj细胞的显微镜照片;以及
图12显示了根据本发明一个实施例放大100倍热损伤修复后bj细胞ki67荧光染色的显微照片。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1外泌体的获得与鉴定
1、外泌体的获得
(1)提供间充质干细胞
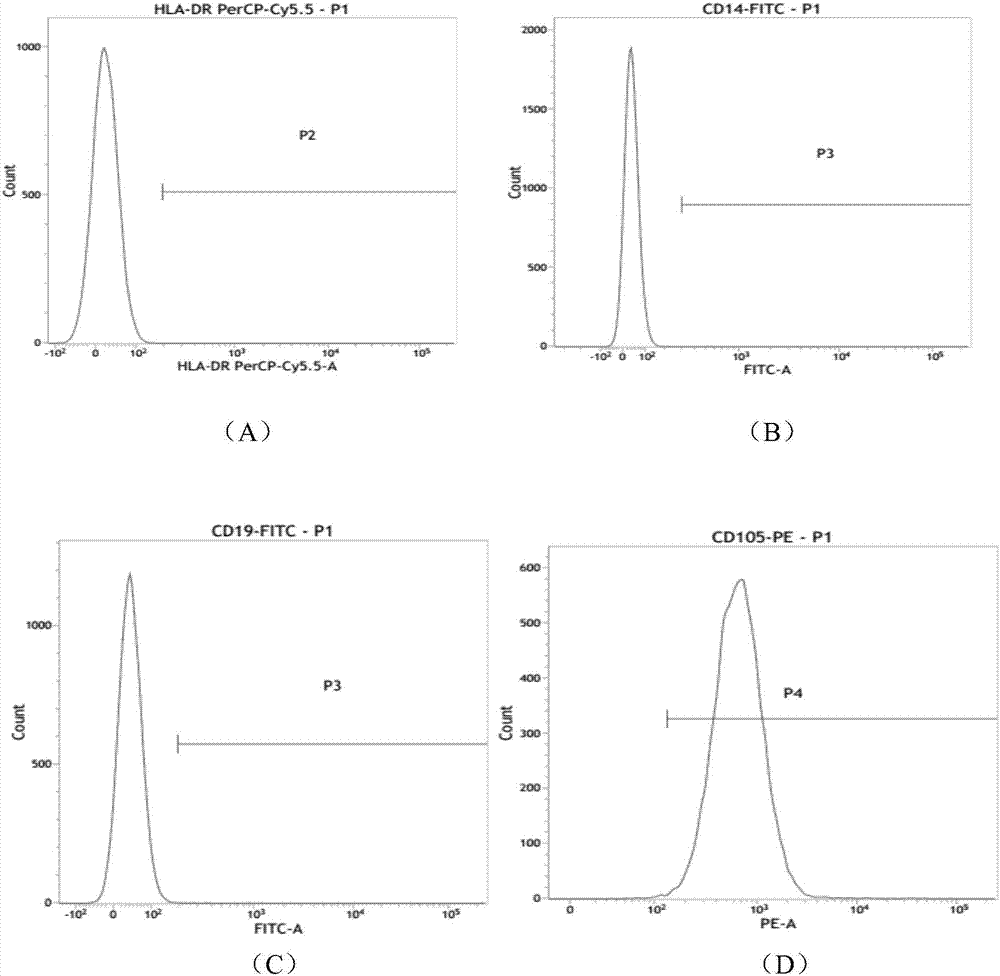
脐带间充质干细胞的形态如图1所示,取扩增殖状态良好的间充质干细胞,采用trypleexpress消化酶将细胞消化为单细胞;然后用含1%bsa的pbs洗涤后,制成含有5×106个脐带间充质干细胞的单细胞悬液,并分别标记cd90、cd73、cd105、cd34、cd45、cd14、cd19、hla-cr流式抗体(bd公司,美国),每管添加量为5μl室温避光孵育20分钟;用含1%bsa的pbs洗涤2遍后,将细胞重悬至400μl,并进行流式细胞检测,结果如图2所示,其中(a)~(h)分别为hla-cr、cd14、cd19、cd105、cd34、cd45、cd73、cd90抗体。由表1能够确定所得到的细胞为纯度高的间充质干细胞。
表1流式细胞仪检测
(2)间充质干细胞的扩增:
将间充质干细胞(形态如图1所示)培养于含无血清培养基(购自三有利公司,中国)的10cm细胞培养皿中。待细胞生长并达到90%以上汇合度时,吸弃培养基后用pbs缓冲液润洗细胞一次,加入trypleexpress酶消化细胞,待细胞变圆并从培养板上脱落时及时用含10%胎牛血清的αmem培养基终止消化,收集细胞悬液至15ml离心管中,1200rpm离心5分钟。吸弃上清后用新鲜无血清培养基重悬细胞,按1:5的传代比例将细胞接种至新的培养皿中,传代培养7~10代。
(3)待扩增最后一代的间充质干细胞生长达到90%以上的汇合度时,吸弃培养基,更换为外泌体收集培养基,添加量为6ml/皿。外泌体收集培养基的配方为αmem(购自gibco)+1%胰岛素-转铁蛋白-硒复合物(购自gibco)+1%非必需氨基酸(购自gibco)+1%谷氨酰胺(购自gibco)。继续培养48小时后收集培养液,依次按下述步骤进行离心操作:4℃,300g离心10分钟,收集上清液;4℃,2000g离心10分钟,收集上清液;4℃,10000g离心30分钟,收集上清液;4℃,110000g离心2小时,收集沉淀物并用35mlpbs缓冲液重悬沉淀;4℃,110000g离心2小时,收集沉淀物并用100~200μlpbs缓冲液重悬沉淀,以便得到外泌体。
2、外泌体的鉴定
利用透射电镜观察经固定及染色后的外泌体的形态外观,在15000-25000倍放大倍率下观察样本,结果如图3所示。外泌体外观呈中央微凹的圆盘形或单侧凹陷的椭球型,直径介于50~150nm之间。
实施例2第二试剂的制备
(1)将新鲜牛尾置于75%酒精中浸泡10分钟,再用无菌生理盐水反复冲洗;
(2)剥离尾腱,去除肌膜和筋膜,置于无菌平皿中;
(3)剪碎尾腱,浸入0.05mol/l醋酸溶液中,4℃振摇48小时;
(4)移入粉碎机中粉碎,再放入4℃冰箱进行二次膨胀;
(5)24小时后,用200目筛网进行过滤,收集滤液,得到胶原蛋白溶液;
(6)在6孔板中,每孔加入5ml胶原蛋白溶液,使其平铺在孔板内;
(7)将孔板在-30℃冰箱预冻6小时,再真空干燥18~24小时,得到胶原海绵;
(8)将胶原海绵置于10cm培养皿中,向所述培养皿中加入30ml0.25%的戊二醛溶液中进行预交联10分钟,得到预交联产物;
(9)向预交联产物中加入30ml0.05mol/l醋酸溶液,于4℃交联24小时,得到交联产物;
(10)用生理盐水冲洗交联产物后进行冻干,并将得到的冻干产物进行灭菌,得到灭菌产物;
(11)向灭菌产物中加入10ml培养液,于37℃浸泡,每天更换培养液,直至培养液的ph值为7.2,弃去培养液,得到生物支架;
(12)将生物支架平铺于培养皿内,向培养皿中加入37℃的培养基,并将装有培养基和生物支架的培养皿置于含5%co2的培养箱中,静置30分钟;以及
(13)向静置后的培养基中按照5×105个细胞/cm2的接种量接种干细胞,在37℃、含5%co2的培养箱中孵育72小时,收集负载干细胞的生物支架,得到第二试剂。
实施例3体外诱导间充质干细胞向表皮细胞分化
1、体外诱导间充质干细胞向表皮细胞分化
在预先铺有基质胶(bd公司,美国)的6孔板上,种植细胞密度为6×104个细胞/cm2的脐带间充质干细胞,每孔加2ml含10%胎牛血清的低糖dmem培养基,在37℃,5%co2培养箱中进行培养至细胞达到50%的融合,改用2ml表皮诱导条件培养基进行诱导7天,隔天半量换液一次。
表皮诱导条件培养基配方:(dmem:df12=1:1(购自sigma)、20ng/ml表皮细胞生长因子(购自r&d)、15ng/ml碱性成纤维细胞生长因子(购自r&d)、1%胰岛素-转铁蛋白-硒复合物(购自sigma)、0.1μm地塞米松(购自sigma)、100u/ml青霉素和100μg/ml链霉素。
2、形态学观察
采用表皮诱导条件培养基进行诱导后,在倒置显微镜下观察细胞形态的变化,如图4所示。细胞中出现较为典型的上皮样细胞形态。
3、免疫荧光染色
将间充质干细胞向表皮细胞诱导分化7天的细胞用pbs缓冲液润洗一次后,加入4%的多聚甲醛室温固定15分钟,含0.3%tritonx100的pbs缓冲液对细胞进行穿膜处理,随后用含10%山羊血清的pbs缓冲液对细胞进行封闭,加入小鼠抗人细胞角蛋白ck19单克隆抗体(型号ck19,北京中杉金桥生物技术有限公司)一抗工作液(1:50)4℃孵育过夜,标记山羊抗鼠的fitc荧光二抗(北京中杉金桥生物技术有限公司),4℃避光孵育30min,用pbs缓冲液充分洗涤细胞三次,在荧光显微镜下观察结果如图5所示。间充质干细胞向表皮细胞诱导,表达表皮干细胞所特有的表面标志ck19,显微镜(100×)下随机计数10个视野内的细胞总数和完全分化的细胞数,经统计学分析显示,细胞分化效率为59.6±4.2%。可以看出,在体外诱导条件下,间充质干细胞具备较强的表皮细胞分化能力。
实施例4裸鼠移植实验
1、动物分组及模型制作
提供balb/c裸鼠20只,体重20克左右,随机分为4组,每组5只,具体操作如下:
用3.5%水合三氯乙醛(0.01ml/g)腹腔注射麻醉,于背部正中切取深至筋膜的全层皮肤作直径为2cm的圆形缺损创面。每组给予不同试剂,然后覆盖凡士林油纱,采用临床打包法进行缝合固定后,单笼饲养。
具体实施方案如下:
a组:不进行任何处理;
b组:将实施例1所得到的5ug/ml外泌体喷于创面上并随后加胶原膜并固定;
c组:在创面上覆盖实施例2所得到的第二试剂;
d组:先将实施例1所得到的外泌体喷于创面上,再覆盖实施例2所得到的第二试剂。
2、创面愈合率计算
于术后7、14、21天将动物创面大小描印于透明薄膜上,采用下列公式进行创面收缩率的计算,并利用sas统计分析软件,组间比较采用方差分析,两两比较采用t检验,p<0.05为有统计学意义。
创面收缩率(%)=100%×(原创面面积-愈合后创面面积)/原创面面积
结果如图6所示。根据创面收缩率的计算,d组(外泌体、干细胞-胶原膜)在移植后7天即达到(58±0.12)%的愈合,b组(单纯外泌体)以及c组(干细胞-胶原膜)分别为(35±0.25)%和(40±0.19)%,创面愈合效果相当,a组只达到(20±0.27)%的愈合,d组的愈合效果与b组、c组、a组存在明显差异(p<0.01)。动物移植实验14天,d组在创面愈合上的优势逐渐减弱,到移植实验21天,d组完全愈合,移植创面平整,弹性好,无明显瘢痕形成;b组和c组愈合效果仅次于d组。由此,表明干细胞与外泌体协同作用,有效地加快皮肤损伤的修复及愈合。
实施例5外泌体与细胞因子用于促进表皮细胞增殖的研究
1、表皮细胞培养:
表皮细胞系hacat细胞(形态如图7所示)培养于含10%胎牛血清的mem培养基中,待细胞生长汇合达到90%以上时,吸弃培养基,用pbs缓冲液润洗细胞一次后加入预热的含0.03%edtana2的0.25%胰蛋白酶,消化10分钟,待细胞变圆且脱离培养皿底部时用含10%胎牛血清的mem培养基终止消化,收集细胞悬液至离心管中,1200rpm离心5分钟,吸弃上清后用新鲜的培养基重悬细胞,细胞计数后按3000细胞/孔的接种量将细胞加至96孔板中培养8小时,hacat细胞完全贴壁。
2、hacat细胞热损伤处理及培养:
将含有完全贴壁的hacat细胞的孔板置于45℃培养箱中处理90分钟(细胞形态如图8所示),随后吸弃培养基,并按如下组别加入0.15ml相应的处理培养基,于37℃,5%二氧化碳培养箱中继续培养24小时。
处理组
a.对照组(mem培养基+10%胎牛血清);
b.实验组1(mem培养基+10%胎牛血清+20ng/ml表皮生长因子);
c.实验组2(mem培养基+10%胎牛血清+10ng/ml碱性成纤维生长因子);
d.实验组3(mem培养基+10%胎牛血清+5μg/ml实施例1所得到的外泌体);
e.实验组4(mem培养基+10%胎牛血清+20ng/ml表皮生长因子+10ng/ml碱性成纤维生长因子);
f.实验组5(mem培养基+10%胎牛血清+10ng/ml碱性成纤维生长因子+5μg/ml实施例1所得到的外泌体);
g.实验组6(mem培养基+10%胎牛血清+20ng/ml表皮生长因子+5μg/ml实施例1所得到的外泌体);
h.实验组7(mem培养基+10%胎牛血清+10ng/ml碱性成纤维生长因子+20ng/ml表皮生长因子+5μg/ml实施例1所得到的外泌体)。
3、细胞免疫荧光检测:
培养结束后,吸弃培养基,用pbs缓冲液润洗一次,加入4%多聚甲醛溶液室温固定细胞15分钟。用pbs缓冲液润洗细胞三次,加入含0.25%tritonx100的pbs缓冲液对细胞进行穿膜处理15分钟(室温)。用含10%驴血清、0.3%tritonx100的pbs缓冲液(封闭液)对细胞进行抗原封闭1小时(室温)。用封闭液按1:400体积比稀释兔抗人ki67抗体(cst公司),并将所得到的抗体稀释液在孵育细胞过夜(4℃)。吸弃ki67抗体稀释液并用pbs缓冲液润洗细胞三次,每次5分钟。用封闭液按1:400体积比稀释驴抗兔荧光二抗alexafluor488igg(h+l)(invitrogen公司),并用所得到的抗体稀释液室温避光孵育细胞1小时。吸弃二抗稀释液并用pbs缓冲液润洗细胞三次,每次5分钟。用pbs缓冲液按1:300体积比稀释dapi,并用所得到的dapi稀释液室温避光孵育细胞3分钟。吸弃稀释液后用pbs缓冲液润洗细胞两次后置于倒置荧光显微镜下观察细胞的染色情况,并随机计数三个视野计算ki67的染色阳性率。染色结果如图9所示,其中,(1)、(3)、(5)、(7)、(9)、(11)、(13)和(15)分别为对照组、实验组1~7的ki67蛋白荧光染色结果,白点代表ki67蛋白阳性;(2)、(4)、(6)、(8)、(10)、(12)、(14)和(16)分别为对照组、实验组1~7的细胞核染料dapi的染色结果,白点代表细胞核。
ki67蛋白是一种与细胞增殖相关的核抗原,参与调控细胞有丝分裂过程,表达于g0期外的所有细胞周期阶段,是标记细胞增殖状态的标志蛋白。hacat细胞在接受热损伤后细胞状态显著下降,细胞增殖停滞。与对照组相比,表皮生长因子或碱性成纤维生长因子以及外泌体共同处理后,细胞核内ki67阳性细胞比例显著提高,表明更多的细胞进入细胞周期并处于增殖状态,而经过实验组4~7处理后,ki67的阳性率均高于实验组1~3,经过实验组7处理后,ki67的阳性率最高,进一步表明外泌体、碱性成纤维生长因子及表皮生长因子协同作用,能够发挥更好地修复效果。
实施例6外泌体与细胞因子用于促进真皮细胞增殖的研究
1、细胞培养:
真皮细胞系bj细胞(形态如图10所示)培养于含10%胎牛血清的hdmem培养基中,待细胞生长汇合达到90%以上时,吸弃培养基,用pbs缓冲液润洗细胞一次后加入预热的trypleexpress酶,消化2分钟,待细胞变圆且脱离培养皿底部时用含10%胎牛血清的hdmem培养基终止消化,收集细胞悬液至离心管中,1200rpm离心5分钟,吸弃上清后用新鲜的含10%胎牛血清的hdmem培养基重悬细胞,细胞计数后按3000细胞/孔的接种量将细胞加至96孔板中培养8小时,bj细胞完全贴壁。
2、bj细胞热损伤处理及培养:
将含有完全贴壁的bj细胞的孔板置于45℃培养箱中处理90分钟(形态如图11所示),随后吸弃培养基,并按如下组别加入0.15ml相应的处理培养基,于37℃,5%二氧化碳培养箱中继续培养24小时。
处理组
a.对照组(hdmem培养基+10%胎牛血清);
b.实验组1(hdmem培养基+10%胎牛血清+20ng/ml表皮生长因子);
c.实验组2(hdmem培养基+10%胎牛血清+10ng/ml碱性成纤维生长因子);
d.实验组3(hdmem培养基+10%胎牛血清+5μg/ml实施例1所得到的外泌体)
e.实验组4(hdmem培养基+10%胎牛血清+20ng/ml表皮生长因子+10ng/ml碱性成纤维生长因子);
f.实验组5(hdmem培养基+10%胎牛血清+10ng/ml碱性成纤维生长因子+5μg/ml实施例1所得到的外泌体);
g.实验组6(hdmem培养基+10%胎牛血清+20ng/ml表皮生长因子+5μg/ml实施例1所得到的外泌体);
h.实验组7(hdmem培养基+10%胎牛血清+10ng/ml碱性成纤维生长因子+20ng/ml表皮生长因子+5μg/ml实施例1所得到的外泌体)。
3、细胞免疫荧光检测:
培养结束后,吸弃培养基,用pbs缓冲液润洗一次,加入4%多聚甲醛溶液室温固定细胞15分钟。用pbs缓冲液润洗细胞三次,加入含0.25%tritonx100的pbs缓冲液对细胞进行穿膜处理15分钟(室温)。用含10%驴血清、0.3%tritonx100的pbs缓冲液(封闭液)对细胞进行抗原封闭1小时(室温)。用封闭液按1:400体积比稀释兔抗人ki67抗体(cst公司),并将所得到的稀释液在4℃孵育细胞过夜。吸弃稀释液并用pbs缓冲液润洗细胞三次,每次5分钟。用封闭液按1:400体积比稀释驴抗兔荧光二抗alexafluor488igg(h+l)(invitrogen公司),并将所得到的稀释液在室温避光孵育细胞1小时。吸弃稀释液并用pbs缓冲液润洗细胞三次,每次5分钟。用pbs缓冲液按1:300体积比稀释dapi,室温避光孵育细胞3分钟。吸弃dapi溶液后用pbs缓冲液润洗细胞两次后置于倒置荧光显微镜下观察细胞的染色情况,并随机计数三个视野计算ki67的染色阳性率。染色结果如图12所示,其中,(1)、(3)、(5)、(7)、(9)、(11)、(13)和(15)分别为对照组、实验组1~7的ki67蛋白荧光染色结果,白点代表ki67蛋白阳性;(2)、(4)、(6)、(8)、(10)、(12)、(14)和(16)分别为对照组、实验组1~7的细胞核染料dapi的染色结果,白点代表细胞核。
与对照组相比,外泌体、表皮生长因子或碱性成纤维生长因子处理后,细胞核内ki67阳性细胞比例显著提高,表明更多的细胞进入细胞周期并处于增殖状态,而经过实验组4~7处理后,ki67的阳性率均高于实验组1~3,经过实验组7处理后,ki67的阳性率最高,进一步表明外泌体、碱性成纤维生长因子及表皮生长因子协同作用,能够发挥更好地修复效果。
实施例7第一试剂和第二试剂共同作用对创面愈合的研究
按照实施例4的方法进行裸鼠移植实验,其中,处理组为:
a组:不进行任何处理;
b组:将第一试剂喷于创面上,其中第一试剂含有:10ng/ml碱性成纤维生长因子+20ng/ml表皮生长因子+5μg/ml实施例1所得到的外泌体;
c组:在创面上覆盖实施例2所得到的第二试剂;
d组:将第一试剂喷于创面上,其中第一试剂含有:10ng/ml碱性成纤维生长因子+20ng/ml表皮生长因子+5μg/ml实施例1所得到的外泌体,再将覆盖实施例2所得到的第二试剂。
结果表明,d组的创面收缩率较其他各组显著升高,说明外泌体、细胞因子、干细胞共同作用于受损皮肤处,对创面具有较佳的修复及再生的效果,使创面愈合速度加快。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!