蛹虫草提取物及其制备方法和应用与流程
本发明涉及天然活性产物
技术领域:
,特别是涉及一种蛹虫草提取物及其制备方法和应用。
背景技术:
:糖尿病(Diabetesmellitus,DM)是一种以高血糖为特征的慢性代谢性疾病。近年来,社会不断进步,人民生活水平不断提高,糖尿病的发病率也不断升高,糖尿病已经成为严重危害人类生命健康的恶性疾病之一,临床上以高血糖为主要特点。我国目前糖尿病的总体患病率已达9.7%,同期糖尿病前期的患病率高达15.5%。根据调查结果所做出的推算显示,我国总糖尿病患病人数达9千2百万以上,糖尿病前期人数达1亿4千8百万以上。近年来的研究发现,蛋白酪氨酸磷酸酶(ProteinTyrosinePhosphatase,PTP)与2型糖尿病的胰岛素信号传导、高血脂、肥胖密切相关。PTPs家族可分为8个亚族:①酪氨酸特异性PTPs,②双特异性PTPs,③细胞分裂周期蛋白25(cdc25)亚族,④第10号染色体缺失的磷酸酶和张力蛋白同源基因(PTEN)亚族,⑤Myotubularins,⑥再生肝磷酸酶(PRL)亚族,⑦低分子量PTPs,⑧新发现的cdc14亚族。其中,与胰岛素信号调节紧密相关的是酪氨酸特异性PTPs。PTP1B是胞内PTPs的代表,是第一个被鉴定并纯化的哺乳动物PTP,广泛表达于肌肉、心、肝、肾、脑等各种组织中。PTP-1B在胰岛素抵抗中发挥了重要的作用,是胰岛素信号转导中一个十分关键的分子,可以负性调节胰岛素和瘦素的信号转导。胰岛素信号传导首先需要胰岛素与胰岛素受体结合。胰岛素受体是由α2β2亚单位组成的四聚体,α亚单位与胰岛素结合后β亚单位的酪氨酸及胰岛素受体底物发生磷酸化而被激活。磷脂酰肌醇3激酶(phosphatidylinositol3-kianse,PI3K)等下游蛋白也被活化,葡萄糖转运蛋白4由细胞内转至细胞膜,最终葡萄糖进入细胞。在上述过程中的磷酸化反应可以被PTP-1B等因子逆转,从而阻止胰岛素信号的传导。如果PTP-1B结构或活性改变,将改变其对胰岛素信号传导的抑制作用。-外周组织胰岛素抵抗和胰岛β细胞功能受损是2型糖尿病发病机制的两个基本条件,而胰岛素信号传导被抑制是胰岛素抵抗的重要环节。PTP-1B升高表达可引起胰岛素抵抗,从而引发2型糖尿病。有资料表明,PTP-1B的表达水平在发生糖尿病或胰岛素抵抗时明显升高。使转基因鼠表达人PTP-1B的有关研究中发现,与对照组相比,实验组鼠肌肉中胰岛素刺激引起的胰岛素受体酪氨酸磷酸化水平降低35%,PI3K活性降低40%~60%,葡萄糖转运所需的蛋白激酶c活性也减弱;表达PTP-1B的小鼠全身葡萄糖清除和肌肉的葡萄糖摄取减少了40%~50%。并有研究表明体重指数正常的初诊2型糖尿病较正常对照者存在明显的胰岛素抵抗,而PTP-1B在前者内脏脂肪组织中的表达较后者显著增高,几乎是后者的4倍。可见内脏脂肪组织PTP-1B的表达升高在胰岛素抵抗中也有重要作用。另有研究报道采用PTP-1B反义寡核苷酸处理糖尿病模型小鼠(ob/ob小鼠),抑制其PTP-1B表达,发现在肝、脂肪和骨骼肌内PTP-1B的表达下调时,ob/ob小鼠血糖恢复正常,与糖代谢有关的各个指标也都趋于正常。以上结果说明,PTP-1B在拮抗胰岛素信号传导中具有重要作用。糖尿病患者体内PTP,尤其是PTP-1B的含量及活性的异常可能存在多方面的原因,基因变异被认为是主要因素。有研究表明,先用限速酶AVAI对653个样本的一种单核苷酸多肽链消化,再利用外显子PCR放大技术对其编码发现,带有PTP981T/981C基因型的人群患2型糖尿病的概率大大增加。目前,PTP1B抑制剂很多,但是大多都是人工合成得到的,具有很大的副作用,临床上成药性很差,到目前为止,还没有一个PTP1B抑制剂在临床上进行应用。而中草药具有天然、多效、毒性小等特点。从中药和天然药物中寻找能够抑制PTP1B的有效成分是迫切需要解决的课题。技术实现要素:基于此,有必要针对上述问题,提供一种蛹虫草提取物,该蛹虫草提取物具有较好的PTP1B抑制作用,为临床上开发降血糖、防治胰岛素抵抗、糖尿病的药物提供一个新的途径。一种蛹虫草提取物的制备方法,其特征在于,包括以下步骤:制备醇提物:取蛹虫草,加入体积百分浓度为80-100%的乙醇水溶液作为提取溶剂,加热提取,然后去除固体不溶物,得醇提液,回收所述醇提液中的溶剂,得醇提物,即为蛹虫草提取物。可以理解的,所述去除固体不溶物的方式有多种,如常规技术中的过滤,离心等手段均可。蛹虫草(CordycepsmilitarisL.Link),又名北冬虫夏草、北虫草,属子囊菌门(Ascomycota),粪壳菌纲(Sordariomycetes),肉座菌目(Hypocreales),虫草菌科(Cordycipitaceae),虫草属(Cordyceps)。目前世界上已发现虫草属真菌350多种,其中我国记录有61种。《新华本草纲要》记载其“性平,味甘,有益肺肾,补精髓,止血化痰”,用于肺结核、老人虚弱和贫血等疾病的治疗。本发明人经过长期的实验研究后发现,采用上述方法制备得到的蛹虫草提取物,对蛋白酪氨酸磷酸酶1B(PTP1B)的抑制作用,可用于开发制备降血糖、防治胰岛素抵抗、糖尿病的药物中。在其中一个实施例中,所述制备醇提物步骤中,每次按照每克蛹虫草加入10mL-20mL提取溶剂的量加入体积百分浓度为90%-100%的乙醇水溶液,加热提取1次-5次,每次30min-120min。在其中一个实施例中,所述蛹虫草提取物的制备方法还包括以下步骤:制备环己烷溶解物:取所述醇提物,加入环己烷,搅拌使所述醇提物充分溶解,然后分离固体不溶物与溶液,分别得环己烷残渣和环己烷溶液,回收所述环己烷溶液中的溶剂,得环己烷溶解物;制备乙酸乙酯溶解物:取所述环己烷残渣,加入乙酸乙酯,搅拌使所述环己烷残渣充分溶解,然后分离固体不溶物与溶液,分别得乙酸乙酯残渣和乙酸乙酯溶液,回收所述乙酸乙酯溶液中的溶剂,得乙酸乙酯溶解物;制备乙酸乙酯萃取物:取所述乙酸乙酯残渣,加入乙醇,搅拌使所述乙酸乙酯残渣充分溶解,然后分离固体不溶物与溶液,得到乙醇溶液,回收所述乙醇溶液中的溶剂,得乙醇溶解物;将所述乙醇溶解物加水溶解,随后再加入乙酸乙酯萃取,取乙酸乙酯层,回收溶剂后得到乙酸乙酯萃取物;所述环己烷溶解物、乙酸乙酯溶解物和乙酸乙酯萃取物中的至少一种即为所述蛹虫草提取物。在其中一个实施例中,所述制备环己烷溶解物步骤中,每次按照每克醇提物加入50mL-100mL环己烷的量加入环己烷,搅拌使所述醇提物充分溶解2次-6次;所述制备乙酸乙酯溶解物步骤中,每次按照每克环己烷残渣加入50mL-100mL乙酸乙酯的量加入乙酸乙酯,搅拌使所述环己烷残渣充分溶解2次-6次;所述制备乙酸乙酯萃取物步骤中,按照每克乙醇溶解物加入10mL-60mL水的量加入水溶解得水溶液,随后每次按照0.5-3倍水溶液体积的量加入乙酸乙酯,萃取2次-5次。在其中一个实施例中,所述蛹虫草提取物的制备方法还包括以下步骤:取所述环己烷溶解物,以正相硅胶色谱柱为固定相,以体积百分比为200∶1~10∶1的环己烷-乙酸乙酯混合溶液为流动相进行洗脱,以TLC薄层色谱检测洗脱液,合并相同组份,分离得到组份3、组份4、组份5、组份6、组份7,所述组份3、组份4、组份5、组份6、组份7的极性依次由小至大;所述TLC薄层色谱检测的条件为:固定相为正相硅胶,展开剂分别为170∶1和80∶1的环己烷-乙酸乙酯混合溶液,显色剂为10%的硫酸水溶液,于日光下检视。所述组份3、组份4、组份5、乙酸乙酯溶解物和乙酸乙酯萃取物中的至少一种即为所述蛹虫草提取物。在其中一个实施例中,所述蛹虫草提取物的制备方法还包括以下步骤:取所述组份4,以反相C18硅胶色谱柱进行分离纯化,具体条件如下:固定相:C18反相硅胶柱,柱直径为7.8mm,柱长度为100mm;流动相:甲醇-水梯度洗脱,具体为:0至15min,水相体积百分数由80%降至50%,15至30min,水相体积百分数由50%降至15%,30至90min,水相体积百分数由15%降至0%;流速:3mL/min;检测波长:190nm和/或254nm;收集第66min和第69min色谱峰的洗脱液,回收溶剂,分别得到单体化合物1和单体化合物2;所述单体化合物1的结构如下:所述单体化合物2的结构如下:所述组份3、单体化合物1、单体化合物2、组份5、乙酸乙酯溶解物和乙酸乙酯萃取物中的至少一种即为所述蛹虫草提取物。本发明还公开了上述的蛹虫草提取物的制备方法制备得到的蛹虫草提取物。本发明还公开了上述的单体化合物1和/或单体化合物2。本发明还公开了上述的蛹虫草提取物、单体化合物1和单体化合物2中的至少一种在作为抑制蛋白酪氨酸磷酸酶1B的抑制剂和/或作为胰岛素增敏剂中的应用。在其中一个实施例中,所述蛋白酪氨酸磷酸酶1B的抑制剂,和/或所述胰岛素增敏剂在制备用于预防和治疗糖尿病、肥胖症及其并发症的保健食品或药物中应用。在其中一个实施例中,所述药物或保健食品的剂型为片剂、颗粒剂、硬胶囊、软胶囊、口服液、丸剂或滴丸。上述剂型可以采用本领域技术人员熟知的方法来进行药剂的制备。根据需要,可以加入各种药学上可接受的载体。所述的载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。本发明的药剂在制备时,可选择的填充剂包括但不限于:淀粉、糖粉、磷酸钙、糊精、微晶纤维素、乳糖、预胶化淀粉、甘露醇等;可选择的粘合剂包括但不限于:羧甲基纤维素钠、PVP-K30、羟丙基纤维素、淀粉浆、甲基纤维素、乙基纤维素、羟丙基甲基纤维素、胶化淀粉等;可选择的崩解剂包括但不限于:干淀粉、交联聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠、低取代羟丙基纤维素等;可选择的润滑剂包括但不限于:硬脂酸镁、滑石粉、十二烷基硫酸钠、微粉硅胶等。与现有技术相比,本发明具有以下有益效果:本发明的一种蛹虫草提取物,对蛹虫草原料进行醇提,得到的醇提物即为蛹虫草提取物具有蛋白酪氨酸磷酸酶1B(PTP1B)的抑制作用,可用于开发制备降血糖、防治胰岛素抵抗、糖尿病的药物中。并且,蛹虫草药食同源,按照上述方法制备的醇提物从蛹虫草中直接提取,具有毒性低、安全性高、可长期服用的优点。进一步的,将上述醇提物进行分离纯化,得到环己烷溶解物、乙酸乙酯溶解物、乙酸乙酯萃取物等有效部位,其PTP1B抑制活性优于上述醇提物。更进一步来说,还可将上述环己烷溶解物进行分离纯化,得到组份3、组份4、组份5及单体化合物1、单体化合物2,具有更佳的PTP1B抑制活性。特别是其中的单体化合物1和单体化合物2对PTP1B的半数抑制浓度分别为21.3μM和19.7μM。为临床上开发降血糖、防治胰岛素抵抗、糖尿病的药物提供一个新的途径。附图说明图1为实施例1制备得到的蛹虫草提取物对PTP1B的抑制率柱形图;图2为实施例2制备得到的蛹虫草提取物对PTP1B的抑制率柱形图。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
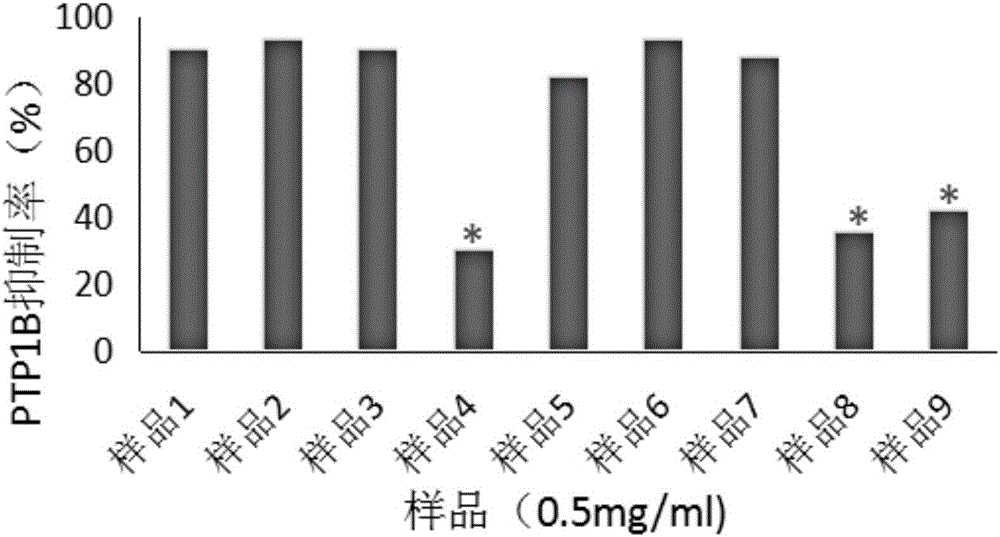
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。实施例1蛹虫草提取物,通过以下方法制备得到:一、制备醇提物。取蛹虫草粗粉200g,按固液比1∶10(每克原料固体加入10ml溶液)加入2000ml体积百分浓度为95%的乙醇水溶液,80℃水浴回流2h,共4次,过滤,得醇提液,合并醇提液;减压浓缩回收乙醇,合并浓缩液,继续于敞口容器中55℃加热烘干,即得醇提物,称重为35.4g。二、制备环己烷溶解物。将上述醇提物置于较大容器中,加入1770ml(50倍)环己烷,搅拌,静止,过滤,收集环己烷溶解液,此过程重复进行4次,环己烷溶解液减压浓缩回收环己烷,合并浓缩液,继续于敞口容器中55℃加热挥尽环己烷,即为环己烷溶解物,称重为5.6g。三、制备乙酸乙酯溶解物。将上述环己烷溶解后的残渣不溶物用乙酸乙酯作为溶解溶剂,按照步骤二中制备环己烷溶解物的方法操作,制备得到乙酸乙酯溶解物,称重为2.7g。四、制备正丁醇溶解物。将上述乙酸乙酯溶解后的残渣不溶物用正丁醇作为溶解溶剂,按照步骤二中制备环己烷溶解物的方法操作,制备得到正丁醇溶解物,称重20.8g。五、正相硅胶分离纯化。取上述步骤二制备得到的环己烷溶解物,采用正向硅胶色谱柱分离,环己烷∶乙酸乙酯(200∶1~10∶1)为流动相梯度洗脱,TLC薄层色谱鉴定相同组分合并。其中,TLC薄层色谱检测的条件为:固定相为正相硅胶,展开剂分别为170∶1和80∶1的环己烷-乙酸乙酯混合溶液,显色剂为10%的硫酸水溶液,于日光下检视,将TLC薄层色谱鉴定相同组分合并后,得到极性依次由小至大的组份3、组份4、组份5、组份6、组份7,称重分别为0.58g、2.12g、1.68g、0.65g、0.45g。六、反向C18硅胶色谱柱分离纯化。取步骤五制备得到的组份4(2.12g),用甲醇溶解,0.2微米微孔滤膜过滤,随后用半制备HPLC(日本岛津)分离纯化,半制备柱为WatersC18柱(柱型号为186001155,填料粒径为5μm,规格为7.8mm×100mm),甲醇水梯度洗脱。具体梯度为:0~15min,水80%~50%,15~30min,水50%~15%,30~90min,水15%~0%,90~120min,水0%;检测波长190nm,254nm;流速3mL/min。分别收集于66min,69min出现色谱峰的洗脱液,回收溶剂后得到单体化合物1和单体化合物2。经FABMS,1H-NMR,13C-NMR,COSY,HMBC,HMQC等波谱数据鉴别后确认该单体化合物1的化学式为:C48H89NO8;结构式如下:上述化合物的表征数据为:FABMS(negative)m/z807[M]+;1H-NMR(500MHz,CD3OD):δ5.81(1H,dt,J=15.1,6.7Hz),5.70(1H,dt,J=15.5,5.5Hz),5.46(1H,dd,J=15.1,6.1Hz),5.44(1H,dt,J=15.5,6.8Hz),5.12(1H,t,J=5.5Hz),4.41(1H,d,J=6.1Hz),4.24(1H,d,J=7.8Hz),4.12(1H,dd,J=10.4,5.4Hz),3.92(1H,m),3.69(1H,dd,J=10.4,3.5Hz),3.22-3.65(56H,m),2.01-2.12(10H,m),1.98(2H,t,J=7.6Hz),1.59(3H,s),1.28-1.34(44H,m),0.88(9H,t,J=6.9Hz).经FABMS,1H-NMR,13C-NMR,COSY,HMBC,HMQC等波谱数据鉴别后确认该单体化合物2的化学式为:C41H77NO9;结构式如下:上述化合物的表征数据为:FABMS(negative)m/z727[M]+;1H-NMR(500MHz,CD3OD):δ5.75(1H,dt,J=15.4,5.4Hz),5.50(1H,dd,J=15.4,6.8Hz),5.08(1H,t,J=7.0Hz),4.30(1H,d,J=7.8Hz),4.11(1H,t,J=6.8Hz),4.06(1H,dd,J=10.2,5.6Hz),4.00(1H,m),3.73(1H,dd,J=10.2,3.6Hz),3.33(2H,m),3.17-3.23(5H,m),2.07(4H,m),1.99(2H,m),1.57(3H,s),1.36(2H,m),1.30-1.39(-CH2-),0.94(6H,t,J=6.3Hz).实施例2蛹虫草提取物,通过以下方法制备得到:一、制备醇提物。取蛹虫草粗粉500g,按固液比1∶15(每克原料固体加入15ml溶液)加入7500ml的无水乙醇,80℃水浴回流1.5h,共4次,过滤,得醇提液,合并醇提液;减压浓缩回收乙醇,合并浓缩液,继续于敞口容器中55℃加热烘干,即得醇提物,称重为90g。二、制备环己烷溶解物。将上述醇提物置于较大容器中,加入5.4L(60倍)环己烷,搅拌,静止,过滤,收集环己烷溶解液,此过程重复进行5次,环己烷溶解液减压浓缩回收环己烷,合并浓缩液,继续于敞口容器中55℃加热挥尽环己烷,即为环己烷溶解物,称重为13.8g。三、制备乙酸乙酯溶解物。将上述环己烷溶解后的残渣不溶物用乙酸乙酯作为溶解溶剂,按照步骤二中制备环己烷溶解物的方法操作,制备得到乙酸乙酯溶解物,称重为6.8g。四、制备无水醇溶解物。将上述乙酸乙酯溶解后的残渣不溶物用无水乙醇作为溶解溶剂,按照步骤二中制备环己烷溶解物的方法操作,制备得到无水乙醇溶解物,称重49.6g。五、制备乙酸乙酯萃取物。将上述无水乙醇溶解后的残渣不溶物加1000ml水溶解,加入2倍量的乙酸乙酯萃取5次,合并乙酸乙酯萃取液,采用减压浓缩方法,得到乙酸乙酯萃取物16.2g,与乙酸乙酯溶解物合并,为组份1,共为23g。六、制备正丁醇萃取物。将余下的水层在60℃加热挥尽乙酸乙酯,水层按照上述步骤中的方法用正丁醇萃取,采用减压浓缩方法,得正丁醇萃取物27.3g,为组份2。七、正相硅胶分离纯化。按照实施例1中正相硅胶分离纯化的方法,取上述步骤二制备得到的环己烷溶解物进行分离纯化,得到与实施例1一致的组份3、组份4、组份5、组份6、组份7,称重分别为1.2g、5.1g、3.9g、2.0g、1.1g。八、反向C18硅胶色谱柱分离纯化。取步骤七制备得到的组份4(5.1g),按照实施例1中反向C18硅胶色谱柱分离纯化的方法操作,同样得到单体化合物1和单体化合物2。实验例1取实施例1制备得到的乙酸乙酯溶解物、正丁醇醇溶解物、组份3、组份4、组份5、组份6、组份7、单体化合物1和单体化合物2,测试各成分对蛋白酪氨酸磷酸酶1B的抑制作用。一、材料1、取乙酸乙酯溶解物、正丁醇溶解物、组份3、组份4、组份5、组份6、组份7,均配成浓度为0.5mg/mL;2、单体化合物1和单体化合物2;3、PTP1B,购自Prospec公司;4、Tris,购自有限责任公司背景鼎国生物技术有限责任公司;5、HCl,购自西陇化工股份有限公司;6、P-NPP,购自北京鼎国昌盛生物技术有限公司;7、熊果酸、科罗索酸,均购自购自北京鼎国昌盛生物技术有限公司,均配成浓度为0.5mg/mL;8、其余试剂均为国产试剂分析纯;二、方法参照文献(Zhang,Y.L.,etal.″Geranylated2-arylbenzofuransfromMorusalbavar.tataricaandtheiralpha-glucosidaseandproteintyrosinephosphatase1Binhibitoryactivities.″Fitoterapia92:116-126.(2014))报道的方法测定PTP1B的活性。简述如下:PTP1B活性测定反应体系,包括:100mMp-NPP(底物),10μL;0.01μg/μL的PTP1B,20μL;缓冲液(25mMTris-HCl,1mMEDTA,1mMDTT,2mMβ-巯基乙醇;pH7.5),65μL;样品5μL,总反应体系100μL。测定方法:在96孔板中先加入65μL缓冲液,再分别加入5μL样品,后加入20μL0.01μg/μL的PTP1B酶,30℃孵育5min,后加入10μL100mMp-NPP启动反应,30℃反应30min,用50μL预冷的3MNaOH终止反应,在405nm处测定吸光度值(OD)。按照上述酶活性测定方法,将表1所示的不同样品用DMSO溶解,405nm处测定吸光度值,每个浓度设置三个复孔,按照如下公式计算抑制率:抑制率=(OD阴性对照组-OD空白对照组)-(OD样品-OD样品空白对照组)/(OD阴性对照组-OD空白对照组)×100%其中:OD阴性对照组包括:缓冲液+PTP1B酶+底物;OD空白对照组包括:缓冲液+底物;OD样品包括:缓冲液+样品+PTP1B酶+底物;OD样品空白对照组包括:缓冲液+样品+底物;三、实验结果1、乙酸乙酯溶解物、正丁醇溶解物、组份3、组份4、组份5、组份6、组份7的抑制活性结果如下表和图1所示:表1不同样品对PTP1B的抑制作用*表示分别与样品1和样品2相比,均表现为具有统计学差异P<0.05。从上述结果中可以看出,在与阳性药熊果酸和科罗索酸在相同浓度(均为0.5mg/mL)下,乙酸乙酯溶解物、组份3、组份4和组份5对蛋白酪氨酸磷酸酶1B(PTP1B)具有较强的抑制作用;正丁醇溶解物和组份6,7对蛋白酪氨酸磷酸酶1B(PTP1B)的抑制作用较弱(与阳性药熊果酸和科罗索酸相比,有显著性差异P<0.05)。2、参照上述方法,测定单体化合物1和单体化合物2的IC50,结果如下表所示。表2.单体化合物对PTP1B的抑制作用从上述结果中可以看出,当单体化合物1的浓度为21.3μM时,对PTP1B有50%抑制作用(IC50);当单体化合物2的浓度为19.7μM时,对PTP1B有50%抑制作用(IC50)。其抑制作用均比组份4强,也就是说,单体化合物1和单体化合物2经过分离纯化后,去除了组份4中无活性或低活性成分,具有最佳的PTP1B抑制作用,且具有干扰成分少,副作用低的优点。实验例2取实施例2制备得到的组份1、组份2、组份3、组份4、组份5、组份6、组份7、单体化合物1和单体化合物2,测试各成分对蛋白酪氨酸磷酸酶1B的抑制作用。一、材料同实验例1。二、方法同实验例1。三、实验结果1、组份1、组份2、组份3、组份4、组份5、组份6、组份7的抑制活性结果如下表和图2所示:表3不同样品对PTP1B的抑制作用成分浓度(mg/mL)抑制率(%)样品1熊果酸0.590.1样品2科罗索酸0.592.9样品3组份10.589.8样品4组份20.530.1*样品5组份30.581.4样品6组份40.592.7样品7组份50.587.8样品8组份60.535.2*样品9组份70.541.9**表示分别与样品1和样品2相比,均表现为具有统计学差异P<0.05。从上述结果中可以看出,在与阳性药熊果酸和科罗索酸相同浓度(均为0.5mg/mL)下,组份1、组份3、组份4和组份5对蛋白酪氨酸磷酸酶1B(PTP1B)具有较强的抑制作用;组份2,6,7对蛋白酪氨酸磷酸酶1B(PTP1B)的抑制作用较弱,(与阳性药熊果酸和科罗索酸相比,有显著性差异P<0.05)。2、参照上述方法,测定单体化合物1和单体化合物2的IC50,结果如下表所示。表4.单体化合物对PTP1B的抑制作用从上述结果中可以看出,当单体化合物1的浓度为21.1μM时,对PTP1B有50%抑制作用(IC50);当单体化合物2的浓度为19.8μM时,对PTP1B有50%抑制作用(IC50)。其抑制作用均比组份4强,也就是说,单体化合物1和单体化合物2经过分离纯化后,去除了组份4中无活性或低活性成分,具有最佳的PTP1B抑制作用,且具有干扰成分少,副作用低的优点。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1