丹参酮类化合物在制备抗肿瘤药物中的应用的制作方法
本发明涉及天然药物领域和抗肿瘤化合物领域,具体涉及了丹参酮类化合物在制备抗肿瘤药物中的应用。
背景技术:
恶性肿瘤是影响全球发病率和死亡率的主要原因,相关统计数据显示,2012年我国恶性肿瘤病新发例大约有358.6万例,死亡病例为218.7万例。预计未来20年新发病例数约增加70%[2012年中国恶性肿瘤发病和死亡分析.中国肿瘤,2016,25(1):1-8]。目前,对恶性肿瘤的治疗手段主要有手术切除和化疗,其中首选手术切除,然而恶性肿瘤在早期易发生远端转移和局部浸润,这给外科手术切除带来了极大的困难。现阶段一线的化疗药物如吉西他滨、顺铂、5-氟尿嘧啶、埃罗替尼和紫杉醇等,均存在治疗后期易耐药、易复发和副作用大等问题。因此,开发能特异性治疗恶性肿瘤且副作用小的新药物一直以来都是肿瘤研究者的夙愿。
丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎,具有祛瘀止痛、活血调经、养心除烦的功效,是我国传统医药学中应用最早的药物之一。现代药用植物化学研究结果显示,丹参主要含有水溶性的酚酸类成分以及以丹参酮类为代表的脂溶性成分。其中,丹参酮类化合物在临床上广泛用于治疗心血管系统疾病,具有扩张冠状动脉、增加冠脉血流量、改善微循环、降低心肌耗氧量、防治心肌缺血和心肌梗塞等作用。近年来,部分丹参酮类化合物对多种癌症表现出的优异的体内外治疗效果逐渐引起了肿瘤研究工作者的关注。现代药理学研究表明,抑瘤机制可能与其诱导肿瘤细胞凋亡密切相关。戴支凯等研究发现,丹参酮ⅡA通过诱导肿瘤细胞凋亡从而对人肺癌细胞A549表现出较强的增殖抑制作用[中国药理学通报,2010,26(7):903-906]。另外,丹参酮Ⅰ、隐丹参酮等对人前列腺癌、肺癌、胰腺癌、胃癌、肝癌和乳腺癌等细胞的生长均表现出一定的抑制作用[天然产物研究与开发,2013,8(30):1160-1165]。
然而,丹参酮类化合物抗肿瘤活性研究的对象主要集中于含量高、应用广泛的活性分子,对于微量丹参酮类化合物抗肿瘤活性的研究鲜有报道。因此,从众多的低含量丹参酮类化合物中筛选出抗肿瘤活性高、抗肿瘤谱广,并且毒性低的单体化合物并不容易,是目前仍未解决的技术问题。
技术实现要素:
一种丹参酮类化合物在制备抗肿瘤药物中的应用,其特征在于,所述的丹参酮类化合物具有以下共同的化学结构通式:
其中,B环或则C环为芳香环;R1为=O、H;R2为H、OH;R3为CH3、(CH3)2;1,2间断键或则Δ2,3中的任一种
涉及以下四种化合物:
本发明的技术方案如下:
一种丹参酮类化合物在制备治疗或预防抗肿瘤的药物中的应用。
所述的丹参酮酮类化合物为丹参中分离得到的一种菲醌类化合物,在化学结构上具有共同的母核;优选地,所述的丹参酮类化合物主要涉及异丹参酮ⅡA(IsotanshinoneⅡA)、小红参醌甲(Trijuganone A)、miltionone I、1-Ketoiso-cryptotanshinone四种化合物。
所述的肿瘤为肺癌、妇科肿瘤和消化道肿瘤;优选地,妇科肿瘤为乳腺癌或宫颈癌,消化道肿瘤为肝癌、结肠癌或胰腺癌。
优选地,所述丹参酮类化合物是从丹参中提取分离的,具体;存在于药物中上述丹参酮类化合物以药学上可接受的盐的形式也具有与所述化合物一样的功效。
优选地,所述丹参酮类化合物通过添加药学上可接受的载体制备成各种剂型。上述剂型为片剂、锭剂、丸剂、胶囊剂、散剂、颗粒剂、口服液、悬浮液、乳剂或注射剂、栓剂、贴剂。
所述丹参酮类四种化合物的浓度范围是1μM-100μM,优选为1μM、5μM和10μM。所述丹参酮类四种化合物的溶剂是:含0.5%-2%DMSO的无血清无双抗的DMEM培养基。
本发明采用CCK-8法对所述丹参酮类化合物的抑制肿瘤细胞增殖的活性进行了评价。其中,所述丹参酮类化合物为本实验室自制,具体制备方法及结构鉴定方法见实施例1。结果显示,经所述丹参酮类化合物处理的人肺癌细胞A549、人乳腺癌细胞MCF-7、人结肠癌细胞Caco-2、人宫颈癌细胞Hela、人肝癌细胞HepG2、人胰腺癌细胞PANC-1均有明显的增殖抑制作用,并且抑制作用随着药物浓度的增加而增强,呈现明显的量效关系。
本发明采用Annexin V/PI双染法对所述丹参酮类化合物所引起的人肺癌细胞A549的凋亡情况进行了检测。与空白组相比,经所述丹参酮类化合物处理后,A549细胞各时期的凋亡率均有所增加,且呈现一定的量效依赖关系。所述化合物在10μM浓度下的诱导A549细胞凋亡的能力最强,该结果与所述化合物表现出的抑制肿瘤细胞增殖的活性保持一致。
附图说明
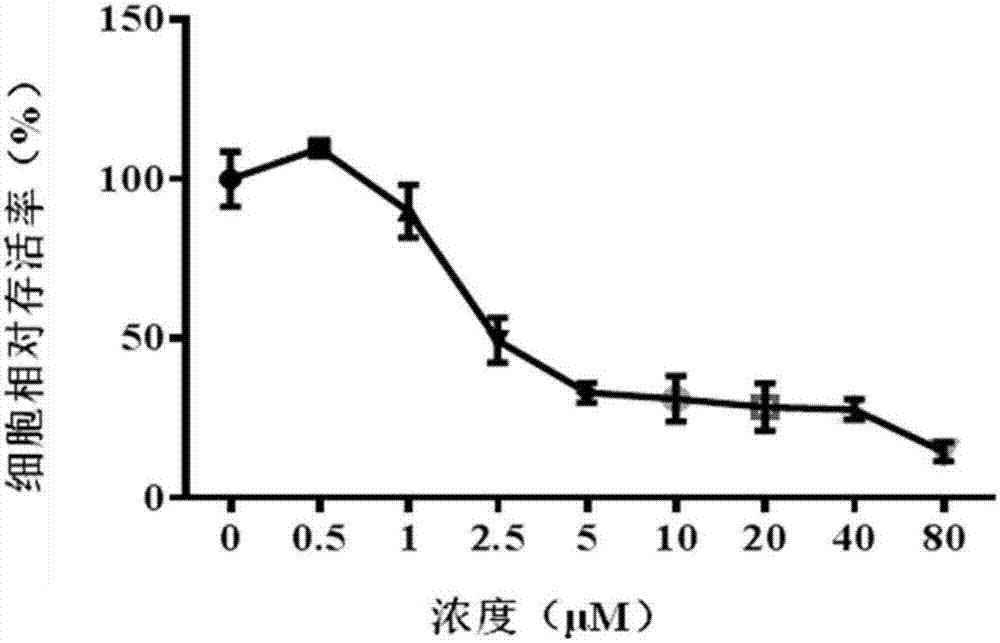
图1为不同浓度的异丹参酮ⅡA(IsotanshinoneⅡA)对人肺癌细胞A549增殖抑制曲线图。
图2为不同浓度的小红参醌甲(Trijuganone A)对人肺癌细胞A549增殖抑制曲线图。
图3为不同浓度的miltionone I对人肺癌细胞A549增殖抑制曲线图。
图4为不同浓度的1-Ketoiso-cryptotanshinone对人肺癌细胞A549增殖抑制曲线图。
图5为不同浓度的异丹参酮ⅡA(IsotanshinoneⅡA)对胰腺癌细胞DT6606增殖抑制曲线图。
图6为不同浓度的小红参醌甲(Trijuganone A)对胰腺癌细胞DT6606增殖抑制曲线图。
图7为不同浓度的miltionone I对胰腺癌细胞DT6606增殖抑制曲线图。
图8为不同浓度的1-Ketoiso-cryptotanshinone对胰腺癌细胞DT6606增殖抑制曲线图。
具体实施方式:
以下通过具体的实施方式对本发明的内容做进一步的说明,但不应当将下述实施例理解为对本发明的限制。在不脱离本发明前述主题的情况下,根据本领域普通技术和常规手段做出的相应技术或手段变更,均包含在本发明之内。
药效学实验例
四种丹参酮类化合物的肿瘤细胞抑制作用及凋亡诱导作用药效学实验及结果:
实验例1
CCK-8法丹参酮类化合物对肿瘤细胞增殖的抑制作用
将实施例1.1所制备的四种丹参酮类化合物用不含血清的培养基分别配制成不同浓度的含药溶液,以人肺癌细胞A549和胰腺癌细胞DT6606为实验对象,取对数生长期状态良好的A549细胞DT6606细胞接种于96孔板中,接种浓度为5000个细胞/孔,置于常规细胞培养箱中培养12h。按照前期的给药方案对肿瘤细胞进行处理,以不含药物的培养基作为阴性对照。培养24小时后,采用CCK-8法测定药物作用后细胞的活力,分析四种所述丹参酮类化合物的体外抗肿瘤活性。具体步骤为:
a)给药:由于所述4种丹参酮类化合物选择用含1%DMSO的无血清无双抗的DMEM培养基作为溶剂,配制不同浓度的受试药物。给药后,培养24小时,同时设置以不含药物的培养基(1%DMSO)作为阴性对照。每组分别设3个复孔。
b)换液:配制含10%CCK-8的无血清无双抗的DMEM培养基,以换液的形式加入,每孔100μL,37℃下继续培养4h。设定空白对照:在不含细胞的培养基中加入CCK-8,测定450nm下的吸光度作为空白对照。
c)酶标仪检测:450nm波长下检测96孔板实验各孔的OD值。细胞活力计算公式为:细胞活力*(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]*100
A(加药):具有细胞、CCK-8溶液和药物溶液的孔的吸光度;
A(空白):具有培养基和CCK-8溶液而没有细胞的孔的吸光度;
A(0加药):具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度。
以细胞抑制率为纵坐标,药物浓度的对数位横坐标,绘制细胞抑制曲线,结果如图1~图8,并用Graphpad 6.0软件计算药物的IC50值(表1)
图1~图8为四种丹参酮类化合物在不同给药浓度下对A549和DT6606细胞株作用24小时的生长抑制情况,结果显示,随着浓度的增加,与相应的对照组比较,人肺癌细胞A549和胰腺癌细胞DT6606的细胞存活率逐渐降低,提示所述四种丹参酮类化合物对肿瘤细胞的增殖抑制作用呈浓度依赖性。
表1四种丹参酮类化合物对不同肿瘤细胞株的IC50值
实验例2
Annexin V/PI双染法评价四种丹参酮类化合物对肺癌细胞A549的凋亡诱导作用
取对数生长期的A549细胞,调整细胞密度为2×104个/孔,接种于24孔板内,每孔1mL,正常培养12h后,弃培养基,分别加入不同浓度(1μM、5μM和10μM)的实施例1.1所制备的四种丹参酮类化合物处理24h,并设置正常对照组,每组设置三个复孔。
弃去培养板中的上清液,用PBS洗涤细胞2次,加入不含EDTA的胰酶消化1min后,用含血清培养基中止,收集细胞于同一离心管,1000rpm离心3min,弃去上清。
加入PBS后,1000rpm离心3min,弃去上清。洗涤两次,加入预先配制好的1×AnnexinV Binding Solution,制成终浓度为1×106个/ml的细胞悬液500μL。取100μL细胞悬液加入到流式管中,向细胞悬液中加入5μL的Annexin V-FITC结合物,再加入5μL的PI solution,室温下避光培养15min后,再加入400μL的1×AnnexinV Binding Solution,待检测。
另设定对照:未染色的细胞,Annexin V-FITC单染色细胞(不进行PI染色),PI单染色细胞(不进行Annexin V-FITC染色)。
最后采用流式细胞仪进行检测,激发波长Ex为488nm,激发波长Em为530nm,Annexin V-FITC的绿色荧光通过FITC通道检测;PI的红色荧光通过PI通道检测,检测应在1h内完成。结果显示(表2):与空白组相比,在所述四种丹参酮化合物作用下的A549细胞各时期的凋亡率均有所增加,且呈现一定的量效依赖关系。各化合物在10μM浓度下的凋亡诱导活性最强,与实验例1所述的CCK-8法测定的细胞增殖抑制实验结果基本一致。
表2四种丹参酮类化合物对人肺癌细胞A549的凋亡诱导作用
实施例1
所述丹参酮类化合物的制备和化学结构鉴定方法
1.1提取与分离
丹参乙酸乙酯部位粗提物2.5kg,加入足量二氯甲烷将其完全溶解,转移至分液漏斗中。向分液漏斗中加入2倍体积的水轻轻混匀后,静置分层,得到二氯甲烷层,转移至圆底烧瓶内,利用旋转蒸发仪浓缩至浸膏状态,得到丹参乙酸乙酯部位提取物。
将丹参乙酸乙酯部位提取物用适量乙酸乙酯溶解,并与4.9kg拌样硅胶(200~300目)拌匀并碾细,待溶剂挥发完毕后,过60目筛后上样。依次采用不同比例的石油醚:乙酸乙酯(20:1,10:1,5:1,1:1)对硅胶柱进行梯度洗脱。
然后采用制备液相对各馏分进行有目标的分离纯化,
高效制备液相系统为Agilent 1100HPLC system;
色谱制备柱为SHIM-PACK PRC-ODS(H)(20mm×25cm,5.0μm);
流动相:
A相为0.02%甲酸-水;
B相为100%乙腈。
起始压力为126bar。
每次进样量为250μL,流速:10mL/min,
检测波长281,254和203nm。
分别于34.681min、40.572min、41.465min、57.264min分别得到化合物1-4。
经溶剂蒸发工作站处理,除去溶剂,回收得到4个活性单体化合物。
1.2结构鉴定方法
将实施例1.1制备所得的4个单体样品分别经高分辨质谱、薄层色谱、核磁共振进行定性分析。其中HPLC-ESI-Q/MS测定每个丹参酮类单体成分的纯度和分子量,Q/TOF-MS确定其分子量并测定其二级碎片离子,确认其结构。1H-NMR和13C-NMR确定其元素组成C、H和O的归属。
高效液相检测条件:高效液相系统为Agilent 1100HPLC system;
分析型色谱柱:Agilent ZorBax SB-C18column(4.6mm×250mm,5μm);
流动相:A相为0.02%甲酸溶液,B相为乙腈;
梯度洗脱程序:
0-5min,25%B;
5-25min,25-45%B;
25-40min,45-50%B;
40-43min,50-55%B;
43-48min,55%B;
48-65min,55-65%B;
65-70min,65-70%B;
70-90min,70-100%B;
90-100min,100%B。流速为0.5mL/min,进样量为2μL,检测波长281nm。
Q/TOF-MS条件:检测器采用Agilent 6530QTOF/MS系统(Agilent Corp,USA),电喷雾离子源(ESI)。
质谱检测条件为:
干燥气流速(N2),9.0L/min;
干燥气体温度,325℃;
nebulizer,45psig;
鞘气温度(sheath gas temperature),400℃;
鞘气流速,10L/min;
毛细管电压,3500V;skimmer,65V;
OCT 1RF Vpp,750V;
碎片电压(fragmentor voltage),120V。
正离子模式为全程监测模式,离子扫描范围设置为m/z 100~1000。样品碰撞能量(collision energy,CE)设定为30V。待测成分的[M+H]+离子(均为基峰)选做母离子用于获取产物离子(碎片离子)。
数据采集及处理分别采用Agilent HPLC-Q/TOF MS MassHunter Acquisition Software Ver.A.01.00(Agilent Technologies)及MassHunter Workstation Software Version B.02.00(Agilent Technologies)分析软件。
1.3结构鉴定结果
化合物1为棕红色针晶,m.p.215~216℃,其最大紫外吸收λmax=240,292,334nm。ESI-MS显示[M+H]+m/z=295.0959,[M+Na]+=m/z 317.0820,[2M+Na]+m/z=613.1740,提示该化合物分子量为296,分子式为C18H14O4。
在1H-NMR(300MHz,CDCl3)谱中,在低场区可以观察到几组芳香氢信号δ:9.29(1H,d,J=8.7Hz,H-1),7.57(1H,dd,J=8.7Hz,H-2),7.39(1H,d,J=6.9Hz,H-3),8.30(1H,d,J=8.7Hz,H-6),7.75(1H,d,J=8.7Hz,H-7)。高场区:4.43(1H,dd,J=6.3Hz,H-15),4.96(1H,t,J=9.6Hz,H-15),3.65(1H,M,H-16),1.41(3H,d,J=6.9Hz,Me-17),2.70(3H,s,Me-18),结合其高分辨质谱二级碎片信息,鉴定此化合物1为异丹参酮ⅡA(IsotanshinoneⅡA)。
化合物2为紫红色针状结晶,m.p.168~170℃,UVλmax=282,291nm。ESI-MS显示[M+H]+m/z=295.0958,[M+Na]+m/z=317.0821,[2M+Na]+m/z=613.1733,提示该化合物的相对分子质量为296,分子式为C18H14O4。1H-NMR(300MHz,CDCl3)δ:H3.29-3.31(2H,t,J=6.4Hz,H-1),1.88-1.92(2H,m,H-2),2.50-2.53(2H,t,J=6.2,H-3),7.90(1H,d,J=8.2Hz,H-6),7.57(1H,d,J=8.2Hz,H-7),7.25(1H,s,H-15),2.20(3H,s,Me-17),5.07(2H,s,H-18),5.50(2H,s,H-18)。据此,鉴定化合物2为小红参醌甲(Trijuganone A)。
化合物3为橘红色针状结晶,m.p.206~208℃,UVλmax=224,266(sh),288。ESI-MS显示[M+H]+m/z=313.1426,[M+Na]+m/z=335.2997,[2M+Na]+m/z=649.1952.提示该化合物相对分子质量为314,分子式为C19H20O4。
在1H-NMR谱中,在低场区可以观察到几组芳香氢信号:δH 8.91(1H,d,J=8.1Hz,H-1),7.61(1H,dd,J=8.1,7.5,H-2),6.92(1H,d,J=7.5Hz,H-3),8.42(1H,d,J=7.8Hz,H-6)和7.95(1H,d,J=7.8Hz,H-7)。3.60-3.48(2H,m)提示分子中含有一个连氧的CH2基团存在。δH 1.04(3H,d,H-17)表明分子中存在着一个连有叔碳的甲基基团,其耦合常数J=6.8Hz。δH2.60(3H,s,H-18)提示可能为一个连有芳香环甲基氢信号。结合相应的质谱信息,鉴定化合物3为Miltionone I。
化合物4为红色针状结晶,m.p.222~223℃,ESI-MS显示[M+H]+m/z=281.1542,[M+Na]+=303.0871,[2M+Na]+为m/z 585.1839,提示该化合物相对分子质量为282,分子式为C19H20O2。
在1H-NMR谱中,在低场区可以观察到:δH 7.90(1H,d,J=7.8Hz,H-6)和7.62(1H,d,J=7.8Hz,H-7)为一组邻位芳香氢信号,7.41(1H,s,H-16)为一个不饱和碳上的质子信号。3.81(1H,d,J=10.5Hz)和3.74(1H,d,J=10.5Hz)提示分子中有一个连氧CH2存在。δH 2.24(3H,s,H-17)表明分子中存在一个甲基氢信号。故将化合物4鉴定为1-Ketoiso-cryptotanshinone。
实施例2
本发明涉及一种组合物,由如下组分组成:丹参酮ⅡA(1mg)、聚维酮(140mg)、乙基纤维素(40mg)、乳糖(50mg)、羧甲基淀粉钠(20mg)、硬脂酸镁(5mg)
其制备方法包括如下步骤:
制备工艺:将主药和除硬脂酸镁之外的辅料混合均匀,以80%乙醇制软材,200目制粒,60℃干燥,加入硬脂酸镁,压片。
实施例3
本发明涉及一种组合物,由如下组分组成:小红参醌甲(1mg)、聚维酮(140mg)、乙基纤维素(40mg)、乳糖(50mg)、羧甲基淀粉钠(20mg)、硬脂酸镁(5mg)
其制备方法包括如下步骤:
制备工艺:将主药和除硬脂酸镁之外的辅料混合均匀,以80%乙醇制软材,200目制粒,60℃干燥,加入硬脂酸镁,压片。
实施例4
本发明涉及一种组合物,由如下组分组成:3miltionone I(1mg)、聚维酮(140mg)、乙基纤维素(40mg)、乳糖(50mg)、羧甲基淀粉钠(20mg)、硬脂酸镁(5mg)
其制备方法包括如下步骤:
制备工艺:将主药和除硬脂酸镁之外的辅料混合均匀,以80%乙醇制软材,200目制粒,60℃干燥,加入硬脂酸镁,压片。
实施例5
本发明涉及一种组合物,由如下组分组成:1-Ketoiso-cryptotanshinone(1mg)、聚维酮(140mg)、乙基纤维素(40mg)、乳糖(50mg)、羧甲基淀粉钠(20mg)、硬脂酸镁(5mg)
其制备方法包括如下步骤:
制备工艺:将主药和除硬脂酸镁之外的辅料混合均匀,以80%乙醇制软材,200目制粒,60℃干燥,加入硬脂酸镁,压片。
实施例6
本发明涉及一种组合物,由如下化合物之一和含1%DMSO的无血清无双抗的DMEM培养基组成,化合物浓度为10μM:
异丹参酮ⅡA(IsotanshinoneⅡA)、
小红参醌甲(Trijuganone A)、
3miltionone I、
1-Ketoiso-cryptotanshinone。
申请人通过大量的试验筛选,本发明的化合物具有抗肿瘤活性高、抗肿瘤谱广,并且毒性低的特点,可作为理想的抗肿瘤药物。
- 还没有人留言评论。精彩留言会获得点赞!