绿原酸及其衍生物在制备肿瘤免疫治疗药物的增敏剂中的用途的制作方法
本发明涉及绿原酸及其衍生物在制备肿瘤免疫治疗药物的增敏剂中的用途,属于医药领域。
背景技术:
恶性肿瘤是严重危害人类健康的重大疾病,患者往往承受巨大的生理和心理痛苦。目前,恶性肿瘤的治疗手段主要包括手术治疗、放疗、化疗和免疫治疗。其中,肿瘤免疫治疗是通过调动机体的免疫系统,增强抗肿瘤免疫力,从而抑制和杀伤肿瘤细胞。当前,肿瘤免疫治疗是肿瘤治疗领域中最具前景的研究方向之一。
程序性死亡受体PD-1(programmed cell death-1)是一种重要的免疫抑制分子,主要在激活的T细胞和B细胞中表达。肿瘤细胞中高表达PD-1的配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路持续激活。PD-1/PD-L1抑制剂可以阻断PD-1与PD-L1、PD-L2的结合,阻断负向调控信号,使T细胞恢复活性,从而增强免疫应答。近期研究发现PD-1/PD-L1的抑制剂在多种肿瘤类型中疗效显著:Opdivo(Nivolumab)为人IgG4单抗,与PD-1受体结合并阻断其与PD-L1、PD-L2的相互作用,从而解除PD-1通路介导的抗肿瘤免疫应答的抑制,其适应证包括黑色素瘤、非小细胞肺癌、肾细胞癌等;Tecentriq(Atezolizumab)为合成的IgG抗PD-L1抗体,临床研究表明,其对非小细胞肺癌、膀胱癌具有显著的治疗作用。
然而,肿瘤的免疫治疗药物,尤其是以PD-1/PD-L1单克隆抗体为代表的免疫哨卡抑制剂在长期的使用过程中,会发生“无响应”或“耐药”的情况,表明许多肿瘤在单独使用抗PD-1单克隆抗体是难以奏效的。因此,亟需开发这类药物的增敏剂,以提高其治疗肿瘤的效果。
技术实现要素:
本发明的目的在于提供绿原酸及其衍生物在制备肿瘤免疫治疗药物的增敏剂中的用途。
式Ⅰ所示化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其晶型、或其同位素体在制备肿瘤免疫治疗药物的增敏剂中的用途:
其中,R1~R3独立选自羟基、C1~C6烷氧基、式Ⅱ所示的取代基或其顺式异构体:
其中,R4、R5独立选自氢、卤素、C1~C6烷基、羟基或C1~C6烷氧基。
进一步地,R1~R3至少一个为式Ⅱ所示的取代基或其顺式异构体。
进一步地,R4、R5独立选自羟基或C1~C3烷氧基。
进一步地,R4、R5独立选自羟基或甲氧基。
进一步地,R4、R5至少一个为羟基。
进一步地,所述化合物结构如式Ⅲ:
进一步地,所述化合物选自:
进一步地,所述的肿瘤免疫治疗药物为PD-1抑制剂和/或PD-L1抑制剂。
进一步地,所述的肿瘤免疫治疗药物为提高IFNγCD8+T淋巴细胞、TNFαCD8+T淋巴细胞、CD8+T淋巴细胞、CD3+T淋巴细胞中一种或几种淋巴细胞数量的药物。
进一步地,所述的肿瘤免疫治疗药物为Opdivo或Tecentriq。
进一步地,所述的肿瘤免疫治疗药物为治疗黑色素瘤、肺癌、肝癌、肾癌、胶质瘤、前列腺癌、胃癌、膀胱癌、结肠癌、乳腺癌、卵巢癌或宫颈癌的药物。
进一步地,所述的增敏剂是以式Ⅰ化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其晶型、或其同位素体为活性成分,加入辅料或者辅助性成分制备而成的制剂。
进一步地,所述的制剂为口服制剂或注射制剂。
进一步地,所述的制剂为胶囊剂或粉针剂。
本发明提供了一种治疗肿瘤的联合用药物,它含有相同或不同规格单位制剂的用于同时或者分别给药的肿瘤免疫治疗药物和增敏剂,以及药学上可接受的载体;其中,所述的增敏剂是以式Ⅰ化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其晶型、或其同位素体为活性成分,加入辅料或者辅助性成分制备而成的制剂。
本发明中,术语“立体异构体”包括立体中心(例如带有4个不同取代基的碳)、轴不对称例如有关键、平面不对称及其混合物的存在。
所述“同位素体”是指其中天然同位素丰度的至少一个原子被不同于天然丰度的同位素富集形式置换的化合物的任何形式。同位素体可以氢置换为氘和/或氚为基础。同样地,天然丰度的12C可被13C或14C置换、天然丰度的14N可被15N置换,天然丰度的16O被17O或18O置换等或任何组合。同位素体可包括化合物内的任何数目的原子被同位素富集形式置换。可实现同位素富集到任何程度。
本发明提供了绿原酸及其衍生物在制备肿瘤免疫治疗药物的增敏剂中的用途。药效实验结果表明,虽然本发明绿原酸及其衍生物本身并无增加CD3+和CD8+T细胞数量,以及提高IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞百分比的作用,但其与肿瘤免疫治疗药物联合使用时,却能显著提高肿瘤浸润组织中IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞的百分比,并对主要效应细胞CD3+和CD8+T淋巴细胞发挥促进增殖作用,从而更好地发挥杀伤肿瘤细胞的作用,作为肿瘤免疫治疗药物的增敏剂具有广阔的临床应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1为实验例1各组小鼠的肿瘤体积图;
图2为实验例1各组小鼠肿瘤浸润组织中IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞的百分比图;
图3为实验例2肺癌小鼠的平均生存期图;
图4为实验例2肾癌小鼠的平均生存期图;
图5为实验例2脑胶质瘤小鼠的平均生存期图;
图6为实验例3中CD3+T淋巴细胞绝对数量统计结果图;
图7为实验例3中CD8+T淋巴细胞绝对数量统计结果图;
图8为实验例4中CD3+T淋巴细胞绝对数量统计结果图;
图9为实验例4中CD8+T淋巴细胞绝对数量统计结果图;
图10为实验例5中CD3+T淋巴细胞绝对数量统计结果图;
图11为实验例5中CD8+T淋巴细胞绝对数量统计结果图;
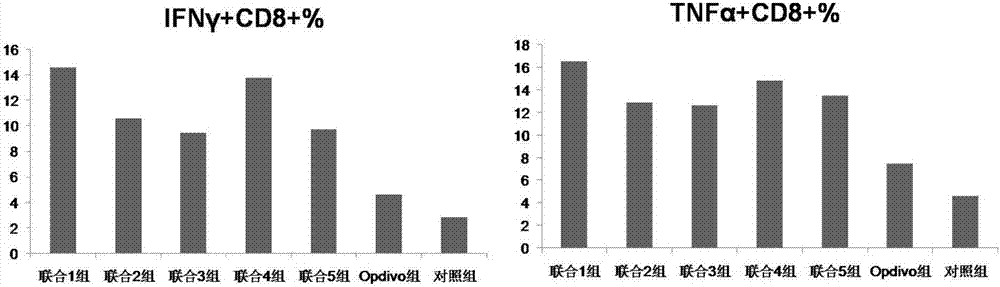
图12为实验例5小鼠肿瘤浸润组织中IFNγCD8+T淋巴细胞百分比图;
图13为实验例5小鼠肿瘤浸润组织TNFαCD8+T淋巴细胞百分比图。
具体实施方式
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
实施例1绿原酸及其衍生物的制备
绿原酸的制备方法见专利ZL2005100207065实施例1,由四川九章生物科技有限公司自主合成;新绿原酸和隐绿原酸均购自成都贝斯特试剂有限公司;3-O-阿魏酰奎尼酸和3-O-异阿魏酰奎尼酸的制备:使用四川九章生物科技有限公司提供的绿原酸原料药,合成3-O-阿魏酰奎尼酸及其异构体3-O-异阿魏酰奎尼酸,合成样品经开放ODS柱粗分后,用半制备液相纯化,检测纯度分别为96.1%、99.3%。
1.仪器与材料
1.1仪器设备
线性离子阱-傅里叶离子回旋共振质谱仪(Thermo Scientific LTQ FT),美国Thermo Scientific公司产品,配有电喷雾离子源(ESI),Thermo Scientific plus HPLC系统(包括MS泵,自动进样器和光电二极管阵列检测器(PAD),Xcalibur2.0SR2数据处理系统;FINNIGAN SURVEYOR PLUS HPLC系统(配有PAD检测器,自动进样器,液相色谱泵);Sigma 3K-15高速离心机;水浴摇床,盛世中方生物公司产品;VORTEX-2涡旋仪,GENIE公司产品;ODS开放柱(1.5×40cm);Model BT600蠕动泵,PreFluid公司产品;LC-6AD半制备液相仪,岛津公司产品。
1.2试剂材料
甲醇,色谱级和分析级,分别为Honeywell公司产品和北京化工厂产品。甲酸,分析纯,Fisher公司产品。硫酸二甲酯,沈阳化学制剂厂产品。三乙胺,Fisher公司产品。氢氧化钠,北京化工厂产品。去离子水,杭州娃哈哈集团公司产品。
2.合成反应
2.1合成反应
总投料200mg绿原酸原料药,每份10mg,平行做20份。称取10mg绿原酸原料药于15mL EP管中,加入1.7mL水溶解,再加入0.3mmol/L氢氧化钠溶液850μL,涡旋30s,加入相转移催化剂四丁基溴化铵1mg,涡旋30s。而后加入170μL硫酸二甲酯,涡旋30s,置于 37℃水浴 15min。最后加入170μL三乙胺,涡旋30s。取反应后的溶液20μL,加水稀释到200μL,13000rpm离心10min,取上清液进HPLC分析,进样量20μL。
2.2萃取处理
向合成反应后的EP管中按1:3体积比加入乙醚,大功率涡旋3min,4500rpm离心10min。将上层乙醚层弃去,合并下层水相于一新的EP管中,置于冻干机中冻干。取水相合并后的溶液20μL,加水稀释到200μL,13000rpm离心10min,取上清液进HPLC分析,进样量20μL。
2.3色谱条件
色谱柱:Waters Symmetry C18(5μm,4.6×250mm)
流动相A:0.1%甲酸水
流动相B:甲醇
洗脱条件:0-40min,25%B
流速:0.9mL/min
柱温:30℃
进样盘温度:10℃
3.ODS开放柱粗分
3.1样品的制备
取出2.2中冻干的样品,加3mL 0.01%甲酸-水溶解,13000rpm离心10min,取上清液上样。
3.2 ODS柱分离
ODS柱填料量为60g。依次用200mL甲醇平衡,200mL0.01%-甲酸水活化。之后采用0.01%甲酸水、10%、20%、30%、40%、60%、100%甲醇洗脱。不同比例甲醇洗脱液也用0.01%甲酸水溶液配制,采用蠕动泵加压。每200mL收集一份洗脱液。每份洗脱溶液取1mL氮气吹干,100μL甲醇复溶,再稀释10倍,进HPLC分析,进样量20μL,色谱条件同2.3。剩余洗脱液分别旋蒸置适量体积,冻干,保存于-80℃冰箱。
4.半制备液相纯化
4.1样品的制备
取出3.2中冻干得到的40%甲醇馏分,加1.5mL水溶解,涡旋30s,13000rpm离心10min,取上清液备用。
4.2半制备液相分离条件
色谱柱:Agilent XDB-C18(5μm,9.4×250mm)
流动相A:0.1%甲酸水
流动相B:甲醇
洗脱条件:0-35min,25%B;35-40min,100%B;40-45min,25%B
流速:5mL/min
进样量:20μL
4.3产物的收集
于20.5-21.5min时间段,收集到化合物A,于 27.0-28.5min时间段,收集到化合物B,采集的溶液分别于37℃旋蒸至适量液体,置于冻干机中冻干,得到A和B两种化合物的纯品。
5.A和B化合物的结构鉴定
借助核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)、异核单量子相干谱(HSQC)、异核多建相关谱(HMBC),鉴定了合成的A和B化合物的结构式。
6.实验结果
6.1合成反应
合成反应结果显示,反应产物中含有绿原酸、A化合物、B化合物及其它杂质。HPLC谱图见图1、图2。
6.2 ODS柱分离
ODS柱分离结果显示,A和B两种化合物在40%甲醇馏分段含量最高,故用来进行下一步的纯化。HPLC谱图见图3。
6.3半制备液相分离
A和B两种化合物在半制备液相上分离良好,便于收集。制备得到A化合物约5mg,B化合物约10mg。HPLC谱图见图4。
6.4结构鉴定
①A化合物的结构鉴定
表1 A化合物核磁数据及解析
由1H-NMR可见,A化合物的δ3.836为甲氧基上三个质子产生的信号。δ7.566,δ6.298为反式双键上两个质子H-7',H-8'裂分产生的双峰。δ7.136,δ6.761,δ7.031分别为苯环上三个质子H-2',H-5',H-6'产生的信号,其中H-6'与H-2'偶合,使H-2'裂分为双峰。H-6'还与H-5'偶合,使H-5'裂分为双峰。H-6'自身裂分为两个双峰。六元环上质子都裂分为多重峰。
由13C-NMR可见,A化合物的δ56.46为甲氧基上碳原子产生的信号。δ177.08,δ168.66出现在低场,为结构中两个羰基碳原子C-7,C-9'产生的信号。δ147.00,δ115.57为反式双键上两个碳原子C-7',C-8'产生的信号。δ127.76,δ111.76,δ149.35,δ150.56,δ116.46,δ124.13为苯环上碳原子产生的信号。δ76.08,δ38.17,δ72.01,δ73.36,δ71.18,δ38.66为六元环上碳原子产生的信号。
由HSQC可见,δ127.76,δ111.76,δ149.35,δ150.56,δ116.46,δ124.13分别为苯环上碳原子C-1',C-2',C-3',C-4',C-5',C-6'产生的信号。δ76.08,δ38.66,δ71.18,δ73.36,,δ72.01,δ38.17分别为六元环上碳原子C-1,C-2,C-3,C-4,C-5,C-6产生的信号。δ2.105,δ2.255,δ4.116,δ3.681,δ5.272,δ2.037,δ2.205分别为H-2a,H-2e,H-3,H-4,H-5,H-6a,H-6e产生的信号。
由HMBC可见,甲氧基上质子(H-10',δ3.836)与3'位碳原子(C-3',δ149.35)远程相关。并且C-3'与H-2'(δ7.136)和H-5'(δ6.761)远程相关。C-3'与H-6'(7.031)无远程相关,综上所述甲基化发生在苯环的C-3'位置。②B化合物的结构鉴定
表2 B化合物的核磁数据及解析
由1H-NMR可见,B化合物的δ3.831为甲氧基上三个质子产生的信号。δ7.526,δ6.258为反式双键上两个质子H-7',H-8'裂分产生的双峰。δ7.028,δ6.889,δ7.007分别为苯环上三个质子H-2',H-5',H-6'产生的信号,其中H-6'与H-2'偶合,使H-2'裂分为双峰。H-6'还与H-5'偶合,使H-5'裂分为双峰。H-6'自身裂分为两个双峰。六元环上质子都裂分为多重峰。
由13C-NMR可见,B化合物的δ56.38为甲氧基上碳原子产生的信号。δ176.99,δ168.45出现在低场,为结构中两个羰基碳原子C-7,C-9'产生的信号。δ146.66,δ114.77为反式双键上两个碳原子C-7',C-8'产生的信号。δ128.93,δ112.49,δ147.98,δ151.50,δ116.29,δ122.84为苯环上碳原子产生的信号。δ76.11,δ38.20,δ72.04,δ73.41,δ71.25,δ38.73为六元环上碳原子产生的信号。
由HSQC可见,δ128.93,δ122.84,δ147.98,δ151.50,δ116.29,δ112.49,分别为苯环上碳原子C-1',C-2',C-3',C-4',C-5',C-6'产生的信号。δ76.11,δ38.73,δ71.25,δ73.41,δ72.04,δ38.20分别为六元环上碳原子C-1,C-2,C-3,C-4,C-5,C-6产生的信号。δ2.096,δ2.250,δ4.111,δ3.669,δ5.274,δ2.031,δ2.200分别为H-2a,H-2e,H-3,H-4,H-5,H-6a,H-6e产生的信号。
由HMBC可见,甲氧基上质子(H-10',δ3.831)与4'位碳原子(C-4',δ151.50)远程相关。并且C-4'与H-2'(δ7.136),H-5'(δ6.761)和H-6'(7.031)远程相关,综上所述甲基化发生在苯环的C-4'位置。
实施例2绿原酸及其衍生物胶囊剂的制备
1.处方
表3本发明绿原酸及其衍生物胶囊剂的处方
2.制法
按上述处方量,分别将主药与壳聚糖混合后溶解于体积浓度为3%的乙酸溶液中得到各化合物的壳聚糖溶液,待用;按处方量将司盘80加入分别加入大豆油中,搅拌均匀后得到混合液,待用;将配制的5份壳聚糖溶液缓慢地滴加到混合液中,不断搅拌得到W/O型乳剂;随即向W/O型乳剂中滴加1mL质量浓度为25%的戊二醛,静置并固化交联2h后,去掉油相并采用加有0.45μm微孔滤膜的布氏漏斗抽滤,并用石油醚洗去微球表面的油相、用质量浓度为2%的亚硫酸氢钠溶液洗去未交联的戊二醛,再利用丙酮脱水并真空干燥2d后,得到各处方条件下各化合物的壳聚糖微球。将所得壳聚糖微球封存于0号胶囊壳中,即得绿原酸壳聚糖微球胶囊剂。
实施例3绿原酸及其衍生物冻干粉针剂的制备
1.处方
表4绿原酸及其衍生物冻干粉针剂的处方
2.制法
在严格无菌的条件下,称取上述各处方量的壳聚糖10g,用体积浓度为3%的乙酸溶液溶解形成壳聚糖溶液,并按处方量称取主药分别溶解于上述壳聚糖溶液中,形成各主药的壳聚糖溶液,将溶解后的溶液静置一段时间并待气泡被除去后进行喷雾干燥,即得到流动性较好的壳聚糖微球,将得到的各绿原酸及类似物的壳聚糖微球灌装成粉针剂,即得相应的冻干粉针剂。
以下通过药效实验证明本发明的有益效果。
实验例1绿原酸及其衍生物对PD-1单抗抗肿瘤药效的增敏作用
Opdivo(Nivolumab)是一种PD-1单克隆抗体,是抗肿瘤免疫治疗药物的典型代表。前期的研究结果显示这一类PD-1单克隆抗体发挥抗肿瘤作用的主要原因是可以有效的上调机体内CD8+T淋巴细胞,促进IFNγ和TNF等因子的分泌,最终实现对肿瘤细胞的杀伤,达到抗肿瘤的作用。PD-1单抗在使用过程中存在耐药或响应率低的问题,如何增加机体对PD-1的响应,持续的上调IFNγ+CD8+T和TNFα+CD8+T淋巴细胞的比例,进而提高PD-1的药效,对其临床应用具有极其重要的作用。本实验例采用PD-1单抗中的代表药物Opdivo作为对照,考察绿原酸及衍生物联合Opdivo治疗对药效和免疫细胞等方面的影响。
1.实验动物和材料
6-8周龄的雄性C57小鼠,体重18-22g;Opdivo(Nivolumab);绿原酸(纯度98%),隐绿原酸(纯度≥98%),新绿原酸(纯度≥98%),3-O-阿魏酰奎尼酸(纯度97%)和3-O-异阿魏酰奎尼酸(纯度97%);B16F10高转移黑色素瘤细胞。
2.实验方法
2.1实验分组与造模
选用小鼠B16F10高转移黑色素瘤细胞系,皮下接种C57小鼠,形成小鼠黑色素异位瘤模型。肿瘤接种6天左右,选肿瘤直径达5mm左右的造模成功的小鼠,随机的分为7组,分别为绿原酸联合Opdivo治疗组、隐绿原酸联合Opdivo治疗组、新绿原酸联合Opdivo治疗组、3-O-阿魏酰奎尼酸联合Opdivo治疗组和3-O-异阿魏酰奎尼酸联合Opdivo治疗组、Opdivo单独治疗组和阴性对照组,依次命名为联合1组、联合2组、联合3组、联合4组、联合5组、Opdivo组和对照组,每组6只小鼠。联合治疗组,每天分别腹腔注射绿原酸及衍生物,每周(7天)腹腔注射Opdivo一次;Opdivo单独治疗组,仅每周腹腔注射一次Opdivo;每组小鼠注射opdivo剂量统一为10mg/kg对照组则正常常规饲养,实验持续6周。具体给药方案如下所示:
表5给药方案
2.2绿原酸及衍生物联合Opdivo治疗对荷瘤小鼠的瘤体积及免疫因子的影响考察
实验过程中,每周测量一次肿瘤大小并记录,结果如图1所示。到实验结束时,处死小鼠,取其肿瘤组织,采用流式细胞内染色的方法,分析肿瘤浸润细胞毒性CD8+T淋巴细胞产生IFNγ和TNFα的能力,结果如图2所示。
3.实验结果
3.1绿原酸及衍生物联合PD-1单抗Opdivo治疗黑色素瘤的药效
图1显示:与Opdivo单独治疗组相比,联合组小鼠的肿瘤体积均显著降低,表明绿原酸及其衍生物能增强Opdivo的药效。其中,绿原酸及3-O-阿魏酰奎尼酸的增强作用最为明显(联合1组和联合4组)。
3.2绿原酸及衍生物联合PD-1单抗Opdivo治疗对小鼠外周血中T淋巴细胞亚群的影响
图2显示,联合治疗组小鼠肿瘤浸润组织中IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞的百分比均显著升高,该作用与对应组的抑瘤结果相一致。
综上,绿原酸及其衍生物能够提高PD-1单抗治疗肿瘤的药效,并对PD-1单抗的主要效应细胞CD8+T淋巴细胞发挥促进增殖作用,从而更好地发挥杀伤肿瘤细胞的作用。以上结果表明,本发明绿原酸及其衍生物对PD-1单抗治疗肿瘤具有增敏作用。
实验例2绿原酸及其衍生物对PD-L1单抗抗肿瘤药效的增敏作用
生存期是衡量抗肿瘤药治疗效果的重要指标,本实验通过观察和记录不同给药方式下各组小鼠的生存期长短,进而评价各种给药方式的药效。
1.实验动物和材料
6-8周龄的雄性C57小鼠,体重18-22g;Tecentriq(atezolizumab);绿原酸(纯度98%),隐绿原酸(纯度≥98%),新绿原酸(纯度≥98%),3-O-阿魏酰奎尼酸(纯度97%)和3-O-异阿魏酰奎尼酸(纯度97%);LLC肺癌细胞系、RenCa肾癌细胞系和G22胶质瘤细胞系。
2.实验方法
2.1实验分组与造模
选用LLC肺癌细胞系、RenCa肾癌细胞系和G22胶质瘤细胞系,皮下接种C57小鼠,分别形成小鼠肺癌、肾癌、胶质瘤异位瘤模型。肿瘤接种一周左右,选肿瘤直径达5mm左右的造模成功的小鼠,随机的分为7组,分别为绿原酸联合Tecentriq治疗组、隐绿原酸联合Tecentriq治疗组、新绿原酸联合Tecentriq治疗组、3-O-阿魏酰奎尼酸联合Tecentriq治疗组和3-O-异阿魏酰奎尼酸联合Tecentriq治疗组、Tecentriq单独治疗组和阴性对照组,分别命名为联合1组、联合2组、联合3组、联合4组、联合5组、Tecentriq组和对照组,每组6只小鼠。联合治疗组,每天分别腹腔注射绿原酸及衍生物,每5天腹腔注射Tecentriq一次;Tecentriq单独治疗组,仅每5天腹腔注射一次Tecentriq;每组小鼠注射Tecentriq剂量统一为15mg/kg,对照组则正常常规饲养,不做任何干预,实验共给药10次,预计持续观察60天。具体给药方案如下所示:
表6给药方案
3.实验结果
3.1绿原酸及衍生物联合PD-L1单抗Tecentriq治疗肺癌、肾癌和恶性脑胶质瘤的抗肿瘤效应
根据实际情况,记录每一组小鼠的生存期,绘制各组实验小鼠的平均生存时间柱形图,结果如图3~5所示。
实验结果表明,相比对照组,各治疗组小鼠的生存期得到明显的提高,在各种肿瘤小鼠模型中,绿原酸与Tecentriq联合1组和3-O-阿魏酰奎尼酸与Tecentriq联合4组相较其它各组,小鼠的平均生存时间有特别明显的延长,而其余各联合组与Tecentriq单独治疗组相比,小鼠的平均生存时间也有了明显的延长。
以上结果证明,本发明绿原酸及其衍生物能有效增加肺癌、肾癌和脑胶质瘤小鼠对PD-L1单抗的敏感性,进而延长其生存期。
实验例3绿原酸及其衍生物联合PD-1单抗对小鼠肝癌模型免疫细胞亚群的调节作用
PD-1单克隆抗体发挥作用主要是能诱导机体产生系统性的免疫应答,这与其后续的抗肿瘤治疗效果呈正相关。为了验证绿原酸及其衍生物联合PD-1单克隆抗体治疗,是否可以诱导小鼠增强免疫应答,本实验通过测定各治疗组小鼠脾脏中CD3+和CD8+T淋巴细胞的绝对数量,来考察本发明绿原酸及其衍生物对PD-1单抗的增敏作用。
1.实验动物和材料
6-8周龄的雄性C57小鼠,体重18-22g;PD-1单抗(科研用PD-1单抗,购于上海田源生物科技有限公司);绿原酸(纯度98%),隐绿原酸(纯度≥98%),新绿原酸(纯度≥98%),3-O-阿魏酰奎尼酸(纯度97%)和3-O-异阿魏酰奎尼酸(纯度97%);HepG2细胞系。
2.实验方法
2.1造模与生物样本的收集
本实验中,先通过腹腔注射的方式,分别向C57小鼠移植3×106HepG2肝癌细胞,各注射25只,然后在6天后再小鼠腹腔中注射抗PD-1单抗、绿原酸与抗PD-1单抗、隐绿原酸与抗PD-1单抗、新原酸与抗PD-1单抗、3-O-阿魏酰奎尼酸与抗PD-1单抗和3-O-异阿魏酰奎尼酸与抗PD-1单抗,联合治疗组,每天分别小鼠腹腔注射绿原酸及衍生物联合PD-1单抗,PD-1单独治疗组,每天腹腔注射一次PD-1单抗,各组PD-1单抗注射剂量统一为10mg/kg,对照组则注射同等体积生理盐水。各组分别命名为PD-1单抗组,联合1组、联合2组、联合3组、联合4组、联合5组和对照组,具体的分组和给药方案如表7所示。各组小鼠在注射完药物的第14天被处死,并收集脾细胞,利用流式细胞仪对其中免疫细胞亚群进行检测。
表7给药方案
3.实验结果
本实验通过流式细胞术,分析经过不同给药方式处理的小鼠脾细胞中淋巴细胞各亚群的绝对数量,结果见图6、7。
实验结果显示,绿原酸及其衍生物联合PD-1单抗组的小鼠,相比于单独使用PD-1单抗组的小鼠,其脾中CD3+和CD8+T细胞的绝对数量显著增加,说明绿原酸及其衍生物能增加小鼠对PD-1单抗的应答,促进其发挥作用的主要因素——CD3+和CD8+T细胞的增殖。
实验例4绿原酸及其衍生物联合PD-L1单抗对前列腺癌小鼠模型免疫细胞亚群的调节作用
PD-L1单克隆抗体发挥作用主要是能诱导机体产生系统性的免疫应答,这与其后续的抗肿瘤治疗效果呈正相关。为了验证绿原酸及其衍生物联合PD-L1单克隆抗体治疗,是否可以诱导小鼠增强免疫应答,本实验通过测定各治疗组小鼠脾脏中CD3+和CD8+T淋巴细胞的比例和绝对数量,来判断绿原酸及其衍生物对PD-L1单抗的增敏作用。
1.实验动物和材料
6-8周龄的雄性C57小鼠,体重18-22g;PD-L1单抗(科研用PD-1单抗,购于上海田源生物科技有限公司);绿原酸(纯度98%),隐绿原酸(纯度≥98%),新绿原酸(纯度≥98%),3-O-阿魏酰奎尼酸(纯度97%)和3-O-异阿魏酰奎尼酸(纯度97%);小鼠RM-1细胞。
2.实验方法
2.1造模与生物样本的收集
本实验中,先通过腹腔注射的方式,分别向C57小鼠移植3×105RM-1前列腺癌细胞,各注射25只,然后在6天后再小鼠腹腔中注射抗PD-L1单抗、绿原酸与抗PD-1单抗、隐绿原酸与抗PD-1单抗、新原酸与抗PD-L1单抗、3-O-阿魏酰奎尼酸与抗PD-1单抗和3-O-异阿魏酰奎尼酸与抗PD-L1单抗,联合治疗组,每天分别小鼠腹腔注射绿原酸及衍生物联合PD-L1单抗,PD-L1单独治疗组,每天腹腔注射一次PD-L1单抗,各组PD-L1单抗注射剂量统一为12mg/kg,对照组则注射同等体积生理盐水。各组分别命名为PD-L1单抗组,联合1组、联合2组、联合3组、联合4组、联合5组和对照组,具体的分组和给药方案如表8所示。各组小鼠在注射完药物的第14天被处死,并收集脾细胞,利用流式细胞仪对其中免疫细胞亚群进行检测。
表8给药方案
3.实验结果
本实验通过流式细胞术,分析经过不同给药方式处理的小鼠脾细胞中淋巴细胞各亚群的绝对数量,结果见图8、9。
实验结果显示,绿原酸及其衍生物联合PD-L1单抗组的小鼠,相比于单独使用PD-L1单抗组的小鼠,其脾中CD3+和CD8+T细胞的绝对数量显著增加,说明绿原酸及其衍生物能增加小鼠对PD-L1单抗的应答,促进其发挥作用的主要因素——CD3+和CD8+T细胞的增殖。
实验例5绿原酸及其衍生物对恶性肿瘤小鼠模型中T淋巴细胞亚群的影响
本实验例作为对照实验,考察单独使用绿原酸及其衍生物对恶性肿瘤小鼠模型中T淋巴细胞亚群的影响。
1.实验动物和材料
6-8周龄的雄性C57小鼠,体重18-22g;绿原酸(纯度98%),隐绿原酸(纯度≥98%),新绿原酸(纯度≥98%),3-O-阿魏酰奎尼酸(纯度97%)和3-O-异阿魏酰奎尼酸(纯度97%);LLC肺癌细胞系和B16黑色素瘤细胞系。
2.实验方法
2.1实验分组与造模
选用LLC肺癌细胞系和B16黑色素瘤细胞系,皮下接种C57小鼠,分别形成小鼠肺癌和黑色素瘤模型。肿瘤接种6天左右,选肿瘤直径达5mm左右的造模成功的小鼠,随机的分为6组,分别为绿原酸治疗组、隐绿原酸治疗组、新绿原酸治疗组、3-O-阿魏酰奎尼酸治疗组和3-O-异阿魏酰奎尼酸治疗组和阴性对照组,依次命名为1组、2组、3组、4组、5组和对照组,每组6只小鼠。具体给药方案如表9所示。实验持续14天后处死小鼠,并收集脾细胞,利用流式细胞仪对其中免疫细胞亚群进行检测,同时,收集各组小鼠的肿瘤组织,采用流式细胞内染色的方法,分析肿瘤浸润细胞毒性CD8+T淋巴细胞产生IFNγ和TNFα的能力,结果如图10~13所示。
表9给药方案
3.实验结果
图10、11显示,单独使用绿原酸及其衍生物对恶性肿瘤小鼠进行治疗,相比于阴性对照组小鼠,其脾脏中CD3+和CD8+T细胞的绝对数量未表现出显著增加,说明绿原酸及其衍生物单独使用并不能增强免疫细胞杀伤性作用。
图12、13显示,绿原酸及其衍生物治疗组小鼠肿瘤浸润组织中IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞的百分比也未见明显升高。
综合以上实验结果,虽然本发明绿原酸及其衍生物本身并无增加CD3+和CD8+T细胞数量,以及提高IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞百分比的作用,但其与肿瘤免疫治疗药物联合使用时,却能显著提高肿瘤浸润组织中IFNγCD8+T淋巴细胞和TNFαCD8+T淋巴细胞的百分比,并对主要效应细胞CD3+和CD8+T淋巴细胞发挥促进增殖作用,从而更好地发挥杀伤肿瘤细胞的作用,作为肿瘤免疫治疗药物的增敏剂具有广阔的临床应用前景。
- 还没有人留言评论。精彩留言会获得点赞!