抗磷脂酰肌醇蛋白多糖‑3的抗体及其应用的制作方法
本发明涉及肿瘤免疫治疗或诊断领域,更具体地,涉及特异识别磷脂酰肌醇蛋白多糖-3(GPC3)的抗体及其应用。
背景技术:
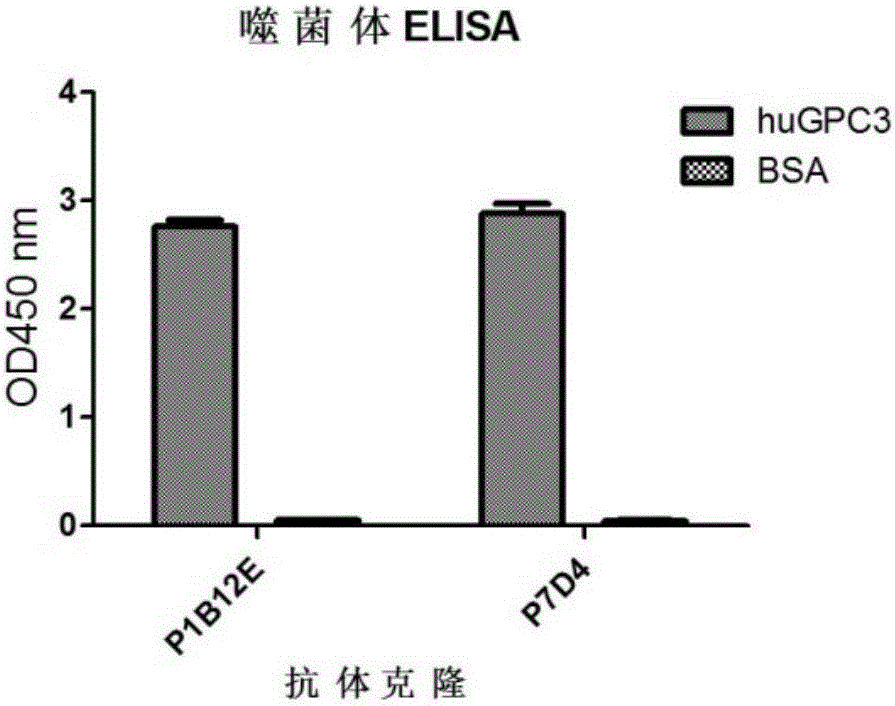
:目前,基于免疫效应细胞的过继性免疫治疗在部分肿瘤中取得了一定的效果,并且该种免疫治疗方法可以克服抗体治疗的上述缺陷,但在大多数肿瘤的疗效仍不能令人满意[GruppSA,etal.Adoptivecellulartherapy.CurrTopMicrobiolImmunol.,2011;344:149-72.]。近年来,根据细胞毒性T淋巴细胞(cytotoxiclymphocyte,CTL)对靶细胞的识别特异性依赖于T淋巴细胞受体(TCellReceptor,TCR)的发现,将针对肿瘤细胞相关抗原的抗体的scFv与T淋巴细胞受体的CD3ζ或FcεRIγ等胞内信号激活基序融合成嵌合抗原受体(Chimericantigenreceptor,CAR),并将其通过如慢病毒感染等方式基因修饰在T淋巴细胞表面。这种CART淋巴细胞能够以主要组织兼容性复合物(MajorHistocompatibilityComplex,MHC)非限制性方式选择性地将T淋巴细胞定向到肿瘤细胞并特异性地杀伤肿瘤。CART淋巴细胞是肿瘤免疫治疗领域的一个新的免疫治疗策略。设计CAR修饰的免疫效应细胞,特别T细胞时,所靶向的抗原基因实际上是一种关键性的选择,鉴于体内基因表达的复杂性以及各种不可控因素,选择到一个合适的用于CAR的基因是非常困难的。并且,很多肿瘤特异性的抗原,很难找到针对其的且适合于构建CAR修饰的免疫效应细胞的特异性分子。磷脂酰肌醇蛋白多糖-3(Glypican-3,GPC3,又称DGSX,GTR2-2,MXR7,OCI-5,SDYS,SGB,SGBS或SGBS1)是一种细胞表面蛋白,属于硫酸乙酰肝素蛋白多糖家族。GPC3基因编码产生70-kDa左右的前体核心蛋白,该前体蛋白能够被弗林蛋白酶(furin)剪切产生40-kDa左右的可溶性的能够进入血液的氨基端(N末端)肽和30-kDa左右含有2个硫酸乙酰肝素(HS)糖链的膜结合的羧基端(C末端)肽。GPC3蛋白通过糖基磷脂酰肌醇(GPI)锚依附在细胞膜上。GPC3高度表达于胎儿肝脏,而不表达于正常成年人的肝组织,但在肝细胞肝癌中恢复表达,与肝癌的发生发展有十分密切的关系,不仅在肝癌发生的早期检出率较高,而且随着肝癌的发展,其检出率也随之增高。而GPC3的表达在肝腺癌,胆管细胞癌,肝转移癌和12种常见实体瘤和21种非肝癌细胞系中均未检测出。此外,GPC3也在例如黑色素瘤,卵巢透明细胞癌、卵黄囊瘤、神经母细胞瘤等肿瘤中表达。考虑到GPC3在肝细胞肝癌,黑色素瘤等肿瘤中特异性的高表达,其被认为是肿瘤免疫治疗的一个候选靶标。虽然,利用抗GPC3抗体进行肝癌检测和利用抗GPC3抗体的抗体依赖的(ADCC)或补体依赖的(CDC)细胞毒性研究方案已有报道,但目前仍没有药用的抗GPC3抗体,仅有中外制药公司在CN200580000807.4公开的GC33抗体在进行一期临床研究,临床应用情况仍有待商榷。另外,抗GPC3抗体不仅可以直接作为治疗性抗体,而且还有望用于诊断、嵌合抗原受体修饰(CAR)的T淋巴细胞等免疫治疗等等。现有研究表明不同的抗体可能会有不同的免疫原性,这种免疫原性会导致抗体或其衍生出来的治疗制剂的疗效及副作用。如基于小鼠抗mesothelin抗体的CART细胞会导致过敏反应,影响其在人体内的长期存活。基于这些考虑,本领域需要进一步优化及制备新的抗GPC3抗体,使其实体瘤的应用中具有良好的肿瘤杀伤活性和极佳的临床应用前景,从而使得GPC3抗体可以切实地被用于肿瘤的诊断和治疗中,惠及广大患者。技术实现要素:本发明的目的在于提供抗磷脂酰肌醇蛋白多糖-3的抗体及其应用。在本发明的第一方面,提供一种特异性识别磷脂酰肌醇蛋白多糖-3(GPC3)的抗体,该抗体具有轻链可变区和重链可变区,且,其轻链可变区的CDR1具有选自下组的氨基酸序列:SEQIDNO:16,SEQIDNO:67,SEQIDNO:69;其轻链可变区的CDR2具有选自下组的氨基酸序列:SEQIDNO:18,SEQIDNO:68,SEQIDNO:70;其轻链可变区的CDR3具有氨基酸序列:SEQIDNO:20;其重链可变区的CDR1具有选自下组的氨基酸序列:SEQIDNO:10,SEQIDNO:60,SEQIDNO:62,SEQIDNO:64;其重链可变区的CDR2具有选自下组的氨基酸序列:SEQIDNO:12,SEQIDNO:61,SEQIDNO:63,SEQIDNO:65,SEQIDNO:66,SEQIDNO:71;其重链可变区的CDR3具有选自下组的氨基酸序列:SEQIDNO:14,SEQIDNO:72。在一个优选例中,所述的抗体包括:抗体(a)(P7D4),其轻链可变区具有SEQIDNO:16所示的CDR1、SEQIDNO:18所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:10所示的CDR1、SEQIDNO:12所示的CDR2、SEQIDNO:14所示的CDR3;抗体(b)(am4),其轻链可变区具有SEQIDNO:16所示的CDR1、SEQIDNO:18所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:60所示的CDR1、SEQIDNO:61所示的CDR2、SEQIDNO:14所示的CDR3;抗体(c)(am14),其轻链可变区具有SEQIDNO:16所示的CDR1、SEQIDNO:18所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:62所示的CDR1、SEQIDNO:63所示的CDR2、SEQIDNO:14所示的CDR3;抗体(d)(am20),其轻链可变区具有SEQIDNO:16所示的CDR1、SEQIDNO:18所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:64所示的CDR1、SEQIDNO:65所示的CDR2、SEQIDNO:14所示的CDR3;抗体(e)(am35),其轻链可变区具有SEQIDNO:67所示的CDR1、SEQIDNO:68所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:10所示的CDR1、SEQIDNO:66所示的CDR2、SEQIDNO:14所示的CDR3;抗体(f)(am42),其轻链可变区具有SEQIDNO:69所示的CDR1、SEQIDNO:70所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:10所示的CDR1、SEQIDNO:66所示的CDR2、SEQIDNO:14所示的CDR3;抗体(g)(T2-23),其轻链可变区具有SEQIDNO:16所示的CDR1、SEQIDNO:70所示的CDR2、SEQIDNO:20所示的CDR3;或其重链可变区具有SEQIDNO:10所示的CDR1、SEQIDNO:71所示的CDR2、SEQIDNO:72所示的CDR3;抗体(h),其识别与(a)~(g)中任一项所述的抗体所识别的抗原决定部位相同的抗原决定部位。在另一优选例中,所述的特异性识别磷脂酰肌醇蛋白多糖-3(GPC3)的抗体可以是:单链抗体(scFV),单克隆抗体,结构域抗体,Fab片段,Fd片段,Fv片段,F(ab’)2片段和其衍生物,或其它形式的抗体;较佳地为单链抗体。在另一优选例中,所述的特异性识别磷脂酰肌醇蛋白多糖-3(GPC3)的抗体是人源化的或全人源的;较佳地为全人源的。在另一优选例中,抗体(a)(P7D4)的重链可变区的氨基酸序列如SEQIDNO:4中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:4中第137-247位所示;抗体(b)(am4)的重链可变区的氨基酸序列如SEQIDNO:25中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:25中第137-247位所示;抗体(c)(am14)的重链可变区的氨基酸序列如SEQIDNO:27中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:27中第137-247位所示;抗体(d)(am20)的重链可变区的氨基酸序列如SEQIDNO:29中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:29中第137-247位示;抗体(e)(am35)的重链可变区的氨基酸序列如SEQIDNO:31中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:31中第137-247位所示;抗体(f)(am42)的重链可变区的氨基酸序列如SEQIDNO:33中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:33中第137-247位所示;或抗体(g)(T2-23)的重链可变区的氨基酸序列如SEQIDNO:35中第1-121位所示;或所述的抗体的轻链可变区的氨基酸序列如SEQIDNO:35中第137-247位所示。在本发明的另一方面,提供一种特异性识别磷脂酰肌醇蛋白多糖-3(GPC3)的抗体,该抗体是人源化的单克隆抗体,含有重链可变区和轻链可变区,其重链可变区包含:SEQIDNO:73所示氨基酸序列的CDR1,SEQIDNO:74所示氨基酸序列的CDR2,SEQIDNO:75所示氨基酸序列的CDR3;或其轻链可变区包含:SEQIDNO:76所示氨基酸序列的CDR1,SEQIDNO:77所示氨基酸序列的CDR2,SEQIDNO:78所示氨基酸序列的CDR3。在一个优选例中,该抗体具有:SEQIDNO:58所示氨基酸序列的重链可变区,或SEQIDNO:59所示氨基酸序列的轻链可变区。在本发明的另一方面,提供编码前面任一所述的抗体的核酸。在本发明的另一方面,提供一种表达载体,其包含所述的核酸。在本发明的另一方面,提供一种宿主细胞,其包含所述的表达载体或基因组中整合有所述的核酸。在本发明的另一方面,提供前面任一所述的抗体的用途,用于制备特异性靶向表达磷脂酰肌醇蛋白多糖-3的肿瘤细胞的靶向性药物,抗体药物偶联物或多功能抗体;或用于制备诊断肿瘤的试剂,该肿瘤表达磷脂酰肌醇蛋白多糖-3;或用于制备嵌合抗原受体修饰的免疫细胞。在本发明的另一方面,提供一种多功能免疫辍合物,所述的多功能免疫辍合物包括:前面任一所述的抗体;以及与之连接(包括共价连接、偶联、附着、吸附)的功能性分子;所述的功能性分子选自:靶向肿瘤表面标志物的分子,抑制肿瘤的分子,靶向免疫细胞的表面标志物的分子或可检测标记物。在一个优选例中,所述的多功能免疫辍合物中,所述的靶向肿瘤表面标志物的分子是结合肿瘤表面标志物的抗体或配体;或所述的抑制肿瘤的分子是抗肿瘤的细胞因子或抗肿瘤的毒素;较佳地,所述的细胞因子包括(但不限于):IL-12、IL-15、IFN-beta、TNF-alpha。在另一优选例中,所述的多功能免疫辍合物中,所述的可检测标记物包括:荧光标记物、显色标记物。在另一优选例中,所述的多功能免疫辍合物中,所述的结合肿瘤表面标志物的抗体是指:识别磷脂酰肌醇蛋白多糖-3以外的其它抗原的抗体,所述的其它抗原包括:EGFR,EGFRvIII,mesothelin,HER2,EphA2,Her3,EpCAM,MUC1,MUC16,CEA,Claudin18.2,叶酸受体,Claudin6,WT1,NY-ESO-1,MAGE3,ASGPR1或CDH16。在另一优选例中,所述的多功能免疫辍合物中,所述的靶向免疫细胞的表面标志物的分子是结合T细胞表面标志物的抗体,其与前面任一所述的抗体形成T细胞参与的双功能抗体(BispecificTcellengager,BiTE)。在另一优选例中,所述的多功能免疫辍合物中,所述的结合免疫细胞表面标志物的抗体是抗CD3抗体。在另一优选例中,所述的抗CD3抗体是单链抗体(scFV),单克隆抗体,Fab片段,Fd片段,Fv片段,F(ab’)2片段和其衍生物,或其它形式的抗体;较佳地为单链抗体。在另一优选例中,所述的抗CD3抗体是人源化的,嵌合的,全人源的或鼠源的。在另一优选例中,所述的多功能免疫辍合物是融合多肽,前面任一所述的抗体以及与之连接的功能性分子之间,还包括连接肽(接头)。在另一优选例中,所述的连接肽的序列为(GlyGlyGlyGlySer)n,其中n为1到5的整数;更佳地,n=3。在另一优选例中,所述的多功能免疫辍合物采用多肽给药或基因给药的方式。在本发明的另一方面,提供编码前面任一所述的多功能免疫辍合物的核酸。在本发明的另一方面,提供所述的多功能免疫辍合物的用途,用于制备抗肿瘤药物,或用于制备诊断肿瘤的试剂,该肿瘤表达磷脂酰肌醇蛋白多糖-3;或用于制备嵌合抗原受体修饰的免疫细胞;较佳地,所述免疫细胞包括:T淋巴细胞、NK细胞或者NKT淋巴细胞。在本发明的另一方面,提供包含前面任一所述的抗体的嵌合抗原受体(Chimericantigenreceptor,CAR),所述的嵌合抗原受体包含顺序连接的:前面任一所述的抗体,跨膜区和胞内信号区;所述的胞内信号区选自:CD3ζ,FcεRIγ,CD27,CD28,CD137,CD134,MyD88,CD40的胞内信号区序列,或其组合。在另一优选例中,所述的嵌合抗原受体中,所述的跨膜区包含CD8或CD28的跨膜区。在另一优选例中,所述的嵌合抗原受体中,所述的嵌合抗原受体包括如下的顺序连接的抗体,跨膜区和胞内信号区:前面任一所述的抗体、CD8和CD3ζ;前面任一所述的抗体、CD8、CD137和CD3ζ;前面任一所述的抗体、CD28分子的跨膜区、CD28分子的胞内信号区和CD3ζ;或前面任一所述的抗体、CD28分子的跨膜区、CD28分子的胞内信号区、CD137和CD3ζ。在另一优选例中,所述的嵌合抗原受体中,所述的抗体是单链抗体或结构域抗体。在另一优选例中,所述的嵌合抗原受体具有:SEQIDNO:49或其中第22-346位所示的氨基酸序列;SEQIDNO:50或其中第22-447位所示的氨基酸序列;SEQIDNO:51或其中第22-491位所示的氨基酸序列;SEQIDNO:52或其中第22-494位所示的氨基酸序列;SEQIDNO:53或其中第22-536位所示的氨基酸序列;SEQIDNO:85所示的氨基酸序列;SEQIDNO:86所示的氨基酸序列;或SEQIDNO:87所示的氨基酸序列。在本发明的另一方面,提供编码所述的嵌合抗原受体的核酸。在另一优选例中,编码所述的嵌合抗原受体的核酸具有:SEQIDNO:44或其中第380-1420位或其中第443-1420位所述的核苷酸序列;SEQIDNO:45或其中第380-1723位或其中第443-1723位所述的核苷酸序列;SEQIDNO:46或其中第380-1855位或其中第443-1855位所述的核苷酸序列;SEQIDNO:47或其中第380-1864位或其中第443-1864位所述的核苷酸序列;SEQIDNO:48或其中第380-1990位或其中第443-1990位所述的核苷酸序列;SEQIDNO:85所述的核苷酸序列;SEQIDNO:87所述的核苷酸序列;或SEQIDNO:89所述的核苷酸序列。在本发明的另一方面,提供一种表达载体,其包含编码所述的嵌合抗原受体的核酸。在另一优选例中,所述的表达载体来源于慢病毒质粒pWPT(或pWPT-eGFP)。在本发明的另一方面,提供一种病毒,所述的病毒包含所述载体。所述的嵌合抗原受体、或编码其的核酸、或包含该核酸的表达载体或病毒的用途,用于制备靶向表达磷脂酰肌醇蛋白多糖-3的肿瘤的基因修饰的免疫细胞。在另一优选例中,所述的表达磷脂酰肌醇蛋白多糖-3的肿瘤包括(但不限于):肝癌,黑色素瘤,卵巢透明细胞癌、卵黄囊瘤、神经母细胞瘤。在本发明的另一方面,提供一种基因修饰的免疫细胞,其转导有编码所述的嵌合抗原受体的核酸,或含有该核酸的表达载体或病毒;或其表面表达所述的嵌合抗原受体。在另一优选例中,所述的免疫细胞还携带外源的细胞因子的编码序列;较佳地,所述的细胞因子包括:IL-12,IL-15或IL-21。在另一优选例中,所述的免疫细胞还表达另一种嵌合抗原受体,该受体不含有CD3ζ,但含有CD28的胞内信号结构域、CD137的胞内信号结构域或者这两者的组合。在另一优选例中,所述的免疫细胞还表达趋化因子受体;较佳地,所述的趋化因子受体包括:CCR2。在另一优选例中,所述的免疫细胞还表达能降低PD-1表达的siRNA或者阻断PD-L1的蛋白。在另一优选例中,所述的免疫细胞还表达安全开关;较佳地,所述的安全开关包括:iCaspase-9,TruancatedEGFR或RQR8。在另一优选例中,所述的免疫细胞包括:T淋巴细胞,NK细胞或NKT细胞。在本发明的另一方面,提供所述的基因修饰的免疫细胞的用途,用于制备抑制肿瘤的药物,所述的肿瘤是表达磷脂酰肌醇蛋白多糖-3的肿瘤。在本发明的另一方面,提供药物组合物(包括药物或诊断试剂),其包括:前面任一所述的抗体或编码该抗体的核酸;或前面任一所述的免疫辍合物或编码该辍合物的核酸;或前面任一所述的嵌合抗原受体或编码该嵌合抗原受体的核酸;或前面任一所述的基因修饰的免疫细胞。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。附图说明图1、在单噬菌体ELISA实验中抗体P1B12E和P7D4对人类GPC3和对照BSA的结合情况。抗体P1B12E和P7D4对人类GPC3和阴性对照BSA的值证明筛选到的两个抗体能特异性结合人类GPC3。图2、人类GPC3的抗体纯化电泳图。图3、抗体scFv-P1B12E-Fc和scFv-P7D4-Fc对GPC3表达阳性的HepG2细胞结合活性分析。图4、P7D4系列抗体对GPC3结合能力的SPR分析。图5、P7D4系列抗体特异性结合重组人GPC3。图6、表达纯化的GPC3蛋白的SDSPAGE电泳鉴定。图7、抗体Y035对人GPC3的结合动力学分析。图8、抗体5A5对人GPC3的结合动力学分析。图9、抗体Y035特异性结合GPC3表达阳性的HepG细胞。具体实施方式本发明人经过深入的研究筛选,获得了特异性识别GPC3的抗体,包括单链抗体和人源化抗体。本发明的抗体可以被应用于制备各种靶向性抗肿瘤药物以及诊断肿瘤的药物。抗GPC3抗体本发明人从全人源天然抗体库中筛选获得对于GPC3结合性能良好的特异性抗体,进一步还对其进行氨基酸突变获得了亲和力进一步呈现显著性提高的抗GPC3抗体,并且找到了其发挥结合性能的关键CDR区。本发明人还利用杂交瘤技术获得了抗GPC3的鼠源抗体,对其进行人源化,经过反复比较,获得对于GPC3结合性能极其优异的人源化抗GPC3抗体,并且找到了其发挥结合性能的关键CDR区。本发明的抗体可以是完整的免疫球蛋白分子,也可以是抗原结合片段,包括但不限于Fab片段,Fd片段,Fv片段,F(ab’)2片段、互补决定区(CDR)片段、单链抗体(scFv)、结构域抗体,二价单链抗体、单链噬菌体抗体、双特异双链抗体、三链抗体、四链抗体。抗体的抗原结合特性可由位于重链和轻链可变区的3个特定的区域来描述,称为互补决定区(complementaritydeterminingregion,CDR),所述的CDR区将可变区间隔成4个框架区域(FR),4个FR的氨基酸序列相对比较保守,不直接参与结合反应。这些CDR形成环状结构,通过其间的FR形成的β折叠在空间结构上相互靠近,重链上的CDR和相应轻链上的CDR构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了FR或CDR区域。CDR区是免疫学感兴趣的蛋白质的序列,本发明的抗体的CDR区是全新的。所述抗体可包含本文揭示的二、三、四、五或者所有六个CDR区。本发明的另一方面包括本文所述抗体的功能变体。所述变体能与亲代抗体竞争特异性结合GPC3,且其识别肿瘤细胞表达的GPC3的能力接近于本发明实施例中提供的具体的抗体。所述功能变体可以具有保守序列修饰,包括核苷酸和氨基酸取代、添加和缺失。这些修饰可以通过本领域己知的标准技术导入,例如定向诱变和随机PCR介导的诱变,并且可包含天然以及非天然核苷酸和氨基酸。较佳地,序列的修饰发生在所述抗体的CDR区以外的区域上。免疫辍合物本发明还提供了多功能免疫缀合物,其包含本文所述抗体以及进一步包含至少一种其它类型的功能性分子。所述的功能性分子选自但不限于:靶向肿瘤表面标志物的分子,抑制肿瘤的分子,靶向免疫细胞的表面标志物的分子或可检测标记物。所述抗体与所述功能性分子可以通过共价连接、偶联、附着、交联等方式构成辍合物。作为一种优选方式,所述免疫缀合物可包含:本发明的抗体以及至少一种靶向肿瘤表面标志物的分子或抑制肿瘤的分子。所述的抑制肿瘤的分子可以是抗肿瘤的细胞因子,或抗肿瘤的毒素;较佳地,所述的细胞因子包括(但不限于):IL-12、IL-15、IFN-beta、TNF-alpha。所述的靶向肿瘤表面标志物的分子例如可以与本发明的抗体协同作用,更精准地靶向肿瘤细胞。作为一种优选方式,所述免疫缀合物可包含:本发明的抗体以及可检测标记物。所述的可检测标记物包括但不限于:荧光标记物、显色标记物;如:酶、辅基、荧光材料、发光材料,生物发光材料、放射性材料、正电子发射金属以及非放射性顺磁性金属离子。也可包含一个以上的标记物。为了检测和/或分析和/或诊断目的用于标记抗体的标记依赖于使用的特定检测/分析/诊断技术和/或方法例如免疫组织化学染色(组织)样品、流式细胞计量术等。对于本领域已知的检测/分析/诊断技术和/或方法合适的标记为本领域技术人员所熟知。作为一种优选方式,所述免疫缀合物可包含:本发明的抗体以及靶向免疫细胞的表面标志物的分子。所述靶向免疫细胞的表面标志物的分子可识别免疫细胞,其携带本发明的抗体达到免疫细胞,同时本发明的抗体可将免疫细胞靶向于肿瘤细胞,从而引发免疫细胞特异性地杀伤肿瘤。作为通过直接或间接(例如通过接头)缀合而化学产生免疫缀合物的一种方式,所述免疫缀合物可以作为融合蛋白而产生,所述融合蛋白包含本发明的抗体及合适的其它蛋白。融合蛋白可以通过本领域已知方法产生,例如通过构建核酸分子以及随后表达所述核酸分子而重组产生,所述核酸分子包含符合读框的编码抗体的核苷酸序列以及编码合适标记的核苷酸序列。本发明另一方面提供了编码本发明的至少一种抗体、其功能变体或者免疫缀合物的核酸分子。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本发明还涉及包含上述的适当DNA序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。嵌合抗原受体及基因修饰的免疫细胞本发明提供了一种表达于免疫效应细胞(免疫细胞)表面的嵌合抗原受体,所述的嵌合抗原受体包含顺序连接的:胞外结合区,跨膜区和胞内信号区,其中所述胞外结合区包含本发明的抗体。将该嵌合抗原受体表达于免疫效应细胞的表面,可使得免疫效应细胞对表GPC3的肿瘤细胞具有高度特异性的细胞毒性作用。如本文所用,所述的“免疫细胞”与“免疫效应细胞”可互换使用,其包括:T淋巴细胞,NK细胞或NKT细胞等,优选的,为NK细胞和T淋巴细胞。作为本发明的优选方式,所述的嵌合抗原受体中,包含的抗体为单链抗体,其通过CD8铰链区与CD8或者CD28的跨膜区相连接,跨膜区后紧接胞内信号区。本发明也包括编码所述嵌合抗原受体的核酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或多肽的片段、类似物和衍生物。嵌合抗原受体的跨膜区可以选自CD8或CD28等蛋白的跨膜区。人CD8蛋白是个异二聚体,由αβ或者γδ两条链组成。在本发明的一个实施方案中,跨膜区选自CD8α或者CD28的跨膜区。此外,CD8α铰链区(hinge)是一个柔性区域,因此,CD8或CD28和跨膜区加上铰链区被用于将嵌合抗原受体CAR的靶点识别结构域scFv和胞内信号区连接起来。胞内信号区可以选自CD3ζ,FcεRIγ,CD27,CD28,CD137,CD134,MyD88,CD4蛋白的胞内信号区,及其组合。CD3分子由五个亚单位组成,其中CD3ζ亚单位(又称CD3zeta,简称Z)含有3个ITAM基序,该基序是TCR-CD3复合体中重要的信号转导区。CD3δZ是截短的不具有ITAM基序的CD3ζ序列,在实践中一般作为阴性对照的构建。FcεRIγ主要分布在肥大细胞和嗜碱性粒细胞表面,其含有一个ITAM基序,在结构、分布及功能上与CD3ζ类似。此外如前所述,CD28,CD137,CD134是共刺激信号分子,在与各自配体结合后其胞内信号区段产生的共刺激作用引起免疫效应细胞(主要是T淋巴细胞)的持续增殖,并能够提高免疫效应细胞分泌IL-2和IFN-γ等细胞因子的水平,同时提高CAR免疫效应细胞在体内的存活周期和抗肿瘤效果。本发明的嵌合抗原受体可以按如下方式顺序连接:本发明的抗体、CD8和CD3ζ;本发明的抗体、CD8、CD137和CD3ζ;本发明的抗体、CD28分子的跨膜区、CD28分子的胞内信号区和CD3ζ;或本发明的抗体、CD28分子的跨膜区、CD28分子的胞内信号区、CD137和CD3ζ。及其组合,其中相关嵌合抗原受体蛋白中CD28a代表CD28分子的跨膜区,CD28b代表CD28分子的胞内信号区。上述各种嵌合抗原受体统称为scFv(GPC3)-CAR。本发明还提供了包含上述编码表达于免疫效应细胞表面的嵌合抗原受体蛋白的核酸的载体。在一个具体实施方案中,本发明使用的载体是一种慢病毒质粒载体pWPT-eGFP。该质粒属于第三代自灭活慢病毒载体系统,该系统共有三个质粒即编码蛋白Gag/Pol、编码Rev蛋白的包装质粒psPAX2;编码VSV-G蛋白的包膜质粒PMD2.G;及空载体pWPT-eGFP,其可以用于重组引入目的核酸序列,即编码CAR的核酸序列。空载体pWPT-eGFP中由延长因子-1α(elongationfactor-1α,EF-1α)启动子调控增强型绿色荧光蛋白(enhancedgreenfluorescentprotein,eGFP)的表达。而包含编码CAR的目的核酸序列的重组表达载体pWPT-eGFP-F2A-CAR是通过由来自口蹄疫病毒(food-and-mouthdiseasevirus,FMDV)的核糖体跳跃序列(ribosomalskippingsequence2A)(简称F2A)实现eGFP与CAR的共表达的。本发明还包括包含上述载体的病毒。本发明的病毒包括包装后的具有感染力的病毒,也包括包含包装为具有感染力的病毒所必需成分的待包装的病毒。本领域内已知的其它可用于将外源基因转导入免疫效应细胞的病毒及其对应的质粒载体也可用于本发明。本发明还提供了基因修饰的免疫效应细胞,其被转导有本发明的核酸或被转导有本发明的上述包含所述含有该核酸的重组质粒,或包含该质粒的病毒。本领域常规的核酸转导方法,包括非病毒和病毒的转导方法都可以用于本发明。基于非病毒的转导方法包括电穿孔法和转座子法。近期Amaxa公司研发的Nucleofector核转染仪能够直接将外源基因导入细胞核获得目的基因的高效转导。另外,基于睡美人转座子(SleepingBeautysystem)或PiggyBac转座子等转座子系统的转导效率较普通电穿孔有较大提高,将nucleofector转染仪与睡美人转座子系统联合应用已有报道[DaviesJK.,etal.CombiningCD19redirectionandalloanergizationtogeneratetumor-specifichumanTcellsforallogeneiccelltherapyofB-cellmalignancies.CancerRes,2010,70(10):OF1-10.],该方法既具有较高的转导效率又能够实现目的基因的定点整合。在本发明的一个实施方案中,实现嵌合抗原受体基因修饰的免疫效应细胞的转导方法是基于病毒如逆转录病毒或慢病毒的转导方法。该方法具有转导效率高,外源基因能够稳定表达,且可以缩短体外培养免疫效应细胞到达临床级数量的时间等优点。在该转基因免疫效应细胞表面,转导的核酸通过转录、翻译表达在其表面。通过对各种不同的培养的肿瘤细胞进行体外细胞毒实验证明,本发明的免疫效应细胞具有高度特异性的肿瘤细胞杀伤效果(亦称细胞毒性)。因此本发明的编码嵌合抗原受体蛋白的核酸,包含该核酸的质粒,包含该质粒的病毒和转导有上述核酸,质粒或病毒的转基因免疫效应细胞可以有效地用于肿瘤的免疫治疗。本发明所述的免疫细胞还可以携带外源的细胞因子的编码序列;所述的细胞因子包括但不限于:IL-12,IL-15或IL-21等。这些细胞因子具有免疫调节或抗肿瘤的活性,能增强效应T细胞及活化的NK细胞的功能,或直接发挥抗肿瘤作用。因此,本领域技术人员可以理解,这些细胞因子的运用有助于所述的免疫细胞更好地发挥作用。本发明所述的免疫细胞还可以表达除了上述嵌合抗原受体以外的另一种嵌合抗原受体,该受体不含有CD3ζ,但含有CD28的胞内信号结构域、CD137的胞内信号结构域或者这两者的组合。本发明所述的免疫细胞还可以表达趋化因子受体;所述的趋化因子受体包括但不限于CCR2。本领域技术人员可以理解,所述的CCR2趋化因子受体可以使得体内的CCR2与之竞争性结合,对于阻断肿瘤的转移是有利的。本发明所述的免疫细胞还可以表达能降低PD-1表达的siRNA或者阻断PD-L1的蛋白。本领域技术人员可以理解,竞争性阻断PD-L1与其受体PD-1的相互作用,有利于恢复抗肿瘤T细胞反应,从而抑制肿瘤生长。本发明所述的免疫细胞还可以表达安全开关;较佳地,所述的安全开关包括:iCaspase-9,TruancatedEGFR或RQR8。药物组合物本发明的抗体、包含该抗体的免疫辍合物以及基因修饰的免疫细胞可以应用于制备药物组合物或诊断试剂。所述的组合物除了包括有效量的所述抗体、免疫辍合物或免疫细胞,还可包含药学上可接受的载体。术语“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。可作为药学上可接受的载体或其组分的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。本发明的组合物可根据需要制成各种剂型,并可由医师根据患者种类、年龄、体重和大致疾病状况、给药方式等因素确定对病人有益的剂量进行施用。给药方式例如可以采用注射或其它治疗方式。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。实施例1、结合人类GPC3的特异性单链抗体(scFv)的制备1.1基于噬菌体展示的GPC3特异性结合抗体的筛选利用噬菌体展示技术,从全人源天然抗体库中筛选人类GPC3(以下简称huGPC3)特异性抗体。为此目的,在400ml2×YT/氨苄青霉素培养基接种噬菌体展示全人源单链抗体天然库的甘油菌(购自上海锐劲生物技术有限公司),使细胞密度达到OD600=0.1,在37℃和200rpm条件下振荡培养直至细胞密度达到OD600=0.5。用1012pfu的M13KO7辅助噬菌体(购自Invitrogen)感染,在30℃和50rpm条件下培养30分钟。加入50mg/L卡那霉素后在37℃和200rpm条件下振荡培养30分钟后,通过离心(15分钟,1600×g,4℃)分离沉淀,重悬于400ml2×YT/氨苄青霉素/卡那霉素培养基,在37℃和200rpm条件下振荡培养16小时。最后细胞通过离心(20分钟,5000×g,4℃)分离沉淀并丢弃,上清用0.45μm规格滤膜过滤后,加入1/4体积20%(w/v)PEG8000、2.5MNaCl溶液并在冰浴中保温1小时沉淀噬菌体颗粒。随后离心沉淀(20分钟,8000×g,4℃),弃上清,将噬菌体重悬于25ml预冷PBS(137mMNaCl,2.7mMKCl,8mMNa2HPO4,2mMKH2PO4)中,离心(5分钟,20000×g,4℃)。向上清液加入1/4体积20%(w/v)PEG8000、2.5MNaCl溶液,并冰浴30分钟再次沉淀噬菌体颗粒。离心沉淀(30分钟,20000×g,4℃),再次将噬菌体沉淀重悬于2ml预冷PBS中,在冰上保持30分钟并离心(30分钟,17000×g,4℃)。上清液与含4%(w/v)BSA的PBS溶液以1:1混合,置于旋转混合器上,室温下保温30分钟,然后直接用于筛选。利用上述噬菌体抗体库,针对生物素标记的人类GPC3重组蛋白(购自上海锐劲生物技术有限公司),实施了四轮定向筛选,筛选方案如下:该噬菌体抗体库与生物素标记的抗原GPC3,在室温下保温2小时,然后与经封闭液2%(w/v)BSA(牛血清白蛋白,购自上海生工)封闭过的链霉亲和素磁珠MyOneC1(购自Invitrogen)在室温下保温30分钟。随后用PBST(含0.1%吐温-20)缓冲液洗涤磁珠,除去非特异性结合或结合能力较弱的噬菌体。结合能力强的噬菌体,则用甘氨酸-盐酸(pH2.2)从磁珠上洗脱下来,用Tris中和液(pH9.1)中和后,用于感染处于对数生长中期的大肠杆菌ER2738,并被用于下一轮筛选。在四轮筛选中,磁珠的用量分别为50μl、20μl、10μl和10μl,生物素标记的抗原GPC3浓度分别为200nM、10nM、5nM和1nM,PBST的洗涤次数分别为10次、10次、15次和20次。1.2GPC3特异性结合抗体的鉴定从第四轮筛选所得的克隆中随机挑选96个,并用单噬菌体ELISA(酶联免疫吸附实验)分析其与人类GPC3的结合能力。为此目的,每个单菌落接种300μl2×YT/氨苄青霉素培养基(含2%葡萄糖)于96孔深孔培养板,并在37℃和250rpm下振荡培养16小时。用20μl培养物接种到500μl2×YT/氨苄青霉素培养基(含0.1%葡萄糖),在37℃和250rpm下振荡培养1.5小时。准备辅助噬菌体溶液,取75μl的M13KO7(滴度为3×1012pfu/ml)混入到15ml2×YT培养基中,50μl/孔加到培养板中。在37℃和150rpm条件培养30分钟,然后加入准备好的卡那霉素溶液50μl/孔(取180μl的50mg/ml卡那霉素,加入到15ml2×YT培养基),在37℃和250rpm下振荡培养16小时。最后离心沉淀细胞(30分钟,5000×g,4℃),上清转移到新的96孔深孔培养板。为进行单噬菌体ELISA,在96孔MediSorpELISA板(购自Nunc)上分别使用100ng/孔抗原GPC3以及阴性对照蛋白BSA(100μl/孔),在4℃包被过夜。每个孔用含2%BSA(w/v)的PBST封闭。随后用PBST清洗孔三次并排净。然后加入100μl/孔上面制备的每种噬菌体溶液到板上各孔中。37℃保温2小时后,用PBST洗涤三次。为了检测结合的噬菌体,将抗M13抗体过氧化物歧化酶偶联物(购自GEHealthcare)以1:5000稀释于PBST中,并取100μl加到每个孔中。37℃保温1小时后用PBST漂洗孔三次,然后用PBS漂洗三次。最后吸取50μlTMB底物加入到孔中,并在室温下显色10分钟,随后加入每孔50μl的2MH2SO4终止显色反应。用酶联免疫检测仪(Bio-Rad)在450nm测量消光值。结合测序分析,观察到两个不同的单链抗体P1B12E(SEQIDNO:1(核苷酸),2(氨基酸))和P7D4(SEQIDNO:3(核苷酸),4(氨基酸)),在ELISA实验中对人类GPC3(huGPC3)结合信号显著较强,对BSA没有结合(图1)。实施例2、抗GPC3的单链抗体的表达和纯化根据标准方案,使用引物对V5-P1B12E-F(SEQIDNO:5)和V5-P1B12E-R(SEQIDNO:6)从筛选得到的克隆P1B12E的质粒(pCantab5E-P1B12E)中扩增出scFv-P1B12E片段,使用引物对V5-P7D4-F(SEQIDNO:7)和V5-P7D4-R(SEQIDNO:8)从筛选得到的克隆P7D4的质粒(pCantab5E-P7D4)扩增出scFv-P7D4片段,通过NheI/BamHI(购自NEB)双酶切,以T4DNA连接酶(购自NEB)于同样以NheI/BamHI双酶切载体质粒pCMV-V5-Fc(该载体在多克隆位点下游融合表达人抗体IgG1的Fc片段,以下简称V5-Fc,购自上海锐劲生物技术有限公司)连接并转化于宿主菌TOP10中,挑取克隆通过PCR鉴定阳性克隆并通过测序确认,分别获得V5-scFv-P1B12E-Fc和V5-scFv-P7D4-Fc真核表达质粒。将上述表达质粒分别转染生长良好的HEK-293F细胞,37℃,5%CO2,125rpm摇床连续培养7天,4000rpm离心10min,去除沉淀,收集上清,并用0.45μm滤膜过滤,将处理好的样品以proteinA(购自GE)亲和柱进行亲和纯化,最终获得纯化的抗体-Fc融合蛋白scFv-P1B12E-Fc和scFv-P7D4-Fc,鉴定结果如图2所示,其分子量在50kD左右。实施例3、流式细胞学分析各个细胞系与抗GPC3单链抗体的结合情况通过荧光激活细胞分选仪(FACS)(BD公司,FACSCalibur)分析抗体scFv-P1B12E-Fc和scFv-P7D4-Fc各自与GPC3阳性的肝癌HepG2细胞系(ATCC)的结合能力。具体方法如下:1).取对数生长期的肝癌HepG2细胞系接种到6cm平皿中,接种细胞密度约为90%,37℃孵箱过夜培养。2).使用10mM的EDTA消化细胞,200g×5min离心收集细胞。以1×106~1×107/mL的浓度重悬于1%含小牛血清的磷酸盐缓冲液(NBSPBS)中,按100ul/管的量加入流式专用管中。3).200g×5min离心,弃上清。4).分别加入待测抗体scFv-P1B12E-Fc和scFv-P7D4-Fc,同时以PBS作为阴性对照,抗体终浓度为10μg/ml,每管加入100ul。冰浴,45分钟。5).每管加入2ml1%NBSPBS,以200g×5min离心,共二遍。6).弃上清,加入1:50稀释的FITC荧光标记的羊抗人抗体(来自上海康成生物工程有限公司),每管加入100ul。冰浴,45分钟。7).每管加入2ml1%NBSPBS,以200g×5min离心,共二遍。8).弃上清,重悬于300ul1%NBSPBS中,流式细胞仪检测。9).应用流式细胞仪数据分析软件WinMDI2.9分析数据。结果如图3,流式细胞分析结果表明,抗体scFv-P7D4-Fc可以特异识别表达GPC3的HepG2细胞,抗体scFv-P1B12E-Fc与HepG2细胞不结合。实施例4、GPC3结合能力提高的P7D4单链抗体变体的筛选和制备为提高P7D4单链抗体对GPC3结合能力,分别对其重链CDR1和CDR2区域、或者轻链CDR1和CDR2的部分氨基酸进行随机突变,并构建对应的亲和力成熟文库H12和L12。4.1、P7D4轻链和重链及其CDR区P7D4scFv核苷酸序列如下(SEQIDNO:3;其中,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列,第364-408位为(Gly4Ser)3连接序列)。P7D4scFv氨基酸序列如下(SEQIDNO:4):P7D4VHCDR1:核苷酸序列:GGATTCACCTTCAGTAGCTATGCTATGCAC(SEQIDNO:9);氨基酸序列:GFTFSSYAMH(SEQIDNO:10)。P7D4VHCDR2:核苷酸序列:gctattagtggtagtggtggtagcacatactacgcagactccgtgaagggc(SEQIDNO:11);氨基酸序列:AISGSGGSTYYADSVKG(SEQIDNO:12)。P7D4VHCDR3:核苷酸序列:gatcgacgagggagccacgctgatgcttttgatgtc(SEQIDNO:13);氨基酸序列:DRRGSHADAFDV(SEQIDNO:14)。P7D4VLCDR1:核苷酸序列:actggaaccagcagtgacgttggtggttataactatgtctcc(SEQIDNO:15);氨基酸序列:TGTSSDVGGYNYVS(SEQIDNO:16)。P7D4VLCDR2:核苷酸序列:ggtaacagcaatcggccctca(SEQIDNO:17);氨基酸序列:GNSNRPS(SEQIDNO:18)。P7D4VLCDR3:核苷酸序列:cagtcctatgacagcagcctgcgtgtggta(SEQIDNO:19);氨基酸序列:QSYDSSLRVV(SEQIDNO:20)。4.2、H12亲和力成熟库的构建通过对P7D4单链抗体进行序列比对和分析,P7D4重链第一个和第二个CDR区域的部分氨基酸被选定,通过引物引入随机化突变,用于构建重链亲和力成熟文库。为制备编码P7D4突变体文库的DNA片段,以质粒pCantab5E-P7D4为模板,通过PCR方法分别得到两段DNA片段,随后通过搭桥PCR的方式拼接而成。具体使用以下操作步骤:为合成基因,在50μl体积中进行PCR反应,每个反应使用质粒pCantab5E-P7D4作为模板,每条引物的终浓度为0.2μM,以及5μl10×KODPlus缓冲液、4μldNTPs(dATP、dCTP、dGTP和dTTP,每种2mM)、2μl25mMMgSO4和1UKODPlus(购自Takara),用水补足体积后,在热循环仪中开始PCR程序。反应先加热样品到94℃预变性5分钟,然后保温25个循环,每个循环是94℃30秒、56℃30秒和68℃30秒。最后在68℃保温10分钟。第一个片段的扩增利用引物S1(SEQIDNO:21,CAACGTGAAAAAATTATTATTCGC)和74H12F1r(SEQIDNO:22,CCAGCCCCTTGCCTGGAGCCTGGCGGACCCAMNNCATAGCATAMNNACTGAAGGTGAATCCAG),第二个片段利用引物74H12F2f(SEQIDNO:23,GCTCCAGGCAAGGGGCTGGAGTGGGTCTCANNKATTAGTNNKNNKGNTNNKNNKACATACTACGCAGACTCC)和S6(SEQIDNO:21,GTAAATGAATTTTCTGTATGAGG)。预期PCR产物通过分析琼脂糖凝胶电泳鉴定,并用WizardSVGelandPCRClean-up试剂盒(购自Promega)从样品中纯化回收。两个片段以等摩尔比加入到第二轮搭桥PCR中作为模板,反应体系仍然使用上述提到的KODPlus体系,反应先加热样品到94℃预变性5分钟,然后保温10个循环,每个循环反应条件是94℃30秒、60℃30秒和68℃30秒。最后在68℃保温10分钟。随后在反应体系中直接加入终浓度为0.2μM的引物S1和S6,并开始PCR程序。反应先加热样品到94℃预变性5分钟,然后保温25个循环,每个循环是94℃30秒、56℃30秒和68℃30秒。最后在68℃保温10分钟。预期PCR产物通过制备性琼脂糖凝胶电泳分离,并用WizardSVGelandPCRClean-up试剂盒根据制造商的说明纯化回收。完整的文库DNA片段两端分别含有sfiI和NotI限制性内切酶识别位点,经限制性内切酶sfiI/NotI进行限制性消化,插入到经过同样双酶切的噬菌粒载体pCANTAB5E中。连接产物使用WizardSVGelandPCRClean-up试剂盒分离样品中的DNA并脱盐,用于电转化。在电转化时,使用电转化杯和电穿孔仪GenePulserII(购自Bio-Rad),转化到自制的感受态大肠杆菌ER2738(购自NEB)。最终确认得到一个含有8.9x109个突变体的文库。4.3、L12亲和力成熟库的构建通过对P7D4单链抗体进行序列比对和分析,P7D4轻链第一个和第二个CDR区域的部分氨基酸被选定,通过引物引入随机化突变,用于构建轻链亲和力成熟突变体文库。为制备编码P7D4突变体文库的DNA片段,以质粒pCantab5E-P7D4为模板,通过PCR方法分别得到两段DNA片段,随后通过搭桥PCR的方式拼接而成。具体使用以下操作步骤:为合成基因,在50μl体积重进行PCR反应,每个反应使用质粒pCantab5E-P7D4作为模板,每条引物的终浓度为0.2μM,以及5μl10×KODPlus缓冲液、4μldNTPs(dATP、dCTP、dGTP和dTTP,每种2mM)、2μl25mMMgSO4和1UKODPlus,用水补足体积后,在热循环仪中开始PCR程序。反应先加热样品到94℃预变性5分钟,然后保温25个循环,每个循环是94℃30秒、56℃30秒和68℃30秒。最后在68℃保温10分钟。第一个片段的扩增利用引物S1和74L12F1r(SEQIDNO:83,GTTTGGGGGCTTTGCCTGGGTACTGTTGGTACCAGGAGACMNNAHNMNNAHNACCAACGTCACTGCTG),第二个片段利用引物74L12F2f(SEQIDNO:84,ACCCAGGCAAAGCCCCCAAACTCCTCATCTATNNKNNKNNKNNKCGGCCCTCAGGGGTC)和S6。预期PCR产物通过分析琼脂糖凝胶电泳鉴定,并用WizardSVGelandPCRClean-up试剂盒从样品中纯化回收。两个片段以等摩尔比加入到第二轮搭桥PCR中作为模板,反应体系仍然使用上述提到的KODPlus体系,在没有引物存在的情况下,反应先加热样品到94℃预变性5分钟,然后保温10个循环,每个循环反应条件是94℃30秒、60℃30秒和68℃30秒。最后在68℃保温10分钟。随后在反应体系中直接加入终浓度为0.2μM的引物S1和S6,并开始PCR程序。反应先加热样品到94℃预变性5分钟,然后保温25个循环,每个循环是94℃30秒、56℃30秒和68℃30秒。最后在68℃保温10分钟。预期PCR产物通过制备性琼脂糖凝胶电泳分离,并用WizardSVGelandPCRClean-up试剂盒根据制造商的说明纯化回收。完整的文库DNA片段两端分别含有sfiI和NotI限制性内切酶识别位点,经限制性内切酶sfiI/NotI进行限制性消化,插入到经过同样双酶切的噬菌粒载体pCANTAB5E中。连接产物使用WizardSVGelandPCRClean-up试剂盒分离样品中的DNA并脱盐,用于电转化。在电转化时,使用电转化杯和电穿孔仪GenePulserII,转化到自制的感受态大肠杆菌ER2738。最终确认得到一个含有1.1x1010个突变体的文库。另外,本发明人也采用errorpronePCR的策略,对整个P7D4片段进行随机突变,构建了库容为7.9×109的文库T2,其中扩增引物对为S1和S6,克隆和构建方式与上述H12和L12一致。以上三个亲和力成熟文库的筛选与实施例1中的筛选过程一致。通过筛选,本发明人鉴定得到六个高亲和力P7D4系列突变体克隆am4、am14、am20、am35、am42和T2-23,其序列信息如下:am4核苷酸序列(SEQIDNO:24,其中,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列,第364-408位为(Gly4Ser)3连接序列):am4氨基酸序列(SEQIDNO:25):重链CDR1:GFTFSTYAMT(SEQIDNO:60)重链CDR2:SISSSGESTYYADSVKG(SEQIDNO:61)重链CDR3:DRRGSHADAFDV(SEQIDNO:14)轻链CDR1:TGTSSDVGGYNYVS(SEQIDNO:16)轻链CDR2:GNSNRPS(SEQIDNO:18)轻链CDR3:QSYDSSLRVV(SEQIDNO:20)其中,第1-121位为重链氨基酸序列,第137-247为轻链氨基酸序列。第122-136为(Gly4Ser)3连接序列。am14核苷酸序列(SEQIDNO:26,其中,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列,第364-408位为(Gly4Ser)3连接序列):am14氨基酸序列(SEQIDNO:27):重链CDR1:GFTFSTYAMA(SEQIDNO:62)重链CDR2:EISSSGSRTYYADSVKG(SEQIDNO:63)重链CDR3:DRRGSHADAFDV(SEQIDNO:14)轻链CDR1:TGTSSDVGGYNYVS(SEQIDNO:16)轻链CDR2:GNSNRPS(SEQIDNO:18)轻链CDR3:QSYDSSLRVV(SEQIDNO:20)其中,第1-121位为重链氨基酸序列,第137-247为轻链氨基酸序列,第122-136为(Gly4Ser)3连接序列。am20核苷酸序列(SEQIDNO:28,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列。第364-408位为(Gly4Ser)3连接序列):am20氨基酸序列(SEQIDNO:29):重链CDR1:GFTFSTYAMA(SEQIDNO:64)重链CDR2:AISMSGESTYYADSVKG(SEQIDNO:65)重链CDR3:DRRGSHADAFDV(SEQIDNO:14)轻链CDR1:TGTSSDVGGYNYVS(SEQIDNO:16)轻链CDR2:GNSNRPS(SEQIDNO:18)轻链CDR3:QSYDSSLRVV(SEQIDNO:20)其中,第1-121位为重链氨基酸序列,第137-247为轻链氨基酸序列,第122-136为(Gly4Ser)3连接序列。am35核苷酸序列(SEQIDNO:30,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列。第364-408位为(Gly4Ser)3连接序列):am35氨基酸序列(SEQIDNO:31):重链CDR1:GFTFSSYAMH(SEQIDNO:10)重链CDR2:AISSSGGSTYYADSVKG(SEQIDNO:66)重链CDR3:DRRGSHADAFDV(SEQIDNO:14)轻链CDR1:TGTSSDVGHKFPVS(SEQIDNO:67)轻链CDR2:KNLLRPS(SEQIDNO:68)轻链CDR3:QSYDSSLRVV(SEQIDNO:20)其中,第1-121位为重链氨基酸序列,第137-247为轻链氨基酸序列。第122-136为(Gly4Ser)3连接序列。am42核苷酸序列(SEQIDNO:32,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列。第364-408位为(Gly4Ser)3连接序列):am42氨基酸序列(SEQIDNO:33):重链CDR1:GFTFSSYAMH(SEQIDNO:10)重链CDR2:AISSSGGSTYYADSVKG(SEQIDNO:66)重链CDR3:DRRGSHADAFDV(SEQIDNO:14)轻链CDR1:TGTSSDVGLMHNVS(SEQIDNO:69)轻链CDR2:KSSSRPS(SEQIDNO:70)轻链CDR3:QSYDSSLRVV(SEQIDNO:20)其中,第1-121为重链氨基酸序列,第137-247为轻链氨基酸序列。第122-136为(Gly4Ser)3连接序列。T2-23核苷酸序列(SEQIDNO:34,第76-105位为重链CDR1,第148-198位为重链CDR2,第295-330位为重链CDR3;第475-516位为轻链CDR1;第562-582位为轻链CDR2,第679-708位为轻链CDR3;其中,第1-363位为重链核苷酸序列,第409-741为轻链核苷酸序列。第364-408位为(Gly4Ser)3连接序列):T2-23氨基酸序列(SEQIDNO:35):重链CDR1:GFTFSSYAMH(SEQIDNO:10)重链CDR2:AISSSGRSTYYADSVEG(SEQIDNO:71)重链CDR3:DRRGSHADALNV(SEQIDNO:72)轻链CDR1:TGTSSDVGGYNYVS(SEQIDNO:16)轻链CDR2:KSSSRPS(SEQIDNO:70)轻链CDR3:QSYDSSLRVV(SEQIDNO:20)其中,第1-121位为重链氨基酸序列,第137-247为轻链氨基酸序列。第122-136为(Gly4Ser)3连接序列。4.4、P7D4系列抗体对GPC3结合能力的SPR分析为定量分析P7D4系列抗体与GPC3的结合,使用BiacoreT200系统(购自GE)通过捕获法分别测量P7D4系列单链抗体的亲和力和动力学参数。根据制造商的说明,用NHS/EDC偶联通过伯氨基将抗人IgG(Fc)的抗体(购自GE)偶联到传感器芯片CM5的羧甲基葡聚糖表面。测量在25℃、30μl/min、1×HBS-EP+工作缓冲液中进行,再生条件为3MMgCl2、10μl/min作用30秒。在每一轮测试循环中,待测试抗体首先被捕获到芯片上,一定浓度的分析物GPC3流过芯片表面,人GPC3与被捕获的抗体相互作用而导致传感片表面分子浓度的变化将由SPR信号的改变而得到测定,并以共振单位(RU)表示。以时间对共振单位(RU)连续作图,得到的传感图记录了整个反应过程包括结合和解离过程(图4)。在所有的单循环动力学中,GPC3的浓度分别为5nM、10nM、20nM、40nM和80nM。用BiacoreT200evaluationsoftware评估所得作用曲线,并计算亲和力KD值。所有P7D4系列单链抗体分别对GPC3的结合数据总结在表1中。表1、P7D4系列单链抗体对GPC3的结合数据由表1可见,改造获得的P7D4系列突变体单链抗体具有良好的亲和力,相对于P7D4单链抗体具有极其显著的提高。4.5、P7D4系列抗体的识别特异性分析为了分析P7D4系列抗体对GPC3蛋白的结合特异性,通过ELISA实验,分别测定P7D4系列单链抗体分别对人GPC家族成员,包括重组人GPC1(rhGPC1)、GPC2(rhGPC2)、GPC3(rhGPC3)、GPC5(rhGPC5)和GPC6(rhGPC6)(购自安迪生物科技(上海)有限公司)的结合活性。为此目的,用0.1MNaHCO3(pH9.6)包被液稀释以上5种抗原,每孔包被100ng,50μl/孔,4℃包被过夜,并用含2%(w/v)BSA的PBST于室温下封闭2小时。然后用PBST漂洗平板三次并去除干净。随后,向每个孔板加入100ng各抗体蛋白的PBST溶液,每个样品的测定使用平行复孔分析。37℃保温2小时后,用PBST漂洗三次,随后加入1:20000稀释的HRP标记的兔抗人Fc抗体(购自上海锐劲生物技术有限公司)100μl/孔,37℃反应1小时。为了检测,用PBST漂洗孔三次,然后用PBS漂洗三次,最后加入TMB显示10分钟,用每孔50μl的2MH2SO4终止显色反应,用酶联免疫检测仪(Bio-Rad)在450nm测量消光值。结果如图5所示,所有P7D4系列的单链抗体均只特异性结合人GPC3,不与人GPC1、GPC2、GPC5和GPC6结合。实施例5、人GPC3抗原及抗该抗原的人源化单克隆抗体的制备5.1人GPC3在真核表达系统中表达及纯化5.1.1GPC3载体构建及鉴定以人肝癌细胞系Huh-7cDNA为模板,以如下引物GPC3-F:GATCGCTAGCACAGCCCCCGCCGCCGC(SEQIDNO:54),GPC3-R:GTACGGATCCTTCAGCGGGGAATGAACGTTC(SEQIDNO:55)进行PCR扩增,获得两端带有酶切位点NheI/BamHI的GPC3片段(1.6kb),将获得的PCR片段用内切酶NheI/BamHI(购自Fermentas公司)双酶切,同时将质粒载体V5H(购自Raygene公司),同样经内切酶NheI/BamHI双酶切,琼脂糖凝胶电泳后回收载体和插入片段,再通过T4DNAligase(购自NEB公司)连接并转化于宿主菌TOP10(购自LIFE公司)中,经氨苄抗性进行筛选,挑取克隆抽提质粒内切酶NheI/BamHI(购自Fermentas公司)双酶切鉴定含插入片断的阳性克隆,并通过测序验证,得到含有正确的人GPC3基因序列的真核表达质粒V5H-GPC3。5.1.2人GPC3蛋白的表达与纯化5.1.2.1.V5H-GPC3质粒的脂质体转染和培养将生长良好的HEK293F细胞(HEK293F,购自LIFE公司)以1×106细胞/毫升的密度接种于细胞三角培养瓶,37℃5%CO2120rpm培养过夜备用;将上述步骤获得的质粒V5H-GPC3与脂质体293Fectin(购自LIFE公司)分别用DMEM稀释并温和混合,室温孵育20min,将孵育好的DNA-脂质体复合物加至293F细胞中,37℃5%CO2120rpm培养72h。收集细胞培养液,4500g离心15min,除去细胞,取上清。5.1.2.2.GPC3蛋白纯化取1ml的Ni-NTAAgarose亲和填料装柱,将Ni-NTA亲和柱用平衡缓冲液(50mMPB、0.3MNaCl、10mM咪唑、pH8.0)平衡10个柱体积。将离心后的细胞培养液上清以1ml/min通过Ni-NTA亲和柱,收集流穿液4℃保存。用清洗缓冲液1(50mMPB、0.3MNaCl、20mM咪唑、pH8.0)洗10个柱体积,收集流穿液于4℃保存。用洗脱缓冲液(50mMPB、0.3MNaCl、250mM咪唑、pH8.0)洗4-5个柱体积,收集洗脱液,在透析液(50mMPB,pH7.8,0.3MNaCl,5%甘油)中4℃透析过夜,即获得GPC3(H)蛋白,取少量进行SDSPAGE电泳(图6)。5.2人GPC3抗原免疫重组蛋白免疫:将上述实施例5.1中得到的1ml纯化人GPC3蛋白GPC3(H)(1.0mg/mL)作为抗原与1mL完全弗氏佐剂(购自Sigma-aldrich公司)充分乳化混合皮下免疫6-8周龄BALB/c小鼠,每只小鼠免疫100μg人GPC3(H)蛋白抗原。4周后人GPC3抗原与不完全弗氏佐剂乳化混合,腹腔注射免疫小鼠,50μg每只小鼠,其后间隔2周,继续腹腔50μg抗原加强免疫。在第4次加强免疫1周后,以GPC3(H)蛋白进行包被,通过ELISA法检测小鼠抗血清效价,继续加强免疫,直至小鼠的抗血清效价达到>105。最后一次加强免疫3周后,脾内免疫上述人GPC3(H)蛋白20μg,备用。5.3抗人GPC3杂交瘤细胞株建立小鼠经脾内加强免疫后4天,在无菌情况下取脾,用100目滤网滤过分离淋巴细胞,与骨髓瘤细胞系SP2/0融合,经次黄嘌呤、氨基蝶呤与胸苷(hypoxathine,aminopterinandthymidine,HAT)选择性培养3天后,补加HT培养基,继续培养1周。以GPC3(H)抗原包被,ELISA筛选阳性克隆,以有限稀释法进行3次亚克隆,继续连续培养2个月,最后获得稳定杂交瘤细胞系(克隆号分别命名为:5A5,7C9,11D3)。5.4腹水生产及抗体的纯化将8-10周龄F1小鼠腹腔注射100μL降植烷(购自Sigma-aldrich公司),1周后,取上述实施例5.4杂交瘤细胞克隆以5×105细胞/小鼠的量注射小鼠腹腔以制备腹水,7到10天后采集腹水,10000g离心10min,取上清备用。取蛋白G亲和柱(购自GE公司)回复室温,用PBS(0.01MPB,0.15MNaCl,pH7.4)平衡5个柱体积。将腹水上清与等体积用PBS(0.01MPB,0.15MNaCl,pH7.4)混匀,0.22μM滤器过滤,过滤的腹水上清液上蛋白G亲和柱,PBS洗5个柱体积。以洗脱缓冲液(0.1MGlycineHCl,pH2.7)洗脱,洗脱液加入1/10体积中和缓冲液(1MNaH2PO4,pH9.0)中和。将溶液用PBS(0.01MPB,0.15MNaCl,pH7.4)透析,其间换液两次,两次换液时间间隔时间大于5小时。将透析溶液于10000g离心10min,上清液通过0.22um滤膜过滤保存,得到纯化的对应各克隆产生的抗人GPC3单抗的溶液。根据分析5A5具有良好的抗原结合能力。5.5GPC3克隆5A5的人源化5.5.15A5抗体的序列分析5A5具有良好的抗原结合能力。测定5A5抗体基因可变区序列VL与VH,综合Kabat、Chothia以及IMGT三种抗体CDRs区的命名方案,确定抗体轻链与重链的六个CDRs区序列。5A5重链的核苷酸序列如下(SEQIDNO:56,其中,下划线的三个区段依次为CDR1、CDR2、CDR3):CAGGTTCAACTGCAGCAGTCTGGGACTGAGCTGGTGAGGCCTGGGGCTTCAGTGAAGCTGTCCTGCAAGGCTTTGGGCTACACATTTACTGACTATGAAATGCACTGGGTGAAGCAGACACCTGTGCATGGCCTGGAGTGGATTGGAGCTATTCATCCAGGAAGTGGTGATACTGCCTACAATCAGAGGTTCAAGGGCAAGGCCACACTGACTGCAGACAAATCTTCCAGCACAGCCTACATGGAGTACAGCAGCCTGACATCTGAGGACTCTGCTGTCTATTACTGTACAAGATTTTATTCCTATGCTTACTGGGGCCAAGGGACTCTGGTCACTGTCTCTGCA5A5轻链的核苷酸序列如下(SEQIDNO:57,其中,下划线的三个区段依次为CDR1、CDR2、CDR3):GATGTTGTGATGACCCAAACTCCACTCTCCCTGCCTGTCAGTCTTGGAGATCAAGCCTCCATCTCTTGCAGATCTAGTCAGAGCCTTGTACACAGTAATGGAAACACCTATTTACAGTGGTACCTGCAGAAGCCAGGCCAGTCTCCAAAGCTCCTGATCTACAAAGTTTCCAATCGATTTTCTGGGGTCCCAGACAGGTTCAGTGGCAGAGGATCAGGGACAGATTTCACACTCAAGATCAGCAGAGTGGAGGCTGAGGATCTGGGAGTTTATTTCTGCTCTCAAAGTATATATGTTCCGTACACGTTCGGAGGAGGGACCAAGCTGGAAATAAAACGG5A5重链的氨基酸序列(SEQIDNO:81,其中,下划线的三个区段依次为CDR1、CDR2、CDR3):QVQLQQSGTELVRPGASVKLSCKALGYTFTDYEMHWVKQTPVHGLEWIGAIHPGSGDTAYNQRFKGKATLTADKSSSTAYMEYSSLTSEDSAVYYCTRFYSYAYWGQGTLVTVSA5A5轻链的氨基酸序列(SEQIDNO:82,其中,下划线的三个区段依次为CDR1、CDR2、CDR3)DVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLQWYLQKPGQSPKLLIYKVSNRFSGVPDRFSGRGSGTDFTLKISRVEAEDLGVYFCSQSIYVPYTFGGGTKLEIKR5.5.2抗体模板的选择抗体模板框架区的选择主要有4个重要因素:免疫原性,抗原结合特性,表达以及抗体的稳定性。(1)根据专利WO2008021156确定抗体轻重链可变区中支持抗体loop结构的氨基酸残基以及轻重链结合区域的氨基酸残基。(2)将5A5的轻链或者重链可变区全长与来自IMGT,VBASE或者NCBI的抗体种系进行序列相似性比对。(3)将5A5的轻链或者重链可变区中CDR区内的loop支持相关的氨基酸残基去掉,然后与来自IMGT,VBASE或者NCBI的抗体种系进行序列相似性比对。(4)将5A5的轻链或者重链可变区中CDR区的氨基酸残基去掉,然后与来自IMGT,VBASE或者NCBI的抗体种系进行序列相似性比对。(5)只保留5A5的轻链或者重链序列中的与支持loop相关的氨基酸残基,然后与来自IMGT,VBASE或者NCBI的抗体种系进行序列相似性比对。(6)只保留5A5的轻链或者重链framework中与支持loop相关的氨基酸残基,然后与来自IMGT,VBASE或者NCBI的抗体种系进行序列相似性比对。(7)综合序列相似性比对的结果,选取相似度最高的抗体种系作为抗体模板。(8)重链的序列相似度比对结果:根据相似度,选取VH1_69*06(IMGT,Accessionnumbers:L22583)作为5A5重链的抗体模板。(9)轻链的序列相似对比对结果:根据相似度,选取VK2D_29*02(IMGT,Accessionnumbers:U41644)作为5A5轻链的抗体模板。5.5.3CDR移植将5A5抗体的轻链或者重链CDR区替换掉抗体模板的CDR区。最终确定人源化抗体(Y035)。其氨基酸序列如下:人源化Y035重链(SEQIDNO:58):EVQLVQSGAEVKKPGASVKVSCKASGYTFSDYEMHWVRQAPGQGLEWMGAIHPGSGDTAYNQRFKGRVTITADKSTSTAYMELSSLRSEDTAVYYCARFYSYAYWGQGTLVTVSA重链CDR1氨基酸序列为:AspTyrGluMetHis(SEQIDNO:73);重链CDR2氨基酸序列为:AlaIleHisProGlySerGlyAspThrAlaTyrAsnGlnArgPheLysGly(SEQIDNO:74);重链CDR3氨基酸序列为:PheTyrSerTyrAlaTyr(SEQIDNO:75)。人源化Y035轻链(SEQIDNO:59):DIVMTQTPLSLPVTPGEPASISCRSSQSLVHSNGNTYLQWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSIYVPYTFGQGTKLEIKR轻链CDR1氨基酸序列为:ArgSerSerGlnSerLeuValHisSerAsnGlyAsnThrTyrLeuGln(SEQIDNO:76);轻链CDR2氨基酸序列为:LysValSerAsnArgPheSer(SEQIDNO:77);轻链CDR3氨基酸序列为:SerGlnSerIleTyrValProTyrThr(SEQIDNO:78)。5.5.4表达和纯化人源化的抗体(1)根据人源化的抗体(Y035)的氨基酸序列,设计核苷酸序列并合成合成的轻链核苷酸序列(SEQIDNO:79,包括信号肽编码序列):GGATCGATATCCACCATGGACATGATGGTGCTGGCCCAGTTCCTGGCCTTCCTGCTGCTGTGGTTCCCAGGCGCTAGATGCGACATCGTGATGACCCAGACCCCCCTGAGCCTGCCCGTGACCCCCGGCGAGCCCGCCAGCATCAGCTGCCGGAGCAGCCAGAGCCTGGTGCACAGCAACGGCAACACCTACCTGCAGTGGTACCTGCAGAAGCCCGGCCAGAGCCCCCAGCTGCTGATCTACAAGGTGAGCAACCGGTTCAGCGGCGTGCCCGACCGGTTCAGCGGCAGCGGCAGCGGCACCGACTTCACCCTGAAGATCAGCCGGGTGGAGGCCGAGGACGTGGGCGTGTACTACTGCAGCCAGAGCATCTACGTGCCCTACACCTTCGGCCAGGGCACCAAGCTGGAGATCAAACGTACGGTGGCT合成的重链核苷酸序列(SEQIDNO:80,包括信号肽编码序列):GGATCGATATCTGCGGCCTATCTAGCCACCATGCGGGTGCTGATCCTGCTGTGGCTGTTTACCGCCTTCCCCGGCTTCCTGAGCGAGGTGCAGCTGGTGCAGAGCGGCGCCGAGGTGAAGAAGCCCGGCGCCAGCGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCAGCGACTACGAGATGCACTGGGTGCGGCAGGCCCCCGGCCAGGGCCTGGAGTGGATGGGCGCCATCCACCCCGGCAGCGGCGACACCGCCTACAACCAGCGGTTCAAGGGCCGGGTGACCATCACCGCCGACAAGAGCACCAGCACCGCCTACATGGAGCTGAGCAGCCTGCGGAGCGAGGACACCGCCGTGTACTACTGCGCCCGGTTCTACAGCTACGCCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCGCCGCTAGCACCAAA(2)把合成的抗体核苷酸序列(信号肽是第16-81位(轻链)第31-84位(重链)),抗体的可变区,恒定区插入到哺乳动物细胞表达载体中从而分别构建出含有重链和轻链的抗体表达载体,通过测序鉴定抗体序列跟设计一致。具体为:以EcoRV和BsiWI双酶切合成的轻链以及pIK-hu12L(购自上海锐劲生物技术有限公司),将轻链插入pIK-hu12L。以EcoRV和NheI双酶切合成的重链以及改造过的pIH-hu12H(购自上海锐劲生物技术有限公司在CH1上通过同义突变增加了一个NheI酶切位点),将重链插入pIH-hu12H。经酶切连接好的载体转化至TOP10感受态细胞,PCR鉴定阳性克隆,经测序鉴定确定序列正确的克隆。将载体通过293Fectin瞬时转染至293F细胞中并表达。离心收集293F培养上清,通过0.45um滤器过滤,通过ProteinA柱亲和层析。利用分光光度计测定A280来确定纯化抗体的浓度。5.6人源化抗体Y035对人GPC3结合能力的SPR分析为定量分析抗体Y035与抗原蛋白人GPC3的结合,使用BiacoreT200系统(购自GE)通过多循环动力学测定方法,测量抗体Y035的亲和力和动力学参数。根据制造商的说明,用NHS/EDC偶联通过伯氨基将抗原蛋白人GPC3(购自上海锐劲生物技术有限公司)偶联到传感器芯片CM5的羧甲基葡聚糖表面,配体最终偶联量为305RU。动力学测量在25℃、30μl/min、1×HBS-EP+工作缓冲液中进行,再生条件为10mMGlycine-HCl(pH2.5)、10μl/min作用25秒。在每一个测量循环中,特定浓度的抗体Y035流过芯片表面,抗体与被固定在芯片上的抗原蛋白人GPC3相互作用而导致传感片表面分子浓度的变化将由SPR信号的改变而得到测定,并以共振单位(RU)表示。以时间对共振单位(RU)连续作图,并扣除了未固定抗原的参比通道的RU数值后,得到的传感图记录了整个反应过程包括结合和解离过程。抗体Y035及抗体5A5对人GPC3的结合动力学分析如图7-8。在动力学测定的不同循环实验中,抗体Y035的浓度分别为6.25nM、12.5nM、25nM、50nM和100nM。用BiacoreT200evaluationsoftware评估所得作用曲线,并计算亲和力KD值。采用同样的方法,对Y035进行人源化改造前的亲本鼠单克隆抗体5A5的亲和力和动力学参数也进行了测定分析。抗体Y035和5A5分别对人GPC3蛋白的结合数据总结在表2中,经过人源化改造后的抗体Y035对人GPC3蛋白的结合能力大大优于鼠源的5A5。表2、抗体Y035与5A5对人GPC3的结合动力学参数5.7抗体Y035的细胞结合活性FACS分析通过荧光激活细胞分选仪(FACS)分析抗体Y035与GPC3阳性的肝癌HepG2细胞系(ATCC)的结合能力,使用GPC3表达阴性的293T(ATCC)细胞作阴性对照。具体方法如下:1)取对数生长期的细胞HepG2和293T分别接种到6cm平皿中,接种细胞密度约为90%,37℃孵箱过夜培养。2)使用10mM的EDTA消化细胞,200g×5min离心收集细胞。以1×106~1×107/mL的浓度重悬于1%含小牛血清的磷酸盐缓冲液(NBSPBS)中,按100ul/管的量加入流式专用管中。3)200g×5min离心,弃上清。4)两个细胞系的实验组分别加入待测抗体Y035,另一个对照为不加抗体的PBS空白对照。抗体的终浓度均为20μg/ml,每管加入100ul。冰浴,45分钟。5)每管加入2ml1%NBSPBS,以200g×5min离心,共二遍。6)弃上清,加入1:100稀释的羊抗人抗体-FITC(来自上海业力生物科技有限公司),每管加入100ul。冰浴,45分钟。7)每管加入2ml1%NBSPBS,以200g×5min离心,共二遍。8)弃上清,重悬于300ul1%NBSPBS中,流式细胞仪检测。应用流式细胞仪数据分析软件Flowjo7.6分析数据,结果如图9所示,流式细胞分析结果标明,抗体Y035可以特异性识别表达GPC3的HepG2细胞,与GPC3表达阴性的293T细胞不结合。实施例6、基于P7D4单链抗体的CAR表达载体的构建和慢病毒制备作为示例,以下构建本发明的慢病毒质粒载体使用的载体系统属于第三代自灭活慢病毒载体系统,该系统共有四个质粒:即编码蛋白Gag/Pol的包装质粒pMDLgRRE(购自addgene),编码Rev蛋白的包装质粒pRSV-REV(购自addgene),编码VSV-G蛋白的包膜质粒pCMV-VSV-G(购自addgene)及基于空载体pRRLSIN-cPPT.PGK-GFP.WPRE(购自addgene)的编码目的基因CAR的重组表达载体,该系统可以有效降低形成可复制性慢病毒颗粒的风险。在本系统中,本发明人首先通过常规分子克隆的技术方式,对空载体pRRLSIN-cPPT.PGK-GFP.WPRE进行改造,用延长因子-1α(elongationfactor-1α,简称EF-1α)的启动子替代了原载体的启动子,并在启动子和CD8αsp信号肽之间增加了MluI酶切位点。具体地,使用ClaI/SalI(购自NEB)双酶切载体pWPT-EGFP(购自addgene),回收1.1Kb的DNA片段,用T4DNA连接酶连接于经ClaI/SalI双酶切的载体pRRLSIN-cPPT.PGK-GFP.WPRE,并转化于宿主菌TOP10中,挑取克隆通过菌落PCR鉴定阳性克隆并通过测序确认,获得重组质粒pRRLSIN-cPPT.EF-1α-EGFP.WPRE。利用前述优化获得的P7D4scFv制备嵌合抗原受体。表3解释了本发明示例的嵌合抗原受体各部分的连接顺序。表3嵌合抗原受体胞外结合区-跨膜区-胞内信号区1-胞内信号区2etc描述P7D4-δZP7D4scFv-CD8-CD3δzeta阴性对照P7D4-ZP7D4scFv-CD8-CD3zeta第一代P7D4-BBZP7D4scFv-CD8-CD137-CD3zeta第二代P7D4-28ZP7D4scFv-CD28a-CD28b-CD3zeta第二代P7D4-28BBZP7D4scFv-CD28a-CD28b-CD137-CD3zeta第三代注:CD28a代表CD28分子的跨膜区,CD28b代表CD28分子的胞内信号区。1、核酸片段的扩增(1)scFv序列的扩增分别以V5-scFv-P7D4-Fc质粒为模板,采用正向引物P7D4fd(SEQIDNO:36,包含部分CD8signalpeptide(CD8sp)的序列,引物序列为:ctccacgccgccaggccgcaggtgcagctgcaggag)和反向引物P7D4re(SEQIDNO:37,包含部分CD8hinge的序列,引物序列为:CGGCGCTGGCGTCGTGGTACCTAGGACGGTGACCTTGG)为引物对,PCR扩增获得P7D4scFv片段。(2)嵌合抗原受体其他部分的核酸序列抗GPC3嵌合抗原受体蛋白的除P7D4scFv外其它部分的核酸序列以专利申请号为201310164725.X中公开的序列SEQIDNO:26,27,28,29和30为模板通过PCR方式获得。具体地,其中包含CD8αsp序列的片段F1以本实施例中构建的质粒pRRLSIN-cPPT.EF-1α-EGFP.WPRE为模板,以引物对PWXLF(SEQIDNO:38,引物序列:gcaggggaaagaatagtagaca)和PRRL-CD8SP-R1(SEQIDNO:39,引物序列:CGGCCTGGCGGCGTGGAG)进行PCR扩增获得。包含CD8-CD3δzeta(δZ)的片段F3-δZ以申请专利201310164725.X中SEQIDNO:26质粒为模板,采用引物对PRRL-CD8hinge(SEQIDNO:40,引物序列:accacgacgccagcgccg)和δZre(SEQIDNO:41,引物序列:GAGGTCGACCTACGCGGGGGCGTCTGCGCTCCTGCTGAACTTCACTCT)通过PCR扩增获得。包含CD8-CD3zeta(Z)的片段F3-Z、包含CD8-CD137-CD3zeta(BBZ)的片段F3-BBZ、包含CD28a-CD28b-CD3zeta(28Z)的片段F3-28Z和包含CD28a-CD28b-CD137-CD3zeta(28BBZ)的片段F3-28BBZ序列分别以申请专利201310164725.X中SEQIDNO:27、SEQIDNO:28、SEQIDNO:29和SEQIDNO:30对应的质粒为模板,采用引物对PRRL-CD8hinge(SEQIDNO:42,引物序列:accacgacgccagcgccg)和R3R(SEQIDNO:43,引物序列:aatccagaggttgattgtcgacctagcgagggggcagggcctgc)通过PCR扩增获得。2、核酸片段的拼接分别将如前述获得的F1核酸片段,与等摩尔的P7D4scFv核酸片段以及等摩尔的F3-δZ或F3-Z或F3-BBZ或F3-28Z或F3-28BBZ核酸片段,进行三片段拼接PCR,拼接条件为:预变性:94℃,4min;变性:94℃,40s;退火:60℃,40s;延伸:68℃,140s,进行5个循环,然后总延伸68℃,10min,补充DNA聚合酶及正向引物PWXLF和反向引物R3R(CD8-CD3δzeta对应的反向引物为δZre,其余的皆为R3R)后PCR扩增30个循环,扩增条件为预变性:94℃,4min;变性:94℃,40s;退火:60℃,40s;延伸:68℃,140s,进行30个循环,然后总延伸68℃,10min。本实施例构建的由F1片段、P7D4scFv或P7D4突变体scFv、以及各类F3片段所组成的片段可以简称为CAR片段,扩增获得的片段分别称为:3、慢病毒质粒载体的构建本实施例构建了由F1片段、P7D4scFv、以及F3片段组件简称为CAR)通过MluI/SalI限制性内切酶双酶切,连入同样双酶切的pRRLSIN-cPPT.EF-1α-EGFP.WPRE载体中,从而构建表达各嵌合抗原受体的慢病毒载体pRRLSIN-cPPT.EF-1α-CAR。构建成功的载体经MluI/SalI酶切鉴定及序列测定正确后,可以准备用于慢病毒包装。如前所述,相关CAR基因经转录翻译为一条肽链,在CD8α信号肽的引导下,抗GPC3嵌合抗原受体将定位在细胞膜上。通过以上构建,分别可获得五个CAR多肽序列,称为:P7D4-δZ(SEQIDNO:49);P7D4-Z(SEQIDNO:50);P7D4-BBZ(SEQIDNO:51);P7D4-28Z(SEQIDNO:52);P7D4-28BBZ(SEQIDNO:53)。4、质粒转染293T包装慢病毒以6×106的密度接种培养至第6~10代的HEK-293T细胞(ATCC:CRL-11268)于10cm培养皿中,37℃,5%CO2培养过夜准备用于转染。培养基为含10%胎牛血清和DMEM(均购自Life公司)。转染的步骤如下:4.1A液配制:将5.2μg的各目的基因质粒pRRLSIN-cPPT.EF-1α-CAR,分别与6.2μg包装质粒pMDLgRRE和pRSV-REV、以及2.4μg包膜质粒pCMV-VSV-G,溶入800μL的无血清DMEM培养液中,混匀。4.2B液配制:将60μgPEI(聚乙烯亚胺1μg/μl,购自Polysciences公司)溶解于800μL的无血清DMEM培养液中,轻轻混匀,室温孵育5min。4.3转染复合物的形成:将A液加入B液中轻轻混合,加入后立即涡旋混合或轻轻混匀,室温下孵育20min。4.4将转染复合物1.6ml滴加入HEK-293T细胞中,4-5h小时后,用2%FBS的DMEM培基给转染的293T细胞换液。在转染孵育72h后,使用0.45μm滤器(购自Millipore公司)过滤收集病毒,然后采用BeckmanOptimaL-100XP超速离心机28000rpm,4℃离心2小时,弃离心上清,离心所得沉淀用1/10~1/50原液体积的AIM-V培养液(购自Life公司)进行重悬,以100μL/管分装冻存于-80℃,以待病毒滴定或感染T淋巴细胞。实施例7、重组慢病毒感染CTL细胞由健康人外周血通过密度梯度离心法获得人外周血单个核细胞(上海市血液中心提供),以约2×106/mL密度加入AIM-V淋巴细胞培养基(购自Invitrogen公司)培养,并以细胞:磁珠比例为1:1加入包被有抗CD3和CD28抗体的磁珠(Invitrogen公司),同时加入终浓度300U/mL的重组人IL-2(购自上海华新生物高技术有限公司)刺激培养48h,然后以用上述重组慢病毒(MOI≈10)感染T细胞。感染后的细胞每隔一天采用5×105/mL的密度进行传代,同时在淋巴细胞培养液中补加终浓度300U/mL的重组人IL-2。感染的CTL细胞在培养第8天时通过流式细胞检测各不同嵌合抗原受体表达。采用带His-tag的人类GPC3重组蛋白(购自上海锐劲生物技术有限公司)进行FACS检测;首先将细胞与该蛋白(50ug/ml)孵育1hr,D-PBS洗涤2次,然后加入抗His-tag的抗体(1:50稀释,购自上海睿星生物技术有限公司),孵育1hr,然后用D-PBS洗涤2次,然后加入FITC标记的羊抗鼠二抗(上海康成生物技术有限公司),孵育50min,D-PBS洗涤3次后,FACS检测。以未感染的T淋巴细胞作为阴性对照,表达不同嵌合抗原受体的病毒感染T细胞其阳性率如表4所示。该阳性率结果表明,通过慢病毒感染的方法能够获得一定阳性率的CAR+T细胞。表4转染有下列CAR的T细胞T细胞转染阳性率P7D4-δZ(阴性对照)59%P7D4-Z65%P7D4-BBZ53%P7D4-28Z61%P7D4-28BBZ54%T细胞在分别感染包装有不同嵌合抗原受体的病毒后,以细胞密度为5×105/ml隔天传代培养、计数、并对传代的细胞培养液补加IL-2(终浓度为300U/ml),培养第11天约有100~1000倍的扩增,表明表达不同嵌合抗原受体的T细胞在体外能够进行一定数量的扩增,为后续体外毒性试验及体内试验提供了保证。实施例8、表达嵌合抗原受体的T淋巴细胞的体外毒性效果实验体外毒性实验使用的材料如下:如表5所示的GPC3阳性肝癌细胞(HepG2和Huh-7)以及GPC3阴性肝癌细胞(SK-HEP-1)作为靶细胞,效应细胞为如实施例7所验证的体外培养12天的FACS检测嵌合抗原受体表达的阳性细胞记为嵌合抗原受体阳性(CAR+)的CTL,效靶比视情况分别为3:1,1:1和1:3,靶细胞数量为10000个/孔,根据不同效靶比对应效应细胞。各组均设5个复孔,取5个复孔的平均值。检测时间为第18h。其中各实验组和各对照组如下:各实验组:各靶细胞+表达不同嵌合抗原受体的CTL,对照组1:靶细胞最大释放LDH,对照组2:靶细胞自发释放LDH,对照组3:效应细胞自发释放LDH。检测方法:采用CytoTox96非放射性细胞毒性检测试剂盒(Promega公司)进行。该方法是基于比色法的检测方法,可替代51Cr释放法。CytoTox检测定量地测量乳酸脱氢酶(LDH)。LDH是一种稳定的胞质酶,在细胞裂解时会释放出来,其释放方式与51Cr在放射性分析中的释放方式基本相同。释放出的LDH培养基上清中,可通过30分钟偶联的酶反应来检测,在酶反应中LDH可使一种四唑盐(INT)转化为红色的甲臜(formazan)。生成的红色产物的量与裂解的细胞数成正比。具体参照CytoTox96非放射性细胞毒性检测试剂盒说明书。细胞毒性计算公式为:具体如表5所示,本发明的P7D4的单链抗体的CAR均有明显的杀伤GPC3阳性肝癌细胞的活性,其中第二代和第三代的P7D4CART细胞比第一代抗肿瘤活性略强。此外,所有CART细胞对GPC3阴性的SK-HEP-1阳性肝癌细胞均没有杀伤活性。这些结果表明P7D4可以选择性地针对GPC3阳性的肝癌细胞,并进行有效的杀伤。此外,本发明的表达P7D4的第一、二、三代CART对GPC3阳性肿瘤细胞呈现效靶比梯度依赖性即效靶比越高细胞毒性作用越强。表5、融合表达单链抗体P7D4的CART细胞的细胞毒性实施例9基于Y035和GC33的CAR-T细胞的制备和比较参照实施例6和7的操作,基于Y035的轻链可变区和重链可变区,分别制备得到Y035-BBZ、Y035-28Z和Y035-28BBZ两种CAR-T细胞;基于GC33的轻链可变区和重链可变区,分别制备得到GC33-28Z和GC33-28BBZ两种CAR-T细胞,作为对照。嵌合抗原受体各部分的连接顺序如表6所示。表6其中,Y035-BBZ的核苷酸序列如下所示(SEQIDNO:85):gaggtgcagctggtgcagagcggcgccgaggtgaagaagcccggcgccagcgtgaaggtgagctgcaaggccagcggctacaccttcagcgactacgagatgcactgggtgcggcaggcccccggccagggcctggagtggatgggcgccatccaccccggcagcggcgacaccgcctacaaccagcggttcaagggccgggtgaccatcaccgccgacaagagcaccagcaccgcctacatggagctgagcagcctgcggagcgaggacaccgccgtgtactactgcgcccggttctacagctacgcctactggggccagggcaccctggtgaccgtgagcgccggtggaggcggttcaggcggaggtggttctggcggtggcggatcggacatcgtgatgacccagacccccctgagcctgcccgtgacccccggcgagcccgccagcatcagctgccggagcagccagagcctggtgcacagcaacggcaacacctacctgcagtggtacctgcagaagcccggccagagcccccagctgctgatctacaaggtgagcaaccggttcagcggcgtgcccgaccggttcagcggcagcggcagcggcaccgacttcaccctgaagatcagccgggtggaggccgaggacgtgggcgtgtactactgcagccagagcatctacgtgccctacaccttcggccagggcaccaagctggagatcaaacgtaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatatctacatctgggcgcccttggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgcaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgagagtgaagttcagcaggagcgcagacgcccccgcgtacaagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcY035-BBZ的氨基酸序列如下所示(SEQIDNO:86)EVQLVQSGAEVKKPGASVKVSCKASGYTFSDYEMHWVRQAPGQGLEWMGAIHPGSGDTAYNQRFKGRVTITADKSTSTAYMELSSLRSEDTAVYYCARFYSYAYWGQGTLVTVSAGGGGSGGGGSGGGGSDIVMTQTPLSLPVTPGEPASISCRSSQSLVHSNGNTYLQWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSIYVPYTFGQGTKLEIKRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPRY035-28Z的核苷酸序列如下所示(SEQIDNO:87):gaggtgcagctggtgcagagcggcgccgaggtgaagaagcccggcgccagcgtgaaggtgagctgcaaggccagcggctacaccttcagcgactacgagatgcactgggtgcggcaggcccccggccagggcctggagtggatgggcgccatccaccccggcagcggcgacaccgcctacaaccagcggttcaagggccgggtgaccatcaccgccgacaagagcaccagcaccgcctacatggagctgagcagcctgcggagcgaggacaccgccgtgtactactgcgcccggttctacagctacgcctactggggccagggcaccctggtgaccgtgagcgccggtggaggcggttcaggcggaggtggttctggcggtggcggatcggacatcgtgatgacccagacccccctgagcctgcccgtgacccccggcgagcccgccagcatcagctgccggagcagccagagcctggtgcacagcaacggcaacacctacctgcagtggtacctgcagaagcccggccagagcccccagctgctgatctacaaggtgagcaaccggttcagcggcgtgcccgaccggttcagcggcagcggcagcggcaccgacttcaccctgaagatcagccgggtggaggccgaggacgtgggcgtgtactactgcagccagagcatctacgtgccctacaccttcggccagggcaccaagctggagatcaaacgtaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggccaacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctccagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcY035-28Z的氨基酸序列如下所示(SEQIDNO:88):EVQLVQSGAEVKKPGASVKVSCKASGYTFSDYEMHWVRQAPGQGLEWMGAIHPGSGDTAYNQRFKGRVTITADKSTSTAYMELSSLRSEDTAVYYCARFYSYAYWGQGTLVTVSAGGGGSGGGGSGGGGSDIVMTQTPLSLPVTPGEPASISCRSSQSLVHSNGNTYLQWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSIYVPYTFGQGTKLEIKRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPRY035-28BBZ的核苷酸序列如下所示(SEQIDNO:89):gaggtgcagctggtgcagagcggcgccgaggtgaagaagcccggcgccagcgtgaaggtgagctgcaaggccagcggctacaccttcagcgactacgagatgcactgggtgcggcaggcccccggccagggcctggagtggatgggcgccatccaccccggcagcggcgacaccgcctacaaccagcggttcaagggccgggtgaccatcaccgccgacaagagcaccagcaccgcctacatggagctgagcagcctgcggagcgaggacaccgccgtgtactactgcgcccggttctacagctacgcctactggggccagggcaccctggtgaccgtgagcgccggtggaggcggttcaggcggaggtggttctggcggtggcggatcggacatcgtgatgacccagacccccctgagcctgcccgtgacccccggcgagcccgccagcatcagctgccggagcagccagagcctggtgcacagcaacggcaacacctacctgcagtggtacctgcagaagcccggccagagcccccagctgctgatctacaaggtgagcaaccggttcagcggcgtgcccgaccggttcagcggcagcggcagcggcaccgacttcaccctgaagatcagccgggtggaggccgaggacgtgggcgtgtactactgcagccagagcatctacgtgccctacaccttcggccagggcaccaagctggagatcaaacgtaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggccaacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctccaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcY035-28BBZ的氨基酸序列如下所示(SEQIDNO:90)EVQLVQSGAEVKKPGASVKVSCKASGYTFSDYEMHWVRQAPGQGLEWMGAIHPGSGDTAYNQRFKGRVTITADKSTSTAYMELSSLRSEDTAVYYCARFYSYAYWGQGTLVTVSAGGGGSGGGGSGGGGSDIVMTQTPLSLPVTPGEPASISCRSSQSLVHSNGNTYLQWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSIYVPYTFGQGTKLEIKRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR采用GPC3阳性肝癌细胞Huh-7作为靶细胞,参照实施例8采用的体外毒性实验方法进行体外测试,在效靶比为1:3时,Y035-28Z和Y035-28BBZ对Huh-7的杀伤率均达35%以上,而GC33-28Z的杀伤率仅为6%,GC33-28BBZ的杀伤率仅为23%,在效靶比为1:1,Y035-28Z对Huh-7的杀伤率达60%以上,而GC33-28Z的杀伤率仅为22%,以上结果表明,本申请Y035-CART细胞的细胞杀伤活性显著优于GC33-CART细胞。实施例10双特异性抗体BiTE的制备(1)Y035单链抗体核苷酸序列的制备培养分泌单克隆抗体的杂交瘤细胞株至对数生长期时,进行细胞计数,取1×107杂交瘤细胞。按照PlusRNAPurificationkit(Invitrogen,12183-555)说明书,从细胞沉淀中提取总RNA。a.逆转录得到cDNA以杂交瘤细胞总RNA做为模板,使用HighcapacityRNAtocDNAkit(Invitrogen,4387406),按照说明书逆转录合成cDNA。b.5’-RACE法扩增抗体可变区以cDNA为模板,使用5’-FullRACEkit(TAKARA,D315),用引物tgctttggtttccaggtgcaagatgtgaggtgcagctggtgcaga(SEQIDNO:91)和引物TATCGGATCCACCACCTCCACGTTTGATCTCCAGCTTGGTG(SEQIDNO:92)扩增。PCR产物经1.5%琼脂糖凝胶电泳分离后,得到的PCR产物为Y035单链抗体的核酸。(2)CD3单链抗体核酸序列的构建以专利201310025302.X公开的抗EpCAM/CD3双特异性抗体为模板,通过引物(SEQIDNO:93,gatatcaaactgcagcagtcag)和引物(SEQIDNO:94,GAGAGGGAGTACTCACCCCAAC)进行PCR,具体反应参考KODPLUS酶说明书,胶回收纯化,得到的PCR产物为CD3单链抗体的核酸。(3)引入NheI酶切位点以载体PIH为模板,通过引物(ggctaactagagaacccactgc,SEQIDNO:95)和PH-R(ACATCTTGCACCTGGAAACCAAAGC,SEQIDNO:96)进行PCR,具体反应参考KODPLUS酶说明书,胶回收纯化PCR产物,得到带有NheI酶切位点的一小段片段。(4)Y035/CD3双特异性抗体编码序列核酸的构建步骤(1)、(2)、(3)所得的PCR产物进行OverlapPCR,以引物(SEQIDNO:95)和引物(SEQIDNO:92)进行PCR,胶回收纯化PCR产物,即为Y035/CD3双特异性抗体编码序列(SEQIDNO:97),序列如下:gaggtgcagctggtgcagagcggcgccgaggtgaagaagcccggcgccagcgtgaaggtgagctgcaaggccagcggctacaccttcagcgactacgagatgcactgggtgcggcaggcccccggccagggcctggagtggatgggcgccatccaccccggcagcggcgacaccgcctacaaccagcggttcaagggccgggtgaccatcaccgccgacaagagcaccagcaccgcctacatggagctgagcagcctgcggagcgaggacaccgccgtgtactactgcgcccggttctacagctacgcctactggggccagggcaccctggtgaccgtgagcgccggtggaggcggttcaggcggaggtggttctggcggtggcggatcggacatcgtgatgacccagacccccctgagcctgcccgtgacccccggcgagcccgccagcatcagctgccggagcagccagagcctggtgcacagcaacggcaacacctacctgcagtggtacctgcagaagcccggccagagcccccagctgctgatctacaaggtgagcaaccggttcagcggcgtgcccgaccggttcagcggcagcggcagcggcaccgacttcaccctgaagatcagccgggtggaggccgaggacgtgggcgtgtactactgcagccagagcatctacgtgccctacaccttcggccagggcaccaagctggagatcaaacgtggaggtggtggatccgatatcaaactgcagcagtcaggggctgaactggcaagacctggggcctcagtgaagatgtcctgcaagacttctggctacacctttactaggtacacgatgcactgggtaaaacagaggcctggacagggtctggaatggattggatacattaatcctagccgtggttatactaattacaatcagaagttcaaggacaaggccacattgactacagacaaatcctccagcacagcctacatgcaactgagcagcctgacatctgaggactctgcagtctattactgtgcaagatattatgatgatcattactgccttgactactggggccaaggcaccactctcacagtctcctcagtcgaaggtggaagtggaggttctggtggaagtggaggttcaggtggagtcgacgacattcagctgacccagtctccagcaatcatgtctgcatctccaggggagaaggtcaccatgacctgcagagccagttcaagtgtaagttacatgaactggtaccagcagaagtcaggcacctcccccaaaagatggatttatgacacatccaaagtggcttctggagtcccttatcgcttcagtggcagtgggtctgggacctcatactctctcacaatcagcagcatggaggctgaagatgctgccacttattactgccaacagtggagtagtaacccgctcacgttcggtgctgggaccaagctggagctgaaa(5)靶向Y035/CD3的双特异性抗体的表达及纯化将Y035/CD3BiTE的质粒瞬时转染至真核细胞293F中,细胞转染过程参考293fectin说明书进行。培养上清用金属亲和层析柱NiSepharoseTM6FastFlow(购自GEHealthcareBio-Science公司)进行纯化,得到Y035/CD3的双特异性抗体(SEQIDNO:98),序列如下所示:EVQLVQSGAEVKKPGASVKVSCKASGYTFSDYEMHWVRQAPGQGLEWMGAIHPGSGDTAYNQRFKGRVTITADKSTSTAYMELSSLRSEDTAVYYCARFYSYAYWGQGTLVTVSAGGGGSGGGGSGGGGSDIVMTQTPLSLPVTPGEPASISCRSSQSLVHSNGNTYLQWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSIYVPYTFGQGTKLEIKRGGGGSDIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSSVEGGSGGSGGSGGSGGVDDIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK选择GPC3表达阳性的HepG2和SK-Hep-1GPC3作为靶细胞,研究了Y035/CD3BiTE在体外的细胞毒性作用,结果显示,溶度为0.1ng/ml的Y035/CD3BiTE对HepG2的细胞杀伤作用达到约60%,对SK-Hep-1GPC3的细胞作用达到约40%。与CN103833852A所述的GPC3/CD3BiTE相比,细胞毒性显著增加。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1