好氧酒糟有机肥浸提液的制备及应用的制作方法
本发明涉及一种好氧酒糟有机肥浸提液的制备及应用,属于堆肥提取液技术领域。
背景技术:
堆肥提取液(compost tea或者compost extracts)是指堆制腐熟的有机物料经过不同方法提取后的提取液。目前堆肥提取液的生产主要有两种工艺,但各有其优缺点。其中一种是好气提取堆肥提取液(Aerated fermentation extracts compost,即AFEC),特点是提取时间短,但是需要外在能源(氧气,糖蜜,鱼乳胶物0.5mol·L-1,腐殖物质,植物提取物等)的补充;而另一种则是厌气提取堆肥提取液(Non-aerated fermentation extracts compost,即NAFEC),特点是不需要外在的能源供应,但是提取时间比较长。
越来越多的研究表明,堆肥提取液不仅能够为作物提供养分和有益的有机营养物质,而且还能够抑制作物病害和改良土壤结构。然而,目前关于堆肥提取液中物质成分和结构特征研究的报道较少。到目前为止,很少有文献报道好气提取酒糟堆肥提取液(AFEC)和厌气提取酒糟堆肥提取液(NAFEC)与直接提取酒糟堆肥提取液(DEC:提取时间短,不需要外加物质和能源)的物质成分与结构特征及其对作物促生效果的差异。
特别是以酒糟堆肥为原料,好气提取和厌气提取工艺对酒糟堆肥提取液中可培养微生物数量以及细菌结构功能多样性的影响目前不清楚。因此,无法针对性的根据作物实际需要来提供不同的酒糟浸提液。
技术实现要素:
本发明要解决的技术问题是:提供一种好氧酒糟有机肥浸提液的制备及应用,制备的浸提液微生物量以及丰度显著高于采用厌氧及直接提取方法,且养分转化性好,易被作物直接吸收,可以克服现有技术的不足。
本发明的技术方案:一种好氧酒糟有机肥浸提液的制备方法,将酒糟堆肥与水按1:8的质量比例充分混匀后置于塑料桶内,在塑料桶中均匀分布地插入三根带有冒气头的气管,在20℃-25℃下持续通气36h,再经纱布过滤后即得酒糟有机肥浸提液。
所述酒糟堆肥中含有机质74.8%、全氮3.57%、全磷2.18%和全钾1.23%。
所述通气量为33L·min-1。
所述酒糟有机肥浸提液在作物叶面喷施上的应用。
本发明的有益效果是:本发明好氧方法所制备的浸提液,与厌氧和直接提取方法相比,在微生物量以及丰度方面提高显著,养分转化性较好;同时由于本浸提液的活性较好,因此特别适合作物叶面使用,易被作物直接吸收。
附图说明
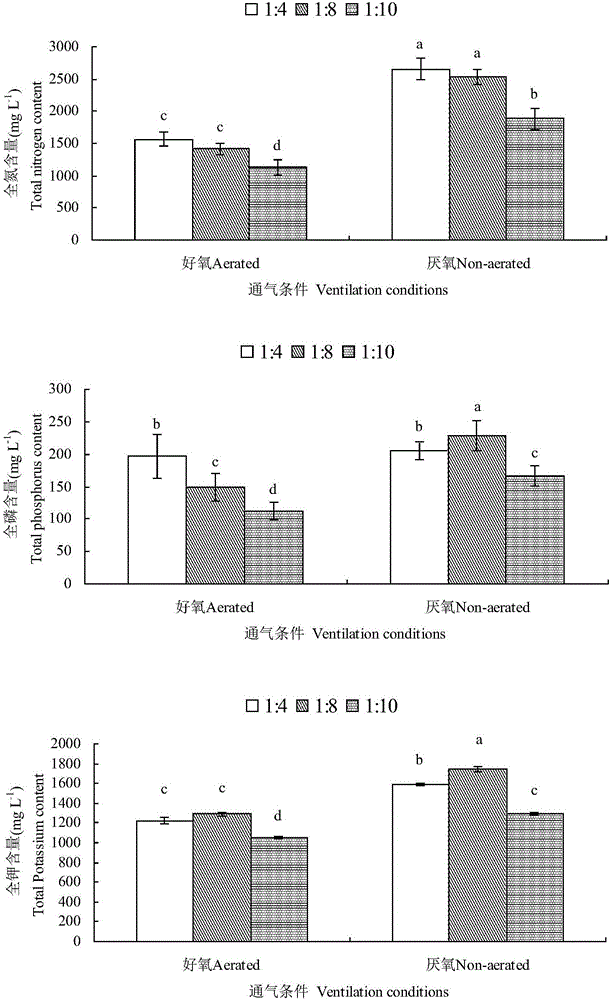
图1为不同提取比例和通气条件对酒糟堆肥提取液养分含量的影响;
图2为不同浸提比例和通气条件对可浸提主要成分提取率的影响(25℃);
图3为不同提取工艺酒糟堆肥提取液中细菌16S rDNA V3片段PCR产物的DGGE图谱;
图4为不同提取工艺酒糟堆肥提取液细菌DGGE图谱系统分析。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
一、实施例:
1、材料准备
酒糟堆肥由金沙加孟农业专业合作社提供,其基本性质如下:有机质(OM):74.8%;全氮(TN):3.57%;全磷(TP):2.18%和全钾(TK):1.23%。
2、浸提液制备
将酒糟堆肥与水按1:8的质量比例充分混匀后置于塑料桶内,在塑料桶中均匀分布地插入三根带有冒气头的气管,在20℃-25℃下持续通气36h,再经双层纱布过滤后即得酒糟有机肥浸提液,在4℃下保存备用,其中通气量为33L·min-1。
3、浸提液使用
在作物生长阶段,可将该浸提液作为根施施用,以利于作物根系的生长,进而起到促生作用。
二、设计试验及分析方法
1、材料准备
原料酒糟堆肥如前所述。
2、不同提取工艺酒糟堆肥提取液制备
将堆肥与水(堆肥与水质量比为1:8)充分混匀,连续搅拌15min,静置片刻,双层纱布过滤后,滤液(在4℃下保存)备用。这种提取方法所获得的提取液称之为直接提取酒糟堆肥提取液(DEC)。
将堆肥与水充分混匀后,密封塑料桶并盖好盖子,保存7天(20℃-25℃),再经双层纱布过滤,滤液(在4℃下保存)备用。这种提取方法所获得的提取液称之为厌气提取酒糟堆肥提取液(NAFEC)。
将堆肥与水充分混匀后,在每个桶中均匀分布地插入三根带有冒气头的气管,持续通气(通气量为33L·min-1)36h(20℃-25℃),经双层纱布过滤,滤液(在4℃下保存)备用。这种提取方法所获得的提取液称之为好气提取酒糟堆肥提取液(AFEC)。
每种工艺重复3次。
3、不同提取工艺酒糟堆肥提取液基本理化性质分析
酒糟堆肥提取液理化性质分析参照有机肥养分测定农业行业标准(2002)和鲍士旦(2000)主编《土壤农化分析》。分析前,需将堆肥提取液经中速定量滤纸(直径为11cm)过滤。有机质含量的测定采用重铬酸钾容量法。
TN、TP和TK的前处理:取2mL酒糟堆肥提取液,双氧水-浓硫酸消煮,定容到100毫升待测。
TN:用连续流动自动分析仪(Auto Analyzers 3,Bran+Luebbe Germany)测定;TP:用钼锑抗比色法722分光光度计测定;TK:用FP6400火焰光度计测定。
电导率(EC)和pH的测定:酒糟堆肥提取液经滤纸过滤后用电导仪(WTW,LF91,Germany)和pH计(PB-10,Sartorius)直接测定。
以上各样品分析重复5次。
总水溶性有机碳(TWSOC)和腐殖酸碳:TWSOC和Humic-C含量采用TOC仪测定(Elementar Liquid TOCⅡ,德国),重复3次。
4、不同提取工艺酒糟堆肥提取液微生物区系和细菌群落结构分析
①不同提取工艺酒糟堆肥提取液可培养微生物区系分析
采用连续稀释培养法(Ren等,2008)。堆肥提取液可培养微生物计数培养基:细菌采用牛肉膏蛋白胨培养基;放线菌用高氏1号培养基;真菌用马丁氏培养基。
②不同提取工艺酒糟堆肥提取液细菌群落结构多样性分析
土壤DNA的提取和纯化方法参考:张瑞福等(2003);黄婷婷等(2004)方法,并稍作修改。具体方法如下:
称取5mL堆肥提取液样品,与13.5mL DNA提取缓冲液混合,加入100μL蛋白酶K(10mg·mL-1),于37℃摇床上振荡30min(225r·min-1);再加入1.5mL的200g·L-1十二烷基硫酸钠(SDS),65℃水浴2h,其间每隔15-20min轻轻颠倒混匀;迅速置于-70℃冰冻30min,取出后于65℃水浴融化,如此反复2-3次裂解细胞;室温离心(12000rpm)10min,收集上清液,转移到50mL离心管中,样品沉淀再加入4.5mL提取液和0.5mL的200g·L-1SDS,涡旋10s,65℃水浴10min,室温离心(12000rpm)10min,收集上清液并与前次上清液合并。上清液用等体积的氯仿-异戊醇(v:v=24:1)抽提,离心后吸取水相转移至另一50mL离心管中,以0.6体积异丙醇室温沉淀1h,室温离心(12000rpm)20min,收集核酸沉淀,用冷的700ml·L-1乙醇洗涤沉淀,吹干,溶解于灭菌的超纯水中,最终体积为200μL。
聚合酶链式反应(PCR)参考Nakatsu等(2000)方法。PCR扩增反应体系:10×缓冲液2.5μL,dNTP(25mmol·L-1)2μL,引物1(25pmol·ìL-1)0.5μL,引物2(25pmol·ìL-1)0.5μL,Mg2+(25mmol·L-1)2.5μL,模板(适当稀释的土壤DNA)1μL,Taq DNA聚合酶1μL,双蒸水15μL,总体积25μL。反应条件:94℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸15s,72℃保持5min,共循环35次,4℃保温。
引物为细菌通用引物:引物1:PRBA338F Bacteria V3region(338-358)5-AC TCC TAC GGG AGG CAG CAG-3;引物2:PRUN518R Universal V3region(534-518)5-ATT ACC GCG GCT GCT GG-3;GC clamp:5-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G-3。
DGGE及DGGE凝胶的分析参考Asakawa等(2008),Nakatsu等(2000)和Navarro-Noya等(2010)。
堆肥提取液中DNA经过PCR扩增后,采用D-Code突变检测系统(Bio-Rad)对样品进行DGGE分析。所用的聚丙烯酰胺凝胶浓度为8%,变性梯度为40%-60%,80V恒温60℃,1×TAE中电泳16h,银染后扫描,采用Quantity One(Bio-Rad)分析结果。
③不同提取工艺酒糟堆肥提取液细菌群落功能多样性指数
准确称取10mL堆肥提取液样品,加入到加入90mL无菌生理盐水(0.85%NaCl)中稀释,在摇床里振摇30min,静止沉淀3~5min,然后进行100倍稀释,以每孔150μL稀释液加入微孔板中,将制备好的菌悬液倒入无菌移液槽中,使用八孔移液器将其接种于Ecoplate的96孔中,放入Biolog Omnilog仪中28℃恒温培养,每15min自动测定波长为590nm和750nm的颜色与浊度。
计算土壤微生物群落功能多样性指数分别由Shannon多样性指数(H)、Simpson优势度指数(D)—和McIntosh均匀度指数(U)来表示。
H=-∑PilnPi;
其中Pi为第i孔相对吸光度值与整个平板相对吸光度值总和的比率;
其中,ni为第i孔的相对吸光值,N为相对吸光度值总和。
5、数据处理
可浸提主要成分提取率(%)=(堆肥浸提液中全氮含量×全氮所占权重+全磷含量×全磷所占权重+全钾含量×全钾所占权重)/(试验所用堆肥中全氮含量×全氮所占权重+全磷含量×全磷所占权重+全钾含量×全钾所占权重)×100。
某一成分所占权重=堆肥浸提液中某一成分的量/全部成分的量。
试验数据用采用Microsoft Excel 2003处理,显著性分析采用SPSS Base Ver.13.0统计软件(SPSS,IL,Chicago,USA)进行Duncan多重比较(P≤0.05)。
6、结果与分析
6.1不同提取比例及通气条件对酒糟堆肥提取液的养分含量的影响
从图1可以看出,不同提取比例和通气条件都能在一定程度上影响酒糟堆肥提取液中的主要养分含量。对于浸提液全氮量而言,不管好气条件和厌氧条件下1:4处理的全氮含量与1:8处理之间无明显差异但显著高于1:10处理,比1:10处理增加39.2%(好气条件)和40.8%(厌氧条件)。对于浸提液全磷量而言,在好气条件下,不论提取比例如何,好气提取酒糟堆肥提取液中的有机质和全磷含量均高于厌气提取酒糟堆肥提取液中的有机质和全磷含量。而好气提取酒糟堆肥提取液和厌气提取酒糟堆肥提取液中的全氮和全钾含量相当。对于不同提取比例而言,堆肥与水的比例为1:8和1:5处理的酒糟堆肥提取液中主要养分含量相对较高(图2)。
6.2好氧条件下不同浸提时间对酒糟堆肥提取液的养分含量的影响
在好气条件下,酒糟堆肥提取液中有机质、全氮、全磷和全钾含量均随着提取时间的延长而逐渐增加,最后趋于稳定(表1)。从表中可以看出,提取36h-84h的酒糟堆肥提取液中有机质、全氮、全磷和全钾含量均没有显著差异。提取36h的酒糟堆肥提取液中有机质、全氮、全磷、全钾含量比提取12h和24h的酒糟堆肥提取液中有机质和全氮含量分别增加了30.5%和5.8%、32.2%和13.7%、25.7%和11.8%、19.0%和8.0%。
表1不同时间对好气提取酒糟堆肥提取液中主要养分含量的影响
注:每列数值后标不同字母表示在5%水平差异显著(邓肯检验)。
6.3不同提取工艺酒糟堆肥提取液可培养微生物区系分析
表2为不同提取工艺酒糟堆肥提取液可培养微生物区系,从表3可以看出,DEC中可培养细菌数量分别比AFEC和NAFEC增加了163.6%和217.8%,而DEC和NAFEC中可培养放线菌数量分别比AFEC提高了256.1%和166.4%,DEC
注:每列数值后标不同字母表示在5%水平差异显著(邓肯检验)。
6.4不同提取工艺酒糟堆肥提取液细菌群落结构多样性分析
图3为不同提取工艺酒糟堆肥提取液中细菌16S rDNA V3片段PCR产物的DGGE图谱,从该图中可看出,与DEC中的细菌DGGE条带数相比,AFEC和NAFEC细菌DGGE条带数明显减少,但是AFEC细菌DGGE条带数又多于NAFEC细菌DGGE条带数。DGGE条带图案相似性系统树由Quantity One软件根据戴斯系数按照Neighbor Joining计算绘出,戴斯系数的范围从0(没有共同条带)到1(所有条带相同)。用戴斯系数计算出的各泳道样品相似性矩阵,用它可以对DGGE图谱中各泳道样品间的相似性进行比较。邻接法分析(Neighbor Joining)表明(图4),三种酒糟堆肥提取液样品的细菌分为两大族群,DEC为一个族群,AFEC和NAFEC为另一个族群,且AFEC和NAFEC族群的相似度达到0.51。
6.5不同提取工艺酒糟堆肥提取液细菌群落功能多样性分析
表3表示不同提取工艺酒糟堆肥提取液细菌DGGE群落结构多样性分析结果。从表中可以看出,AFEC和NAFEC细菌丰度指数分别比DEC减少了15.0%和45.0%,而NAFEC细菌丰度指数比AFEC减少了35.3%。三种酒糟堆肥提取液细菌多样性指数的变化趋势同细菌丰度指数的变化趋势,DEC细菌多样性指数分别比AFEC和NAFEC增加了7.9%和19.0%,而AFEC细菌多样性指数比NAFEC增加了13.7%。然而,三种酒糟堆肥提取液细菌均度指数则没有显著差异。对于不同提取工艺酒糟堆肥提取液细菌稳定性指数,DEC和AFEC细菌稳定性指数比NAFEC分别增加了51.0%和54.2%,而DEC细菌稳定性指数与AFEC细菌稳定性指数相当。
表3不同提取工艺酒糟堆肥提取液细菌DGGE群落结构多样性分析
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!