与小麦株高主效QTL紧密连锁的分子标记及其应用的制作方法
本发明涉及一种与小麦株高主效QTL紧密连锁的分子标记及其应用,属于生物技术领域。
背景技术:
小麦是我国第三大粮食作物。据中国粮油信息网报道,2013年-2014年全国小麦供给约2208亿斤,需求约2328亿斤,年度缺口约120亿斤,国内小麦供需仍处于紧平衡并略有缺口状态。我国新的粮食安全战略目标是确保水稻、小麦、玉米三大主粮自给率保持在95%以上,其中水稻、小麦两大口粮保持100%自给。随着人口不断增加和耕地面积的减少,进一步提高我国小麦单产对于对保障国家粮食安全具有重要的现实意义。
发现和利用产量相关的关键基因,对挖掘小麦产量遗传潜力,提高小麦单产起着重要作用。例如,“绿色革命”中半矮秆品种的培育使小麦等作物产量得到了大幅度提高。小麦矮秆基因Rht1的克隆及功能研究说明,一个或少数基因就有可能导致一次产量育种的重大突破。最新研究表明,Rht1基因在降低株高的同时,也导致粒重显著降低。因此,要打破现有高产品种的单产水平,需要利用新的矮秆基因,相关基因的定位和克隆也是小麦株高性状改良的重要基础。
国内外学者已经利用不同的遗传背景及不同环境条件对株高QTL进行了定位分析研究。Ellis等(2005)定位了许多能降低株高但不影响早期生长的基因。Keller等(1999)利用普通小麦Forno和斯卑尔脱小麦Oberkulmer的重组自交系群体,在三个环境中检测到分布于9条染色体上的11个QTLs,单个QTL可解释表型变异的7.9%-31.4%,全部QTLs可解释72.6%的表型变异。刘冬成等(2003)利用ND3338×F390的F2:3家系在4个环境条件下定位了7个与小麦株高相关的QTL,单个QTL可解释表型变异的5.2%-37.2%,所有的QTL可解释表型变异的64.8%-75.0%。Wang等(2009)利用Heshangmai×Yu8679的RIL群体检测到6个株高QTL,分别位于1D、2D、3D和4D染色体上,单个QTL可解释表型变异的5.83%-25.24%。
分子标记的开发利用及分子标记技术的日趋成熟和完善,进一步为小麦数量性状基因的定位研究提供了有利工具。Cadalen等(1998)利用Courtot与中国春杂交产生的DH群体定位了9个与小麦株高相关的QTL,其中有2个RFLP标记Xfba1-4B、Xfba211-4D分别与矮秆基因Rht1、Rht2连锁。石涛等(2008)通过BSA法,利用F2分离群体筛选到2A染色体上的2个SSR标记wmc522和wmc198与矮秆基因连锁。
20世纪60年代以来,小麦矮秆基因研究取得较大进展,矮秆和半矮秆小麦品种的 育成和推广对全世界小麦产量的提高起了关键作用。截至目前,已命名了25个与株高相关的Rht(reduced height)基因,其中11个来自于自然突变,另外的14个来自于物理化学诱变(李杏普等,2010)(如表1所示)。近年来,随着小麦基因组数据平台和高通量测序技术的日益成熟和完善,关于矮杆基因的定位和克隆的研究也比较多。例如,Pearce等(2011)通过对Rht1基因的不同拷贝进行分析,阐明了相同基因的不同拷贝间因序列差异而产生不同表型的分子基础。Gasperini等(2012)利用Cappelle-Desprez和Cappelle-Desprez的2D染色体片段代换系,对Rht8基因进行了精细定位,将Rht8定位在1.29cM的区间内并认为该基因降低株高可能与油菜素内酯有关。
表1 部分小麦矮杆基因的名称、染色体位置和来源
矮杆基因的发现和利用最早始于19世纪日本的地方品种赤小麦(Akagomugi)和达摩(Daruma)。1916年,育种家Strampelli利用赤小麦参加杂交在意大利育成矮杆小麦品种矮粒多(赵洪璋等,1991)。1935年,日本从达摩矮源的杂交后代中育成了著名的农林10号。之后,美国于20世纪40年代引进农林10号育成了高产品种Gaines和Nugains;20世纪70年代,英国J.A.Report利用农林10号的衍生系育成了最早的高产品种Maris Fundin和Hobbit。1962年,世界玉米小麦改良中心利用农林10号育成了丰产性强、适应性广、株高65cm-85cm、叶片直立的墨西哥小麦Pitic62、Penjamo62等第一批矮杆春小麦,在中美、中东、南亚、南美、北非等地广为种植。1964年利用智利小麦沃格尔系的衍生后代,1974年育成了半矮秆冬小麦品种Fundin,随后又育成Hobbit、Norman、Avelon等半矮秆高产品种,推广面积达4000万hm2以上。
我国在小麦的育种中也利用了小麦的矮杆基因,但是矮杆基因来源比较单一。杨松杰等(2006)对中国主要麦区的239份品种的矮杆基因频率分析结果表明,中国小麦品种或品系携带的Rht-B1b矮秆基因来自St2422/464和农林10号,Rht-D1b矮秆基因来自农林10号、水源86、辉县红和蚰包麦。我国生产上利用的矮源研究较多的是Rht-B1b、Rht-D1b和Rht8,不同麦区3个矮秆基因的分布频率大小不同(张晓科等,2007)。
技术实现要素:
本发明的目的是提供一种成套DNA分子,由SEQ ID No.1所示的DNA分子和SEQ ID No.2所示的DNA分子组成;
所述SEQ ID No.1所示的DNA分子和所述SEQ ID No.2所示的DNA分子可以独立包装,也可以混合包装;
所述成套DNA分子用于鉴定或辅助鉴定小麦株高性状。
鉴定或辅助鉴定小麦株高性状的方法也属于本发明的保护范围,包括如下步骤:以京冬6号小麦的基因组DNA为模板,以所述的成套DNA分子为引物进行PCR扩增,得到PCR扩增产物,将其记作PCR扩增产物A;以待测小麦的基因组DNA为模板,以所述的成套DNA分子为引物进行PCR扩增,得到PCR扩增产物,将其记作PCR扩增产物K;所述PCR扩增产物A由大小为Nbp的DNA分子和378bp的DNA分子组成,如果所述PCR扩增产物K也由所述大小为Nbp的DNA分子和所述378bp的DNA分子组成,则所述待测小麦为基因型为A的待测小麦,如果所述PCR扩增产物K不由所述大小为Nbp的DNA分子和所述378bp的DNA分子组成,则所述待测小麦为基因型为非A的待测小麦,所述基因型为A的待测小麦的株高低于或候选低于基因型为非A的待测小麦;
所述N大于378;
所述基因型为非A的待测小麦可以为如下待测小麦:以农大3338的基因组DNA为模板,以所述的成套DNA分子为引物进行PCR扩增,得到PCR扩增产物,将其记作PCR扩增产物B;所述PCR扩增产物B由所述大小为Nbp的DNA分子和360bp的DNA分子组成,如果所述PCR扩增产物K也由所述大小为Nbp的DNA分子和所述360bp的DNA分子组成,则所述待测小麦为基因型为非A的待测小麦。
鉴定或辅助鉴定小麦株高的试剂盒也属于本发明的保护范围,该试剂盒包含所述的成套DNA分子;
该试剂盒还包含记载在可读载体上的使用说明,说明中记载上述方法。
上述成套DNA分子或上述试剂盒在制备与小麦株高性状相关的SSR分子标记中的应用也属于本发明的保护范围。
上述成套DNA分子、上述方法和/或上述试剂盒在小麦选育中的应用也属于本发 明的保护范围;
所述小麦选育是根据上述方法选择基因型为A的小麦进行育种。
上述方法中所述待测小麦为周8425B、郑育麦9987、核生2号、矮抗58、郑麦7698、鲁麦22、平原50、SNO55849、泰农2987、泰山24、泰山4606、烟农24、存麦8号、德宏福麦6号、德宏福麦7号、泛麦8号、华培8号、华育116、冀麦325、浚2016、兰考198、平安8号、平安9号、濮麦9号、齐麦2号、神麦1号、天民198、天民298、温9519、温9629、西农979、新麦9号、徐麦0054、徐科316、预麦49-198、预展4号、中鉴49、中育113、周麦17、兰考926、洛旱7号、长4738、晋47、远旱805、邯7086、衡4332、衡观35、衡观216、中麦629、DI4、鄂麦14、Hubel、金丰7183、济麦22、开麦21、科遗5214、良星99、农大212、农大3634、泉麦890、许科718、新麦20、许农5号、西农94、育德1号、宜麦8号、藏1817、藏1863、豫麦57、法国1、法国2和法国3中的至少一种。
本发明在小麦株高性状的分子标记辅助育种中具有重要应用。
附图说明
图1为小麦株高主效QTL QPh-5A.1区间与水稻、短柄草的同源性关系比对结果。
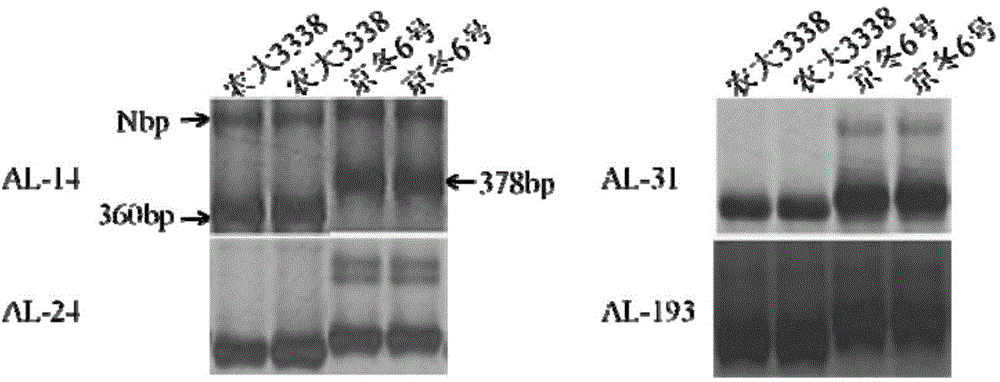
图2为AL-14、AL-24、AL-31和AL-193共4个SSR分子标记在亲本农大3338和京冬6号中的扩增带型。
图3为小麦株高主效QTL QPh-5A.1区间的分子标记遗传连锁图谱。
图4为新开发的SSR标记AL-14在部分小麦不同材料中的扩增带型。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
小麦农大3338和小麦京冬6号均在文献“逯腊虎,魏强,王飞等.普通小麦农大3338×京冬6号DH系群体株高及节间长度的QTL分析.中国农业大学学报,2014,19(1):1-8.”中公开过,公众可从中国农业大学获得。
周8425B、郑育麦9987、核生2号、矮抗58、郑麦7698、鲁麦22、平原50、SNO55849、泰农2987、泰山24、泰山4606、烟农24、存麦8号、德宏福麦6号、德宏福麦7号、泛麦8号、华培8号、华育116、冀麦325、浚2016、兰考198、平安8号、平安9号、濮麦9号、齐麦2号、神麦1号、天民198、天民298、温9519、温9629、西农979、新麦9号、徐麦0054、徐科316、预麦49-198、预展4号、中鉴49、中育113、周麦17、兰考926、洛旱7号、长4738、晋47、远旱805、邯7086、衡4332、衡观35、衡观216、中麦629、DI4、鄂麦14、Hubel、金丰7183、济麦22、开麦21、科遗5214、良星99、农大212、农大3634、泉麦890、许科718、新麦20、许农5号、西 农94、育德1号、宜麦8号、藏1817、藏1863、豫麦57及3份法国小麦材料法国1、法国2和法国3为目前国内广泛推广的小麦品种,公众可从中国农业大学获得。
下述实施例中的株高QTL QPh-5A.1为降低株高的主效QTL。
实施例1、SSR分子标记AL-14的发现及应用
一、QPh-5A.1区间内SSR分子标记的筛选
前期初定位结果中,小麦5A染色体上的株高QTL QPh-5A.1的加性效应为2.46cm-4.73cm,可解释株高变异的2.75%-11.87%,该QTL位于两个SNP标记BS00021805_51和BS00010698_51之间且该区间内暂无其他标记的报道。在此基础上,本发明针对目标区间BS00021805_51-BS00010698_51,继续开发新的分子标记,以期为该株高QTL QPh-5A.1的精细定位及分子标记辅助育种奠定基础。
根据国际小麦基因组测序协会(http://www.wheatgenome.org/)发布的genome zipper,进行株高主效QTL QPh-5A.1区间内小麦与水稻、短柄草的染色体共线性关系比对(如图1所示)。根据同源性关系比对结果,利用该区间内所包含的水稻基因序列,从小麦基因组测序协会数据库中提取获得小麦株高主效QTL QPh-5A.1区间内的基因组序列。在此基础上,借助primer3.0进行目标区间内的引物设计。分别提取两个亲本农大3338和京冬6号的幼嫩叶片的基因组DNA并以此为模板,利用设计的引物对进行PCR扩增,得到PCR扩增产物,并将PCR扩增产物进行8%的非变性聚丙烯酰胺凝胶电泳检测及小群体验证,最终获得QPh-5A.1区间内多态性明显且带型清晰的4个SSR分子标记AL-14、AL-24、AL-31和AL-193。
AL-14、AL-24、AL-31和AL-193共4个SSR分子标记在亲本农大3338和京冬6号中的扩增带型如图2所示。
二、QPh-5A.1区间内的连锁图谱构建
以农大3338为母本,以京冬6号为父本杂交得到F1并对F1代植株进行花药培养再加倍后,自交多代,获得由203个植株组成的DH群体。提取DH群体、京冬6号及农大3338的基因组DNA,分别以其为模板,利用QPh-5A.1区间两端的SNP标记BS00021805_51和BS00010698_51及步骤一获得的4个多态性SSR标记进行PCR扩增,得到PCR扩增产物,并将PCR扩增产物进行8%聚丙烯酰胺凝胶电泳,检测各分子标记的扩增带型,将DH群体单株的扩增带型与京冬6号、农大3338的扩增带型进行比较。其中带型与亲本京冬6号相同的记为A,与亲本农大3338相同的记为B,缺失记为“-”。在此基础上,借助JoinMap4.0进行QPh-5A.1区间内的遗传图谱构建,其中“A” 记为2,“B”记为0,“-”记为-1。利用Kosambi函数,获得6个分子标记在目标区段上的最优顺序及标记间新的遗传距离即目标区段内的遗传连锁图谱,如图3所示,图3中,左侧数字表示各分子标记间的相对遗传距离,单位为cM。
图3表明,AL-14、AL-31和AL-193共3个SSR分子标记被加密到目标区间BS00021805_51-BS00010698_51内且AL-14与顶端标记BS00021805_51连锁最紧密,其间的遗传距离仅为0.63cM,而AL-24位于区间顶端SNP分子标记BS00021805_51上仅0.66cM处,可视为与目标QTL连锁的分子标记。
SSR分子标记AL-14的引物、退火温度如表2所示。
表2 SSR分子标记AL-14的引物、退火温度(Tm)
三、不同小麦材料中株高主效QTL QPh-5A.1的检测
提取农大3338、京冬6号、国内目前广泛推广的小麦品种中的69份小麦材料:周8425B、郑育麦9987、核生2号、矮抗58、郑麦7698、鲁麦22、平原50、SNO55849、泰农2987、泰山24、泰山4606、烟农24、存麦8号、德宏福麦6号、德宏福麦7号、泛麦8号、华培8号、华育116、冀麦325、浚2016、兰考198、平安8号、平安9号、濮麦9号、齐麦2号、神麦1号、天民198、天民298、温9519、温9629、西农979、新麦9号、徐麦0054、徐科316、预麦49-198、预展4号、中鉴49、中育113、周麦17、兰考926、洛旱7号、长4738、晋47、远旱805、邯7086、衡4332、衡观35、衡观216、中麦629、DI4、鄂麦14、Hubel、金丰7183、济麦22、开麦21、科遗5214、良星99、农大212、农大3634、泉麦890、许科718、新麦20、许农5号、西农94、育德1号、宜麦8号、藏1817、藏1863、豫麦57及3份法国小麦材料法国1、法国2和法国3的基因组DNA,并分别以各小麦的基因组DNA为模板,利用新开发的与目标QTL QPh-5A.1连锁最紧密的SSR分子标记AL-14的引物对(即表2所示的AL-14的正向引物和反向引物)进行PCR扩增,得到各PCR扩增产物,并将各PCR扩增产物进行8%聚丙烯酰胺凝胶电泳,检测SSR分子标记AL-14在不同小麦材料中的扩增带型。SSR分子标记AL-14在部分小麦材料中的扩增结果如图4所示。
根据如下标准进行待测小麦基因型的判断:将以农大3338的基因组DNA为模板,以表2所示的AL-14的正向引物(SEQ ID No.1)和反向引物(SEQ ID No.2)为引物进行PCR扩增得到的PCR扩增产物记作PCR扩增产物B;将以京冬6号的基因组DNA 为模板,以表2所示的AL-14的正向引物(SEQ ID No.1)和反向引物(SEQ ID No.2)为引物进行PCR扩增得到的PCR扩增产物记作PCR扩增产物A;将PCR扩增产物A和PCR扩增产物B进行8%的聚丙烯酰胺凝胶电泳,PCR扩增产物A和PCR扩增产物B均由两条电泳条带组成,如图4所示。进一步的测序结果证明,PCR扩增产物A和PCR扩增产物B均由两条大小不同的DNA分子组成,PCR扩增产物B由大小为Nbp的DNA分子和大小为360bp的DNA分组成,PCR扩增产物A由大小为Nbp的DNA分子和大小为378bp的DNA分子组成,其中N>378,;以待测小麦的基因组DNA为模板,以表2所示的AL-14的正向引物(SEQ ID No.1)和反向引物(SEQ ID No.2)为引物进行PCR扩增得到PCR扩增产物,将该PCR扩增产物记作PCR扩增产物K,将PCR扩增产物K的聚丙烯酰胺凝胶电泳的带型与PCR扩增产物A的同一浓度的聚丙烯酰胺凝胶电泳的带型相同的待测小麦,即PCR扩增产物K由大小为Nbp的DNA分子和大小为378bp的DNA分子组成的待测小麦,记作基因型为A的小麦,将PCR扩增产物K不由大小为Nbp的DNA分子和大小为378bp的DNA分子组成的待测小麦,记作基因型为非A的小麦,其中基因型为非A的小麦可以为聚丙烯酰胺凝胶电泳的带型与PCR扩增产物B的同一浓度的聚丙烯酰胺凝胶电泳的带型相同的待测小麦,即PCR扩增产物K由大小为Nbp的DNA分子和大小为360bp的DNA分子组成的待测小麦。以上N均相同。
统计以上除农大3338、京冬6号以外的72份不同小麦材料的检测结果,如表3所示。
表3表明,对于SSR分子标记AL-14,31份小麦材料的PCR扩增产物的电泳带型与京冬6号相同,基因型均为A,计算其基因型变异频率为43.06%。由此推测,以上基因型检测结果中与京冬6号相同的31份材料中可能含有该株高主效QTL QPh-5A.1,其株高低于或候选低于不含有该株高主效QTL QPh-5A.1的小麦材料。
表3 AL-14在72份不同小麦材料中的基因型变异频率
本发明通过同源比对,开发了与小麦株高主效QTL QPh-5A.1连锁的4对SSR标记AL-14、AL-24、AL-31和AL-19且AL-14与目标QTL连锁最紧密,对目标区间进行了加密,为目标QTL的精细定位和克隆提供新的遗传标记。同时,利用AL-14对不同小麦品种中是否含有降低株高的主效QTL QPh-5A.1进行检测,从而快速筛选出具有该株高主效QTL的小麦品种。由此可见,本发明所提供的SSR标记AL-14可用于小麦株高性状的分子标记辅助育种及图位克隆,大大加快小麦矮杆高产品种的选育进程。
- 还没有人留言评论。精彩留言会获得点赞!