蛋白Bach1在制备细胞Wnt信号通路抑制剂中的用途的制作方法
本发明属于生物技术及医药领域,涉及蛋白Bach1的新用途,具体涉及一种蛋白Bach1在用于制备细胞Wnt信号通路抑制剂中的用途。
背景技术:
现有技术公开了Wnt信号通路是细胞内十分重要的信号通路,它与肿瘤、血管再生、细胞增殖、组织再生、胚胎发育、以及神经、骨骼的发生和发展密切相关。研究显示,Wnt信号转导途径主要分为依赖于β-catenin/TCF转录复合物的经典Wnt信号转导途径(Wnt/β-catenin途径)及不依赖于β-catenin/TCF转录复合物的非经典Wnt信号转导途径(Wnt/Ca2+途径和Wnt/JNK途径)。在经典Wnt信号转导途径中,转录激活子β-Catenin是核心成分;在没有Wnt信号的情况下,细胞质中的β-Catenin和许多蛋白形成多蛋白复合物,β-Catenin被泛素化降解;当Wnt信号通路活化时,Wnt与受体Fzd结合激活细胞内的一些蛋白阻止了β-Catenin的降解。有研究报道了β-Catenin在细胞内积累并进入细胞核与T细胞因子TCF淋巴细胞增强因子家族的转录因子形成复合物激活下游基因的转录。业内技术人员认为,由于Wnt/β-catenin信号途径与众多的癌症和疾病有关系,所以调节失控的Wnt/β-catenin信号途径可以作为治疗与Wnt/β-catenin信号途径相关疾病的一个重要手段,因此,Wnt/β-catenin信号通路抑制剂的研究与应用对于异常Wnt信号通路相关疾病的治疗具有重要意义。
BTB-CNC同源体1(BTB and CNC homology 1,Bach1)是一个转录抑制因子,属于碱性亮氨酸拉链蛋白家族,其结构高度保守,广泛存在于哺乳动物各种组织中;人的Bach1蛋白含736个氨基酸,分子量为92kDa。已知Bach1调控的下游基因有血红素氧合酶-1(heme oxygenase-1,HO-1)等,但是,目前还未见有关Bach1作为Wnt信号通路抑制剂以及相关应用的报道。
技术实现要素:
本发明的目的是提供蛋白Bach1的新用途,具体涉及蛋白Bach1在用于制备细胞Wnt信号通路抑制剂中的用途。
本发明所述的Bach1蛋白,其氨基酸序列如SEQ ID NO.1所示的多肽。
本发明中,进行了Bach1抑制细胞Wnt/β-catenin调控路径实验,其中包括:通过Bach1抑制Wnt/β-catenin报告基因TOPFlash的活性和靶基因的表达,Bach1抑制β-catenin与TCF4的蛋白结合,Bach1抑制β-catenin与CBP/P300的蛋白结合,和通过招募HDAC1与Wnt靶基因的启动子区域结合等试验;以及进行了Bach1诱导细胞周期阻滞和凋亡,抑制细胞增殖实验,其中包括:细胞周期分析实验,细胞凋亡实验,和细胞增殖实验;实验结果显示,所述的Bach1通过直接阻断β-catenin/TCF的蛋白结合干扰转录复合体的形成以实现Wnt信号通路抑制;Bach1通过抑制Wnt信号通路实现Wnt信号通路报告基因和靶基因表达抑制;Bach1通过选择性抑制Wnt信号通路诱导细胞周期阻滞和凋亡以实现细胞增殖抑制。
本发明公开了蛋白Bach1能用于抑制细胞经典Wnt信号途径的新用途,经实验证实,Bach1能抑制经典Wnt信号通路的报告基因或目的基因的表达活性,Bach1蛋白通过直接阻断β-catenin/TCF的蛋白结合干扰转录复合体的形成从而抑制Wnt信号通路靶基因表达,抑制细胞增殖并诱导凋亡,实验结果表明,蛋白Bach1可作为干预异常Wnt信号通路有关的疾病(例如,与Wnt信号通路激活相关的疾病或是Wnt信号通路组分突变所致的遗传疾病)的药物靶点;进一步用于制备调节经典Wnt信号途径的药物,和用于制备细胞Wnt信号通路抑制剂,尤其是用于制备预防和/或治疗与异常Wnt信号通路有关的疾病的药物。
本发明所述的与Wnt信号通路激活相关的疾病,选自:癌症,血管发生,异常细胞增殖,糖尿病性视网膜病,肺纤维化,类风湿性关节炎,硬皮病,霉菌或病毒感染,骨或软骨疾病,阿尔茨海默病或骨关节炎等;
本发明所述的Wnt信号通路组分突变所致的遗传疾病,选自:结肠息肉病、骨质疏松-假性神经胶质瘤综合征、家族性渗出性玻璃体视网膜病变、视网膜血管发生、早期冠心病、先天性四肢切断综合征、2型糖尿病、富尔曼综合征、维尔姆斯瘤、骨骼发育异常、灶性皮肤发育不全、常染色体隐性甲缺如、神经管缺陷或α地中海贫血(ATRX)综合征。
附图说明
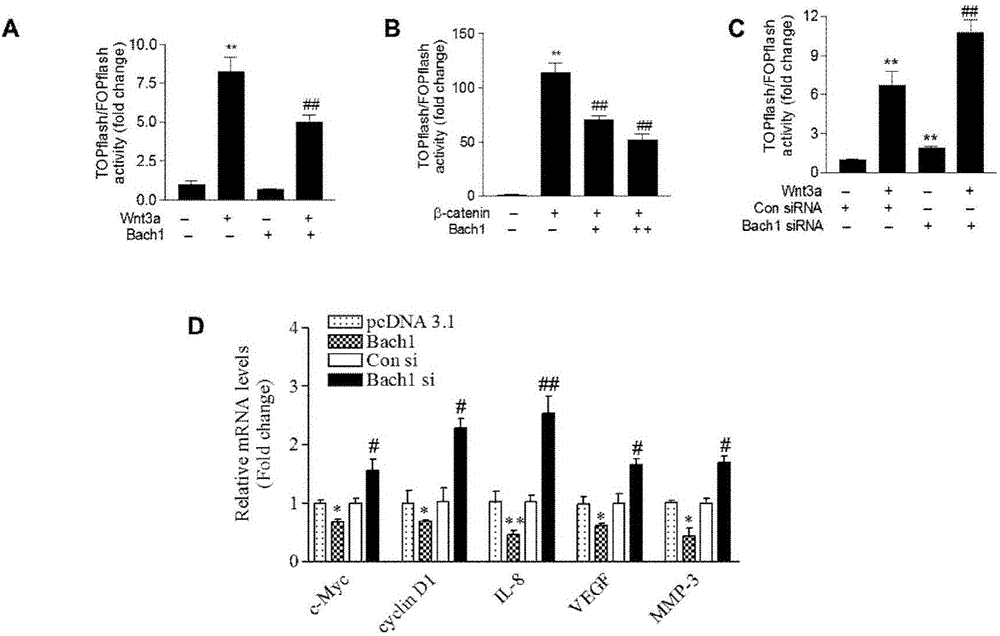
图1为Bach1抑制细胞经典Wnt信号途径报告基因TOPFlash的活性和靶基因 的表达,其中,
图1A显示,Bach1基因过表达抑制Wnt3a激活的TOPFlash报告基因活性;图1B显示,Bach1基因过表达抑制β-catenin激活的TOPFlash报告基因活性;图1C显示,Bach1基因抑制增加基础或Wnt3a激活的TOPFlash报告基因活性;图1D显示,Bach1基因过表达抑制,Bach1基因减少促进Wnt/β-catenin信号途径靶基因的表达。
图2为Bach1与TCF4结合,抑制β-catenin与TCF4的蛋白结合,
其中,图2A显示了利用免疫共沉淀法分析Bach1与TCF4的相互作用,Bach1全长或Bach1N-段与TCF4有结合;图2B显示Bach1对β-catenin与TCF4结合的影响,Bach1抑制β-catenin与TCF4的蛋白结合。
图3为利用免疫共沉淀法分析Bach1对β-catenin与CBP/P300结合的影响,
其中,图3A和3B显示了Bach1抑制β-catenin与CBP/P300的蛋白结合;图3C显示了Bach1抑制β-catenin的乙酰化水平。
图4为Bach1通过招募HDAC1与Wnt靶基因的启动子区域结合,抑制靶基因转录,
其中,图4A显示了利用免疫共沉淀法分析Bach1与HDCA1的相互作用,结果表明,Bach1与组蛋白去乙酰化酶1(HDCA1)有结合;图4B显示了Bach1对组蛋白去乙酰化酶活性的影响,结果表明,Bach1过表达增加组蛋白去乙酰化酶活性,酶活性的增加可以被特异性的组蛋白去乙酰化酶抑制剂Trichostatin A(TSA)所抑制;图4C显示了利用染色质免疫共沉淀法分析Bach1是否与IL-8启动子区结合,结果表明,Bach1与IL-8启动子区(-1—-193)有结合;图4D显示了利用染色质免疫共沉淀法分析Bach1过表达对β-catenin,HDAC1与IL-8启动子区结合的影响,结果表明,Bach1过表达招募HDAC1与IL-8的启动子区域结合,抑制β-catenin与IL-8的启动子区域结合,从而抑制IL-8基因转录。
图5为Bach1诱导细胞周期阻滞和凋亡,抑制细胞增殖,
其中,图5A显示了Bach1过表达引起细胞S期阻滞;图5B显示了Bach1过表达诱导细胞的凋亡;图5C显示了Bach1过表达在48和72小时后抑制细胞增殖。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1 Bach1抑制细胞Wnt/β-catenin调控路径试验
试验例1-1:Bach1抑制Wnt/β-catenin报告基因TOPFlash的活性和靶基因的表达
(1)细胞培养
HEK293T细胞在含10%胎牛血清的DMEM(美国Invitrogen公司)培养液中培养,37℃,CO2浓度5%,人微血管内皮细胞(HMVEC)由美国马萨诸塞大学邵荣教授赠予,在ECM培养液中培养;Wnt3a条件培养基从Wnt3a细胞株(CRL-2647,购自美国ATCC细胞库)制备:采用加10%胎牛血清的DMEM细胞培养基培养Wnt3a细胞4天,然后离心收集上清培养基,对照条件培养基从L细胞株(CRL-2648,购自美国ATCC细胞库)制备:采用加10%小牛血清的DMEM细胞培养基培养L细胞4天,然后离心收集上清培养基,经液氮速冻后-80℃长期保存;
(2)细胞转染和荧光素酶(Luciferase,Luc)分析
细胞用脂质体lipofectamin2000(美国Invitrogen公司)按照说明书转染TOPFlash或FOPFlash报告基因质粒(美国Millipore公司)或者Bach1siRNA或对照siRNA,同时共转染pCMV-β-galactosidase(β-gal)质粒作为内参;转染的细胞培养18-20小时后,加入加有小于等于20μM的小分子药物的Wnt3a条件培养基刺激16-20小时,然后用reporter lysis buffer(Promega公司)裂解细胞,用荧光素酶检测系统(Promega公司)检测;β-gal活性用分析缓冲液在37℃孵育1小时后,分光光度计测定420nm吸光度,Luc/β-gal比值为相对的Luc活性(定义为TOPFlash报告基因活性),并以FOPFlash报告基因为对照校正;
(3)RNA提取和逆转录-实时定量多聚酶链反应(RT-PCR)
细胞总RNA的提取按照说明书用Tripure试剂制备;用M-MLV逆转录酶,以oligo(dT)18为引物,将2μg的总RNA逆转录合成cDNA;用特异性的引物扩增VEGF,IL-8,c-Myc,cyclin D1,MMP-3和GAPDH的基因,引物序列如下:
VEGF上游引物(5’-ATCTTCAAGCCATCCTGTGTGC-3’),
VEGF下游引物(5’-CAAGGCCCACAGGGATTTTC-3’);
IL-8上游引物(5’-CTCTCTTGGCAGCCTTCCTGA-3’),
IL-8下游引物(5’-CCCTCTGCACCCAGTTTTCCTT-3’);
c-Myc上游引物(5’-ACAGCGTCTGCTCCACCT-3’),
c-Myc下游引物(5’-CCTCATCTTCTTGTTCCTCCT-3’);
cyclin D1上游引物(5’-TGGAGGTCTGCGAGGAACA-3’),
cyclin D1下游引物(5’-CCTTCATCTTAGAGGCCACGAA-3’);
MMP-3上游引物(5’-TGCTGTTTTTGAAGAATTTGGGTT-3’),
MMP-3下游引物(5’-AGTTCCCTTGAGTGTGACTCG-3’);
GAPDH上游引物(5’-CCATCTTCCAGGAGCGAGATC-3’),
GAPDH下游引物(5’-GCCTTCTCCATGGTGGTGAA-3’);
进行实时荧光定量PCR(方法按照SYBR green PCR master mix试剂盒的说明书),用2-△△Ct方法进行定量分析;结果显示,Bach1基因过表达抑制Wnt3a激活的TOPFlash报告基因活性;Bach1基因过表达抑制β-catenin激活的TOPFlash报告基因活性;Bach1基因抑制增加基础或Wnt3a激活的TOPFlash报告基因活性;Bach1基因过表达抑制,Bach1基因减少促进Wnt/β-catenin信号途径靶基因的表达。
试验例1-2:Bach1抑制β-catenin与TCF4的蛋白结合
(1)蛋白免疫共沉淀实验
HEK293T细胞共转染TCF4-HA和Bach1-flag全长或N-段或C-段Bach1质粒,48小时后收集细胞裂解液用于免疫沉淀和免疫印记实验;免疫沉淀具体的步骤为:将细胞裂解液蛋白(1-1.5mg)与抗Flag的抗体(10μg)混合,4℃孵育3小时,然后加入蛋白A/G琼脂糖珠20μl 4℃孵育过夜,将黏附有Flag抗原抗体复合物的琼脂糖珠用RIPA缓冲液洗1次,PBS洗4次。最后加入2×SDS上样缓冲液,将捕捉的蛋白100℃变性5分钟,然后进行SDS-聚丙烯酰胺凝胶电泳进行蛋白质免疫印记;
(2)蛋白免疫印记实验
通过步骤:细胞RIPA缓冲液(150mM NaCl,100mM Tris,pH8.0,1%Triton X-100,1%脱氧胆酸钠,1%SDS,5mM EDTA,10mM NaF,含蛋白酶抑制剂) 裂解细胞,冰上孵育30分钟,12000rpm离心10分钟收集含有总蛋白的上清,用Bio-Rad蛋白定量试剂盒检测蛋白浓度,等量蛋白进行SDS-聚丙烯酰胺凝胶电泳,并用湿转法将蛋白转移到尼龙膜上,用含0.05%Tween 20,5%脱脂奶粉的PBS缓冲液封闭1小时,特定的抗体4℃孵育过夜,次日洗膜后用二抗孵育1小时,洗膜3-4次,用化学发光试(PE公司)按照说明书操作,在化学发光仪上检测特定蛋白条带;
(3)TCF4融合蛋白与Bach1的结合实验
将构建的TCF4原核表达载体PGEX-TCF4转化大肠杆菌BL21,挑取单菌落接种于含有100纳克/毫升氨卞的2×YT培养基中,37℃振摇培养过夜活化菌种,37℃放大培养至OD600约为0.9时,加入IPTG至终浓度为1mM,18℃诱导培养24小时后离心收集菌体;该菌体超声裂解上清液即为TCF4融合蛋白,与GST-beads 4℃孵育过夜,再与转染Bach1或β-catenin的HEK293T细胞裂解液4℃孵育过夜,结合在beads上的蛋白进行Western blot,用抗体检测相应蛋白;结果表明,Bach1全长或Bach1N-段与TCF4有结合。
试验例1-3:Bach1抑制β-catenin与CBP/P300的蛋白结合,抑制β-catenin的乙酰化
已知CBP/P300是两种组蛋白乙酰化酶,它们可以与β-catenin结合,促进β-catenin的乙酰化,激活下游基因的转录,本实施例中,利用免疫共沉淀法分析Bach1对β-catenin与CBP/P300结合的影响,结果表明,Bach1抑制β-catenin与CBP/P300的蛋白结合;Bach1抑制β-catenin的乙酰化水平;
试验例1-4:Bach1通过招募HDAC1与Wnt靶基因的启动子区域结合,抑制靶基因转录
(1)组蛋白去乙酰化酶分析实验
用细胞核蛋白抽提试剂盒抽提HEK293T细胞的细胞核,按照说明书检测细胞核中的组蛋白去乙酰化酶活性(美国Millipore公司),在激发波长360nm,发射波长450nm读荧光值;
(2)染色质免疫共沉淀实验
HEK293T细胞加入甲醛固定液,室温固定10分钟,收集将细胞沉淀超声破碎染色质,将DNA与Protein G磁珠,Bach1抗体4℃孵育过夜,结合在beads上的DNA进行实时定量检测,引物序列如下:IL-8ChIP(-1—-193)上游引物(5’-TATTTTAAAGATCAAAGAAAACTTTCG-3’),IL-8ChIP(-1—-193)下游引物(5’-TGCTCCGGTGGCTTTTTATATC-3’);IL-8ChIP(-309—-418)上游引物(5’-TGGCTGGCTTATCTTCAC-3’),IL-8ChIP(-309—-418)下游引物(5’-TAGAGTGGCAGGTGTTAG-3’);IL-8ChIP(-833—-939)上游引物(5’-CTGGAGCATAAACATACC-3’),IL-8ChIP(-833—-939)下游引物(5’-AATAGGAGGGCTTCAATA-3’);
用免疫共沉淀法分析Bach1与HDCA1的相互作用,结果表明,Bach1与组蛋白去乙酰化酶1(HDCA1)有结合;;Bach1过表达增加组蛋白去乙酰化酶活性,酶活性的增加可以被特异性的组蛋白去乙酰化酶抑制剂Trichostatin A(TSA)所抑制;Bach1与IL-8启动子区(-1—-193)有结合;Bach1过表达招募HDAC1与IL-8的启动子区域结合,抑制β-catenin与IL-8的启动子区域结合,从而抑制IL-8基因转录。
实施例2:Bach1诱导细胞周期阻滞和凋亡,抑制细胞增殖试验
(1)细胞周期分析实验
利用Bach1腺病毒或对照腺病毒感染人微血管内皮细胞,Bach1腺病毒(Ad-Bach1)或对照病毒(Ad-GFP)由上海吉凯基因化学技术公司提供;72小时后,收集细胞,用冰乙醇固定,离心后弃上清,加入1ml DNA染色液(含PI和RNaseA),室温孵育30分钟,送至流式细胞仪检测;
(2)细胞凋亡实验
利用Annexin V/PI试剂盒(美国Invitrogen公司)检测细胞的凋亡,收集人微血管内皮细胞,每100μl细胞悬液加入5μl Alexa488annexin V(Component A)和1μl 100μg/ml PI工作液;室温孵育15分钟;加入400μl 1×annexin-binding buffer(Component C),混匀,送至流式细胞仪检测分析;
(3)细胞增殖实验
细胞的增殖用bromodeoxyuridine(BrdU)参入法检测,将Bach1腺病毒感染 的人微血管内皮细胞(5000个)种在96孔板中,每6个孔为一组,以未处理的作为对照,在不同时间点向培养液中加入BrdU孵育6小时,BrdU参入量的检测按照试剂盒说明书的方法检测,以450nm的平均吸光度值来比较细胞的增殖情况,结果表明,Bach1过表达引起细胞S期阻滞;Bach1过表达诱导细胞的凋亡;Bach1过表达在48和72小时后抑制细胞增殖。
SEQUENCE LISTING
<110> 复旦大学
<120> 蛋白Bach1在制备细胞Wnt信号通路抑制剂中的用途
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 736
<212> PRT
<213> Homo sapiens
<400> 1
Met Ser Leu Ser Glu Asn Ser Val Phe Ala Tyr Glu Ser Ser Val His
1 5 10 15
Ser Thr Asn Val Leu Leu Ser Leu Asn Asp Gln Arg Lys Lys Asp Val
20 25 30
Leu Cys Asp Val Thr Ile Phe Val Glu Gly Gln Arg Phe Arg Ala His
35 40 45
Arg Ser Val Leu Ala Ala Cys Ser Ser Tyr Phe His Ser Arg Ile Val
50 55 60
Gly Gln Ala Asp Gly Glu Leu Asn Ile Thr Leu Pro Glu Glu Val Thr
65 70 75 80
Val Lys Gly Phe Glu Pro Leu Ile Gln Phe Ala Tyr Thr Ala Lys Leu
85 90 95
Ile Leu Ser Lys Glu Asn Val Asp Glu Val Cys Lys Cys Val Glu Phe
100 105 110
Leu Ser Val His Asn Ile Glu Glu Ser Cys Phe Gln Phe Leu Lys Phe
115 120 125
Lys Phe Leu Asp Ser Thr Ala Asp Gln Gln Glu Cys Pro Arg Lys Lys
130 135 140
Cys Phe Ser Ser His Cys Gln Lys Thr Asp Leu Lys Leu Ser Leu Leu
145 150 155 160
Asp Gln Arg Asp Leu Glu Thr Asp Glu Val Glu Glu Phe Leu Glu Asn
165 170 175
Lys Asn Val Gln Thr Pro Gln Cys Lys Leu Arg Arg Tyr Gln Gly Asn
180 185 190
Ala Lys Ala Ser Pro Pro Leu Gln Asp Ser Ala Ser Gln Thr Tyr Glu
195 200 205
Ser Met Cys Leu Glu Lys Asp Ala Ala Leu Ala Leu Pro Ser Leu Cys
210 215 220
Pro Lys Tyr Arg Lys Phe Gln Lys Ala Phe Gly Thr Asp Arg Val Arg
225 230 235 240
Thr Gly Glu Ser Ser Val Lys Asp Ile His Ala Ser Val Gln Pro Asn
245 250 255
Glu Arg Ser Glu Asn Glu Cys Leu Gly Gly Val Pro Glu Cys Arg Asp
260 265 270
Leu Gln Val Met Leu Lys Cys Asp Glu Ser Lys Leu Ala Met Glu Pro
275 280 285
Glu Glu Thr Lys Lys Asp Pro Ala Ser Gln Cys Pro Thr Glu Lys Ser
290 295 300
Glu Val Thr Pro Phe Pro His Asn Ser Ser Ile Asp Pro His Gly Leu
305 310 315 320
Tyr Ser Leu Ser Leu Leu His Thr Tyr Asp Gln Tyr Gly Asp Leu Asn
325 330 335
Phe Ala Gly Met Gln Asn Thr Thr Val Leu Thr Glu Lys Pro Leu Ser
340 345 350
Gly Thr Asp Val Gln Glu Lys Thr Phe Gly Glu Ser Gln Asp Leu Pro
355 360 365
Leu Lys Ser Asp Leu Gly Thr Arg Glu Asp Ser Ser Val Ala Ser Ser
370 375 380
Asp Arg Ser Ser Val Glu Arg Glu Val Ala Glu His Leu Ala Lys Gly
385 390 395 400
Phe Trp Ser Asp Ile Cys Ser Thr Asp Thr Pro Cys Gln Met Gln Leu
405 410 415
Ser Pro Ala Val Ala Lys Asp Gly Ser Glu Gln Ile Ser Gln Lys Arg
420 425 430
Ser Glu Cys Pro Trp Leu Gly Ile Arg Ile Ser Glu Ser Pro Glu Pro
435 440 445
Gly Gln Arg Thr Phe Thr Thr Leu Ser Ser Val Asn Cys Pro Phe Ile
450 455 460
Ser Thr Leu Ser Thr Glu Gly Cys Ser Ser Asn Leu Glu Ile Gly Asn
465 470 475 480
Asp Asp Tyr Val Ser Glu Pro Gln Gln Glu Pro Cys Pro Tyr Ala Cys
485 490 495
Val Ile Ser Leu Gly Asp Asp Ser Glu Thr Asp Thr Glu Gly Asp Ser
500 505 510
Glu Ser Cys Ser Ala Arg Glu Gln Glu Cys Glu Val Lys Leu Pro Phe
515 520 525
Asn Ala Gln Arg Ile Ile Ser Leu Ser Arg Asn Asp Phe Gln Ser Leu
530 535 540
Leu Lys Met His Lys Leu Thr Pro Glu Gln Leu Asp Cys Ile His Asp
545 550 555 560
Ile Arg Arg Arg Ser Lys Asn Arg Ile Ala Ala Gln Arg Cys Arg Lys
565 570 575
Arg Lys Leu Asp Cys Ile Gln Asn Leu Glu Ser Glu Ile Glu Lys Leu
580 585 590
Gln Ser Glu Lys Glu Ser Leu Leu Lys Glu Arg Asp His Ile Leu Ser
595 600 605
Thr Leu Gly Glu Thr Lys Gln Asn Leu Thr Gly Leu Cys Gln Lys Val
610 615 620
Cys Lys Glu Ala Ala Leu Ser Gln Glu Gln Ile Gln Ile Leu Ala Lys
625 630 635 640
Tyr Ser Ala Ala Asp Cys Pro Leu Ser Phe Leu Ile Ser Glu Lys Asp
645 650 655
Lys Ser Thr Pro Asp Gly Glu Leu Ala Leu Pro Ser Ile Phe Ser Leu
660 665 670
Ser Asp Arg Pro Pro Ala Val Leu Pro Pro Cys Ala Arg Gly Asn Ser
675 680 685
Glu Pro Gly Tyr Ala Arg Gly Gln Glu Ser Gln Gln Met Ser Thr Ala
690 695 700
Thr Ser Glu Gln Ala Gly Pro Ala Glu Gln Cys Arg Gln Ser Gly Gly
705 710 715 720
Ile Ser Asp Phe Cys Gln Gln Met Thr Asp Lys Cys Thr Thr Asp Glu
725 730 735
- 还没有人留言评论。精彩留言会获得点赞!