FOXR2基因和表达产物在肝癌诊断与治疗中的应用的制作方法
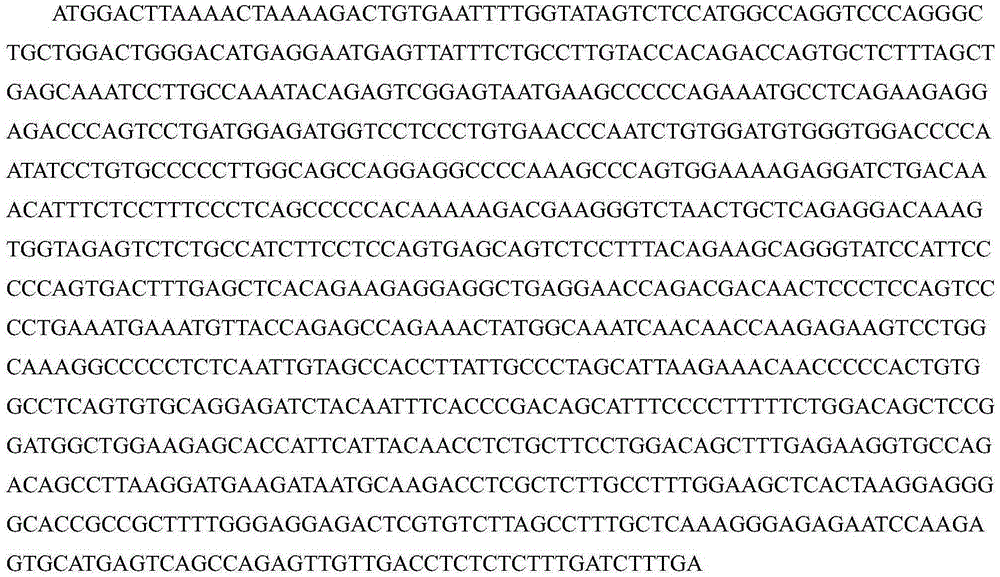
本发明属于基因治疗和诊断技术领域,特别是涉及一种FOXR2基因及其表达产物在肝癌的诊断和治疗中的应用。
背景技术:
肝细胞癌(hepatocellularcarcinoma,HCC)是我国常见的恶性肿瘤之一,从全球范围来看,它是世界最常见的第五大肿瘤,是导致肿瘤相关死亡的第三大原因。而在我国,肝癌的死亡率较高仅次于肺癌、食道癌而居第三位。由于缺乏敏感和特异的早期诊断方法,临床上发现多为晚期,总体疗效差、死亡率高,我国每年死于肝癌约11万人,占全世界肝癌死亡人数的45%。肝癌初期症状并不明显,晚期主要表现为肝痛、乏力、消瘦、黄疸、腹水等症状。由于起病隐匿,发展迅速,确诊时大多数患者已经达到局部晚期或者发生远处转移,自然生存期很短。肝癌的早期诊断对于有效治疗和长期生存至关重要。
通常认为癌胚和糖蛋白抗原、酶和同工酶、细胞因子、基因都可用作原发性肝癌标志物。目前,在我国对肝癌的定性诊断以检测血清AFP(甲胎蛋白)为主。AFP通常正常值为20μg/L以下。凡AFP>500μg/L持续1个月,或AFP>200μg/L持续2个月而无肝病活动证据,可排除妊娠和生殖腺胚胎癌者,应高度怀疑肝癌,可通过医学影像学诊断加以确诊。在肝癌早期诊断发展史中,AFP开创了肝癌免疫诊断的先河,使肝癌早期诊断成为可能,并掀起了肿瘤标志物研究的热潮。然而肝癌早期诊断自运用AFP进行筛查诊断发展至今,未能再取得突破性进展,即不能使治愈率或5年生存率得以提高,甚至在检查中出现AFP正常而肿瘤已至肝癌早期的现象。虽然AFP的敏感性和特异性均不令人满意,但由于目前还没有其他肿瘤标志物的特异性可与AFP相媲美,因此,AFP仍然是目前全球范围内应用最广泛的肝癌肿瘤标志物。截止到目前,肝癌的早期诊断和指导个性化治疗的分子分型诊断仍是我们面临的极大挑战,而发现灵敏度和特异性更高的新的肿瘤标志物, 是提高肝癌早期诊断水平的关键。
近二十年来肝癌的治疗效果取得较大进步,疗效的提高主要得益于诊断水平的提高,特别是影像学技术的发展,使得部分病例能够在早期发现,得以根治。但对于大多数中晚期肝癌来说,如何提高疗效对于各个国家来说都是难题。因此除了手术、放疗、介入等常规治疗外,肝癌的治疗手段相对来说比较多,包括射频消融、瘤内无水酒精注射、聚焦超声热疗等局部治疗手段,目前已经形成“外科治疗为主、局部治疗为辅、多学科综合治疗模式”。其中,肝癌的化疗药物基本沿用其他肿瘤的治疗药物,针对性较差,总体疗效不佳,迫切需要寻找新的作用靶点,研究和开发肝癌特异的新药物,以提高化疗的特异性和有效性。
技术实现要素:
本发明公开了一种人FOXR2基因及其表达产物的应用,用于制备肝癌的诊断及治疗产品。
本发明的第一方面提供了一种FOXR2基因或FOXR2蛋白的用途,用于制备检测肝癌的试剂或试剂盒;
在另一优选例中,所述的试剂盒包括:对FOXR2蛋白或mRNA进行定量检测的试剂以及相应的标签或说明书。
在另一优选例中,所述的试剂包括FOXR2特异性引物、特异性抗体、探针和/或芯片。
在另一优选例中,上述的试剂包括检测用芯片,包括核酸芯片和蛋白质芯片。
在另一优选例中,所述的核酸芯片包括基片和点样在基片上的肝癌相关基因的特异性寡核苷酸探针,所述的肝癌相关基因的特异性寡核苷酸探针包括与FOXR2基因或mRNA特异性结合的探针。
在另一优选例中,所述的蛋白质芯片包括基片和点样在基片上的肝癌相关蛋白的特异性抗体,所述的肝癌相关蛋白的特异性抗体包括抗FOXR2蛋白的特异性抗体。
在另一优选例中,所述的FOXR2蛋白包括融合蛋白和非融合蛋白。
本发明的第二方面,提供了一种用于检测肝癌的诊断试剂盒,所述的试剂盒含有一容器,所述容器中含有检测FOXR2蛋白或mRNA的检测试剂; 以及标签或说明书,所述标签或说明书注明所述试剂盒用于检测肝癌。
在另一优选例中,所述的标签或说明书中注明以下内容:
当检测对象的FOXR2相对参照蛋白的mRNA表达量与癌旁组织的FOXR2相对参照蛋白的mRNA表达量之比≥1.5,则提示该检测对象患肝癌的几率高于普通人群。
在另一优选例中,所述参照蛋白包括β-肌动蛋白。
在另一优选例中,所述的检测试剂包括:特异性引物、特异性抗体、探针和/或芯片。
在另一优选例中,所述的试剂盒用于检测人肝组织样品或血液样品。
在另一优选例中,所述的肝组织样品包括肝癌组织、癌旁组织或政策肝组织。
本发明的第三方面,提供了一种FOXR2蛋白、FOXR2基因或其抑制剂的用途,用于制备抑制癌细胞生长或增殖的药物,或用于制备治疗肝癌的药物。
在另一优选例中,所述的抑制剂包括:FOXR2的抗体、FOXR2核酸的反义RNA、siRNA、shRNA以及FOXR2的活性抑制剂。
在另一优选例中,所述的抑制剂包括FOXR2基因的si-1或si-2,优选地,如SEQ ID NO.:9-10和/或SEQ ID NO.:11-12所示。
本发明的第四方面,提供了一种体外非治疗性的抑制肝癌细胞生长或增殖的方法,包括步骤:在FOXR2蛋白或其抑制剂存在下,培养肝癌细胞,从而抑制肝癌细胞生长或增殖。
在另一优选例中,所述的方法包括向肝癌细胞的培养体系中添加FOXR2抑制剂,从而抑制肝癌细胞生长或增殖。
本发明的第五方面,提供了一种筛选治疗肝癌的候选化合物的方法,包括步骤:
(a)测试组中,在细胞的培养体系中添加测试化合物,并观察所述测试组的细胞中FOXR2的表达量和/或活性;在对照组中,在相同细胞的培养体系中不添加测试化合物,并观察对照组的所述细胞中FOXR2的表达量和/或活性;
其中,如果测试组中细胞的FOXR2的表达量和/或活性小于对照组,就表明该测试化合物是对FOXR2的表达和/或活性有抑制作用的治疗肝癌的候选化合物。
在另一优选例中,所述的肝癌细胞包括各种常用肝癌细胞系,例如HCC-LM3,WRL-68,YY-8103,Huh7,Hep3B,或L02。
在另一优选例中,所述方法还包括步骤:
(b)对于步骤(a)中获得的候选化合物,进一步测试其对肝癌细胞生长或增殖的抑制作用。
在另一优选例中,所述步骤(b)中包括步骤:测试组中,癌细胞的培养体系中添加测试化合物,并观察癌细胞的数量和/或生长情况;在对照组中,在癌细胞的培养体系中不添加测试化合物,并观察癌细胞的数量和/或生长情况;其中,如果测试组中癌细胞的数量或生长速度小于对照组,就表明该测试化合物是对癌细胞的生长或增殖有抑制作用的治疗肝癌的候选化合物。
本发明的第六方面,还提供了一种抑制或治疗肝癌的方法,包括步骤:给需要治疗的对象(哺乳动物)施用安全有效量的FOXR2抑制剂的用途。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1A和B为实施例1中实时定量PCR检测FOXR2基因在41例肝癌病人癌组织和癌旁组织中的表达情况示意图,其中,“N”指癌旁组织,“C”指肝癌组织。结果显示28例(68.3%)病人的癌组织中FOXR2基因表达量高于相应的癌旁组织。
图1C显示了免疫组化手段检测FOXR2基因在人肝癌组织样本和癌旁组织的表达差异,其中,“N”指癌旁组织,“C”指肝癌组织,病人的癌组织中FOXR2基因表达量高于相应的癌旁组织。
图2A显示了FOXR2基因的cDNA序列。
图2B显示了FOXR2基因所编码蛋白的氨基酸序列。
图3A显示了FOXR2在肝癌细胞株Hep3B、Huh7、YY-8103和L02中的过表达情况,说明FOXR2在真核表达载体中成功表达。
图3B显示了过表达的FOXR2蛋白增强了肝癌细胞株Hep3B、Huh7、 YY-8103和L02的增长能力。
图3C显示了过表达的FOXR2蛋白促进了L02的增殖。
图4A显示了人工合成的siRNA有效的干扰了FOXR2基因的表达。
图4B显示了通过RNA干扰的方法沉默FOXR2的表达抑制肝癌细胞WRL68和HCC-LM3的增长。
图5显示了通过RNA干扰的方法沉默FOXR2的表达抑制了肝癌细胞WRL68和HCC-LM3在软琼脂中的克隆形成能力,进而说明FOXR2促进肝癌细胞的恶性表征。
图6A显示了过表达的FOXR2基因促进肝癌细YY-8103在裸鼠皮下形成肿瘤的能力。无论在体积和肿瘤重量上FOXR2过表达组都比对照组大和重,同时两组具有统计学意义。
图6B显示了沉默FOXR2基因表达抑制肝癌细胞WRL68在裸鼠皮下形成肿瘤的能力。无论在体积和肿瘤重量上FOXR2沉默表达组都比对照组小和轻,同时两组具有统计学意义。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,FOXR2在癌组织中低表达,而在癌旁组织及正常组织中高表达,因此FOXR2可作为肝癌检测的标志物用于检测或辅助性检测肝癌。此外,FOXR2的抑制剂可抑制癌细胞(尤其是肝癌细胞)的生长。在此基础上完成了本发明。
FOXR2蛋白和多核苷酸
叉头框(Forkheadbox,Fox)蛋白家族是一类DNA结合区具有翼状螺旋结构的转录因子,目前有19个亚族,它们不仅通过结合DNA来激活或抑制目的基因的转录活性,有些还能直接同异染色质结合参与其重构,协同其他转录因子参与转录调节。Fox蛋白在胚胎发育、细胞周期调控、糖类和脂类代谢、生物老化和免疫调节等多种生物学过程中发挥作用,在肿瘤的发生发展过程中也扮演重要角色。FOXR2是FOX蛋白家族的重要一员。迄今,有关FOXR2基因功能的报道文章不多。本发明首次阐述了FOXR2在肝癌中的表达情况并通过细胞生物学的研究手段证明FOXR2促进肝癌细胞的增殖,是一个潜在的致癌基因。
本发明的目的是公开了一种人FOXR2基因及其表达产物的应用,用于制 备肝癌诊断及治疗的产品。本发明的FOXR2基因及其表达产物,可作为诊断肝癌的特异性标志基因,使肝癌诊断更加准确、快速;本发明的FOXR2基因及其表达产物,还可作为制备治疗肝癌的分子药物,提供新的肝癌治疗途径。因此,本领域迫切需要开发可用于肝癌诊断的相关蛋白,为了有效地抑制肝癌细胞的生长,本领域迫切需要开发可用于抑制肝癌细胞生长的药物,以提高化疗的特异性和有效性。
在本发明中,“本发明蛋白”、“本发明多肽”、“FOXR2蛋白”可互换使用,指简称为FOXR2)。应理解,所述术语还包括FOXR2的活性片段和衍生物。
在本发明中,“本发明基因”、“本发明多核苷酸”指编码FOXR2蛋白或其活性片段和衍生物的核苷酸序列,包括正义和反义核酸。FOXR2基因定位于细胞染色体6q15,cDNA全长为786bp,编码全长261个氨基酸的蛋白。
在本发明中,术语“FOXR2蛋白”、“FOXR2多肽”或“肝癌标志物FOXR2”可互换使用,都指具有人蛋白FOXR2氨基酸序列的蛋白或多肽。
FOXR2,又名SRSF12(serine/arginine-rich splicing factor 12,富含丝氨酸和精氨酸的剪切因子12),因最初发现作为SR的抑制因子且分子量为35kD而得名。SR蛋白是一类富含丝氨酸和精氨酸的具有RRM RNA结合结构域的剪切因子,具有调控真核细胞pre-mRNA转录本选择性剪切掉内含子并拼接外显子的功能。体内研究发现,FOXR2能够拮抗其它SR蛋白并激活腺病毒E1A的pre-mRNA 5’最末端的选择性剪切(Alison E,et al.2001.THE JOURNAL OF BIOLOGICAL CHEMISTRY)。
FOXR2基因的cDNA序列如SEQ ID NO.:1所示;Genbank登录号135295,FOXR2的cDNA序列CCDS47459.1以及其编码的氨基酸序列NP_542781.3。
FOXR2基因所编码蛋白的氨基酸序列如SEQ ID NO.:2所示。
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多核苷酸和多肽是没有分离纯化的,但同样的多核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
如本文所用,“分离的FOXR2蛋白或多肽”是指FOXR2蛋白基本上不含天然与其相关的其它蛋白、脂类、糖类或其它物质。本领域的技术人员能用标准的蛋白质纯化技术纯化FOXR2蛋白。基本上纯的多肽在非还原聚丙烯酰 胺凝胶上能产生单一的主带。在本发明中,FOXR2蛋白包括融合蛋白和非融合蛋白。
本发明的多肽可以是重组多肽、天然多肽、合成多肽,优选重组多肽。本发明的多肽还可包括或不包括起始的甲硫氨酸残基。
本发明的多核苷酸可以是DNA形式或RNA形式。DNA形式包括cDNA、基因组DNA或人工合成的DNA。DNA可以是单链的或是双链的。DNA可以是编码链或非编码链。
编码FOXR2的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码多肽的功能。
本发明还涉及与上述的序列杂交的核酸片段,包括正义和反义的核酸片段。如本文所用,“核酸片段”的长度至少含15个核苷酸,较好是至少30个核苷酸,更好是至少50个核苷酸,最好是至少100个核苷酸以上。核酸片段可用于核酸的扩增技术(如PCR)以确定和/或分离编码FOXR2蛋白的多核苷酸。
本发明的人FOXR2核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。对于PCR扩增法,可根据已公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cDNA库或按本领域技术人员已知的常规方法所制备的cDNA库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细 胞中分离得到有关序列。
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
应用PCR技术扩增DNA/RNA的方法被优选用于获得本发明的基因。用于PCR的引物可根据本文所公开的本发明的序列信息适当地选择,并可用常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的DNA/RNA片段。
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或FOXR2蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。
通过常规的重组DNA技术,可利用本发明的多核苷酸序列可用来表达或生产重组的FOXR2蛋白。一般来说有以下步骤:
(1).用本发明的编码人FOXR2蛋白的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
(2).在合适的培养基中培养的宿主细胞;
(3).从培养基或细胞中分离、纯化蛋白质。
本领域的技术人员熟知的方法能用于构建含人FOXR2编码DNA序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的DNA序列可有效连接到表达载体中的适当启动子上,以指导mRNA合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(GFP),或用于大肠杆菌的四环素或氨苄青霉素抗性。
包含上述的适当DNA序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属的细菌细胞;真菌细胞如酵母;植物细胞;果蝇S2或Sf9的昆虫细胞;CHO、COS、或293细胞的动物细胞等。
用重组DNA转化宿主细胞可用本领域技术人员熟知的常规技术进行。当 宿主为原核生物如大肠杆菌时,能吸收DNA的感受态细胞可在指数生长期后收获,用CaCl2法处理,所用的步骤在本领域众所周知。另一种方法是使用MgCl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的DNA转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(HPLC)和其它各种液相层析技术及这些方法的结合。
抗体
本发明还包括对人FOXR2蛋白具有特异性的多克隆抗体和单克隆抗体,尤其是单克隆抗体。这里,“特异性”是指抗体能结合于人FOXR2基因产物或片段。较佳地,指那些能与人FOXR2基因产物或片段结合但不识别和结合于其它非相关抗原分子的抗体。本发明的抗体可以通过本领域内技术人员已知的各种技术进行制备。
本发明不仅包括完整的单克隆或多克隆抗体,而且还包括具有免疫活性的抗体片段,如Fab’或(Fab)2片段;抗体重链;抗体轻链;遗传工程改造的单链Fv分子;或嵌合抗体。
抗人FOXR2蛋白的抗体可用于免疫组织化学技术中,检测活检标本中的人FOXR2蛋白。
抑制剂和药物组合物
利用本发明蛋白,通过各种常规筛选方法,可筛选出与FOXR2蛋白发生相互作用的物质,尤其是抑制剂等。
本发明FOXR2蛋白的抑制剂(包括抗体、反义核酸以及其他抑制剂),当在治疗上进行施用(给药)时,可抑制FOXR2蛋白的表达和/或活性,进而抑制肝癌细胞的生长或增殖。通常,可将这些抑制剂配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中pH通常约为5-8,较佳地pH约为6-8,尽管pH值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):胃肠内、瘤内、肌内、腹膜内、静脉内、皮下、皮内、或局部给药。
可用于本发明的抑制剂包括:FOXR2的抗体、FOXR2核酸的反义RNA、siRNA、shRNA以及FOXR2的活性抑制剂。其中,典型的FOXR2抑制剂为siRNA和shRNA。
可用于本发明的siRNA包括多种以FOXR2为靶点的siRNA,本领域技术人员可以根据该靶点进行常规筛选,其中,一种优选的siRNA包括如SEQ ID NO:9(正义链)和SEQ ID NO.:10(反义链)所示的序列(si-1);或优选的siRNA包括如SEQ ID NO:11(正义链)和SEQ ID NO.:12(反义链)所示的序列(si-2)。
典型地,将FOXR2基因作为制备肝癌治疗药物的靶点的技术方案包括以下方案:
1.化学合成双链核糖核酸分子,其序列特异性针对FOXR2基因序列,利用脂质体包裹递送至肝癌细胞内干扰FOXR2基因的表达,观察软琼脂克隆形成能力、细胞增殖等细胞生物学特性的改变。可利用本领域常规的方法来设计和合成特异性针对FOXR2的核酸序列(如siRNA)。
2.利用各种载体,包括DNA载体、慢病毒载体来干扰FOXR2基因的表达,达到体内干扰FOXR2基因的效果,检测它们对裸鼠皮下所成瘤体的治疗效果,从而实现抑制肝癌增殖的目的。
3.获得能够特异性抑制FOXR2基因转运活性的多肽、单克隆抗体,达到抑制FOXR2活性的目的,从而现实抑制肝癌细胞体内增殖的目的。
本发明还提供了一种药物组合物,它含有安全有效量的本发明FOXR2蛋白或其抑制剂以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐 水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。诸如片剂和胶囊之类的药物组合物,可通过常规方法进行制备。药物组合物如针剂、溶液、片剂和胶囊宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克-10毫克/千克体重。
检测方法和试剂盒
本发明还涉及定量和定位检测人FOXR2蛋白水平或mRNA水平的诊断试验方法。这些试验是本领域所熟知的。试验中所检测的人FOXR2蛋白水平,可以用于诊断肝癌。
一种检测样品中是否存在FOXR2蛋白的方法是利用FOXR2蛋白的特异性抗体进行检测,它包括:将样品与FOXR2蛋白特异性抗体接触;观察是否形成抗体复合物,形成了抗体复合物就表示样品中存在FOXR2蛋白。
FOXR2蛋白或其多核苷酸可用于FOXR2蛋白相关疾病的诊断和治疗。本发明的多核苷酸的一部分或全部可作为探针固定在微阵列或DNA芯片上,用于分析组织中基因的差异表达分析和基因诊断。抗FOXR2的抗体可以固定在蛋白质芯片上,用于定量检测样品中的FOXR2蛋白。
本发明还提供了一种检测肝癌的试剂盒,它含有特异性扩增FOXR2的引物对和/或FOXR2特异性抗体,优选的引物如SEQ ID NO.:5和SEQ ID NO.:6所示。
筛选方法
本发明还提供了基于FOXR2进行药物筛选的方法。一种方法是先筛选影响(促进)FOXR2表达或活性的化合物,然后对筛选出的化合物进一步测试其对肝癌细胞的抑制性能。一种筛选方法可基于FOXR2的mRNA的表达水平。
其中,代表性的癌细胞包括(但并不限于):肝癌细胞。
通用方法:
(1)临床组织样本的获取
肝癌及癌旁组织取自手术治疗的肝癌患者,在获取样本前均与患者签订了知情同意书。手术切除的肝脏一经离体,迅速切取肿瘤原发灶及周围5cm以外的癌旁组织,投入液氮中速冻并移至-80℃冰箱保存,运输时储存于液氮中。 癌与癌旁组织均通过病理专家做出最终诊断。样本依据Edmondson分级标准分为I-III级。
(2)组织及细胞RNA抽提
采用TRIzol Reagent(Invitrogen)试剂抽提RNA,具体操作如下:
1)研钵、碾杵和匀浆器等器皿洗净,分别再用ddH2O和DEPC H2O冲洗,然后在180℃烘箱中烘约4小时,以去除RNA酶;
2)在研钵中加入适量液氮使之预冷,将组织从液氮中迅速取出,切取约50-100mg大小,在研钵中研磨成粉末;
3)用刮匙将研磨好的组织粉末尽可能完全的移至无RNA酶的EP管中,EP管被预先加入适量体积(1ml)TRIzol试剂,充分匀浆;
4)室温放置5分钟,按比例向离心管中加入氯仿(200μl/1ml TRIzol),迅速剧烈振荡15秒,室温静置2-3分钟,4℃,12000×g条件下离心15分钟;
5)将上层水相尽可能地转移至新的无RNA酶的EP管中,加入等体积的异丙醇,颠倒混匀5次,室温静置10分钟,4℃,12000×g条件下离心10分钟,此时可见RNA沉淀;
6)将上清倒掉,加入75%乙醇(1ml/1ml TRIzol),混匀,洗涤RNA,离心4℃,7500×g条件下离心5分钟;
7)弃上清,尽可能除尽残留乙醇,沉淀自然干燥5-10min(注意切勿完全干燥);加入30-50μl DEPC H2O,吹吸几次,溶解RNA沉淀;
8)酶标仪测定RNA浓度及纯度OD 260/280(1.8-2.0);凝胶电泳观察有无降解,-80℃保存。
细胞株RNA抽提,取对数生长期的细胞,吸取培养液,根据培养皿的面积加入相应量的TRIzol试剂(1ml TRIzol/10cm2)裂解细胞,吹打几次,将裂解下来的细胞收集至无RNA酶的EP管中,其余按照上述步骤4)-8)完成氯仿-异丙醇法分离纯化RNA。
(3)RNA的逆转录
用M-MLV Reverse Transcriptase(Promega)逆转录,操作如下:
1)在无核酸酶的EP管中加入以下组分:
置于PCR仪中,70℃,5分钟,然后立即在冰上冷却5min。
2)在上述体系中再加入以下组分:
轻轻混匀后,置于PCR仪中,37℃,60min。
逆转得到的cDNA置于4℃保存。
(4)实时定量PCR
实时定量PCR反应使用Premix Ex TaqTM(Perfect Real Time)试剂盒(TaKaRa Biotechnology Co.,Ltd.Dalian,China)的反应体系,利用Thermal Cycler DiceTMReal Time System(TP800实时荧光定量PCR仪,TaKaRa)进行操作。定量PCR的扩增产物长度以80bp-150bp最为合适(可以延长至300bp)。
反应体系如下:
反应条件:
溶解曲线分析步骤:
95℃ 15sec
60℃ 30sec
95℃ 15sec
解离时间为4sec。
荧光本底信号和阈值采用仪器设置的默认值,每次PCR反应结束后会自动生成,Ct值表示每个反应管内的荧光信号达到设定阈值(基线荧光强度的10倍)时所经历的循环数;目的基因FOXR2每个模板做3个复管,得到的Ct值取平均值;FOXR2基因的Ct平均值减去相应模板的内参基因(β-actin)的Ct平均值,得到ΔCt。肝癌组的ΔCt减去相应癌旁组织的ΔCt,得到ΔΔCt值,肝癌组和癌旁组中的FOXR2基因的倍数关系用2-ΔΔCt表示。
(5)真核表达载体构建
1)模板:人肝永生化细胞L02的cDNA文库。
2)真核表达载体的选择:pcDNATM3.1/myc-His(-)A,5522nucleotides。
3)根据FOXR2mRNA(NM_198451.3)序列,结合表达载体pcDNATM3.1/myc-His(-)A的酶切位点设计引物,引物序列为Forward:5-ccaccATGGACTTAAAACTAAAAGACTG(SEQ ID NO.:3);Reverse:5-gttcGGTACCAAGATCAAAGAGAGAGGTCAAC-3(SEQ ID NO.:4)。其中反向引物中FOXR2的终止密码子被去除,使得FOXR2的C末端带上c-myc和6xHis标签。利用高保真性DNA聚合酶PrimeSTARTMHS DNA Polymerase(TaKaRa),以L02cDNA为模板扩增基因FOXR2全长开放读码框,50μl总反应体系成分如下:
采用两步PCR法(95℃,10sec;60℃,90sec),扩增35个循环。PCR产物大小约1.0kb,1%琼脂糖凝胶电泳鉴定大小,割胶回收(胶纯化试剂盒:MACHEREY-NAGEL)符合片段大小的PCR产物。
4)EcoRV,KpnI(TaKaRa Biotechnology Inc.Dalian,China)双酶切回收PCR产物及载体质粒pcDNATM3.1/myc-His(-)A,酶切反应体系如下:
37℃酶切反应1小时;割胶回收酶切产物。
5)连接:酶切回收的PCR产物与载体按照摩尔数比(4:1)的比例混合,DNA连接酶体系链接,体系中还包括2.5μl 4×SolutionⅠ(TaKaRa Code:D102A),ddH2O补齐至10μl,16℃连接2h乃至过夜;
6)转化:取10μl连接产物与100μl感受态细菌(TOP10或DH5α)混合,冰上放置30min,42℃热激90sec,立即置于冰上5min,加入800μl不含抗生素的LB培养液,37℃、200rpm振荡培养30min,使菌体复苏且扩增一代,3000rpm离心2min,去除大部分上清,留50-100μl菌液,,轻轻吹打沉淀混匀,然后均匀涂于有氨苄青霉素抗性(Amp+)的LB平板上,37℃培养12-16小时。
7)克隆鉴定:挑取经过氨苄抗性筛选后生长的菌落在加氨苄青霉素的液体培养基中扩大培养,抽取质粒进行酶切鉴定:取1-2μg小抽质粒用EcoRV,KpnI双酶切,琼脂糖凝胶电泳鉴定酶切片段大小,载体pcDNATM3.1/myc-His(-)A片段大小约5.5kb,FOXR2读码框片段大小约1000bp,符合大小的克隆送测序确认插入片段序列的正确性。
(6)细胞生长曲线的测定
1)将不同种类的HCC细胞根据其生长特性按3-5×103/100μl/孔计算细胞总量,充分消化细胞后,稀释到所需浓度,接种于96孔板内。每天每组三复孔,按5-7天接种细胞;
2)待细胞基本贴壁后观察细胞状态和数目。用CCK-8显色剂(Cell Counting Kit-8,DOJINDO,Japan)进行显色反应,每100μl培养液加10μl CCK-8,37℃,5%CO2培养箱放置孵育1h,酶标仪测定450nm处的吸光度,记录,确定细胞实际的起始密度,作为生长相对零点。
3)每天或隔天半量换液,具体视实验要求而定;
4)显微镜下观察细胞形态,固定时间间隔测量,记录细胞生长状况;
5)一般测5至7天。待测定结束后,收集数据进行处理,用Excel绘出图表。
(7)细胞克隆形成实验
1)转染:采用LipofectamineTM2000(Invitrogen)转染细胞,过表达或沉默细胞中FOXR2基因的表达;
2)转染后的细胞,于6孔板或35mm培养皿用正常培养液培养24h后消化计数,按一定数目接种至100mm培养皿(不同细胞株数目不同),继续培养24h,然后依据细胞种类加入适当浓度的G418(600-1000μg/ml),以筛选转染阳性的细胞克隆;
3)培养2-3周,其间每隔3-5天更换新鲜培养液并加G418筛选,直至有肉眼可见的细胞克隆形成;
4)吸去培养皿内的培液,1×PBS洗两次,考马斯亮蓝R-250染色2h,用水轻轻冲洗后,再用考马斯亮蓝染色脱色液脱色30-60min;
5)克隆形成染色结果拍照,按照相同的标准(细胞克隆大小)对每个培养皿上的细胞克隆进行计数。
(8)蛋白质印迹(Western Blot)
1)蛋白样品制备:培养的细胞吸去培养上清后,用预冷的1XPBS洗两次,加入2×SDS裂解液(100mM Tris-Cl,pH=6.8,4%SDS,20%甘油),充分裂解后,沸水浴加热10min,12000×g离心10min,上清转移至新管中,BCA Protein Assay Kit对获得的蛋白进行定量,-80℃保存;
2)蛋白电泳分离:在蛋白样品加入适量含有200mM DTT的上样缓冲液(loading buffer),沸水浴加热10min,稍作离心,SDS-PAGE蛋白凝胶电 泳分离样品;
3)转膜:将电泳胶、硝酸纤维膜、厚(薄)滤纸垫板浸于转膜缓冲液中(24mM Tris,192mM甘氨酸,20%甲醇)平衡15-20min。按正极-1层厚滤纸垫板-硝酸纤维膜-电泳胶-2层薄滤纸垫板-负极的顺序放好,湿转仪(XCell SureLockTM,invitrogen)30伏转膜30-40min;
4)封闭:5%脱脂奶粉/0.1%PBST作为封闭液,水平摇床,室温封闭30min-2h;
5)一抗:一抗用封闭液稀释(参考抗体说明书推荐浓度),室温孵育2h或者4℃孵育过夜,0.1%PBST洗三次,每次5min;
6)二抗:荧光二抗用封闭液稀释(1:1000),室温孵育30min,0.1%PBST洗三次,每次5min;
7)扫膜:ODYSSEY红外成像系统扫描硝酸纤维素膜,保存图像。
(9)软琼脂克隆形成实验
1)分别配制1%和2%的低熔点Agarose(TaKaRa公司),高温高压灭菌;
2)配制2×DMEM培养液(2.5×DMEM,含20%FBS);
3)将37℃保温的2%Agarose和2×DMEM培养液按相同体积混合,以每孔0.5ml加到24孔板中,置于4℃冰箱中,待凝固后使用;
4)充分消化培养的细胞成单个细胞,计数,稀释成相同浓度(3000-5000个/0.5ml);
5)将细胞悬液与37℃保温的1%Agarose以相同体积混合,加到已经铺好下层胶的24孔板中,每孔0.5ml,置于4℃冰箱10min;
6)在凝固的软琼脂上加入0.2ml培养液,置于37℃,5%CO2培养箱中,继续培养2-3周;
7)显微镜下观察每个孔里面细胞克隆的生长情况,计数,进行分析。
(10)裸鼠成瘤实验
1)所用小鼠为5-6周大小的雄性BLAB/c nu裸鼠,由上海斯莱克实验动物有限公司提供,饲养于南方模式动物培养中心;
2)取处理后的细胞,以相同数量接种于小鼠皮下(不同细胞种类接种数目不同),为避免个体差异导致的误差,同种细胞不同处理可左右对称接种于同 一只小鼠;
3)待出现可见肿瘤后,每3天监测肿瘤大小,游标卡尺读取肿瘤长径和短径,按以下公式计算肿瘤体积:体积=长径×短径2;
4)持续监测约8-9次后,整理数据,统计。
(11)抗体获得和免疫检测
1)抗原蛋白获得
从Genebank数据库中获得人FOXR2基因的cDNA序列,通过PCR扩增获得编码框,插入原核生物或真核生物表达载体中,表达FOXR2蛋白,并按基因工程表达产物的纯化体系纯化蛋白。
2)抗体制备
可采用以下几种方法制备抗体:
a细胞融合法:用上述制备的FOXR2蛋白免疫动物(包括兔子、山羊等),获得脾脏细胞,再与骨髓瘤细胞融合,并按常规单克隆抗体制备技术制备单克隆抗体。
b利用噬菌体表面展示库,克隆免疫动物的脾脏IgG可变区并表达成基因工程单克隆抗体。
c利用纯化的蛋白免疫动物,制备多抗血清。
3)检测
a用制备的抗体(多抗或单抗),用组织化学方法进行肝癌的病理检测,阴性信号为肝癌。
b取患者血清,用ELISA方法检测,阴性反应为肝癌可疑病人。
c将FOXR2抗体作为蛋白质芯片的探针之一,用于多种肿瘤诊断。
实施例1:FOXR2在临床样本中的表达模式
通过大量实验研究,发现叉头框蛋白FOXR2在肝癌组织中明显上升。在41对临床样本中,通过实时定量PCR检测发现有28对样本肝癌组织中FOXR2的表达明显高于相应的癌旁组织,上调率达到68.3%,统计学分析表明p<0.01(图1A),说明结果的可靠性。同时,通过免疫组化方法检测了一定数量的肝癌组织中FOXR2的表达模式,如图1C所示,病人的癌组织中FOXR2基因表达量高于相应的癌旁组织。实验中所用检测FOXR2表达的实时定量PCR的引物序 列为:5-TCAGTGTGCAGGAGATCTAC-3(SEQ ID NO.:5)和:5-AAGATCAAAGAGAGAGGTCAAC-3(SEQ ID NO.:6)。作为内参的β-actin的引物序列为:5-cctggcacccagcacaatg-3(SEQ ID NO.:7)和:5-gggccggactcgtcatact-3(SEQ ID NO.:8)。
实施例2:过表达FOXR2基因促进肝癌细胞的增殖
通过NCBI网上检索,FOXR2的cDNA序列CCDS 35308.1(图2A)(SEQ ID NO.:1)以及其编码的氨基酸序列NP_940853.1(图2B)(SEQ ID NO.:2)。为了验证FOXR2在肝癌发生中的功能,我们首先构建了其真核表达载体,将FOXR2的cDNA克隆进pcDNATM3.1/myc-His(-)A,转染构建的质粒进入肝癌细胞后进行western blot检测,发现FOXR2成功的表达(图3A)。接下来的功能实验生长曲线和克隆形成结果表明,FOXR2的过量表达促进肝癌细胞Hep3B、Huh7、YY-8103和L02的增殖、克隆形成能力(图3B,C)。用于构建FOXR2真核表达载体的引物序列为Forward:5-ccaccATGGACTTAAAACTAAAAGACTG-3(SEQ ID NO.:3);Reverse:5-gttcGGTACCAAGATCAAAGAGAGAGGTCAAC-3(SEQ ID NO.:4)。
实施例3:沉默FOXR2的表达抑制细胞生长
为了进一步验证FOXR2的细胞生长促进功能,采取RNA干扰沉默其表达的方式检测细胞生长情况的变化。用于干扰FOXR2表达的siRNA由上海吉码制药有限公司合成,序列为:si-1正义链5-GCUCCCUAGAUGAGAUACAdTdT-3(SEQ ID NO.:9);si-1反义链5-UGUAUCUCAUCUAGGGAGCdTdT-3(SEQ ID NO.:10)。si-2正义链5-GGUGUUAAGUAAAGUUAGAdTdT-3(SEQ ID NO.:11);si-2反义链5-UCUAACUUUACUUAACACCdTdT-3(SEQ ID NO.:12)。作为干扰对照的NC非特异性核苷酸序列为:正义链5-UUCUCCGAACGUGUCACGUdTdT-3(SEQ ID NO.:13);反义链5-ACGUGACACGUUCGGAGAAdTdT-3(SEQ ID NO.:14)。经实时定量PCR检测表明,人工合成的干扰siRNA能够有效的下调FOXR2的表达水平(图4A),生长曲线实验也证明了FOXR2的下调能够抑制肝癌细胞WRL68和HCC-LM3的生长(图4B),有力的支持FOXR2促进肿瘤细胞生长的结论。
实施例4:FOXR2促进肝癌细胞的恶性表征
软琼脂克隆形成能力是反映肿瘤细胞恶性程度的一个强有力的体外指标。 为了检测FOXR2对肝癌细胞恶性程度的影响,选取了WRL-68和HCC-LM3(购自中科院细胞所细胞库)作为沉默表达的研究对象。经过对生长在软琼脂中的细胞克隆数分析(图5),最终确定沉默表达FOXR2能够有效抑制WRL-68和HCC-LM3细胞的恶性程度,表明FOXR2促进肝癌细胞的恶性。
实施例5:FOXR2影响肝癌细胞在裸鼠皮下的成瘤能力
体外实验已经明确表明FOXR2促进肝癌细胞的生长,接下来利用荷瘤裸鼠模型来研究FOXR2的表达对肝癌细胞裸鼠皮下成瘤能力的影响。将1×106个过表达FOXR2的YY-8103(来源上海市中山医院)细胞和对照细胞对称注射入裸鼠腹部皮下,观察瘤体的生长情况,并用游标卡尺记录下每隔3天的瘤体长度和宽度。1个月后,杀死裸鼠取出瘤体称重。结果表明FOXR2的过表达有效促进YY-8103细胞在裸鼠皮下的成瘤能力(图6A)。同样,将1×106个沉默表达FOXR2的WRL68细胞和对照细胞对称注射入裸鼠腹部皮下,观察瘤体生长情况并记录。最终的结果表明FOXR2的下调有效的抑制了WRL68细胞裸鼠皮下成瘤的能力(图6B)。
本发明实验证实FOXR2基因在肝癌组织中的表达明显高于癌旁组织,并且通过外源FOXR2基因过量表达可以显著促进肝癌细胞的生长,因此FOXR2基因及其表达产物可作为诊断肝癌的标志物和用于肝癌治疗的药物靶点,使肝癌诊断更加准确、快速。总之,本发明FOXR2基因及其用途为防治肝癌提供了新的治疗靶点和有效新药。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!