利用CRISPR/Cas9系统定点修饰ALS基因获得抗除草剂水稻的系统及其应用的制作方法
本发明涉及基因工程领域中利用CRISPR/Cas9系统定点修饰ALS基因获得抗除草剂水稻的系统及其应用。
背景技术:
CRISPR/Cas9系统是继ZFNs和TALENs技术之后出现的基因组定点编辑新技术。与ZFNs和TALENs不同的是,CRISPR/Cas9系统对靶位点的识别依赖于核酸之间碱基互补配对,可对任何紧随PAM(NGG)的20bp的靶点序列进行编辑,且其靶点在基因组中的分布频率很高,因此对于需要定点编辑的靶基因,更容易找到合适的靶位点;另外CRISPR/Cas9系统可同时对同一基因的不同位点或多个基因的位点进行定向编辑,使其运用更加灵活;此外,CRISPR/Cas9系统操作简单快捷,每次打靶只需替换原有载体上20-30bp的核苷酸序列,更适宜规模化,高通量操作。CRISPR/Cas9作为一种新的靶向基因修饰技术,展现了广阔的发展潜力和应用前景,有望成为未来基因定向编辑的最强有力的工具之一。目前已经应用于水稻、小麦、拟南芥以及本生烟基因组的定点敲除研究中,但尚未有进行重要农作物目标农艺性状通过定点修饰(氨基酸替换或定点整合)进行遗传改良的研究。
利用CRISRP/Cas9系统在作物中对基因组编辑主要分为三种,基因的定点敲除方法获得突变体、对靶标基因的定点修饰及外源基因定点整合。因定点敲除操作方便,技术成熟等特点,在现有报道中最多。Shan等(2013)成功获得水稻OsBADH2、OsPDS基因突变体,突变概率为7.1%-9.4%。Wang等(2013)利用CRISPR技术成功定点敲除小麦TaMLO-A1基因。Miao等(2013)对水稻叶绿素合成基因CAO1和分蘖夹角控制基因LAZY进行编辑,结果表明,有83.3%的T0代转基因植株中CAO1基因相应位点发生了突变,而有高达91.6%的转基因植株中LAZY基因相应位点发生了突变,其中LAZY基因的突变纯合体的比例达到50%,均表现出分蘖夹角变大的表型。Zhang等(2014)对2个水稻亚种(粳稻日本晴和籼稻Kasalath)11个靶基因中CRISPR/Cas9诱导产生突变的效率、特点、遗传性及特异性等进行分析,T0代转基因植株突变效率高达66.7%,而且超过一半的靶基因位点在T0代获得纯合突变体,突变体后代的遗传传递符合经典的孟德尔定律。Ma等(2015)利用CRISPR/Cas9系统共编辑水稻中46个靶位点,突变率平均为85.4%,大部分为均一的双等位突变(54.9%)和纯合突变(24.7%),并可遗传到后代。以上研究说明,利用CRISPR/Cas9系统可实现对作物特定基因的高效定点突变。
利用CRISRP/Cas9系统对植物进行定点氨基酸替换和外源基因定点整合的研究,目前只有几例报道。Miao等(2013)通过将GUUS基因与CRISPR/Cas9系统同时转入到水稻中,可检测到GUS活性,说明同源重组发生。Schiml等(2014)将CRISPR/Cas9以及两端含有与spacer相同序列的模板DNA构建到同一个T-DNA中转化拟南芥,通过同源重组DNA修复途径,在AtADH1基因的靶标位点精确插入卡那霉素的抗性基因nptII。Li等(2015)将外源片段和CRISPR/Cas9同时导入大豆中,并在愈伤组织中检测到成功定点修饰的ALS1基因,但尚未获得植株。但将抗潮霉素基因表达盒与CRISPR/Cas9系统同时导入到大豆中,通过PCR及Southern鉴定确定获得同源重组株系,整合基因的遗传符合孟德尔遗传规律。Svitashev等(2015)通过同源重组方法将liguleless-1基因定点重组到玉米基因组中。此外,将CRISPR/Cas9系统和外源修饰片段(双链和单链DNA)同时通过基因枪或农杆菌方法导入玉米中,成功将ALS2的第165位的脯氨酸修饰为丝氨酸(P165S)的植株并获得磺脲类除草剂抗性。
通过基因组编辑介导的同源重组,定点修饰提高重要农作物的除草剂抗性,是目前基因组编辑研究领域的热点之一。传统获得抗除草剂作物方法主要是(1)通过外源基因导入(epsps,bar,pmi等)提高农作物的除草剂抗性,已经有多项报道,但因为是属于转基因作物,其在重要粮食作物中的推广应用受到限制,目前尚未有抗除草剂的转基因小麦和水稻商业化生产的报道。此外,抗除草剂基因漂移可能形成超级杂草等转基因生物安全问题而备受关注。(2)植物氨基酸合成中的关键酶一直是新型除草剂研发中重要的靶标酶。通过EMS将作物内源基因突变,提高重要农作物的除草剂抗性,已经在小麦、大麦和水稻等有相关报道。但因EMS突变的随机性,需要大面积广泛筛选具有除草剂抗性和其它农艺性状未改变的突变体,因此,此技术很难得到广泛应用。
靶标乙酰乳酸合成酶(ALS)抑制剂类除草剂双草醚是目前开发最活跃的领域之一。乙酰乳酸合成酶(Acetolactate synthase,ALS)存在于植物中,它能催化丙酮酸为乙酰乳酸,具有高度专一性和极高的催化效率,从而合成植物体内3种必需的支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)。磺脲类、咪唑啉酮类、嘧啶羧酸类除草剂可抑制ALS活性,破坏植物体内缬氨酸、亮氨酸和异亮氨酸的合成,从而导致植物死亡。Swanson等(1989)利用小孢子化学诱变的方法获得2个抗咪唑啉酮类除草剂的油菜突变体PMl和PM2,PMl和PM2都由ALS基因点突变而成,其中PMl是基因BnALS1的第653位丝氨酸发生突变,PM2是基因BnALS2的第574位色氨酸发生突变(以拟南芥的ALS氨基酸位置计算)(Hattori et al.1995)。2014年3月,Cibus Global公司利用单核苷酸基因修复技术(Gene Repair OligoNucleotide technology),成功获得了ALS基因编辑后抗磺脲类除草剂油菜,目前已经在加拿大获得商业化生产 (http://www.cibus.com/technology.php)。磺脲类、咪唑啉酮类、嘧啶羧酸类除草剂广泛应用于生产中,具备生物活性高、杀草谱广的优点,并且对人和动物具有安全性(Endo et al.,2007)。
技术实现要素:
本发明所要解决的技术问题是如何获得抗除草剂的水稻。
为解决上述技术问题,本发明首先提供了用于植物基因组定点修饰的系统。
本发明所提供的用于植物基因组定点修饰的系统,含有用于植物基因组定点修饰的载体和供体DNA;所述用于植物基因组定点修饰的载体含有Cas9蛋白表达盒、gRNA表达盒和供体DNA;所述gRNA表达盒编码两种gRNA,所述两种gRNA分别靶向于目的植物的靶DNA的两个靶位点;所述靶DNA中待定点修饰片段位于所述两个靶位点之间;所述两个靶位点中位于上游的靶位点为上游靶位点,位于下游的靶位点为下游靶位点;
所述供体DNA含有所述上游靶位点、所述下游靶位点和位于所述上游靶位点和所述下游靶位点之间的定点修饰片段;所述定点修饰片段为要替换所述待定点修饰片段的DNA片段。
上述系统中,所述定点修饰可为氨基酸替换,外源基因定点整合或外源片段定点整合。
上述系统中,所述供体DNA还含有用于和所述靶DNA进行同源重组的上游同源臂和下游同源臂,所述上游同源臂位于所述上游靶位点与所述定点修饰片段之间,所述下游同源臂位于所述定点修饰片段与所述下游靶位点之间。
上述系统中,所述植物或所述目的植物可为单子叶植物或双子叶植物;所述单子叶植物可为禾本科植物,进一步的,所述禾本科植物具体可为水稻。
上述系统中,所述靶DNA可为编码乙酰乳酸合成酶的基因;所述乙酰乳酸合成酶为a1或a2的蛋白质:
a1、氨基酸序列是SEQ ID No.2的蛋白质;
a2、在SEQ ID No.2所示的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有乙酰乳酸合成酶活性的由a1衍生的蛋白质。
上述系统中,所述靶DNA的核苷酸序列为SEQ ID No.3所示。
上述系统中,所述上游靶位点序列为SEQ ID No.1的第7590-7609位所示的DNA片段;所述下游靶位点序列为SEQ ID No.1的第8032-8051位所示的DNA片段;所述定点修饰片段为SEQ ID No.1的第7716-7979位所示的DNA片段。
上述系统中,所述gRNA表达盒包括gRNA表达盒1和gRNA表达盒2,所述gRNA表达盒1编码gRNA1(如gRNAW548L),所述gRNA表达盒2编码gRNA2(如gRNAS627I),所述gRNA1靶向于所述上游靶位点,所述gRNA2靶向于所述下游靶位点。
上述系统中,所述Cas9蛋白表达盒包括启动Cas9蛋白基因转录的启动子(如Ubiquitin启动子)、Cas9蛋白基因和终止Cas9蛋白基因转录的终止子(如NOS终止子);所述gRNA表达盒1包括启动gRNA1编码基因转录的启动子(如水稻U3启动子)、所述gRNA1编码基因和终止所述gRNA1编码基因转录的终止子(如Poly-A终止子);所述gRNA表达盒2包括启动gRNA2编码基因转录的启动子(如水稻U3启动子)、所述gRNA2编码基因和终止所述gRNA2编码基因转录的终止子(如Poly-T终止子)。
上述系统中,所述gRNA表达盒1(如gRNAW548L表达盒)的序列为SEQ ID No.1的第261-747位所示的DNA片段;所述gRNA表达盒2(如gRNAS627I表达盒)的序列为SEQ ID No.1的第8328-8814位所示的DNA片段。
上述系统中,所述用于植物基因组定点修饰的载体可为重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor,其为SEQ ID No.1所示的载体。SEQ ID No.1的第900-7570位所示的核苷酸序列为所述Cas9蛋白表达盒,SEQ ID No.1的第5580-7570位所示的核苷酸序列为启动所述Cas9蛋白基因转录的Ubiquitin启动子,SEQ ID No.1的第1446-5576位所示的核苷酸序列为所述Cas9蛋白基因,SEQ ID No.1的第900-1152位所示的核苷酸序列为所述终止Cas9蛋白基因转录的NOS终止子;SEQ ID No.1的第261-747位所示的核苷酸序列为所述gRNA表达盒1,SEQ ID No.1的第367-747位所示的核苷酸序列为启动所述gRNA1编码基因转录的水稻U3启动子,SEQ ID No.1的第271-366位所示的核苷酸序列为所述gRNA1编码基因,SEQ ID No.1的第261-270位所示的核苷酸序列为终止所述gRNA1编码基因转录的Poly-A终止子;SEQ ID No.1的第8328-8814位所示的核苷酸序列为所述gRNA表达盒2,SEQ ID No.1的第8328-8708位所示的核苷酸序列为启动所述gRNA2编码基因转录的水稻U3启动子,SEQ ID No.1的第8709-8804位所示的核苷酸序列为所述gRNA2编码基因,SEQ ID No.1的第8805-8814位所示的核苷酸序列为终止所述gRNA2编码基因转录的Poly-T终止子;SEQ ID No.1的第7590-8051位所示的核苷酸序列为所述供体DNA(arm donor),SEQ ID No.1的第7590-7609位所示的核苷酸序列为所述上游靶位点,SEQ ID No.1的第7616-7715位所示的核苷酸序列为所述上游同源臂,SEQ ID No.1的第7716-7979位所示的核苷酸序列为所述定点修饰片段,SEQ ID No.1的第7980-8025位所示的核苷酸序列为所述下游同源臂,SEQ ID No.1的第8032-8051位所示的核苷酸序列为所述下游靶位点。
上述系统还可包括进行PCR扩增所需的其它试剂、进行凝胶电泳所需的试剂、PCR仪、电泳仪、凝胶成像系统和照相机。
为解决上述技术问题,本发明还提供了一种用于植物基因组定点修饰的方法。
本发明所提供的一种用于植物基因组定点修饰的方法,包括向目的植物中导入所 述用于植物基因组定点修饰的系统,得到植物基因组被定点修饰的植物。
上述方法中,所述用于植物基因组定点修饰的系统中所述用于植物基因组定点修饰的载体和所述供体DNA的摩尔比可为1:(0-40),具体可为1:20。
上述方法中,所述定点修饰可为氨基酸替换,外源基因定点整合或外源片段定点整合。
上文中,定点修饰具体可为将乙酰乳酸合成酶(ALS)的第548位色氨酸(W)突变为亮氨酸(L)和第627位丝氨酸(S)突变为异亮氨酸(I)。
本发明还提供了下述1)-5)中任一种应用:
1)上述系统在植物基因组定点修饰中的应用;
2)上述系统在培育基因组被定点修饰的植物中的应用;
3)上述系统在培育抗除草剂植物中的应用;
4)上述系统在植物育种中的应用;
5)上述系统在转基因植物研究中,利用定点修饰后的ALS基因作为筛选标记基因的应用。
上述应用中,所述定点修饰可为氨基酸替换,外源基因定点整合或外源片段定点整合。
上述应用中,所述定点修饰后的ALS基因是将SEQ ID No.2所示的乙酰乳酸合成酶中的第548位色氨酸(W)(野生型中该位置的色氨酸的密码子为TGG)突变为亮氨酸(L)(该位置亮氨酸的密码子为TTG),第627位丝氨酸(S)(野生型中该位置的丝氨酸的密码子为AGT)突变为异亮氨酸(I)(该位置异亮氨酸的密码子为ATT),其它氨基酸残基不变得到的乙酰乳酸合成酶定点修饰蛋白的编码基因。
上述应用中,所述除草剂可为嘧啶羧酸类、磺脲类或咪唑啉酮类除草剂,具体可为嘧啶羧酸类除草剂,进一步的,所述嘧啶羧酸类除草剂具体可为双草醚(BS)。
上文中,所述植物可为单子叶植物或双子叶植物;所述目的植物可为单子叶植物或双子叶植物;所述单子叶植物可为禾本科植物,所述禾本科植物具体可为水稻。
实验证明,采用本发明的体外构建含有Cas9蛋白的表达盒、两个靶点的gRNA表达盒、及外源片段arm donor(供体DNA)两端加两个gRNA可识别的靶点序列的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor与外源片段arm donor通过基因枪方法共转化水稻愈伤组织,能够成功将乙酰乳酸合成酶(ALS)中的第548位色氨酸(W)突变为亮氨酸(L)和第627位丝氨酸(S)突变为异亮氨酸(I),实现了水稻ALS基因的定点修饰,获得了同源重组的纯合系植株,无脱靶效应,并且同源重组的植株具有抗除草剂双草醚的特性。因此,本研究建立了一种利用CRISPR/Cas9系统定点修饰乙酰乳酸合成酶(ALS)基因获得抗除草剂水稻的技术体系,同时为在水稻和其它作 物中利用此CRISPR/Cas9系统进行基因的定点修饰、替换和外源基因定点整合提供了依据,为改良其它重要农作物的农艺性状提供基础。
附图说明
图1为重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor的框架图。
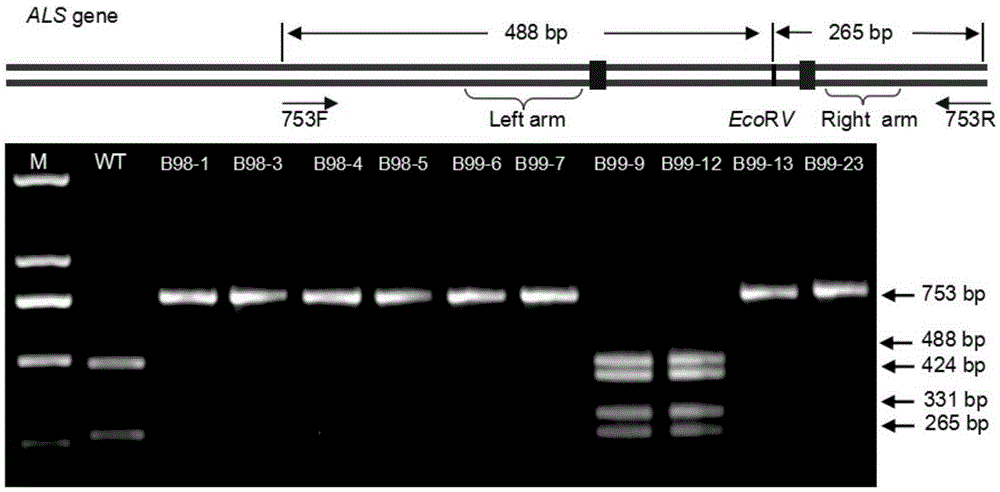
图2为部分T0代定点修饰水稻的PCR产物酶切鉴定结果。其中,M为DL2000DNA分子量Marker,WT为野生型水稻组植株的PCR产物酶切鉴定结果。
图3为Cas9-arm donor组植株的同源重组类型的测序结果鉴定。其中,WT ALS为野生型水稻植株的ALS的基因;Donor为供体DNA基因型。
图4为Cas9-arm donor组植株的ALS的第548位氨基酸位点和第627位氨基酸位点附近的核苷酸序列的同义突变结果。
图5为检测Cas9-arm donor组植株中是否存在重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor上相关序列的鉴定。其中,A为检测Cas9-arm donor组植株所用引物位置标示图;B为PCR检测Cas9-arm donor组植株中是否含有Cas9蛋白基因的琼脂糖凝胶电泳图;C为PCR检测Cas9-arm donor组植株中是否含有gRNA表达盒的琼脂糖凝胶电泳图;D为PCR检测Cas9-arm donor组植株中随机整合的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor中的外源片段arm donor是否完整的琼脂糖凝胶电泳图;vector为重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor,WT为野生型组水稻植株的PCR产物酶切鉴定结果。
图6为喷洒双草醚(Bispyribac-sodium)36天后植株的生长情况。其中,1、2和3均为双位点同源重组成功的植株,4、5和6均为野生型水稻植株。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的日本晴水稻(下文中为野生型水稻)种子为中国农业科学院作物科学研究所国家农作物种质资源保存中心的产品。
下述实施例中的pCXUN质粒(吴照祥.水稻雌配子发育相关基因FGA1的克隆与初步功能分析[D].福建农林大学,2011.)公众可从中国农业科学院作物科学研究所获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中所用到的引物对序列及其用途如表1所示。
表1、所用引物对的序列及用途
下述实施例以日本晴水稻作为将要进行基因组定点修饰的目的植物,以日本晴水稻的乙酰乳酸合成酶基因作为靶DNA(核苷酸序列为SEQ ID No.3),构建将日本晴水稻的乙酰乳酸合成酶的第548位色氨酸(W)(野生型中该位置的色氨酸的密码子为TGG)突变为亮氨酸(L)(该位置亮氨酸的密码子为TTG),第627位丝氨酸(S)(野生型中该位置的丝氨酸的密码子为AGT)突变为异亮氨酸(I)(该位置异亮氨酸的密码子为ATT)的定点修饰水稻。
日本晴水稻中的乙酰乳酸合成酶基因中还含有EcoR V酶切位点,供体DNA(arm donor)该酶切位点在不改变氨基酸的情况下被定点突变掉。
实施例1、用于乙酰乳酸合成酶(ALS)基因定点突变的载体的构建
将载体pCXUN的XcmI,KpnI及PmeI识别位点依次插入SEQ ID No.1的第1446-5576位,第19-799位和第8272-9086位所示的DNA序列,保持其它DNA序列不变,得到重组表达载体pCXUN-cas9-gRNA548-gRNA627。测序结果表明重组表达载体pCXUN-cas9-gRNA548-gRNA627中含有SEQ ID No.1的第1446-5576位的核苷酸所示的Cas9蛋白基因,SEQ ID No.1的第261-747位核苷酸所示的gRNA表达盒1(gRNAW548L表达盒,编码gRNAW548L)和SEQ ID No.1的第8328-8814位核苷酸所示的gRNA表达盒2(gRNAS627I表达盒,编码gRNAS627I)。
将化学合成定点修饰的ALS基因片段用1osdonorF/6osdonorR引物对进行PCR扩增,得到PCR扩增产物同源重组元件,命名为arm-Donor(供体DNA)。用Hind III限制性内切酶酶切重组表达载体pCXUN-cas9-gRNA548-gRNA627并回收,获得载体酶切后的线性载体pCXUN-cas9-gRNA548-gRNA627。将线性载体pCXUN-cas9-gRNA548-gRNA627与arm-Donor进行连接得到重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor(图1)。测序结果表明,重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor的核苷酸序列如SEQ ID No.1所示。其中,SEQ ID No.1的第900-7570位所示的核苷酸序列为Cas9蛋白表达盒,SEQ ID No.1的第5580-7570位所示的核苷酸序列为启动Cas9蛋白基因转录的Ubiquitin启动子,SEQ ID No.1的第1446-5576位所示的核苷酸序列为Cas9蛋白基因,SEQ ID No.1的第900-1152位所示的核苷酸序列为终止Cas9蛋白基因转录的NOS终止子;SEQ ID No.1的第261-747位所示的核苷酸序列为gRNA表达盒1,SEQ ID No.1的第367-747位所示的核苷酸序列为启动gRNA1编码基因转录的水稻U3启动子,SEQ ID No.1的第271-366位所示的核苷酸序列为gRNA1编码基因,SEQ ID No.1的第261-270位所示的核苷酸序列为终止gRNA1编码基因转录的Poly-A终止子;SEQ ID No.1的第8328-8814位所示的核苷酸序列为gRNA表达盒2,SEQ ID No.1的第8328-8708位所示的核苷酸序列为启动gRNA2编码基因转录的水稻U3启动子,SEQ ID No.1的第8709-8804位所示的核苷酸序列为gRNA2编码基因,SEQ ID No.1的第8805-8814位所示的核苷酸序列为终止gRNA2编码基因转录的Poly-T终止子;SEQ ID No.1的第7590-8051位所示的核苷酸序列为arm donor(供体DNA),SEQ ID No.1的第7590-7609位所示的核苷酸序列为上游靶位点,SEQ ID No.1的第7616-7715位所示的核苷酸序列为上游同源臂,SEQ ID No.1的第7716-7979位所示的核苷酸序列为定点修饰片段,SEQ ID No.1的第7980-8025位所示的核苷酸序列为下游同源臂,SEQ ID No.1的第8032-8051位 所示的核苷酸序列为下游靶位点。
实施例2、ALS的第548位和627位双位点氨基酸定点修饰水稻的获得及验证
一、定点修饰水稻的获得
选取饱满的日本晴水稻种子,剥去种皮,灭菌洗涤后,均匀的点入R1固体培养基(4.3g/L MS& Vitamins盐+30g/L蔗糖+0.5g/L MES+300mg/L酪蛋白氨基酸+2.8g/L L-脯氨酸+2mg/L 2,4-D+4g/L植物凝胶,pH 5.8)中,28℃持续光照2-3周诱导愈伤组织的形成。将诱导得到的愈伤组织用含有浓度为0.3M甘露醇和浓度为0.3M山梨醇的R1培养基高渗处理4-6h后,得到高渗处理后的愈伤组织。
将实施例1中的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor和arm-donor按摩尔比1:20混合后采用基因枪轰击上述高渗处理的愈伤组织,采用0.6μm的金粉,轰击压力为900psi进行轰击,得到转化后的愈伤组织;将转化后的愈伤组织在添加浓度为0.3M甘露醇和浓度为0.3M山梨醇的R1培养基上培养16h后转移至含有浓度为50mg/L潮霉素的R1筛选培养基(4.3g/L MS&Vitamins盐+30g/L蔗糖+0.5g/L MES+300mg/L酪蛋白氨基酸+2.8g/L L-脯氨酸+2mg/L 2,4-D+4g/L植物凝胶,pH 5.8)上,在28℃条件下持续光照2周转移至含有浓度为0.4μM Bispyribac-sodium的R1筛选培养基上,在28℃条件下持续光照2周。选取生长良好呈嫩黄色的阳性愈伤组织,用无菌镊子移至含有浓度为0.4μM Bispyribac-sodium的R4分化培养基(4.3g/L MS&Vitamins盐+30g/L蔗糖+0.5g/L MES+2g/L酪蛋白氨基酸+30g/L山梨醇+2mg/L激动素+1mg/L NAA+4g/L植物凝胶,pH 5.8)中,在28℃条件下持续光照培养。待分化出来的幼苗长至2至5mm时,将幼苗转入不含激素和抗生素的R5培养基(2.15g/L MS&Vitamins盐+15g/L蔗糖+0.5g/L MES+2g/L植物凝胶,pH 5.8)中,在28℃条件下持续光照培养2-3周,之后移入土中置于温室中生长(培养条件为:温度28-30℃,光照为16h光照/8h黑暗),共获得116株T0代定点修饰水稻,记为Cas9-arm donor组。
将高渗处理后的愈伤组织按照上述Cas9-arm donor组的愈伤组织培育成水稻植株的方法进行培养,但不添加BS和潮霉素筛选剂,获得非定点修饰水稻,记为野生型组。
二、同源重组植株的鉴定
1、同源重组植株的PCR酶切鉴定
分别选取52株步骤一获得的Cas9-arm donor组T0代定点修饰水稻和10株步骤一获得的野生型组水稻,使用植物基因组DNA提取试剂盒(天根生化科技(北京) 有限公司)提取再生植株的叶片DNA。以提取的再生植株的叶片DNA为模板,根据乙酰乳酸合成酶(ALS)基因序列设计引物对753F/R进行PCR反应,PCR反应体系如下:
反应条件:94℃预变性4min;94℃变性40s,58℃退火40s,72℃延伸1min,共35个循环;最后72℃延伸10min。
由于arm-Donor与植物自身ALS基因具有很高的同源性,为了排除arm-Donor对同源重组植株的鉴定的干扰,将引物对753F/R设在arm-Donor片段两端,因水稻自身ALS基因含有限制性内切酶EcoR V酶切位点,将arm-Donor片段的该位点在不改变氨基酸前提下定点突变掉,因此PCR扩增产物不能被限制性内切酶EcoR V切开的即为重组成功的植株,不能够被限制性内切酶EcoR V进行酶切的PCR扩增产物的片段长度为753bp。将PCR扩增产物利用限制性内切酶EcoR V进行酶切检测。
对PCR扩增产物进行琼脂糖凝胶电泳,结果表明,Cas9-arm donor组有48株T0代定点修饰水稻均不能被限制性内切酶EcoR V切开(图2),有4株植株能被限制性内切酶EcoR V切开,测序结果表明4株能被限制性内切酶EcoR V切开的植株为一条链在ALS的第548位氨基酸的密码子处发生同源重组,在ALS的第627位氨基酸的密码子处没有发生同源重组,另外一条链在ALS的第548位氨基酸的密码子处和第627位氨基酸的密码子处均发生非同源重组;野生型组水稻均可以被限制性内切酶EcoR V切开。
随机抽取52株Cas9-arm donor组T0代定点修饰水稻,利用引物对753F/R得到的PCR扩增产物进行克隆测序分析。分析结果表明,Cas9-arm donor组没有被限制性内切酶EcoR V切开的T0代定点修饰水稻均为同源重组成功植株,并为纯合株系,Cas9-arm donor组重组成功植株的ALS与野生型相比,第548位色氨酸(W)(野生型中该位置的色氨酸的密码子为TGG)均突变为亮氨酸(L)(该位置亮氨酸的密码子为TTG),第627位丝氨酸(S)(野生型中该位置的丝氨酸的密码子为AGT) 均突变为异亮氨酸(I)(该位置异亮氨酸的密码子为ATT),其它氨基酸均没有变化,但是这两个位点附近的核苷酸发生同义突变,第548位氨基酸位点附近的核苷酸序列和第627位氨基酸位点附近的核苷酸序列均如图4所示。
Cas9-arm donor组中的植株B99-9、B99-10、B99-11和B99-12可以被限制性内切酶EcoR V切开的植株为部分重组成功,一条链上只有ALS的第548位氨基酸的密码子处同源重组成功,ALS的第627位氨基酸的密码子处没有发生同源重组,另外一条链在ALS的第548位氨基酸的密码子处和第627位氨基酸的密码子处均发生非同源重组(表2,图2,图3)。
表2、重组结果的统计
注:Ho代表纯合株系,Com-He代表复合杂合株系,“+”代表检测结果为阳性。
2、同源重组植株是否存在重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor上相关序列的鉴定
根据重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor序列,分别设计检测Cas9蛋白基因的引物对cas9F/R,检测gRNA表达盒的引物对U3F/R和检测植株中随机整合的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor中的外源片段arm donor是否完整的引物对365F/R。上述三种引物对的PCR反应体系如下:
反应条件:94℃预变性4min;94℃变性40s,55℃退火40s,72℃延伸1min,共进行35个循环;最后72℃延伸10min。检测Cas9蛋白基因的引物对cas9F/R在含有Cas9蛋白基因的植株中扩增得到的片段长度为738bp;检测gRNA表达盒的引物对U3F/R在含有gRNA表达盒的植株中扩增得到的片段长度为614bp;检测植株中随机整合的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor中的外源片段arm donor是否完整的引物对365F/R在植株中的arm donor全部被编辑时扩增得到的片段长度均为365bp,在植株中的arm donor未被编辑扩增得到的片段长度为841bp,在植株中的arm donor部分被编辑时扩中同时含有365bp和841bp的扩增片段,分别对PCR扩增产物进行琼脂糖凝胶电泳。
利用检测Cas9蛋白基因的引物对cas9F/R对步骤一获得的Cas9-arm donor组52株T0代定点修饰水稻进行PCR检测,结果表明,除了植株B99-9、B99-10、B99-11和B99-12,其它植株均含有Cas9蛋白基因,PCR扩增产物中含有738bp长度的扩增片段。含有Cas9蛋白基因的植株已经全部同源重组成功并且为纯合株系,所以gRNA无法识别定点修饰后的ALS基因,不存在嵌合体的情况发生。植株B99-9、B99-10、B99-11和B99-12等4颗植株虽然仍有ALS的第627位点没有被编辑,但因没有Cas9蛋白基因的完整序列在内,同样无法再被重新编辑(图5中B)。
利用检测gRNA表达盒的引物对U3F/R对步骤一获得的Cas9-arm donor组52株T0代定点修饰水稻进行PCR检测,检测结果表明,所有植株均含有gRNA表达盒(图5中C),PCR扩增产物中均含有614bp长度的扩增片段。
利用检测植株中随机整合的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor中的外源片段arm donor是否完整的引物对365F/R对步骤一获得的Cas9-arm donor组52株T0代定点修饰水稻进行PCR检测,检测结果表明,52株植株中有51株植株全部为大片段缺失类型,即所有外源片段arm donor均被设计的组载体pCXUN-cas9-gRNA548-gRNA627-arm donor编辑,gRNA548和gRNA627的存在将外源 片段arm donor切下并用于定点修饰水稻自身ALS基因,因此为大片段缺失类型。其中,植株B99-9为唯一一株仍然存在841bp长片段PCR扩增产物的植株(图5中D),测序结果表明,该植株在ALS的第548和627位点的氨基酸的密码子处均发生了非同源重组。
3、重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor的脱靶分析
根据网上预测软件(http://crispr.dbcls.jp/),分别对gRNA548和gRNA627可能存在的脱靶位点进行预测,并根据可能存在脱靶位点的侧翼序列设计引物对:针对gRNAW548L表达盒的引物对为OFF1F/R和OFF2F/R,针对gRNAS627I表达盒的引物对为OFF3F/R、OFF4F/R和OFF5F/R,利用上述引物对对所获得的步骤一获得的Cas9-arm donor组T0代定点修饰水稻进行PCR扩增,反应条件如下:
反应条件:94℃预变性4min;94℃变性40s,55℃退火40s,72℃延伸1min s,共进行35个循环;最后72℃延伸10min。引物对OFF1F/R、OFF2F/R、OFF3F/R、OFF4F/R和OFF5F/R对脱靶植株的扩增片段长度分别为492bp、606bp、597bp、388bp和382bp。
利用引物对OFF1F/R、OFF2F/R、OFF3F/R、OFF4F/R和OFF5F/R对30颗植株进行PCR扩增,并将PCR扩增产物克隆并测序。检测结果表明,所设计的重组载体pCXUN-cas9-gRNA548-gRNA627-arm donor中gRNA表达和表达得到的gRNA并不存在脱靶情况(表3)。
表3、靶点脱靶分析
4、同源重组成功的植株对除草剂双草醚(BS)的抗性鉴定
对野生型水稻和步骤一获得的ALS的第548位和627位双位点氨基酸的密码子处同源重组成功的Cas9-arm donor组T0代定点修饰水稻喷洒浓度为100μM的双草醚(Bispyribac-sodium)30-50天后,观察植株的生长状态。
结果如图6所示,喷洒浓度为100μM的双草醚(Bispyribac-sodium)36天后野生型水稻植株枯萎,Cas9-arm donor组T0代定点修饰同源重组成功的植株生长正常。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向脑胶质瘤的双重修饰脂质体给药系统的制备和应用的制作方法与工艺
- 一种基于强电荷修饰的靶向基团作为药物包覆剂的设计方法与流程
- 用于靶向遗传修饰的方法和组合物,以及这些组合物的使用方法与流程
- DUOX2修饰的DC疫苗及其靶向杀伤胰腺癌起始细胞的应用的制造方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程
- 脑部引经药修饰的脑靶向纳米给药系统及其制备方法与流程
- 肿瘤抑制基因的杂合修饰和1型神经纤维瘤病的猪模型的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 用于通过单步多重靶向进行靶向遗传修饰的方法和组合物与流程
- 导致单性结实坐果的经修饰的基因的制造方法与工艺