一种基于强电荷修饰的靶向基团作为药物包覆剂的设计方法与流程
本发明涉及生物医学领域,特别是涉及封装及靶向输送药物和选择性释放药物的药物设计方法及应用。
背景技术:
癌症已经成为当今在全球范围内威胁人类生命的头号疾病。目前对于肿瘤治疗方向,可分为手术治疗方法及非手术治疗方法。肿瘤的非手术治疗方法包括化疗和放疗,但由于肿瘤细胞在与正常细胞具有很高的相似性的同时还具有更高的生命力,对肿瘤细胞的特异性药物设计成为现有非手术疗法的一项首要议题,也就是说,要求抗癌药物具有更高的选择性或靶向传递系统。当治疗效果选择性地集中在肿瘤组织、肿瘤细胞或肿瘤基因时,就形成了对于肿瘤的靶向治疗,从而降低对正常组织的副作用。这其中,肿瘤靶向治疗最重要组成部分之一就是抗肿瘤靶向给药系统,这种系统可以把有效抗癌药物选择性或专一性地输送到肿瘤组织,同时,通过控制特定生理部位的药物剂量,从而达到降低抗癌药对非靶点部位的副作用和毒性的效果。
近年来,可以有效封装药物并实现靶向肿瘤组织快速释放的药物输送系统(dds)越来越多地引起科研人员的广泛关注,其中,最引人注目的就是智能药物输送系统(sdds)。一般情况下,一个理想的智能药物传递设计包括生物相容性材料具有可忽略的毒性,对肿瘤细胞具有显著的靶向性,稳定的药物封装率和在不同条件下精确可控释放的几个基本要素。与传统的药物输送系统相比,智能药物输送系统具有对于特定的外界环境刺激信号如物理信号(应力、温度、电荷、超声、光等)、化学(离子强度、ph等)、生物因素信号(生物分子、酶类)特异释放治疗药物这一显著优点。目前,智能药物输送系统已被应用于抗肿瘤载体及药物的研究,但一方面由于其表面不具有良好的包覆和特异的靶向功能性分子,故纳米技术现阶段在改善药物输送过程的同时,也明显提高其他正常组织器官对药物的摄取量,具有很大的毒副作用。另一方面,现阶段对于靶向肿瘤的药物输送载体还存在载药率低及合成工艺复杂等诸多问题。
技术实现要素:
本发明提供一种简便的基于结合带有强电荷的肽链结构修饰的靶向基团作为药物载体包覆剂的设计方法,能够同时实现对癌细胞靶向成像,靶向治疗且在肿瘤部位特异释放药物三种功能。
本发明的技术方案提出一种简便的利用靶向基团结合带有强电荷的多肽链通过静电作用包覆带电的药物或光学信号结构的设计方案,可以同时实现癌细胞靶向成像,靶向治疗且在肿瘤部位特异释放药物三种功能。
本发明提出的针对癌细胞的靶向输送药物并检测治疗响应和特异性释放的药物
,与现有技术相比,具有如下优点:
1)所述有强电荷的肽链结构同时具有有效封装药物并实现靶向肿瘤组织快速释放的双重功能,有效减少正常组织器官对药物的摄取量。
2)本发明合成方法简便,易于调控,合成出的药物载体生物相容性好。
附图说明
图1为基于结合带有强电荷的肽链结构修饰的靶向基团作为药物载体包覆剂的设计方案图。
图2为实施例中靶向癌细胞特异受体(egfr)双响应显像且表征药物释放的细胞图。
具体实施方式
下面结合实施例(但不限于所举实施例)进一步描述本发明:
以已经合成的带有强电荷的肽链为例,描述带有强电荷的肽链在纳米复合物合成及肿瘤靶向成像、靶向给药中的作用:
以带有强正电荷的,通过6个精氨酸修饰的6-精氨酸-affibody肽链为例:
所述带有强正电荷的通过6个精氨酸修饰的6-精氨酸-affibody肽链是利用大肠杆菌发酵的生物合成方法获得。大肠杆菌通过发酵、分离、提纯、冻干后可获得带有能够表达带有强正电荷的通过6个精氨酸修饰的6-精氨酸-affibody重组蛋白。
所述通过6个精氨酸修饰的6-精氨酸-affibody肽链,除可以通过静电相互作用包覆药物外,其还具有在胰腺癌细胞中被胰酶特异性识别并切断的特征,从而达到在胰酶作用下选择性释放药物的功能。
以包覆载药金纳米量子点为例对其功能进行说明:
1.6-精氨酸-affibody-巯基十一酸金纳米量子点的合成及表征。
4mg6-精氨酸-affibody溶解于4ml巯基十一酸金纳米量子点(mua-auncs)溶液中震荡搅拌24小时,将所获溶液通过截获分子量为12kda的透析袋去离子水流动透析后获得6-精氨酸-affibody-巯基十一酸金纳米量子点。
在所述6-精氨酸-affibody-巯基十一酸金纳米量子点中,包覆剂巯基十一酸在金原子表面形成很强的金-硫共价键,在水溶液中可以使6-精氨酸-affibody-金纳米量子点更加稳定。透射电镜(tem)显示所述巯基十一酸金纳米量子点在水溶液中具有1.65-2,25纳米的晶体尺寸并呈匀质分布,当加入靶向的6-精氨酸-affibody对其官能化后,所述6-精氨酸-affibody-巯基十一酸金纳米量子点的晶体尺寸增大到20纳米左右,从而证实靶向的6-精氨酸-affibody的确实修饰到了巯基十一酸金纳米量子点的表面。
ζ电位是判断粒子之间的静电排斥作用的一个很好的指标,因此,它可以用于表征液体中材料的表面电荷。当加入靶向的6-精氨酸-affibody对其官能化后,所述6-精氨酸-affibody-巯基十一酸金纳米量子点的减少到-30mv左右,从而证实所述6-精氨酸-affibody-巯基十一酸金纳米量子点带有强正电性。ζ电位高于30的绝对值说明所述修饰了带有强正电荷的6-精氨酸-affibody的巯基十一酸金纳米量子点是比普通的巯基十一酸金纳米量子点更加稳定的一种结构。
所述6-精氨酸-affibody-巯基十一酸金纳米量子点1650cm-1(ν-co-nh-),1590cm-1(νascoo-),1210cm-1(νcn)and1100cm-1(νcn)处存在特殊的红外(ir)吸收谱带。
所述6-精氨酸-affibody-巯基十一酸金纳米量子点具有很强的光学信号响应,其最大吸收波长在280nm处,荧光发射波长在616nm处,在紫外光激发下显红色荧光。
2.6-精氨酸-affibody-巯基十一酸金纳米量子点的应用
下面结合实施例(但不限于所举实施例)进一步描述所述6-精氨酸-affibody-巯基十一酸金纳米量子点的几种用途:
实施例一:6-精氨酸-affibody-巯基十一酸金纳米量子点用于癌细胞显像
以靶向高表达表皮生长因子受体(egfr)的癌细胞显像为例:
步骤一:高表达表皮生长因子受体(egfr)的癌细胞hepg2,bxpc3和几乎不表达表皮生长因子受体(egfr)的癌细胞a549分别以5×104个细胞/板的浓度在35毫米共焦板上接种并过夜培养。
步骤二:以每100微升所述6-精氨酸-affibody-巯基十一酸金纳米量子点加入到900微升的细胞培养基为孵育浓度对上述细胞在37℃下温育三十分钟。
步骤三:将上述细胞用含有4%磷酸盐缓冲液的多聚甲醛固定三十分钟。
步骤四:将上述细胞用4'6二脒基-2-苯基吲哚(dapi)染色十分钟。
步骤五:在激光共聚焦显微镜下观察对上述高表达表皮生长因子受体(egfr)的癌细胞的显像结果。
激光共聚焦显微结果显示,高表达表皮生长因子受体(egfr)的癌细胞hepg2的细胞轮廓迅速转身鲜艳的红色,是bxpc3细胞亮度的2.18倍,而几乎不表达表皮生长因子受体(egfr)的癌细胞a549只有微弱的红色,从而说明,所述靶向高表达表皮生长因子受体(egfr)的6-精氨酸-affibody-巯基十一酸金纳米量子点可以通过特异性抗体在体外检测特异性细胞表面上不同量的表皮生长因子受体(egfr),从而对hepg2,a549和bxpc3细胞的表皮生长因子受体的表达水平进行简便并准确定量。
所述利用靶向高表达表皮生长因子受体(egfr)的6-精氨酸-affibody-巯基十一酸金纳米量子点显像方法同传统方法相比,避免了传统通过免疫组织化学方法定量评价细胞表面受体状态时复杂和不敏感等缺陷,所述6-精氨酸-affibody-巯基十一酸金纳米量子点为定量评价细胞表面受体状态提供了一种直接,快速,方便的检测方法。
实施例二:6-精氨酸-affibody-巯基十一酸金纳米量子点用于药物载体
以负载带有负电荷的药物甲氨蝶呤(mtx)为例:
步骤一:将上述巯基十一酸金纳米量子点取2ml加入到2ml(1mmol/l)的mtx溶液中,搅拌四小时。
步骤二:将所获溶液通过截获分子量为3kda的透析袋去离子水流动透析后获得巯基十一酸-mtx金纳米量子点。
步骤三:将4mg6-精氨酸-affibody加入到4ml上述巯基十一酸-mtx金纳米量子点中,搅拌24小时。
步骤四:将所获溶液通过截获分子量为12kda的透析袋去离子水流动透析后获得6-精氨酸-affibody-巯基十一酸-mtx金纳米量子点。
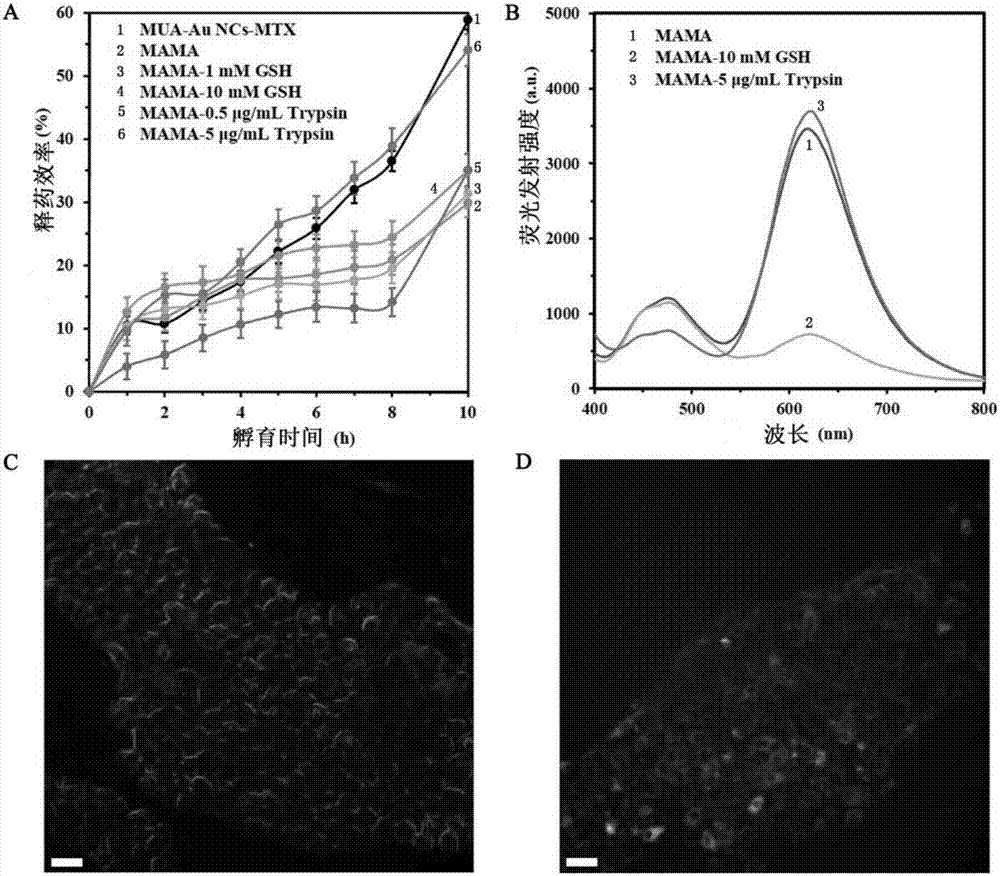
所述巯基十一酸-mtx金纳米量子点24小时后在ph7.4和ph6.6时的释药效率分别为66%和66.67%,当带有强正电荷的affibody肽链修饰后,其在ph7.4和ph6.6时的释药效率分别降低至33.65%和20.38%,从而说明所述带有强正电荷的affibody肽链具有通过静电相互作用有效封装与其电荷相反的药物的功能。
所述6-精氨酸-affibody-巯基十一酸-mtx金纳米量子点当环境条件从中性ph7.4向弱酸性ph6.6变化时,mtx的释放率增高,从而说明所述affibody-巯基十一酸-mtx金纳米量子点在癌细胞生存环境(弱酸性)中比在正常人体液环境(中性)中释药效果更好,从而能够有效减少正常组织器官对药物的摄取量,实现靶向肿瘤组织释放的理想效果。
所述6-精氨酸-affibody-巯基十一酸-mtx金纳米量子点当外界溶液中谷胱甘肽(gsh)的浓度由1mm向10mm变化时,mtx的释放率增高,从而说明所述affibody-巯基十一酸-mtx金纳米量子点在癌细胞生存环境(谷胱甘肽浓度高)中比在正常人体液环境(谷胱甘肽浓度低)中释药效果更好,从而也能够有效减少正常组织器官对药物的摄取量,实现靶向肿瘤组织释放的理想效果。
所述6-精氨酸-affibody-巯基十一酸-mtx金纳米量子点当外界溶液中胰酶的浓度由0.5μg/ml向5μg/ml变化时,mtx的释放率增高,从而说明所述affibody-巯基十一酸-mtx金纳米量子点在胰腺癌细胞(bxpc3)生存环境(胰酶浓度高)中比在正常人体液环境(胰酶浓度低)中释药效果更好,从而也能够有效减少正常组织器官对药物的摄取量,实现靶向胰腺肿瘤组织释放的理想效果。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向脑胶质瘤的双重修饰脂质体给药系统的制备和应用的制作方法与工艺
- 一种基于强电荷修饰的靶向基团作为药物包覆剂的设计方法与流程
- 用于靶向遗传修饰的方法和组合物,以及这些组合物的使用方法与流程
- DUOX2修饰的DC疫苗及其靶向杀伤胰腺癌起始细胞的应用的制造方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程
- 脑部引经药修饰的脑靶向纳米给药系统及其制备方法与流程
- 肿瘤抑制基因的杂合修饰和1型神经纤维瘤病的猪模型的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 用于通过单步多重靶向进行靶向遗传修饰的方法和组合物与流程
- 导致单性结实坐果的经修饰的基因的制造方法与工艺
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺