敲除DCF1基因在制备缓解阿尔兹海默症状药物中的应用的制作方法
本发明涉及敲除dcf1基因在制备缓解阿尔兹海默症状药物中的应用。
发明背景
ad(alzheimerdisease)是一种常见的神经系统退行性疾病,其临床表现主要是进行性痴呆,病理特征是在脑组织中出现老年斑(senileplaques,sp)、神经原纤维缠结(neurofibrillarytangles,nft)、神经元减少。伴随着老龄化社会到来,ad的发病率不断升高。据统计:全球约有2千多万ad病人,并正以每年460万人的速度增加。极大的降低了该人群的生活质量和预期寿命,已造成严重的社会影响。淀粉样前体蛋白(amyloidprecursorprotein,app)经过蛋白裂解酶的剪切后能够分泌出β-淀粉样蛋白42(amyloid-βprotein42,aβ42)和β-淀粉样蛋白4(0amyloid-βprotein40,aβ40),而aβ42能够导致阿尔兹海默症(ad),ad的发生主要表现为aβ42肽沉积到脑中,形成老年斑。
目前临床针对ad的药物干预大多采用改善认知功能,延缓疾病进展的方法。第一类是作用于神经递质的药物:加强中枢胆碱能活动,可以改善老年人的学习记忆能力。胆碱治疗目的是促进和维持残存的胆碱能神经元的功能。第二类是脑代谢赋活药物:此类药物的作用较多而复杂,主要是扩张脑血管,增加脑皮质细胞对氧、葡萄糖、氨基酸和磷脂的利用,促进脑细胞的恢复,改善脑细胞功能。这些药物的药效维持能力较为有限,随着治疗时间的延长,治疗效果亦会减弱,并且会出现较强的药物依赖情况,副作用较大。
树突状细胞因子(dendriticcellfactor1,dcf1),也称为跨膜蛋白59(transmembraneprotein59,tmem59),属于一种单次跨膜蛋白。目前ad相关研究显示,在ad患者和模型小鼠的大脑内,都可以检测出β-淀粉样蛋白沉淀,这种异常的蛋白沉积与ad患者和模型小鼠的学习记忆力障碍密切相关。研究显示,淀粉样蛋白的沉积在神经元退化和凋亡,神经通路退化中扮演着重要角色。app蛋白是i型跨膜蛋白,由位于细胞膜外的n末端长片段和细胞内的c末端较短片段构成,广泛存在于全身很多组织细胞膜的突触上。app在ad中起着至关重要的作用。迄今为止,国内外的研究已经发现在细胞内过表达dcf1基因可以抑制app的糖基化从而使不成熟的app滞留在高尔基体内。但是,在完整的动物模型中去研究dcf1和ad的关系还未见诸报端。鉴于现有的ad治疗药物并不能起到人们预期的效果,而基因治疗可能是取得突破的关键治疗手段,我们用实验室现有的小鼠和引进的ad模型小鼠杂交,得到了敲除dcf1基因的ad模型小鼠。
因此,以dcf1基因为靶点应用于ad的治疗,期望其能够减少ad疾病中淀粉样蛋白的产生和聚集,缓解神经元损伤和中枢神经系统的退化,从而达到缓解并改善ad患者的症状。
技术实现要素:
本发明的目的之一在于提供一种dcf1基因在制备缓解阿尔兹海默疾病症状药物中的应用。
本发明的目的之二在于提供一种敲除dcf1基因在制备减少β-淀粉样蛋白42的产生和聚集药物中的应用。
本发明的目的之三在于提供一种敲除dcf1基因在制备缓解神经元损伤和中枢神经系统的退化药物中的应用。
本发明的目的之四在于提供一种敲除dcf1基因在制备改善阿尔兹海默疾病中学习记忆能力障碍药物中的应用。
ad动物模型为:b6.cg-tg(appswe,psen1de9)(购于南京模式动物研究所)
此双转基因小鼠简称app-ps1小鼠,表达嵌合的小鼠/人淀粉样前体蛋白(mo/huapp695swe)和突变的人类早老素1(ps1-de9)。这些小鼠广泛应用于大脑神经性疾病的研究中,特别是阿尔茨海默症中淀粉样蛋白斑的形成。本发明通过使用实验室独有的dcf1基因敲除小鼠(dcf1-/-小鼠)和ad模型小鼠杂交数代后,得到app-ps1-dcf1-/-小鼠。利用同窝app-ps1小鼠作为对照进行行为学实验,观察dcf1的敲除对于ad小鼠学习记忆力的影响情况。
本发明新颖之处在于首次提出用dcf1基因治疗ad疾病,并且发现小鼠中敲除dcf1基因可以有效缓解ad疾病。本发明中以ad小鼠模型为载体,应用动物行为学实验检测dcf1的敲除对ad小鼠模型空间学习记忆能力的影响,实验结果显示dcf1的敲除可以有效改善ad小鼠模型的学习记忆能力障碍。
本发明主要是运用野生型,dcf1敲除以及ad模型鼠作为对照,以敲除dcf1基因的ad模型鼠为研究对象。通过小鼠鼠脑冰冻切片硫代黄素染色发现敲除dcf1后可以减少老年斑沉积;从行为学方面,观察小鼠空间学习记忆能力,证明dcf1敲除后可以增强ad小鼠的学习记忆能力;进而发现和证明dcf1的敲除可以缓解阿尔兹海默症。同时也为研发新的ad治疗药物提供了基因靶点。
附图说明
图1为dcf1敲除后,ad模型小鼠海马与皮层区域老年斑减少。实验组为app-ps1-dcf1-/-小鼠大脑海马区冰冻切片硫代黄素s染色,对照组为app-ps1小鼠。分别对疾病发生过程中的三个不同的年龄段进行考察,每个年龄段的每种基因型各取3只小鼠,每只小鼠取三个连续切片,统计硫代黄素着色斑块面积占白色矩形框内脑片总面积的比值(mean±sem)a图展示实验组和对照组不同年龄段的小鼠全脑老年斑沉积情况;b图是实验组和对照组不同年龄段的小鼠硫代黄素着色斑块面积占白色矩形框内脑片总面积的比值的统计情况;c图是实验组和对照组小鼠大脑海马dg区形成的单个老年斑的放大图片。(***表示与对照组比较p<0.001;**表示与对照组比较p<0.01;*表示与对照组比较p<0.05;其中样本量n=3)。
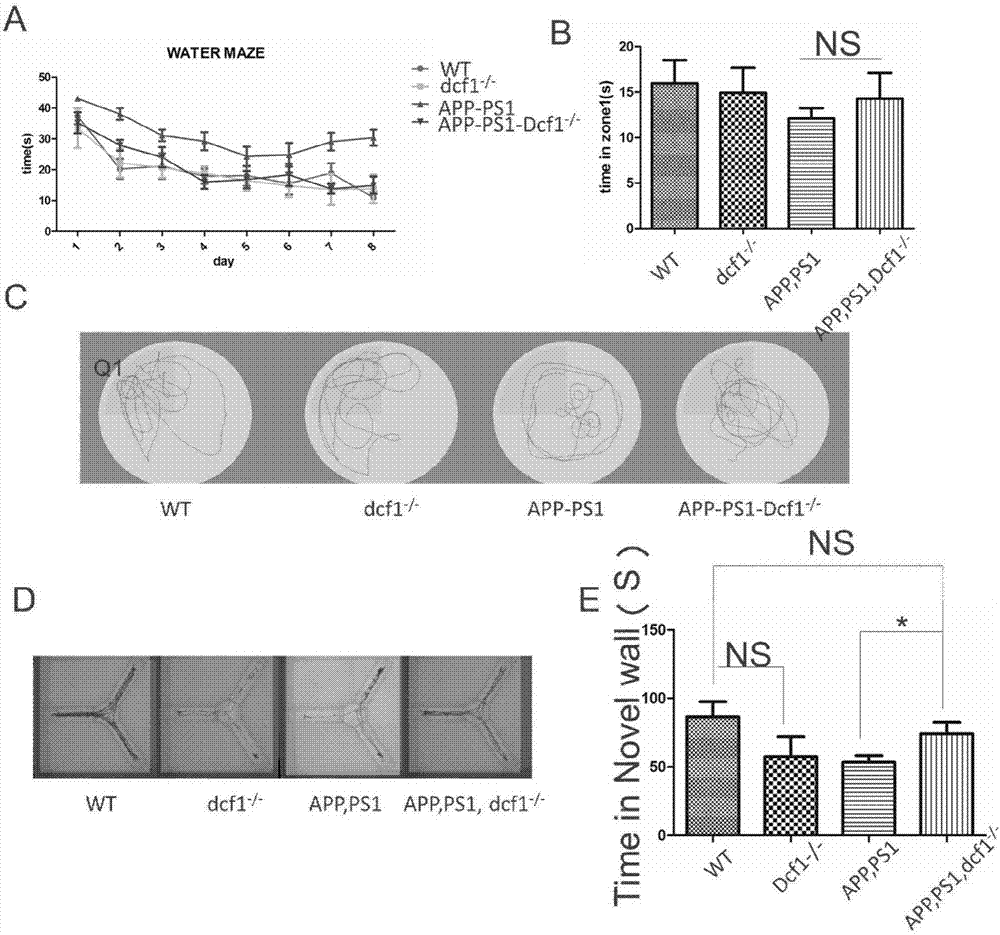
图2为dcf1敲除后,ad模型小鼠水迷宫和y迷宫行为学显示,dcf1的敲除缓解了ad症状。实验组为12个月的app-ps1-dcf1-/-小鼠,对照组为app-ps1小鼠以及wt,dcf1-/-小鼠。a图和b图显示敲除dcf1后,12月龄ad模型小鼠的空间学习记忆能力回到野生型的水平,在野生型中单独敲除dcf1对小鼠没有影响;c图是第九天测试时候各个基因型代表性轨迹图;d图是各个基因型在y迷宫中的代表性轨迹图;e图是各个基因型在新异壁中的停留时间统计图,显示了敲除dcf1后,ad小鼠在新异壁中的停留时间增长。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
1.冰冻切片的制作:
(a)试剂和材料准备4%pfa:0.2mpb250ml,nacl4.5g,加200mlddh2o,放入37℃摇床,待pfa完全溶解,定容至500ml,保存于4℃冰箱,一般可保存2-3个月。0.9%nacl:称取9gnacl,加900mlddh2o,定容至1l,保存于4℃。20%蔗糖溶液:称取100g蔗糖,加0.2mpb25ml,nacl4.5g,加200mlddh2o,待蔗糖溶解,定容至500ml。30%蔗糖溶液:称取150g蔗糖,加0.2mpb25ml,nacl4.5g,加200mlddh2o,待蔗糖溶解,定容至500ml。铬明胶溶液配制:0.5%明胶+0.1%铬明矾,称取2.5g明胶,加500mlddh2o,60℃水浴锅溶解明胶后,再加入0.5g铬明矾,待完全溶解后,0.22μm滤膜过滤。载玻片的准备:将全新的免洗玻片放入无水乙醇中浸泡过夜,第二天用干净的丝绸布将玻片捞出擦拭干净,置于玻片铁架上,然后浸入预热60℃的铬明胶溶液1分钟,取出后用力甩干玻片上多余液体,37℃烘干,此步骤做三次,将玻片放在干燥无灰尘的地方保持,待用。
(b)小鼠心脏灌流(1)用2%戊巴比妥钠溶液,按照100μl/30g腹腔注射小鼠。(2)待小鼠处于麻醉状态时,将小鼠四肢固定于白色泡沫板上。(3)用眼科剪将小鼠腹腔、胸腔及心包膜打开,并暴露出心脏。(4)左心室进针,止血镊固定针尖,剪破右心耳,进针不能太深,不然会穿到右心室,进入肺循环,灌注速度也不要太快,不然也会灌到肺循环那边。(5)推动装有预冷生理盐水的注射器,将体循环中血液排尽,当出口处无明显血液颜色,肝脏表面发白时,换成预冷的4%pfa进行灌注,结束后小鼠四肢会变得冰冷僵硬。
(c)鼠脑固定脱水(1)用眼科剪和眼科镊取出完整鼠脑,若灌流效果出色,小鼠脑袋呈现发白状,无血色,放在4%pfa中继续固定4-6小时。(2)用1×pbs清洗鼠脑,去除多余4%pfa、然后浸泡至装有20%蔗糖溶液的50ml离心管中,待鼠脑下沉至管底,移走20%蔗糖溶液,加入30%蔗糖溶液。(3)待鼠脑在30%蔗糖溶液中沉入管底,取出鼠脑,用滤纸吸干鼠脑表面,然后将脑袋置于橡胶翻口塞中,用otc包埋剂浸没脑袋,需做好鼠脑方位标记,方便切片时确定鼠脑前后位置,一般标记嗅球所在方位,放在-80℃冰箱迅速冻结成块,以待切片之用。
(d)切片(1)将置于-80℃的鼠脑标本拿出,置于-20℃的冰冻切片机1小时,目的是使样本温度升至-20℃。(2)样品托上抹一层otc包埋剂,将样本从橡胶翻口塞取出,置于其上,平放于切片机内,一定要注意标记样本的方位,方便后续切片。(3)切片机保持-20℃恒温,切片不受外界温度和环境影响,切片时,首先找到目标位置,调节防卷板的前后位置,找到最佳贴片位置,载玻片附贴组织切片时切勿上下移动,一般切片厚度20μm,贴好的玻片在切片机的玻璃盖上放置30分钟后放入玻片盒,37℃烘箱过夜后可用于免疫组化,暂时不用的切片可置于-80℃冰箱长期保存。
2.硫代黄素s染色:
(a)所需试剂:(1)用pbs配置05%的硫代黄素s染色液;(2)01%tritonx-100-pbs通透剂;(3)用超纯水配置50%的脱色液。
(b)染色步骤:(1)将冰冻切片拿出恢复至室温,pbs西三次每次5min;(2)用0.1%tritonx-100-pbs通透30min;(3)用硫代黄素s染色液染色12h;(4)用脱色液脱色30min。(5)用荧光封片剂封片。
(c)观察方法:使用蔡司激光共聚焦显微镜观察和拍摄全脑横截面图片。
参见图1,本实验证明了在ad模型小鼠中dcf1基因的敲除减少了老年斑的聚集从而缓解了ad疾病。a为不同年龄段app-ps1小鼠和app-ps1-dcf1-/-小鼠全脑老年斑检测,其中白色方框区域用来统计老年斑面积。b为老年斑面积占区域内脑片面积的百分比统计图。可见敲除了dcf1以后,app-ps1小鼠的老年斑在6个月和9个月分别有显著性缓解(p<0.05),17个月也有显著性缓解(p<0.01)。c为敲除dcf1以后app-ps1小鼠海马dg区单个老年斑面积明显减小。
3.行为学观察:
(a)水迷宫行为学实验
1.架设好摄像头与实验装置,调整好光度,水温调整在20℃-22℃。
2.取实验小鼠提前放入实验房间适应环境30min。
3.设置好noldus行为学分析软件,把实验区域划平均分为四个象限,在第一象限放置平台,平台低于水面1.5cm,在软件换面捕捉区域划分出平台区域。
4.取实验鼠放入水中,自由活动1min,如果实验鼠在1min内找到平台,记录实验鼠找到平台的时间,实验鼠在平台上待30s后放回鼠笼中;如果实验鼠在1min内没找到平台,引导实验鼠到达平台,实验鼠在平台上待30s后放回鼠笼中。
5.按步骤4重复测试完所有实验鼠,实验时间控制在9:00-19:00。
6.第二天到第八天重复步骤4、5.
7.取出平台,取实验鼠放入水中,自由活动2min。记录实验鼠进入第一象限的时间、穿过平台区域的次数。
(b)y-迷宫行为学实验
1.架设好摄像头与实验装置,调整好光度。
2.取实验用小鼠提前放在实验房间适应环境30min。
3.设置好noldus行为学分析软件,把实验区域划分为为新异臂和原始区,两者之间用挡板隔开。
4.取实验鼠放入原始区,实验鼠在原始区自由活动5min。
5.拿开挡板,实验鼠自由活动5min,记录实验鼠进入新异臂的次数和在新异臂活动的时间。
6.取出实验鼠放回鼠笼中,清除实验鼠在y-迷宫中产生的垃圾,均匀喷洒75%酒精,擦拭干净实验装置。用挡板隔开新异臂和原始区,静置3min,使75%酒精完全挥发掉。
7.重复步骤4、5、6,依次测试完所有实验鼠。实验时间控制在9:00-19:00。
参见图2,a代表在水迷宫训练期间,敲除dcf1以后,app-ps1小鼠表现出明显的缓解,空间学习能力提升。b代表在水迷宫测试期间,敲除dcf1以后,app-ps1小鼠表现出缓解,空间记忆能力提升。c图是训练期间各个基因型具有代表性的游泳轨迹图。d图是y迷宫测试时各个基因型具有代表性的运动轨迹图。e图是y迷宫测试,敲除了dcf1的app-ps1小鼠呈现出学习识别能力的提升。
- 还没有人留言评论。精彩留言会获得点赞!