包含细胞结合剂和细胞毒性剂的缀合物的制作方法
相关申请的引用
本申请依据35u.s.c.§119(e)要求在2014年9月3日提交的美国临时申请号62/045,264、2014年12月3日提交的美国临时申请号62/086,986、2015年4月17日提交的美国临时申请号62/149,379和2015年6月29日提交的美国临时申请号62/186,235的提交日的权益,各案的完整内容,包括所有附图、化学式、说明书和权利要求书,均以引用的方式并入本文中。
发明背景
抗体-药物缀合物(adc)和细胞结合剂-药物缀合物是作为对多种癌症具有功效的一类有效抗肿瘤剂而出现。细胞结合剂-药物缀合物(诸如adc)通常由三个不同要素构成:细胞结合剂(例如抗体);接头;和细胞毒性部分。通常,细胞毒性药物部分共价连接至抗体上的赖氨酸,产生缀合物,该缀合物为在抗体分子上不同位置处连接不同数量药物的adc的非均质混合物。
发明概要
令人惊奇地发现,细胞结合剂(诸如抗体)上的n末端丝氨酸残基的2-羟基乙胺部分可选择性氧化成醛基,同时抗体不会过度氧化。所得到的具有醛基的抗体能够与具有醛反应性基团的细胞毒性药物或经由具有醛反应性基团的接头化合物进行位点特异性缀合。所得抗体-药物缀合物意外地保持与未缀合抗体类似的抗原结合亲和力,不过事实上,缀合位点是位于抗体的n末端。此外,所得缀合物尽管具有每个抗体仅连接两个分子的药物负载,但出乎意料地展现出高效力,且耐受性优于赖氨酸连接的缀合物。
在某些实施方案中,所述细胞结合剂(诸如抗体)是经由肟键联(-c=n-o-)共价连接至细胞毒性剂。令人惊奇的是,相比最近公开的发现(参见agarwal等人,proc.natl.acad.sci.usa110:46-51,2013),肟键联在体内具有高度稳定性。
本发明提供一种由以下结构式表示的细胞结合剂-细胞毒性剂缀合物:
或其药学上可接受的盐,其中:
cba是共价连接至jcb’基团的细胞结合剂;
jcb’是通过使所述cba上的醛基与连接至基团l的醛反应性基团反应所形成的部分,其中所述醛基是衍生自由以下结构式表示的2-羟基乙胺部分的氧化:
其中所述2-羟基乙胺部分是丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分;
l是间隔基或键;
jd’是将所述细胞毒性剂d与基团l连接的连接部分,或当l是键时不存在;
d是经由所述连接部分jd’共价连接至l或当l是键时经由jcb’连接至cba的细胞毒性剂;且
w是1、2、3或4。
本发明还提供一种重组抗体重链(hc)、轻链(lc)或其抗原结合部分,其包含具有seqidno:1的氨基酸序列的异源信号肽。
本发明还提供一种重组抗体重链(hc)、轻链(lc)或其抗原结合部分,其包含紧邻所述重链(hc)、轻链(lc)或其抗原结合部分的信号肽的最后一个残基的c末端的ser或thr残基。
还提供一种经修饰抗体,其是由在所述重链、轻链或其抗原结合部分的成熟加工序列上具有n末端ser或thr的抗体氧化得到,其中在所述经修饰抗体中,所述n末端ser或thr已氧化成醛基。
本发明还包括编码本文所描述的重组抗体重链(hc)、轻链(lc)或其抗原结合部分的多核苷酸以及产生本文所描述的重组抗体重链(hc)、轻链(lc)或其抗原结合部分的方法。
在一个实施方案中,本发明是有关一种制备细胞结合剂-细胞毒性剂缀合物的方法,所述方法包括以下步骤:
(a)用氧化剂将细胞结合剂的2-羟基乙胺部分氧化以形成具有醛基的经氧化细胞结合剂;其中所述2-羟基乙胺部分为丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分,且由以下结构式表示:
(b)使所述经氧化细胞结合剂:
(i)与具有醛反应性基团的细胞毒性剂-接头化合物或具有醛反应性基团的细胞毒性剂接触,以形成所述细胞结合剂-细胞毒性剂缀合物;或
(ii)与具有醛反应性基团的接头化合物接触,以形成与接头结合的经修饰抗体或其经修饰抗原结合部分,随后使所述经修饰抗体或所述其经修饰抗原结合部分与细胞毒性剂反应,以形成所述细胞结合剂-细胞毒性剂缀合物;或
(iii)与细胞毒性剂接触,随后添加具有醛反应性基团和可与所述细胞毒性剂形成共价键的反应性基团的接头化合物,以形成所述细胞结合剂-细胞毒性剂缀合物。
在一个实施方案中,本发明是有关一种由下式表示的细胞毒性化合物:
或其药学上可接受的盐,其中:
ld’、ld”和ld”’之一是由下式表示:
-nr5-p-c(=o)-(crarb)r-zd1-(crarb)r′-jcb(a’)
且另两个相同或不同,且独立地选自-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(och2ch2)n-rc;卤素;胍鎓[-nh(c=nh)nh2];-or;-nr’r”;-no2;-nr’cor”;-sr;-sor’;-so2r’;-so3h;-oso3h;-so2nr’r”;氰基;叠氮基;-cor’;-ocor’;和-oconr’r”;
zd1为不存在、-c(=o)-nr9-或–nr9-c(=o)-;
p为氨基酸残基或含有介于2至20个之间的氨基酸残基的肽;
ra和rb在每次出现时独立地为–h、(c1-c3)烷基或带电荷的取代基,或可电离的基团q;
r和r’独立地为1至6的整数;
在n与c之间的双线
y为选自以下的离去基团:-or、-ocor’、-ocoor’、-oconr’r”、-nr’r”、-nr’cor”、-nr’nr’r”、任选取代的5元或6元含氮杂环(例如,经由氮原子连接的哌啶、四氢吡咯、吡唑、吗啉等)、由-nr’(c=nh)nr’r”表示的胍鎓、氨基酸或由-nrcop’表示的肽、-sr、-sor’、卤素、氰基、叠氮基、-oso3h、亚硫酸酯基(-so3h或-so2h)、焦亚硫酸酯(h2s2o5)、单-、二-、三-和四-硫代磷酸酯(po3sh3、po2s2h2、pos3h2、ps4h2)、硫代磷酸酯(rio)2ps(ori)、ris-、riso、riso2、riso3、硫代硫酸酯(hs2o3)、连二亚硫酸酯(hs2o4)、二硫代磷酸酯(p(=s)(ork’)(s)(oh))、羟肟酸(rk’c(=o)noh)和甲醛次硫酸根(hoch2so2-),或其混合物,其中ri为具有1至10个碳原子的直链或支链烷基,且经至少一个选自-n(rj)2、-co2h、-so3h和-po3h的取代基取代;ri可进一步任选经本文关于烷基所描述的取代基取代;rj为具有1至6个碳原子的直链或支链烷基;rk’为具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基、芳基、杂环基或杂芳基;
p’为氨基酸残基或含有介于2至20个之间的氨基酸残基的肽;
r在每次出现时独立地选自由下列组成的组:-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(ch2ch2o)n-rc;任选取代的具有6至18个碳原子的芳基;任选取代的含有一个或多个独立地选自氮、氧和硫的杂原子的5元至18元杂芳基环;或任选取代的含有1至6个独立地选自o、s、n和p的杂原子的3元至18元杂环;
r’和r”各自独立地选自-h;-oh;-or;-nhr;-nr2;-cor;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(ch2ch2o)n-rc;和任选取代的具有1至6个独立地选自o、s、n和p的杂原子的3元至18元杂环;
rc为-h,或任选取代的具有1至4个碳原子的直链或支链烷基;
n为1至24的整数;
x’选自-h;胺保护基;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(ch2ch2o)n-rc;任选取代的具有6至18个碳原子的芳基;任选取代的含有一个或多个独立地选自氮、氧和硫的杂原子的5元至18元杂芳基环;和任选取代的含有1至6个独立地选自o、s、n和p的杂原子的3元至18元杂环;
y’选自-h;氧代基;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;任选取代的6元至18元芳基;任选取代的含有一个或多个独立地选自氮、氧和硫的杂原子的5元至18元杂芳基环;任选取代的含有1至6个杂原子的3元至18元杂环;
r1、r2、r3、r4、r1’、r2’、r3’和r4’各自独立地选自由下列组成的组:-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(och2ch2)n-rc;卤素;胍鎓[-nh(c=nh)nh2];-or;-nr’r”;-no2;-nco;-nr’cor”;-sr;-sor’;-so2r’;-so3-h;-oso3h;-so2nr’r”;氰基;叠氮基;-cor’;-ocor’;和-oconr’r”;
r6为-h、-r、-or、-sr、-nr’r”、-no2或卤素;
a与a’相同或不同,且独立地选自-o-、氧代(-c(=o)-)、-crr’o-、-crr’-、-s-、-crr’s-、-nr5和-crr’n(r5)-;
r5和r9各自独立地为-h,或任选取代的具有1至10个碳原子的直链或支链烷基;
jcb是醛反应性基团。
本发明中还包括一种医药组合物,其包含式(i)的缀合物或式(d18’)-(d23’)的细胞毒性化合物或其药学上可接受的盐,和药学上可接受的载体。
所述医药组合物可进一步包括第二治疗剂(例如化学治疗剂)。
本发明还包括一种在哺乳动物(例如人)中抑制异常细胞生长或治疗增生性病症、破坏性骨病症、自身免疫病症、移植物抗宿主疾病、移植排斥反应、免疫缺陷、炎性疾病、感染性疾病、病毒疾病、纤维化疾病、神经退化性病症、胰腺炎或肾病的方法,所述方法包括向所述哺乳动物施用治疗有效量的式(i)的缀合物或式(d18’)-(d23’)表示的细胞毒性化合物或其药学上可接受的盐。
在相关实施方案中,上述方法进一步包括向所述哺乳动物依序或连续施用第二治疗剂(例如化学治疗剂)。
附图简述
图1显示了使用工程改造的含n末端ser的人源化单株抗体humov19-nts#2合成humov19-nts#2-接头1-化合物aadc的方案1。
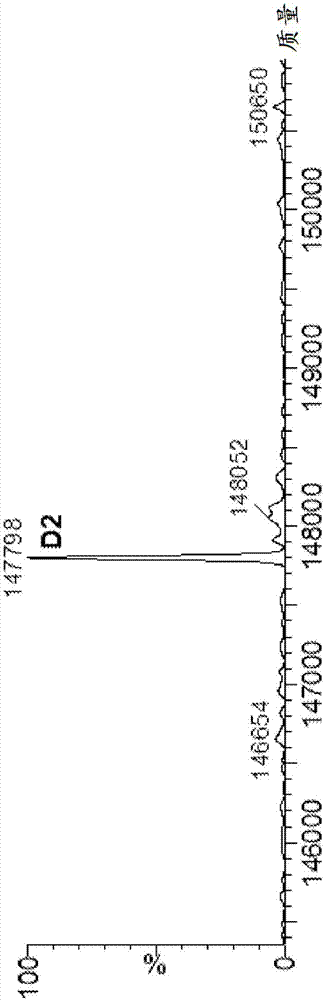
图2为完整humov19-nts#2-接头1-化合物a的q-tof质谱(ms)资料。显然,反应产物是每个抗体并有两个化合物a分子的均质adc。
图3显示了使用工程改造的含n末端ser的人源化单株抗体humov19-nts#2合成humov19-nts#2-氨氧基-乙酰基-maynmaadc的方案2。
图4为完整humov19-nts#2-氨氧基-乙酰基-maynma的q-tof质谱(ms)资料。显然,反应产物是每个抗体并有两个maynma分子的均质adc。
图5显示了使用工程改造的含n末端ser的人源化单株抗体(例如humov19-nts#1)合成抗体(诸如humov19-nts#1)-接头1-化合物aadc的方案3。
图6显示了完整humov19-nts#1-接头1-化合物a的q-tof质谱(ms)资料。
图7a显示了n末端ser特异性缀合不会明显地影响抗体与抗原的结合。humov19-nts#2-maynma(或serimab-may)和humov19-nts#2-化合物a(或serimab-sdgn462)两者为包含分别经由工程改造的n末端ser残基连接至类美登素和细胞毒性化合物a(或磺酸化dgn462(sdgn462))的人源化igg单株抗体humov19的adc。通过facs检测结合至t47d表面上任何adc(或对照ab)的fitc缀合的山羊抗人igg-fcγ二次抗体来测量t47d(即,该表面上的frα抗原)与adc(或对照抗体或facs缓冲液对照物)之间的结合。
图7b显示了humov19-nts#2-接头1-化合物a与表达frα抗原的t47d细胞的facs结合数据。赖氨酸负载的humov19-sspdb-化合物a与n末端修饰的humov19-nts#2-接头1-化合物a具有相当的细胞结合,该结合还类似于未缀合的天然humov19和工程改造的humov19-nts#2的细胞结合(参见表中的ec50值)。
图8a显示n末端ser特异性修饰或缀合不会明显地影响抗体与抗原的结合。如上文图7a和7b中所示,如通过facs所测量,野生型抗frα抗体humov19、其n末端ser修饰形式humov19-nts#2(“serimab”)、以及其各自与类美登素的缀合物ab-smcc-dm1(野生型humov19的赖氨酸残基经由smcc接头连接至dm1)和serimab-may(humov19-nts#2经由工程改造的n末端ser连接至类美登素)均与带有frα的t47d细胞具有基本上相同的结合亲和力。
图8b显示,n末端ser特异性修饰或缀合不会明显地影响抗体与抗原的结合。如上文图7a和7b中所示,如通过facs所测量,野生型抗frα抗体humov19、其n末端ser修饰形式humov19-nts#2(“serimab”)、以及其与细胞毒性化合物a的缀合物(serimab-sdgn462)均与带有frα的t47d细胞具有基本上相同的结合亲和力。
图9a显示了adc缀合物mov19-nts#2-接头1-化合物a对kb子宫颈细胞株的细胞毒性的评估的结果。数据显示,本发明的位点特异性n末端ser连接的serimab-化合物a缀合物的效力以抗体浓度计为赖氨酸缀合的sspdb-化合物a的约3倍,且以化合物a的浓度计为约5倍。两种缀合物具有相同的不依赖于抗原的活性,因为在1μm未缀合的humov19存在下,这两种所测试的缀合物阻断kb细胞上的抗原结合位点的效力大致相同。
图9b显示出adc缀合物serimab-may对kb子宫颈细胞株的细胞毒性的评估的结果。数据显示,在较高dar(细胞毒性化合物与抗体比率)下,serimab-may缀合物具有与赖氨酸缀合物ab-smcc-dm1相同的效力。
图10和11显示出可用于制备本发明的缀合物的示例性细胞毒性化合物。
图12a-12d显示出用于制备本发明的缀合物的示例性方案。
图13显示了在带有nci-h2110的scid小鼠中humov19-nts#2-接头1-化合物a的体内功效。
图14a显示了具有二硫化物接头的serimab-sdgn462缀合物的结构。虚线指示产生所观察的靶细胞分解代谢物的裂解位点的位置。图14b显示了在kb子宫颈癌细胞中体外形成的serimab-sdgn462缀合物的分解代谢物的孵育、纯化和分离方案。示出了由lc-ms鉴别的四种分解代谢物以及m/z比率的计算值和观测值。
图15a显示了具有不可裂解接头的serimab-may缀合物的结构。虚线指示产生所观察的靶细胞分解代谢物的裂解位点的位置。图15b显示了在kb子宫颈癌细胞中体外形成的serimab-may缀合物的分解代谢物的孵育、纯化和分离方案。显示出由lc-ms鉴别的两种分解代谢物以及m/z比率的计算值和观测值。
图16显示了有关serimab-sdgn462和相应lys连接的ab-sspdb-sdgn462缀合物的旁观者杀灭测定(bystanderkillingassay)的结果。
图17显示了使用工程改造的含n末端ser的人源化单株抗体合成hucd123-sd8缀合物的示例性方案。
图18显示了用于合成带有接头1残基的hucd123-6-serimab-sd1缀合物的示例性方案。
图19显示了用于合成humov19nts2s3-serimab-dgn462缀合物或具有4dar的humov19nts2s3-serimab-sdgn462缀合物(humov19nts2s3-serimab-sdgn462)的示例性方案,所述缀合物带有接头1残基。
图20显示了具有4dar的humov19nts2s3-serimab-sdgn462缀合物(humov19nts2s3-serimab-sdgn462)的q-tof质谱(ms)资料。
图21a显示了用于合成具有4dar的humov19nts2s3-serimab-maynma缀合物的示例性方案。图21b显示了具有4dar的ser连接的humov19-serimab-maynma缀合物的q-tof质谱(ms)资料。
图22a-22c显示,在aml细胞株shi-1(图22a)和hnt-34(图22b),以及cml细胞株molm-1(图22c)中,hucd123-6(hucd123-6rv1.1s2-serimab-d8,实心黑色圆圈)中的serimab的活性至少与同一抗体的赖氨酸连接的缀合物(hucd123-6rv1.1-d2,实心黑色三角形)相同。在每个图中连接空心数据点的虚线曲线表示在阻断浓度(500nm)的未缀合hucd123-6抗体存在下对应缀合物(即,hucd123-6rv1.1s2-serimab-d8为空心圆圈,和hucd123-6rv1.1-d2为空心倒三角形)的活性。有关lys连接的抗体-d2缀合物的结构,参见实施例28(示出humov19-d2结构,而且hucd123-6rv1.1-d2缀合物具有相同结构)。
图23显示,n末端ser特异性修饰或缀合不会明显地影响抗体与抗原的结合。如通过facs所测量,野生型抗frαhumov19抗体、其n末端ser修饰形式humov19-nts2(“humov19-serimab抗体”)和其与细胞毒性化合物d8的缀合物(humov19-serimab-d8)与带有frα的t47d细胞具有基本上相同的结合亲和力。
图24显示,hucd123-6gv4.7s3-serimab-sd1缀合物(参见图18)在eol-1细胞中显示出与hucd123-6gv4.7s2(或s3)-serimab-d8缀合物类似的效力。还示出了lys连接的hucd123-6gv4.7s3-sspdb-d1和hucd123-6gv4.7s3-d2缀合物的结果。
图25显示了在较高dar下,经ser连接hucd123抗体的dgn462化合物针对eol-1细胞的抗原特异性效力为赖氨酸连接形式的3倍。
图26a-26c显示,serimab-d8(humov19-nts#2-serimab-d8)缀合物具有与赖氨酸缀合物(humov19-d2)相当的抗原特异性效力和靶结合。
图27显示了有关humov19-serimab-d8和相应lys连接的humov19-d2缀合物的旁观者杀灭测定的结果。
图28显示了在humov19-nts#2-氨氧基-乙酰基maynma缀合物中肟键联的体内稳定性。
图29显示了用100μg/kg或150μg/kg赖氨酸连接的humov19-d2缀合物或者200μg/kghumov19-serimab-d8处理的雌性cd-1小鼠的个体体重变化百分比。
图30显示了用于合成本发明的缀合物的示例性方案。
图31a和31b显示了用于合成本发明的缀合物的示例性方案。
发明详述
现将更详细地提及本发明某些实施方案,其实例以所附结构和化学式说明。尽管本发明将结合所列举的实施方案进行描述,但应了解,其不意欲将本发明局限于那些实施方案。正相反,本发明意欲涵盖可包括在由权利要求书所界定的本发明的范围内的所有替代方案、修改和等效内容。本领域技术人员将认识到可用于实践本发明的与本文所描述的方法和材料类似或等效的许多方法和材料。
应了解,除非清楚地否定或不恰当,否则本文所描述的任何实施方案,包括在本发明不同方面和本说明书不同部分(包括仅在实施例中描述的实施方案)下描述的那些实施方案(例如化合物、缀合物、组合物、制备和使用方法)可与本发明的一个或多个其它实施方案组合。实施方案组合不限于经由多项附属权利要求所要求的那些具体实施方案。
定义
如本文所使用,“直链或支链烷基”是指具有一至二十个碳原子的饱和直链或支链单价烃基。烷基的实例包括但不限于甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、-ch2ch(ch3)2、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲基-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、1-庚基、1-辛基和类似基团。优选地,烷基具有一至十个碳原子。更优选地,烷基具有一至四个碳原子。
“直链或支链烯基”是指具有两个至二十个碳原子和至少一个不饱和位点(即,碳-碳双键)的直链或支链单价烃基,其中烯基包括具有“顺式”和“反式”取向,或替代地具有“e”和“z”取向的基团。实例包括但不限于乙烯基(-ch=ch2)、丙烯基(-ch2ch=ch2)和类似基团。优选地,烯基具有两个至十个碳原子。更优选地,烯基具有两个至四个碳原子。
“直链或支链炔基”是指具有两个至二十个碳原子和至少一个不饱和位点(即,碳-碳三键)的直链或支链单价烃基。实例包括但不限于乙炔基、丙炔基、1-丁炔基、2-丁炔基、1-戊炔基、2-戊炔基、3-戊炔基、己炔基和类似基团。优选地,炔基具有两个至十个碳原子。更优选地,炔基具有两个至四个碳原子。
术语“碳环”、“碳环基”和“碳环状环”是指具有3至12个碳原子(单环形式)或具有7至12个碳原子(双环形式)的单价非芳族饱和或部分不饱和环。具有7至12个碳原子的双环碳环可例如按双环[4,5]、[5,5]、[5,6]或[6,6]系统形式布置,且具有9或10个环原子的双环碳环可按双环[5,6]或[6,6]系统形式布置,或按桥接系统形式布置,诸如双环[2.2.1]庚烷、双环[2.2.2]辛烷和双环[3.2.2]壬烷。单环碳环的实例包括但不限于环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基和类似基团。
术语“环状烷基”和“环烷基”可互换使用。该术语是指单价饱和碳环基团。优选地,环状烷基为3元至7元单环基团。更优选地,环状烷基为环己基。
术语“环状烯基”是指在环结构中具有至少一个双键的碳环基团。
术语“环状炔基”是指在环结构中具有至少一个三键的碳环基团。
“芳基”意指通过从母体芳族环系统的单一碳原子移除一个氢原子得到的具有6至18个碳原子的单价芳族烃基。一些芳基在示例性结构中以“ar”表示。芳基包括含与饱和、部分不饱和环或芳族碳环或杂环稠合的芳族环的双环基团。典型的芳基包括但不限于衍生自苯(苯基)、取代的苯、萘、蒽、茚基、二氢茚基、1,2-二氢萘、1,2,3,4-四氢萘基和类似基团的基团。优选地,芳基为苯基。
术语“杂环”、“杂环基”和“杂环状环”在本文中可互换使用,且指至少一个环原子为选自氮、氧、磷和硫的杂原子且其余环原子为c的具有3至18个环原子的饱和或部分不饱和(即,在环内具有一个或多个双键和/或三键)碳环基团,其中一个或多个环原子任选独立地经一个或多个以下描述的取代基取代。杂环可为具有3至7个环成员(2至6个碳原子和1至4个选自n、o、p和s的杂原子)的单环,或具有7至10个环成员(4至9个碳原子和1至6个选自n、o、p和s的杂原子)的双环,例如:双环[4,5]、[5,5]、[5,6]或[6,6]系统。杂环描述于paquette,leoa.;“principlesofmodernheterocyclicchemistry”(w.a.benjamin,newyork,1968),具体而言,第1、3、4、6、7和9章;“thechemistryofheterocycliccompounds,aseriesofmonographs”(johnwiley&sons,newyork,1950至今),具体而言,第13、14、16、19和28卷;和j.am.chem.soc.(1960)82:5566中。“杂环基”还包括杂环基团与饱和、部分不饱和环或芳族碳环或杂环稠合的基团。杂环的实例包括但不限于吡咯烷基、四氢呋喃基、二氢呋喃基、四氢噻吩基、四氢吡喃基、二氢吡喃基、四氢噻喃基、哌啶子基、吗啉代、硫代吗啉代、氧硫杂环己基、哌嗪基、高哌嗪基、吖丁啶基、氧杂环丁基、硫杂环丁基、高哌啶基、氧杂环庚基、硫杂环庚基、氧氮杂环庚三烯基、二氮杂环庚三烯基、硫杂环庚三烯基、2-吡咯啉基、3-吡咯啉基、吲哚啉基、2h-吡喃基、4h-吡喃基、二噁烷基、1,3-二氧杂环戊基、吡唑啉基、二硫杂环己基、二硫杂环戊烯基、二氢吡喃基、二氢噻吩基、二氢呋喃基、吡唑烷基、咪唑啉基、咪唑烷基、3-氮杂双环[3.1.0]己基、3-氮杂双环[4.1.0]庚基和氮杂双环[2.2.2]己基。在此定义的范围内还包括螺部分。环原子经氧代(=o)部分取代的杂环基团的实例有嘧啶酮基和1,1-二氧代-硫吗啉基。
术语“杂芳基”是指含有一个或多个独立地选自氮、氧和硫的杂原子的具有5元或6元环的单价芳族基团,且包括具有5-18个原子的稠环系统(其中至少一个为芳族环)。杂芳基的实例为吡啶基(包括例如,2-羟基吡啶基)、咪唑基、咪唑并吡啶基、嘧啶基(包括例如,4-羟基嘧啶基)、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、喹啉基、异喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、噌啉基、吲唑基、吲哚嗪基、呔嗪基、哒嗪基、三嗪基、异吲哚基、喋啶基、嘌呤基、噁二唑基、三唑基、噻二唑基、呋咱基、苯并呋咱基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、萘啶基和呋喃并吡啶基。
如果可能,杂环或杂芳基可为碳连接的(碳连接的)或氮连接的(氮连接的)。举例来说而非限制,碳键结的杂环或杂芳基是在吡啶的2、3、4、5或6位键结,在哒嗪的3、4、5或6位键结,在嘧啶的2、4、5或6位键结,在吡嗪的2、3、5或6位键结,在呋喃、四氢呋喃、硫代呋喃、噻吩、吡咯或四氢吡咯的2、3、4或5位键结,在噁唑、咪唑或噻唑的2、4或5位键结,在异噁唑、吡唑或异噻唑的3、4或5位键结,在氮丙啶的2或3位键结,在吖丁啶的2、3或4位键结,在喹啉的2、3、4、5、6、7或8位键结,或在异喹啉的1、3、4、5、6、7或8位键结。
举例来说而非限制,氮键结的杂环或杂芳基是在氮丙啶、吖丁啶、吡咯、吡咯烷、2-吡咯啉、3-吡咯啉、咪唑、咪唑烷、2-咪唑啉、3-咪唑啉、吡唑、吡唑啉、2-吡唑啉、3-吡唑啉、哌啶、哌嗪、吲哚、吲哚啉、1h-吲唑的1位;异吲哚或异吲哚啉的2位;吗啉的4位;和咔唑或o-咔啉的9位处键结。
杂芳基或杂环基中存在的杂原子包括氧化形式,诸如no、so和so2。
术语“卤基”或“卤素”是指f、cl、br或i。
上述烷基、烯基、炔基、环状烷基、环状烯基、环状炔基、碳环基、芳基、杂环基和杂芳基可任选经超过一个(例如2、3、4、5、6或更多个)取代基取代。
如果取代基被描述为“经取代”,则非氢取代基是在所述取代基的碳、氧、硫或氮上氢取代基的位置。因此,例如,取代的烷基取代基是至少一个非氢取代基处于烷基取代基上氢取代基的位置的烷基取代基。为了说明,单氟烷基是经氟取代基取代的烷基,且二氟烷基是经两个氟取代基取代的烷基。应认识到,如果在一个取代基上存在超过一个取代,则每一非氢取代基可相同或不同(除非另作陈述)。
如果一个取代基被描述为“任选经取代”,则所述取代基可为(1)未取代的,或(2)取代的。如果取代基的碳被描述为任选经取代基清单中的一个或多个取代,则所述碳上的一个或多个氢(其范围为存在的任何数量)可独立地和/或一起独立选择的任选存在的取代基置换。如果取代基的氮被描述为任选经取代基清单中的一个或多个取代,则所述氮上的一个或多个氢(其范围为存在的任何数量)可各自被独立选择的任选存在的取代基置换。一个示例性取代基可以-nr’r”描绘,其中r’和r”连同其所连接的氮原子一起可形成杂环。由r’和r”连同其所连接的氮原子一起形成的杂环可为部分或完全饱和的。在一个实施方案中,杂环由3至7个原子组成。在另一个实施方案中,所述杂环选自由吡咯基、咪唑基、吡唑基、三唑基、四唑基、异噁唑基、吡啶基和噻唑基组成的组。
本说明书可互换地使用术语“取代基”、“基团(radical)”和“基团(group)”。
如果一组取代基共同地描述为任选经取代基清单中的一个或多个取代,则所述组可包括:(1)不可取代的取代基;(2)未经任选存在的取代基取代的可取代的取代基;和/或(3)经一个或多个任选存在的取代基取代的可取代的取代基。
如果一个取代基被描述为任选经特定数量的非氢取代基取代,则所述取代基可(1)未经取代;或(2)经至多所述特定数量的非氢取代基或经至多所述取代基上最大数量的可取代位置取代,以数量较小的为准。因此,例如,如果一个取代基被描述为任选经至多3个非氢取代基取代的杂芳基,则具有少于3个可取代位置的任何杂芳基将任选经至多仅所述杂芳基所具有的可取代位置的数量的非氢取代基取代。在非限制性实施例中,此类取代基可选自具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;芳基;杂芳基;杂环基;卤素;胍鎓[-nh(c=nh)nh2];-or100;nr101r102;-no2;-nr101cor102;-sr100;由-sor101表示的亚砜;由-so2r101表示的砜;磺酸酯基-so3m;硫酸酯基-oso3m;由-so2nr101r102表示的磺酰胺;氰基;叠氮基;-cor101;-ocor101;-oconr101r102;和聚乙二醇单元(-och2ch2)nr101,其中m为h或阳离子(诸如na+或k+),r101、r102和r103各自独立地选自h;具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元(-och2ch2)n-r104,其中n是1至24的整数;具有6至10个碳原子的芳基;具有3至10个碳原子的杂环,和具有5至10个碳原子的杂芳基,且r104为h,或具有1至4个碳原子的直链或支链烷基,其中由r100、r101、r102、r103和r104表示的基团中的烷基、烯基、炔基、芳基、杂芳基和杂环基任选经一个或多个(例如2、3、4、5、6或更多个)独立地选自以下的取代基取代:卤素、-oh、-cn、-no2,和具有1至4个碳原子的未取代的直链或支链烷基。优选地,上述任选取代的烷基、烯基、炔基、环状烷基、环状烯基、环状炔基、碳环基、芳基、杂环基和杂芳基的取代基包括卤素、-cn、-nr102r103、-cf3、-or101、芳基、杂芳基、杂环基、-sr101、-sor101、-so2r101和-so3m。
术语“化合物”或“细胞毒性化合物”、“细胞毒性二聚体”和“细胞毒性二聚体化合物”可互换使用。其意欲包括结构或化学式或其任何衍生物已在本发明中公开,或结构或化学式或其任何衍生物已以引用的方式并入的化合物。该术语还包括本发明中所公开的所有化学式的化合物的立体异构体、几何异构体、互变异构体、溶剂合物、代谢物、盐(例如药学上可接受的盐)和前药,以及前药盐。该术语还包括前述任一种的任何溶剂合物、水合物和多晶形物。在本申请中所描述的本发明的某些方面中,有关“立体异构体”、“几何异构体”、“互变异构体”、“溶剂合物”、“代谢物”、“盐”、“前药”、“前药盐”、“缀合物”、“缀合物盐”、“溶剂合物”、“水合物”或“多晶形物”的具体陈述不应解释为意图在未使用这些其它形式陈述术语“化合物”的本发明的其它方面中省略这些形式。
如本文所使用,术语“免疫缀合物”或“缀合物”是指连接至细胞结合剂(即,抗cd123/il-3rα抗体或抗frα抗体,或其片段)的化合物或其衍生物,且其由以下通式定义:a-l-c,其中c=细胞毒素,l=接头,且a=细胞结合剂(cba),诸如抗cd123/il-3rα抗体或抗frα抗体,或抗体片段。免疫缀合物还可通过颠倒次序的通式定义:c-l-a。
如本文所使用,术语“可连接至细胞结合剂”是指包含至少一个适于将化合物或其衍生物键结至细胞结合剂的连接基团或其前体的本文所描述的这些化合物或其衍生物。
术语给定基团的“前体”是指可通过任何脱保护、化学修饰或偶合反应而产生所述基团的任何基团。
术语“连接至细胞结合剂”是指包含经由适合连接基团或其前体结合至细胞结合剂的本文所描述的细胞毒性剂化合物或细胞毒性剂-接头化合物(例如式(d1’)-(d29’)的化合物和式(ii)的细胞毒性剂-接头化合物)或其衍生物中至少一种的缀合物分子。
术语“手性”是指具有镜像搭配物不可重叠性的特性的分子,而术语“非手性”是指在其镜像搭配物可重叠上的分子。
术语“立体异构体”是指具有相同化学构造和连接性,但其原子在空间中的取向不同且无法通过关于单键旋转而互变的化合物。
“非对映异构体”是指具有两个或更多个手性中心且分子间不呈镜像的立体异构体。非对映异构体具有不同的物理特性,例如熔点、沸点、光谱特性和反应性。非对映异构体混合物可依据高分辨率分析程序,诸如结晶、电泳和色谱法分离。
“对映异构体”是指一种化合物的具有彼此不可重叠的镜像的两种立体异构体。
本文所使用的立体化学定义和惯例一般遵循s.p.parker编辑,mcgraw-hilldictionaryofchemicalterms(1984)mcgraw-hillbookcompany,newyork;以及eliel,e.和wilen,s.,“stereochemistryoforganiccompounds”,johnwiley&sons,inc.,newyork,1994。本发明的化合物可含有不对称或手性中心,且因此以不同立体异构形式存在。预期本发明化合物的所有立体异构形式,包括但不限于非对映异构体、对映异构体和构型异构体,以及其混合物,诸如外消旋混合物,形成本发明的一部分。许多有机化合物以光学活性形式存在,即,其能够旋转平面偏振光的平面。在描述光学活性化合物时,使用了前缀d和l,或r和s来指示所述分子关于其手性中心的绝对构型。前缀d和i或(+)和(-)用于指示化合物旋转平面偏振光的标记,其中(-)或l意味着所述化合物为左旋的。具有前缀(+)或d的化合物为右旋的。对于指定化学结构,这些立体异构体是相同的,不过其彼此呈镜像。特定立体异构体还可称为对映异构体,且此类异构体的混合物常称为对映异构体混合物。对映异构体的50:50混合物称为外消旋混合物或外消旋物,其可在化学反应过程中无立体选择性或立体特异性情况下出现。术语“外消旋混合物”和“外消旋物”是指两种对映异构物质的等摩尔量混合物,不管光学活性如何。
术语“互变异构体”或“互变异构形式”是指可经由低能量障壁互变的具有不同能量的结构异构体。举例来说,质子互变异构体(还称为质子转移互变异构体)包括经由质子移动引起的互变,诸如酮-烯醇和亚胺-烯胺异构。价键异构体包括由一些键结电子再组织引起的互变。
如本申请中所使用,术语“前药”是指能够酶促或水解活化或者转化成更具活性的活性母体形式的本发明化合物的前体或衍生物形式。参见例如,wilman,“prodrugsincancerchemotherapy”,biochemicalsocietytransactions,14:375-382,615thmeetingbelfast(1986);和stella等人,“prodrugs:achemicalapproachtotargeteddrugdelivery”,directeddrugdelivery,borchardt等人(编辑),第247-267页,humanapress(1985)。本发明的前药包括但不限于含酯前药、含磷酸酯前药、含硫代磷酸酯前药、含硫酸酯前药、含肽前药、d-氨基酸修饰的前药、糖基化前药、含β-内酰胺的前药、含任选取代的苯氧基乙酰胺的前药、含任选取代的苯基乙酰胺的前药、5-氟胞嘧啶和其它5-氟尿嘧啶前药,其可转化成更具活性的细胞毒性游离药物。可衍生化成用于本发明中的前药形式的细胞毒性药物的实例包括但不限于本发明的化合物和化学治疗剂,如上文所描述。
术语“前药”还意欲包括在生物条件(体外或体内)下可水解、氧化或以其它方式反应而提供本发明化合物的化合物的衍生物。前药可能仅在生物条件下反应时变得有活性,或其可在呈其未反应形式时具有活性。本发明所涵盖的前药的实例包括但不限于具有本文所公开的任一化学式的化合物的类似物或衍生物,其包含可生物水解部分,诸如可生物水解的酰胺、可生物水解的酯、可生物水解的氨基甲酸酯、可生物水解的碳酸酯、可生物水解的酰脲和可生物水解的磷酸酯类似物。前药的其它实例包括了包含-no、-no2、-ono或-ono2部分的具有本文所公开的任一化学式的化合物的衍生物。前药可典型地使用熟知方法制备,诸如burger’smedicinalchemistryanddrugdiscovery(1995)172-178,949-982(manfrede.wolff编辑,第5版)所描述的方法;另参见goodman和gilman,thepharmacologicalbasisoftherapeutics,第8版,mcgraw-hill,int.编辑,1992,“biotransformationofdrugs”。
本发明前药的一种优选形式包括含本发明的化合物/缀合物的亚胺键与亚胺反应性试剂之间形成的加合物的本发明化合物(存在或不存在连接基团)和缀合物。本发明前药的另一优选形式包括诸如具有式(i)-(iv)的化合物,其中当n与c之间的双线
术语“亚胺反应性试剂”是指能够与亚胺基团反应的试剂。亚胺反应性试剂的实例包括但不限于亚硫酸盐(h2so3、h2so2,或hso3-、so32-或hso2-与阳离子形成的盐);偏亚硫酸氢盐(h2s2o5,或s2o52-与阳离子形成的盐);单-、二-、三-和四-硫代磷酸盐(po3sh3、po2s2h3、pos3h3、ps4h3,或po3s3-、po2s23-、pos33-或ps43-与阳离子形成的盐);硫代磷酸酯((rio)2ps(ori)、rish、risoh、riso2h、riso3h);各种胺(羟胺(例如nh2oh)、肼(例如nh2nh2)、nh2o-ri、ri’nh-ri、nh2-ri)、nh2-co-nh2、nh2-c(=s)-nh2;硫代硫酸盐(h2s2o3,或s2o32-与阳离子形成的盐);连二亚硫酸盐(h2s2o4,或s2o42-与阳离子形成的盐);二硫代磷酸盐(p(=s)(ork)(sh)(oh),或其与阳离子形成的盐);异羟肟酸(rkc(=o)nhoh,或与阳离子形成的盐);酰肼(rkconhnh2);甲醛次硫酸盐(hoch2so2h,或hoch2so2-与阳离子形成的盐,诸如hoch2so2-na+);糖化核苷酸(诸如gdp-甘露糖);氟达拉滨(fludarabine);或其混合物,其中ri和ri’各自独立地为具有1至10个碳原子的直链或支链烷基且经至少一个选自-n(rj)2、-co2h、-so3h和-po3h的取代基取代;ri和ri’可进一步任选本文所述的烷基取代基取代;rj是具有1至6个碳原子的直链或支链烷基;且rk是具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;芳基;杂环基;或杂芳基(优选rk是具有1至4个碳原子的直链或支链烷基;更优选rk为甲基、乙基或丙基)。优选地,所述阳离子为单价阳离子,诸如na+或k+。优选地,亚胺反应性试剂选自亚硫酸盐、羟胺、尿素和肼。更优选地,亚胺反应性试剂为nahso3或khso3。
如本文所使用且除非另作指示,否则术语“可生物水解的酰胺”、“可生物水解的酯”、“可生物水解的氨基甲酸酯”、“可生物水解的碳酸酯”、“可生物水解的酰脲”和“可生物水解的磷酸酯类似物”分别意谓这样一种酰胺、酯、氨基甲酸酯、碳酸酯、酰脲或磷酸酯类似物,其1)不会破坏所述化合物的生物活性且赋予所述化合物有利的体内特性,诸如吸收、作用持续时间或作用起始;2)本身不具生物活性,但在体内转化成生物活性化合物。可生物水解的酰胺的实例包括但不限于低级烷基酰胺、α-氨基酸酰胺、烷氧基酰基酰胺和烷基胺基烷基羰基酰胺。可生物水解的酯的实例包括但不限于低级烷基酯、烷氧基酰氧基酯、烷基酰胺基烷基酯和胆碱酯。可生物水解的氨基甲酸酯的实例包括但不限于低级烷基胺、取代的亚乙基二胺、氨基酸、羟基烷基胺、杂环和杂芳族胺,和聚醚胺。特别有益的前药和前药盐是当将本发明化合物施用给哺乳动物时,增加所述化合物的生物利用率者。
如本文所使用,短语“药学上可接受的盐”是指本发明化合物的药学上可接受的有机或无机盐。示例性盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟碱酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、丹宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、反丁烯二酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲烷磺酸盐(“甲磺酸盐”)、乙烷磺酸盐、苯磺酸盐、对甲苯磺酸盐、双羟萘酸盐(即,1,1’-亚甲基-双-(2-羟基-3-萘酸盐))、碱金属(例如钠和钾)盐、碱土金属(例如镁)盐,和铵盐。药学上可接受的盐可涉和包含另一分子,诸如乙酸根离子、琥珀酸根离子或其它抗衡离子。所述抗衡离子可为使母体化合物上的电荷稳定的任何有机或无机部分。另外,药学上可接受的盐可在其结构中具有超过一个带电原子。多个带电原子作为所述药学上可接受的盐的一部分的情形可具有多个抗衡离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个抗衡离子。
如果本发明的化合物为一种碱,则所需药学上可接受的盐可通过本领域中可用的任何适合方法制备,例如,用诸如盐酸、氢溴酸、硫酸、硝酸、甲烷磺酸、磷酸和类似物的无机酸,或用诸如乙酸、马来酸、琥珀酸、扁桃酸、反丁烯二酸、丙二酸、酮戊酸、草酸、乙醇酸、水杨酸、吡喃糖苷酸(诸如葡糖醛酸或半乳糖醛酸)、α羟基酸(诸如柠檬酸或酒石酸)、氨基酸(诸如天冬氨酸或谷氨酸)、芳族酸(诸如苯甲酸或肉桂酸)、磺酸(诸如对甲苯磺酸或乙烷磺酸)或类似物处理游离碱。
如果本发明的化合物为一种酸,则所需药学上可接受的盐可通过任何适合方法制备,例如,用无机或有机碱,诸如胺(伯胺、仲胺或叔胺)、碱金属氢氧化物或碱土金属氢氧化物,或类似物处理游离酸。适合盐的说明性实例包括但不限于衍生自氨基酸(诸如甘氨酸和精氨酸)、氨、伯胺、仲胺和叔胺,以及环状胺(诸如哌啶、吗啉和哌嗪)的有机盐,以及衍生自钠、钙、钾、镁、锰、铁、铜、锌、铝和锂的无机盐。
如本文所使用,术语“溶剂合物”意指进一步包括通过非共价分子间力结合的化学计算量或非化学计算量的溶剂的化合物,所述溶剂为诸如水、异丙醇、丙酮、乙醇、甲醇、dmso、乙酸乙酯、乙酸和乙醇胺、二氯甲烷、2-丙醇或类似物。化合物的溶剂合物或水合物易于通过向所述化合物中添加至少一摩尔当量羟基溶剂(诸如甲醇、乙醇、1-丙醇、2-丙醇或水)以引起亚胺部分的溶剂化或水合作用来制备。
术语“异常细胞生长”和“增生性病症”在本申请中可互换使用。除非另作指示,否则如本文中所使用,“异常细胞生长”是指独立于正常调控机制(例如丧失接触抑制作用)的细胞生长。此包括例如以下各物的异常生长:(1)通过表达突变的酪氨酸激酶或过表达受体酪氨酸激酶来增殖的肿瘤细胞(肿瘤);(2)发生异常酪氨酸激酶活化的其它增生性疾病的良性和恶性细胞;(3)在受体酪氨酸激酶作用下增殖的任何肿瘤;(4)通过异常丝氨酸/苏氨酸激酶活化而增殖的任何肿瘤;和(5)发生异常丝氨酸/苏氨酸激酶活化的其它增生性疾病的良性和恶性细胞。
术语“癌症”和“癌”是指或描述哺乳动物中典型地以不受调控的细胞生长为特征的生理病状。“肿瘤”包含一个或多个癌细胞,和/或良性或癌变前细胞。
“治疗剂”涵盖生物试剂,诸如抗体、肽、蛋白质、酶或化学治疗剂。
“化学治疗剂”是可用于治疗癌症的化合物。
“代谢产物”是经由特定化合物、其衍生物或其缀合物,或其盐在体内代谢产生的产物。化合物、其衍生物或其缀合物的代谢产物可使用本领域中已知的常规技术鉴别,且其活性可使用多项测试(诸如本文所描述的那些测试)测定。此类产物可例如由所施用的化合物的氧化、羟基化、还原、水解、酰胺化、脱酰胺、酯化、去酯化、酶促裂解和类似反应产生。因此,本发明包括本发明的化合物、其衍生物或其缀合物的代谢产物,包括通过使本发明的化合物、其衍生物或其缀合物与哺乳动物接触一段足以得到其代谢产物的时间的方法产生的化合物、其衍生物或其缀合物。
短语“药学上可接受”指示,所述物质或组合物必须在化学上和/或毒理学上与构成制剂的其它成分和/或用其治疗的哺乳动物相容。
术语“保护基”或“保护部分”是指在化合物、其衍生物或其缀合物上的其它官能基反应时,常用于阻断或保护特定官能基的取代基。举例来说,“胺保护基”或“胺保护部分”是连接至氨基以阻断或保护化合物中的氨基官能基的取代基。此类基团是本领域中熟知的(参见例如,p.wuts和t.greene,2007,protectivegroupsinorganicsynthesis,第7章,j.wiley&sons,nj),且其实例有氨基甲酸酯,诸如氨基甲酸甲酯和氨基甲酸乙酯、fmoc、取代的氨基甲酸乙酯、经1,6-β-消除裂解的氨基甲酸酯(还称为“自降解”)、尿素、酰胺、肽、烷基和芳基衍生物。适合氨基保护基包括乙酰基、三氟乙酰基、叔丁氧基羰基(boc)、苯甲氧基羰基(cbz)和9-芴基甲氧羰基(fmoc)。有关保护基及其用途的一般说明,参见p.g.m.wuts&t.w.greene,protectivegroupsinorganicsynthesis,johnwiley&sons,newyork,2007。
术语“离去基团”是指在取代或置换期间离开的带电荷基团或不带电荷部分。此类离去基团为本领域中熟知的且包括但不限于卤素、酯、烷氧基、羟基、甲苯磺酸酯基、三氟甲磺酸酯基、甲磺酸酯基、腈、叠氮化物、氨基甲酸酯基、二硫化物、硫酯和重氮鎓化合物。
术语“双官能交联剂”、“双官能接头”、“交联剂”或“接头化合物”是指具有两个反应性基团的修饰剂;其中一个反应性基团能够与细胞结合剂反应,而另一个与细胞毒性化合物反应,由此将两个部分连接在一起。此类双官能交联剂是本领域中熟知的(参见例如,isalm和dent,bioconjugation,第5章,第218-363页,grovesdictionariesinc.newyork,1999)。举例来说,能够经由硫酯键来键联的双官能交联剂包括用以引入马来酰亚胺基的4-(n-马来酰亚胺基甲基)-环己烷-1-甲酸n-琥珀酰亚胺酯(smcc),或用以引入碘代乙酰基的4-(碘代乙酰基)-氨基苯甲酸n-琥珀酰亚胺酯(siab)。在细胞结合剂上引入马来酰亚胺基或卤代乙酰基的其它双官能交联剂是本领域中熟知的(参见美国专利申请号2008/0050310、20050169933,从piercebiotechnologyinc.p.o.box117、rockland、il61105、usa获得),且包括但不限于双-马来酰亚胺基聚乙二醇(bmpeo)、bm(peo)2、bm(peo)3、n-(β-马来酰亚胺基丙氧基)琥珀酰亚胺酯(bmps)、γ-马来酰亚胺基丁酸n-琥珀酰亚胺酯(gmbs)、ε-马来酰亚胺基己酸n-羟基琥珀酰亚胺酯(emcs)、5-马来酰亚胺基戊酸nhs、hbvs、4-(n-马来酰亚胺基甲基)-环己烷-1-羧基-(6-酰胺基己酸n-琥珀酰亚胺酯)(其为smcc的“长链”类似物(lc-smcc))、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、4-(4-n-马来酰亚胺基苯基)-丁酸酰肼或盐酸盐(mpbh)、3-(溴代乙酰胺基)丙酸n-琥珀酰亚胺酯(sbap)、碘代乙酸n-琥珀酰亚胺酯(sia)、κ-马来酰亚胺基十一烷酸n-琥珀酰亚胺酯(kmua)、4-(对-马来酰亚胺基苯基)-丁酸n-琥珀酰亚胺酯(smpb)、6-(β-马来酰亚胺基丙酰胺基)己酸琥珀酰亚胺酯(smph)、(4-乙烯基磺酰基)苯甲酸琥珀酰亚胺酯(svsb)、二硫代双-马来酰亚胺基乙烷(dtme)、1,4-双-马来酰亚胺基丁烷(bmb)、1,4双马来酰亚胺基-2,3-二羟基丁烷(bmdb)、双-马来酰亚胺基己烷(bmh)、双-马来酰亚胺基乙烷(bmoe)、4-(n-马来酰亚胺基-甲基)环己烷-1-甲酸磺基琥珀酰亚胺酯(磺基-smcc)、(4-碘-乙酰基)氨基苯甲酸磺基琥珀酰亚胺酯(磺基-siab)、间马来酰亚胺基苯甲酰基-n-羟基磺基琥珀酰亚胺酯(磺基-mbs)、n-(γ-马来酰亚胺基丁氧基)磺基琥珀酰亚胺酯(磺基-gmbs)、n-(ε-马来酰亚胺基辛酰氧基)磺基琥珀酰亚胺酯(磺基-emcs)、n-(κ-马来酰亚胺基十一烷酰氧基)磺基琥珀酰亚胺酯(磺基-kmus)和4-(对马来酰亚胺基苯基)丁酸磺基琥珀酰亚胺酯(磺基-smpb)。
杂双官能交联剂为具有两个不同反应性基团的双官能交联剂。含有胺反应性n-羟基琥珀酰亚胺基(nhs基团)和羰基反应性肼基的杂双官能交联剂还可用于连接本文所描述的细胞毒性化合物与细胞结合剂(例如抗体)。此类可商购的杂双官能交联剂的实例包括琥珀酰亚胺基6-肼基烟碱酰胺丙酮腙(sanh)、4-肼基对苯二甲酸琥珀酰亚胺酯盐酸盐(shth)和肼烟酸琥珀酰亚胺酯盐酸盐(shnh)。带有酸不稳定性键联的缀合物还可使用本发明的带有肼的苯并二氮杂
能够经由二硫键连接细胞结合剂与细胞毒性化合物的双官能交联剂是本领域中已知的且包括用以引入二硫代吡啶基的3-(2-吡啶基二硫代)丙酸n-琥珀酰亚胺酯(spdp)、4-(2-吡啶基二硫代)戊酸n-琥珀酰亚胺酯(spp)、4-(2-吡啶基二硫代)丁酸n-琥珀酰亚胺酯(spdb)、4-(2-吡啶基二硫代)2-磺基丁酸n-琥珀酰亚胺酯(磺基-spdb)。可用于引入二硫代团的其它双官能交联剂是本领域中已知的且公开于美国专利6,913,748、6,716,821,和美国专利公开案20090274713和20100129314中,全部以引用的方式并入本文中。或者,还可使用引入硫醇基团的交联剂,诸如2-亚氨基硫杂环戊烷、高半胱氨酸硫代内酯或s-乙酰基琥珀酸酐。
如本文所定义,“接头”、“连接部分”或“连接基团”是指将两个基团(诸如细胞结合剂和细胞毒性化合物)连接在一起的部分。典型地,所述接头在连接其所连接的两个基团的条件下基本上呈惰性。双官能交联剂可包含两个反应性基团,连接部分的每一端一个,由此使一个反应性基团可首先与细胞毒性化合物反应以提供带有连接部分和第二反应性基团的化合物,接着所述第二反应性基团可与细胞结合剂反应。或者,双官能交联剂的一端可首先与细胞结合剂反应以提供带有连接部分和第二反应性基团的细胞结合剂,接着所述第二反应性基团可与细胞毒性化合物反应。连接部分可含有允许所述细胞毒性部分在特定位点释放的化学键。适合化学键是本领域中熟知的且包括二硫键、硫醚键、酸不稳定性键、光不稳定性键、肽酶不稳定性键和酯酶不稳定性键(参见例如,美国专利5,208,020、5,475,092、6,441,163、6,716,821、6,913,748、7,276,497、7,276,499、7,368,565、7,388,026和7,414,073)。优选为二硫键、硫醚键和肽酶不稳定性键。可用于本发明中的其它接头包括不可裂解的接头,诸如美国公开案号20050169933中详细描述的那些接头;或带电荷的接头或亲水性接头,其描述于us2009/0274713、us2010/01293140和wo2009/134976,各专利以引用的方式明确地并入本文中。
术语“氨基酸”是指天然存在的氨基酸或非天然存在的氨基酸。其可由nh2-c(raa’raa)-c(=o)oh表示,其中raa和raa’各自独立地为h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;芳基;杂芳基;或杂环基,或raa与n末端氮原子一起可形成杂环(例如在脯氨酸中)。术语“氨基酸残基”是指当自氨基酸的胺端和/或羧基端移除一个氢原子时的相应残基,诸如-nh-c(raa’raa)-c(=o)o-。
术语“阳离子”是指带有正电荷的离子。阳离子可为单价的(例如na+、k+等)、二价的(例如ca2+、mg2+等)或多价的(例如al3+等)。优选阳离子为单价的。
术语“治疗有效量”意指在受试者体内引起所希望的生物反应的活性化合物或缀合物的量。此类反应包括相较于不存在所述治疗,或预防、抑制或延迟疾病症状或疾病本身的发展的情况,减轻所治疗的疾病或病症的症状,预防、抑制或延迟疾病症状或疾病本身的复发,增加受试者的寿命。有效量的确定恰在本领域技术人员的能力范围内,尤其是依据本文所提供的详细公开内容。化合物i的毒性和治疗功效可通过在细胞培养和实验动物中进行的标准医药程序确定。本发明化合物或缀合物或者拟施用给受试者的其它治疗剂的有效量将取决于多发性骨髓瘤的分期、类别和状态,以及受试者的特征,诸如一般健康状况、年龄、性别、体重和耐药性。本发明化合物或缀合物或者拟施用的其它治疗剂的有效量还将取决于施用途径和剂型。可单独地调整剂量和时间间隔以提供足以维持所希望的治疗效果的活性化合物的血浆水平。
术语“人源化抗体”是指非人类(例如鼠类)抗体的形式,其为特定免疫球蛋白链、嵌合免疫球蛋白或其含有最少非人类(例如鼠类)序列的片段。典型地,人源化抗体是来自互补决定区(cdr)的残基经来自具有所希望的特异性、亲和力和能力的非人类物种(例如小鼠、大鼠、兔、仓鼠)的cdr的残基置换的人类免疫球蛋白(jones等人,nature321:522-525,1986;riechmann等人,nature332:323-327,1988;verhoeyen等人,science239:1534-1536,1988)。
在一些情况下,人类免疫球蛋白的fv构架区(fr)残基是经来自具有所希望的特异性、亲和力和能力的非人类物种的抗体中的相应残基置换。人源化抗体可进一步通过取代fv构架区中和/或经置换非人类残基内的其它残基进行修饰以精制并优化抗体特异性、亲和力和/或能力。一般而言,人源化抗体将包含至少一个,且典型地两个或三个可变结构域的基本上全部,所述结构域含有所有或基本上所有的与非人类免疫球蛋白对应的cdr区,而所有或基本上所有的fr区为人类免疫球蛋白序列的fr区。人源化抗体还可包含免疫球蛋白恒定区(fc)的至少一部分,典型地为人类免疫球蛋白恒定区的至少一部分。用于产生人源化抗体的方法的实例描述于美国专利5,225,539和5,639,641;roguska等人,proc.natl.acad.sci.usa91(3):969-973,1994;和roguska等人,proteineng.9(10):895-904,1996(全部以引用的方式并入本文中)中。在一些实施方案中,“人源化抗体”为表面重塑的抗体。在一些实施方案中,“人源化抗体”为cdr移植的抗体。
细胞结合剂-细胞毒性剂缀合物
本发明提供细胞结合剂-细胞毒性剂缀合物,其包含经由多种接头,包括但不限于二硫化物接头、硫醚接头、酰胺键结的接头、酸不稳定性接头和酯酶不稳定性接头,共价连接至一个或多个本发明细胞毒性剂分子的本文所描述的细胞结合剂。
在第一实施方案中,本发明提供一种具有结构式(i)的细胞结合剂-细胞毒性剂缀合物:
或其药学上可接受的盐,其中:
cba是共价连接至jcb’基团的细胞结合剂;
jcb’是通过使所述cba上的醛基与连接至基团l的醛反应性基团反应所形成的部分,其中所述醛是衍生自由以下结构式表示的2-羟基乙胺部分的氧化:
其中所述2-羟基乙胺部分是丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分;
l是间隔基或键;
jd’是连接细胞毒性剂d与基团l的连接部分;
d是经由所述连接部分jd’共价连接至l或当l是键时经由jcb’连接至cba的细胞毒性剂;且
w是1、2、3或4。
任何醛反应性基团均可用于本发明中。示例性醛反应性基团包括但不限于r.c.larock,1999,comprehensiveorganictransformations,第2版,wiley-vch中描述的那些基团。
在一个实施方案中,醛反应性基团为肼、酰肼或羟胺。
在另一个实施方案中,醛反应性基团选自:
其中:xa为ch2、o或nch3;u’为nh、o、s或ch2;u为h或供电子基团;xb和xb’各自独立地为–oh、-sh或–nh2;rz和rz’各自独立地为h或烷基(优选为–me);rz”为h或烷基;且xc为n或ch。更具体地,所述醛反应性基团为
在第1个具体实施方案中,对于具有结构式(i)的缀合物或其药学上可接受的盐,jcb’是由以下结构式之一表示:
其中:xa为ch2、o或nch3;u’为nh、o、s或ch2;u为h或供电子基团;xb1和xb1’各自独立地为–o-、-s-或–nh-;rz和rz’各自独立地为h或烷基(优选为–me);且rz”为h或烷基;s1为共价连接至所述细胞结合剂的位点;且s2为共价连接至基团l的位点。更具体地,jcb’为
在第2个具体实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
其中:
s3为共价连接至基团jcb’的位点;
s4为共价连接至基团d的位点;
za1为不存在、-so2nr9-、-nr9so2-、-c(=o)-nr9-、-nr9-c(=o)-、-(ch2ch2)p’nr9-c(=o)-、-c(=o)-nr9(ch2ch2)p’、-(ch2ch2)p’-c(=o)nr9-、-nr9c(=o)(ch2ch2)p’-、-c(=o)-o-或-o-c(=o)-;
za2为不存在、-so2nr9-、-nr9so2-、-c(=o)-nr9-、-nr9-c(=o)-、-c(=o)-o-、-o-c(=o)-、-c(=o)-nr9-(ch2ch2o)p-、-nr9-c(=o)-(ch2ch2o)p-、-(och2ch2)p-c(=o)nr9-或-(och2ch2)p-nr9-c(=o)-;
r9为h或任选取代的烷基;
p和p’各自独立地为1至10的整数;
q为h、带电荷的取代基或可电离的基团;
ra1、ra2、ra3、ra4在每次出现时独立地为h或任选取代的烷基;
q1和r1各自独立地为0至10的整数,条件为q1和r1不同时为0;且其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在一个实施方案中,q为i)h;ii)-so3h、-z’-so3h、-opo3h2、-z’-opo3h2、-po3h2、-z’-po3h2、-co2h、-z’-co2h、-nr11r12或-z’-nr11r12,或其药学上可接受的盐;或iii)-n+r14r15r16x﹣或-z’-n+r14r15r16x﹣;z’为任选取代的亚烷基、任选取代的亚环烷基或任选取代的亚苯基;r14至r16各自独立地为任选取代的烷基;x﹣为药学上可接受的阴离子;且其余变量是如上文在第2个具体实施方案中所描述。更具体地,q为–so3h或–co2h,或其药学上可接受的盐。
在另一个实施方案中,za1不存在;za2为-c(=o)-nr9-或-nr9-c(=o)-;且其余变量是如上文在第2个具体实施方案的任何实施方案中所描述。更具体地,r9为h。
在另一个实施方案中,za1和za2均不存在;且其余变量是如上文在第2个具体实施方案的任何实施方案中所描述。
在另一个实施方案中,ra1、ra2、ra3和ra4均为-h;q和r各自独立地为0至4的整数;且其余变量是如上文在第2个具体实施方案的任何实施方案中所描述。
在另一个实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
或其药学上可接受的盐;且其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在第3个具体实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
其中:
s3为共价连接至基团jcb’基团的位点;
s4为共价连接至基团d的位点;
zb1和zb2各自独立地为不存在、-so2nr9-、-nr9so2-、-c(=o)-nr9-、-nr9-c(=o)-、-c(=o)-o-、-o-c(=o)-、-ch2-o-、-o-ch2-、-(ch2ch2o)p-或-(och2ch2)p’-、-nr9-c(=o)-ch2-或-ch2-c(=o)-nr9-,其中p和p’独立地为1至1000的整数;
e1和e2之一为-c(=o)-,而另一个为-nr9-;或e1和e2之一为–c(=o)-或–nr9-,而另一个不存在;
r9为h或任选取代的烷基;
p为[xx]1-10,其中每个xx为独立选择的氨基酸的残基,或p为-(nrm-ch2ch2)s-;
s为1至5的整数;
rm为h,或任选经带电荷的取代基或可电离的基团取代的烷基;
rb1、rb2、rb3、rb4、rb5和rb6在每次出现时各自独立地为h或任选取代的烷基;
m1和n1在每次出现时独立地为0至10的整数;且其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在一个实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
其中:
zb1和zb2均不存在,或zb1和zb2之一不存在而另一个为-ch2-o-或-o-ch2-;
n1为1至6的整数;且其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。更具体地,rb1和rb2均为h。
在另一个实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
其中:
zb1和zb2各自独立地为不存在、-ch2-o-、-o-ch2-、-nr9-c(=o)-ch2-或-ch2-c(=o)-nr9-;
n1和m1各自独立地为1至6的整数;且
其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在一个更具体实施方案中,对于上文任何实施方案中所描述的式(l2),zb1和zb2均不存在。在另一个更具体实施方案中,对于上述式(l2),zb1为-ch2-o-;且zb2不存在。或者,对于上述式(l2),zb1为-ch2-c(=o)-nr9-;且zb2为-o-ch2-或不存在。甚至更具体地,r9为-h。
在一个实施方案中,对于上文任何实施方案中所描述的式(l2),p为[xx]2-4。在另一个实施方案中,对于上文任何实施方案中所描述的式(l2),p为[xx]2或[xx]3。如本文所使用,每一xx为独立选择的氨基酸的残基。
在另一个实施方案中,对于上文任何实施方案中所描述的式(l2),p为蛋白酶可裂解的肽。更具体地,p为在肿瘤组织中表达的蛋白酶可裂解的肽。在另一个更具体实施方案中,p为溶酶体蛋白酶可裂解的肽。
在另一个实施方案中,对于上文任何实施方案中所描述的式(l2),p选自由下列组成的组:val-cit、val-lys、phe-lys、lys-lys、ala-lys、phe-cit、leu-cit、lle-cit、trp、cit、phe-ala、phe-n9-甲苯磺酰基-arg、phe-n9-硝基-arg、phe-phe-lys、d-phe-phe-lys、gly-phe-lys、leu-ala-leu、ile-ala-leu、val-ala-val、ala-leu-ala-leu(seqidno:17)、β-ala-leu-ala-leu(seqidno:18)、gly-phe-leu-gly(seqidno:19)、val-arg、arg-val、arg-arg、val-d-cit、val-d-lys、val-d-arg、d-val-cit、d-val-lys、d-val-arg、d-val-d-cit、d-val-d-lys、d-val-d-arg、d-arg-d-arg、ala-ala、ala-d-ala、d-ala-ala、andd-ala-d-ala.、gly-gly-gly、ala-ala-ala、d-ala-ala-ala、ala-d-ala-ala、ala-ala-d-ala、ala-val-cit和ala-val-ala。更具体地,p为gly-gly-gly、ala-ala-ala、d-ala-ala-ala、ala-d-ala-ala、ala-val-ala、gly-gly或ala-ala。
在另一个实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
且其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在第4个具体实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
s3为共价连接至基团jcb’的位点;
s4为共价连接至基团d的位点;
zc1为不存在、-so2nr9-、-nr9so2-、-c(=o)-nr9-、-nr9-c(=o)-、-c(=o)-o-、-o-c(=o)-、-ch2-o-、-o-ch2-、-(ch2ch2o)p-或-(och2ch2)p’-,
其中p和p’独立地为1至1000的整数;
jd’为
a和a’各自独立地为任选取代的亚烷基、任选取代的亚烯基、任选取代的亚炔基、任选取代的亚环烷基、任选取代的亚环烯基或任选取代的亚环炔基;
q为-z1-p-z2-;
q’为-z1’-p’-z2’-;
z1和z2之一为-c(=o)-,而另一个为-nrh-;
z1’和z2’之一为-c(=o)-,而另一个为-nrh’-;
p和p’各自独立地为不存在、任选取代的亚烷基、-(ch2-ch2-o)j-、-(o-ch2-ch2)j-或[xx]1-10,其中每个xx为独立选择的氨基酸的残基;
j为介于1与500之间的整数;
k为0或1;
l为-(cr5r6)v-、-(cr7r8)q-n(rg)-(cr9r10)r-、-(cr7r8)q-c(ra)(rg)-(cr9r10)r或-(cr11r12)s-n(rg)-(cr13r14)t-n(rg’)-(cr15r16)u-;
rg和rg’各自独立地为-(cr17r18)p-z-v;
p为介于1与5之间的整数;
v为h、带电荷的取代基或可电离的基团;
z为不存在、-c(=o)nrh-亚烷基-或-nrh-c(=o)-亚烷基-;
rh和rh’在每次出现时独立地为h或任选取代的烷基;
r5至r18在每次出现时独立地为h或任选取代的烷基;
q、r、s、t、u和v各自独立地为介于0与10之间的整数;且其余变量是如上文第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在一个实施方案中,对于具有式(i)的缀合物或其药学上可接受的盐,-l-jd’-是由以下结构式表示:
其中:
r19至r22在每次出现时独立地为h或任选取代的烷基;
m和n各自独立地为0至10;且其余变量是如上文在第一实施方案或第1个具体实施方案中所描述。更具体地,r19至r22各自为h;r5和r6各自为h;r7至r10各自为h;且r11至r16各自为h。
在一个实施方案中,对于式(l4)-(l11),p和p’在每次出现时独立地为[xx]1-10。更具体地,p和p’在每次出现时独立地为[xx]2-5;且其余变量是如上文所描述。
在另一个实施方案中,对于式(l4)-(l11),p和p’各自为可经蛋白酶裂解的肽。在另一个实施方案中,p和p’各自为在肿瘤组织中表达的蛋白酶可裂解的肽。或者,p和p’各自为溶酶体蛋白酶可裂解的肽。
在另一个实施方案中,对于式(l4)-(l11),p和p’各自选自由下列组成的组:val-cit、val-lys、phe-lys、lys-lys、ala-lys、phe-cit、leu-cit、lle-cit、trp、cit、phe-ala、phe-n9-甲苯磺酰基-arg、phe-n9-硝基-arg、phe-phe-lys、d-phe-phe-lys、gly-phe-lys、leu-ala-leu、ile-ala-leu、val-ala-val、ala-leu-ala-leu(seqidno:17)、β-ala-leu-ala-leu(seqidno:18)、gly-phe-leu-gly(seqidno:19)、val-arg、arg-val、arg-arg、val-d-cit、val-d-lys、val-d-arg、d-val-cit、d-val-lys、d-val-arg、d-val-d-cit、d-val-d-lys、d-val-d-arg、d-arg-d-arg、ala-ala、ala-d-ala、d-ala-ala和d-ala-d-ala、gly-gly-gly、ala-ala-ala、d-ala-ala-ala、ala-d-ala-ala、ala-ala-d-ala、ala-val-cit、ala-val-ala和β-ala-gly-gly-gly。更具体地,p和p’各自为gly-gly-gly、ala-ala-ala、d-ala-ala-ala、ala-d-ala-ala、ala-val-ala或β-ala-gly-gly-gly。
在某些实施方案中,上文所描述的任何实施方案中的[xx]在每次出现时为独立选择的氨基酸的残基,所述氨基酸选自:天然存在的氨基酸、合成氨基酸、氨基酸类似物,或以与所述天然存在的氨基酸类似的方式起作用的氨基酸模拟物。
在某些实施方案中,上文所描述的任何实施方案中的[xx]在每次出现时为独立选择的氨基酸的残基,所述氨基酸选自由下列组成的组:组氨酸、丙氨酸、异亮氨酸、精氨酸、亮氨酸、天冬酰胺、赖氨酸、天冬氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、谷氨酸、苏氨酸、谷氨酰胺、色氨酸、甘氨酸、缬氨酸、脯氨酸、丝氨酸、酪氨酸、n-甲基-组氨酸、n-甲基-丙氨酸、n-甲基-异亮氨酸、n-甲基-精氨酸、n-甲基-亮氨酸、n-甲基-天冬酰胺、n-甲基-赖氨酸、n-甲基-天冬氨酸、n-甲基-甲硫氨酸、n-甲基-半胱氨酸、n-甲基-苯丙氨酸、n-甲基-谷氨酸、n-甲基-苏氨酸、n-甲基-谷氨酰胺、n-甲基-色氨酸、n-甲基-甘氨酸、n-甲基-缬氨酸、n-甲基-脯氨酸、n-甲基-丝氨酸、n-甲基-酪氨酸、羟基脯氨酸、γ-羧基谷氨酸、硒代半胱氨酸、o-磷酸丝氨酸、高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍、瓜氨酸、鸟氨酸、半胱氨酸磺酸、半胱氨酸亚磺酸、3-氨基丙氨酸、3-二甲氨基丙氨酸、2-氨基-4-(二甲氨基)丁酸、2,4-二氨基丁酸、2-氨基-6-(二甲氨基)己酸、2-氨基-5-(二甲氨基)戊酸和β-丙氨酸,其各自独立地为l或d异构体。更具体地,每个xx独立地为甘氨酸或丙氨酸的残基。
在第5个具体实施方案中,对于具有式(i)的缀合物,d为类美登素;且其余变量是如上文在第一实施方案或第1、2、3或4个实施方案,或其中所描述的任何更具体实施方案中所描述。
在一个更具体实施方案中,d是由以下结构式表示的类美登素:
其中:
rm、rm’和rm”在每次出现时独立地为h或任选取代的烷基;
r1’、r2’、r3’和r4’在每次出现时独立地为h、任选取代的任选取代的任选取代的烷基、任选取代的烯基、任选取代的环烷基、任选取代的杂环基、任选取代的芳基或任选取代的杂芳基;
i为介于0与15之间的整数;且
s5为共价连接至基团jd’的位点;
-l-jd’-是如上文在第一实施方案或第2或4个具体实施方案,或其中所描述的更具体实施方案中所描述。
更具体地,d是由以下结构式表示:
在另一具体实施方案中,d是由以下结构式表示:
其中:rm、rm’和rm”在每次出现时独立地为h或任选取代的烷基;s5为共价连接至基团jd’的位点;且-l-jd’-是如上文在第一实施方案或第3个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
更具体地,d是由以下结构式表示:
在第6个具体实施方案中,d为苯并二氮杂
在一个更具体实施方案中,d是由以下结构式表示的苯并二氮杂
其中:
在n与c之间的双线
y选自-h、-or、-ocor’、-sr、-nr’r”、-so3m、-so2m或-oso3m,其中m为-h或阳离子,诸如na+或k+;
r为-h、任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基,或peg基团-(ch2ch2o)n-rc,其中n为1至24的整数,且rc为具有1至4个碳原子的直链或支链烷基;
r’与r”相同或不同,且选自-h;-oh;-or;-nrrg’;-cor;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;任选取代的具有6至18个碳原子的芳基;任选取代的具有1至6个选自o、s、n和p的杂原子的3元至18元杂环;peg基团-(ch2ch2o)n-rc,其中n为1至24的整数,优选n为2、4或8;且rg’为-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;或peg基团-(ch2ch2o)n-rc;
x’选自由下列组成的组:-h;-oh;取代或未取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;苯基;和胺保护基;
y’选自由下列组成的组:-h;氧代基;取代或未取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;
a和a’选自-o-和-s-;
w’不存在,或选自-o-、-n(re)-、-n(re)-c(=o)-、-n(c(=o)re)-、-s-或-ch2-s-、-ch2nre-;
rx不存在,或选自具有1至10个碳原子的直链、支链或环状烷基;
re为-h;具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;或-(ch2-ch2-o)n-rk,其中rk为-h;具有1至6个碳原子的直链、支链、环状烷基,任选带有仲氨基(例如-nhr101)或叔氨基(-nr101r102);或者5元或6元含氮杂环,诸如哌啶或吗啉,其中r101和r102各自独立地为具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;且
g选自-ch-或-n-;
x”与x”’相同或不同,且独立地选自-(ch2)n’-、-nr’-、-co-、-bh-、-so-或-so2-;
y”与y”’相同或不同,且独立地选自-o、-(ch2)n’-、-nr’-或-s-;
z”与z”’相同或不同,且独立地选自-(ch2)n’-、-cr7’r8’-、-nr9’-、-o-和-s-;
n’选自0、1、2和3;
r7’与r8’相同或不同,并且各自独立地选自-h、-oh、-sh、-cooh、-nhr’、聚乙二醇单元-(och2ch2)n-、氨基酸、带有2至6个氨基酸的肽单元、任选取代的具有1至10个碳原子的直链、支链或环状烷基;
r9’独立地选自-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基;聚乙二醇单元-(och2ch2)n-;
ra、ra’、rb和rb’相同或不同,并且独立地选自由下列组成的组:-h、卤基,或任选取代的具有1至10个碳原子的支链、直链或环状烷基;或ra与ra’和/或rb与rb’一起分别形成含有双键的基团=b和=b’;
=b与=b’相同或不同,且独立地选自任选取代的支链或直链烯基或羰基;
qa为qa1-ar-qa2;
qa’为qa1’-ar’-qa2’;
qa1和qa1’各自独立地为不存在、具有1至6个碳原子的直链、支链或环状烷基,或-ch=ch单元;
ar和ar’各自独立地不存在,或表示芳基;
qa2和qa2’各自独立地选自-h;与所述反应性基团键结的连接基团;取代或未取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-rc’-(och2ch2)n-rc;或选自卤素、胍鎓[-nh(c=nh)nh2]、-or、-nr’r”、-no2、-nco、-nr’cor”、-sr、由-sor’表示的亚砜、由-so2r’表示的砜、磺酸酯基-so3m、硫酸酯基-oso3m、由so2nr’r”表示的磺酰胺、氰基、叠氮基、-cor’、-ocor’或-oconr’r”的取代基;且
rc’不存在,或选自具有1至5个碳原子的直链或支链烷基、烯基或炔基。
在另一个更具体实施方案中,d是由以下结构式表示:
或其药学上可接受的盐,其中ra”与rb”相同或不同,且选自-h和-me;且其余变量是如上文所描述。
在某些实施方案中,对于式(d6)-(d17),在n与c之间的双线
m为-h或药学上可接受的阳离子(例如na+);
x’和y’均为-h;
a和a’均为-o-;
r6为-ome;且
rx为具有1至6个碳原子的直链或支链烷基。
在一个更具体实施方案中,d是由以下结构式表示:
或其药学上可接受的盐,其中y为-h或-so3m,且m为h+或阳离子。甚至更具体地,y为-so3m,且m为h+、na+或k+。
在第7个具体实施方案中,对于具有式(i)的缀合物,-l-jd’-为键;且d是由以下结构式表示:
或其药学上可接受的盐,其中:
l’、l”和l”’之一是由下式表示:
且另两个相同或不同,且独立地选自-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(och2ch2)n-rc;卤素;胍鎓[-nh(c=nh)nh2];-or;-nr’r”;-no2;-nr’cor”;-sr;-sor’;-so2r’;-so3h;-oso3h;-so2nr’r”;氰基;叠氮基;-cor’;-ocor’;和-oconr’r”;
zd1为不存在、-c(=o)-nr9-或–nr9-c(=o)-;
p为氨基酸残基或含有介于2至20个之间的氨基酸残基的肽;
ra和rb在每次出现时独立地为–h、(c1-c3)烷基或带电荷的取代基,或可电离的基团q;
r和r’独立地为1至6的整数;
在n与c之间的双线
y为选自以下的离去基团:-or、-ocor’、-ocoor’、-oconr’r”、-nr’r”、-nr’cor”、-nr’nr’r”、任选取代的5元或6元含氮杂环(例如,经由氮原子连接的哌啶、四氢吡咯、吡唑、吗啉等)、由-nr’(c=nh)nr’r”表示的胍鎓、氨基酸或由-nrcop’表示的肽、-sr、-sor’、卤素、氰基、叠氮基、-oso3h、亚硫酸酯基(-so3h或-so2h)、焦亚硫酸酯(h2s2o5)、单-、二-、三-和四-硫代磷酸酯(po3sh3、po2s2h2、pos3h2、ps4h2)、硫代磷酸酯(rio)2ps(ori)、ris-、riso、riso2、riso3、硫代硫酸酯(hs2o3)、连二亚硫酸酯(hs2o4)、二硫代磷酸酯(p(=s)(ork’)(s)(oh))、羟肟酸(rk’c(=o)noh)和甲醛次硫酸根(hoch2so2-),或其混合物,其中ri为具有1至10个碳原子的直链或支链烷基,且经至少一个选自-n(rj)2、-co2h、-so3h和-po3h的取代基取代;ri可进一步任选经本文关于烷基所描述的取代基取代;rj为具有1至6个碳原子的直链或支链烷基;rk’为具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基、芳基、杂环基或杂芳基;
p’为氨基酸残基或含有介于2至20个之间的氨基酸残基的肽;
r在每次出现时独立地选自由下列组成的组:-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(ch2ch2o)n-rc;任选取代的具有6至18个碳原子的芳基;任选取代的含有一个或多个独立地选自氮、氧和硫的杂原子的5元至18元杂芳基环;或任选取代的含有1至6个独立地选自o、s、n和p的杂原子的3元至18元杂环;
r’和r”各自独立地选自-h;-oh;-or;-nhr;-nr2;-cor;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(ch2ch2o)n-rc;和任选取代的具有1至6个独立地选自o、s、n和p的杂原子的3元至18元杂环;
rc为-h,或任选取代的具有1至4个碳原子的直链或支链烷基;
n为1至24的整数;
x’选自-h;胺保护基;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(ch2ch2o)n-rc;任选取代的具有6至18个碳原子的芳基;任选取代的含有一个或多个独立地选自氮、氧和硫的杂原子的5元至18元杂芳基环;和任选取代的含有1至6个独立地选自o、s、n和p的杂原子的3元至18元杂环;
y’选自-h;氧代基;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;任选取代的6元至18元芳基;任选取代的含有一个或多个独立地选自氮、氧和硫的杂原子的5元至18元杂芳基环;任选取代的含有1至6个杂原子的3元至18元杂环;
r1、r2、r3、r4、r1’、r2’、r3’和r4’各自独立地选自由下列组成的组:-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(och2ch2)n-rc;卤素;胍鎓[-nh(c=nh)nh2];-or;-nr’r”;-no2;-nco;-nr’cor”;-sr;-sor’;-so2r’;-so3-h;-oso3h;-so2nr’r”;氰基;叠氮基;-cor’;-ocor’;和-oconr’r”;
r6为-h、-r、-or、-sr、-nr’r”、-no2或卤素;
a与a’相同或不同,且独立地选自-o-、氧代(-c(=o)-)、-crr’o-、-crr’-、-s-、-crr’s-、-nr5和-crr’n(r5)-;且
r5和r9各自独立地为-h或任选取代的具有1至10个碳原子的直链或支链烷基;且其余变量是如上文在第一实施方案或第1个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
在一个更具体实施方案中,对于式(d18)-(d23),l’是由式(a)表示,且l”和l”’均为–h。
在另一个更具体实施方案中,对于式(d18)-(d23):
在n与c之间的双线
r1、r2、r3、r4、r1’、r2’、r3’和r4’均为-h;
r6为-ome;
x’和y’均为-h;
a和a’为-o-;且
m为h+、na+或k+;且其余变量是如上文第7个具体实施方案或上文所描述的任何更具体实施方案中所描述。
在另一个更具体实施方案中,对于式(d18)-(d23),ra和rb均为h;且其余变量是如上文第7个具体实施方案或上文所描述的任何更具体实施方案中所描述。
在另一个更具体实施方案中,对于式(d18)-(d23),r5和r9各自独立地为h或me;且其余变量是如上文第7个具体实施方案或上文所描述的任何更具体实施方案中所描述。更具体地,r5和r9均为h。
在另一个更具体实施方案中,对于式(d18)-(d23),p为含有2至10个氨基酸残基的肽;且其余变量是如上文第7个具体实施方案或上文所描述的任何更具体实施方案中所描述。更具体地,p为含有2至5个氨基酸残基的肽。甚至更具体地,p选自gly-gly-gly、ala-val、val-ala、val-cit、val-lys、phe-lys、lys-lys、ala-lys、phe-cit、leu-cit、lle-cit、trp、cit、phe-ala、phe-n9-甲苯磺酰基-arg、phe-n9-硝基-arg、phe-phe-lys、d-phe-phe-lys、gly-phe-lys、leu-ala-leu、ile-ala-leu、val-ala-val、ala-leu-ala-leu(seqidno:17)、β-ala-leu-ala-leu(seqidno:18)和gly-phe-leu-gly(seqidno:19)、val-arg、arg-val、arg-arg、val-d-cit、val-d-lys、val-d-arg、d-val-cit、d-val-lys、d-val-arg、d-val-d-cit、d-val-d-lys、d-val-d-arg、d-arg-d-arg、ala-ala、ala-d-ala、d-ala-ala和d-ala-d-ala。
在另一个更具体实施方案中,对于具有式(i)的缀合物,-l-jd’-d是由以下结构式表示:
或其药学上可接受的盐,其中y为h或-so3m,且m为h+、na+或k+。
在第8个具体实施方案中,式(i)的缀合物是由以下结构式表示:
上文所描述的任一实施方案(诸如第一实施方案或第1至8个具体实施方案,或其中所描述的任何更具体实施方案)的缀合物中的cba可为本文所描述的任何细胞结合剂,诸如以下第二实施方案中所描述的那些细胞结合剂。
在某些实施方案中,上文所描述的任一实施方案(诸如第一实施方案或第1至8个具体实施方案,或其中所描述的任何更具体实施方案)的缀合物可包含每个细胞结合剂(例如抗体)分子结合的1-4个细胞毒性剂分子。在某些实施方案中,所述缀合物可包含每个细胞结合剂分子2或4个细胞毒性剂分子。每个细胞结合剂(例如抗体)分子所结合的细胞毒性剂分子的数量可经光谱法,通过测量类美登素化合物在280nm与252nm下的吸光度比率,和苯并二氮杂
本发明还提供一种组合物,其包含上文所描述的任一实施方案(诸如第一实施方案或第1至8个具体实施方案,或其中所描述的任何更具体实施方案)的缀合物。在某些实施方案中,所述组合物中至少约50%、60%、70%、80%、90%、95%、99%、99.5%、99.9%或更高百分比的缀合物具有2或4个细胞毒性剂共价连接至每一cba。在某些实施方案中,在上文所描述的组合物中,不超过约20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%或0.1%的缀合物仅具有1个细胞毒性剂共价连接至每一cba。
细胞结合剂
在第二实施方案中,本发明提供一种用于制备本文所描述的细胞结合剂-细胞毒性剂缀合物的细胞结合剂(cba)。此类cba可为一种蛋白质(例如自然界中所发现的蛋白质,或者工程改造的或重组蛋白质),诸如抗体、其抗原结合部分(其可包括抗体衍生物)或抗体模拟蛋白。此类蛋白质cba的n末端可包含2-羟基乙胺部分,其可为丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分。2-羟基乙胺部分可使用本发明的方法氧化而变为醛基,醛基可接着与醛反应性基团反应以形成目标缀合物。
在一个相关方面中,本发明还提供某些工程改造的蛋白质cba,诸如工程改造的抗体、其抗原结合部分(或抗体衍生物),或抗体模拟蛋白,其可具有ser或thr作为n末端残基,与此类抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白的无ser、无thr天然序列相对。
可通过紧接着信号肽序列之后插入ser/thr密码子来添加n末端ser/thr。此种信号肽序列可为抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白的天然信号肽,或可为与所述抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白的成熟加工序列的n末端融合的异源信号肽。
此处,“成熟加工序列(例如重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列)”是指某些分泌蛋白,诸如所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的经过加工的序列,所述分泌蛋白经合成而具有n末端信号肽(天然存在的信号肽,或使用重组技术n末端融合的异源信号肽)。在包括信号肽裂解在内的正常成熟过程之后,所得到的成熟加工序列一般缺乏所有信号肽序列。
seqidno:1和6可用作此类天然或异源信号肽。抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白的成熟加工序列中的n末端残基可能存在另外的序列变化,只要在信号肽裂解之后,n末端残基为ser/thr即可。
具体而言,可通过使用自鼠类抗folr1抗体fr1-2.1(由2013年4月16日保藏于atcc且atcc保藏号为pta-120197的杂交瘤产生)的轻链信号肽获得的特定信号肽序列来添加n末端ser/thr,所述信号肽是由seqidno:1表示。已意外地发现,此信号肽序列以独特方式进行加工而留下其最后一个ser作为蛋白质的成熟加工序列的n末端残基。
不管n末端ser/thr是天然存在于cba中,抑或使用本文所描述的任何重组技术工程改造的,本发明的另一方面还提供一种经修饰的cba(例如经修饰抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白),其中其n末端ser/thr已氧化成醛基。在某些实施方案中,醛是衍生自抗体或其抗原结合部分的重链上n末端ser/thr的氧化。所述氧化可使用本文所描述的本发明的任何方法进行。此种经修饰cba可与带有醛反应性基团(诸如本文所描述的那些基团)的接头反应以形成本发明的缀合物。
因此,本发明还提供一种使用本发明的经修饰cba(例如,抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白)制备本文所描述的本发明缀合物的方法。本发明还提供一种编码任何经工程改造的cba(例如,抗体、其抗原结合部分(或抗体衍生物)或抗体模拟蛋白)的多核苷酸,其产生具有n末端ser/thr的cba的成熟加工序列。
在某些实施方案中,醛基是位于蛋白质cba(例如抗体或其抗原结合部分)的n末端。举例来说,n末端醛基可衍生自n末端丝氨酸或苏氨酸的氧化。
在一个实施方案中,n末端丝氨酸或苏氨酸可天然存在于蛋白质cba(例如抗体或其抗原结合部分)中。举例来说,所述抗体或其抗原结合部分可包含seqidno:3的轻链序列,或源自于编码seqidno:1的信号肽的相同小鼠生殖系序列的轻链序列。在一个相关实施方案中,所述抗体或其抗原结合部分是包含seqidno:3的轻链序列,或源自于编码seqidno:1的信号肽的相同小鼠生殖系序列的轻链序列的鼠类抗体或其抗原结合部分的嵌合抗体、人源化抗体或人类抗体,或其抗原结合部分。
类似地,所述抗体或其抗原结合片段可包含源自于鼠类igkv6-32*01序列(即,sivmtqtpkfllvsagdrvtitckasqsvsndvawyqqkpgqspklliyyasnrytgvpdrftgsgygtdftftistvqaedlavyfcqqdyssp,seqidno:20)的轻链序列。在一个相关实施方案中,所述抗体或其抗原结合部分是包含源自于seqidno:20的igkv6-32*01序列的轻链序列的鼠类抗体或其抗原结合部分的嵌合抗体、人源化抗体或人类抗体,或其抗原结合部分。
此外,所述抗体或其抗原结合部分可包含源自于以下所列人λv3家族v基因序列(即,seqidno:21-41)中任一个的轻链序列。在一个相关实施方案中,所述抗体或其抗原结合部分是包含源自于以下所列人λv3家族v基因序列的轻链序列的鼠类抗体或其抗原结合部分的嵌合抗体、人源化抗体或人类抗体,或其抗原结合部分。
人λv3家族v基因序列
iglv3-1*01
syeltqppsvsvspgqtasitcsgdklgdkyacwyqqkpgqspvlviyqdskrpsgiperfsgsnsgntatltisgtqamdeadyycqawdssta(seqidno:21)
iglv3-10*01
syeltqppsvsvspgqtaritcsgdalpkkyaywyqqksgqapvlviyedskrpsgiperfsgsssgtmatltisgaqvedeadyycystdssgnhx(seqidno:22)
iglv3-10*02
syeltqppsvsvspgqtaritcsgdalpkkyaywyqqksgqapvlviykdskrpsgiperfsgsssgtmatltisgaqvededdyycysadysgn(seqidno:23)
iglv3-12*01
syeltqphsvsvataqmaritcggnnigskavhwyqqkpgqdpvlviysdsnrpsgiperfsgsnpgntttltisrieagdeadyycqvwdsssdhp(seqidno:24)
iglv3-12*02
syeltqphsvsvataqmaritcggnnigskavhwyqqkpgqdpvlviysdsnrpsgiperfsgsnpgntatltisrieagdeadyycqvwdsssdhp(seqidno:25)
iglv3-13*01
syeltqppavsvspgqtariscsgdvlrdnyadwypqkpgqapvlviykdgerpsgiperfsgstsgnttaltisrvltkggadyycfsgd*nnl(seqidno:26)
iglv3-16*01
syeltqppsvsvslgqmaritcsgealpkkyaywyqqkpgqfpvlviykdserpsgiperfsgsssgtivtltisgvqaedeadyyclsadssgtyp(seqidno:27)
iglv3-19*01
sseltqdpavsvalgqtvritcqgdslrsyyaswyqqkpgqapvlviygknnrpsgipdrfsgsssgntasltitgaqaedeadyycnsrdssgnhl(seqidno:28)
iglv3-21*01
syvltqppsvsvapgktaritcggnnigsksvhwyqqkpgqapvlviyydsdrpsgiperfsgsnsgntatltisrveagdeadyycqvwdsssdhp(seqidno:29)
iglv3-21*02
syvltqppsvsvapgqtaritcggnnigsksvhwyqqkpgqapvlvvyddsdrpsgiperfsgsnsgntatltisrveagdeadyycqvwdsssdhp(seqidno:30)
iglv3-21*03
syvltqppsvsvapgktaritcggnnigsksvhwyqqkpgqapvlvvyddsdrpsgiperfsgsnsgntatltisrveagdeadyycqvwdsssdhp(seqidno:31)
iglv3-22*01
syeltqlpsvsvspgqtaritcsgdvlgenyadwyqqkpgqapelviyedserypgiperfsgstsgntttltisrvltedeadyyclsgdednp(seqidno:32)
iglv3-25*01
syelmqppsvsvspgqtaritcsgdalpkqyaywyqqkpgqapvlviykdserpsgiperfsgsssgttvtltisgvqaedeadyycqsadssgtyp(seqidno:33)
iglv3-25*02
syeltqppsvsvspgqtaritcsgdalpkqyaywyqqkpgqapvlviykdserpsgiperfsgsssgttvtltisgvqaedeadyycqsadssgtyp(seqidno:34)
iglv3-25*03
syeltqppsvsvspgqtaritcsgdalpkqyaywyqqkpgqapvlviykdserpsgiperfsgsssgttvtltisgvqaedeadyycqsadssg(seqidno:35)
iglv3-27*01
syeltqpssvsvspgqtaritcsgdvlakkyarwfqqkpgqapvlviykdserpsgiperfsgsssgttvtltisgaqvedeadyycysaadnnl(seqidno:36)
iglv3-31*01
sselsqepavsvalg*taritcqgdsiedsvvnwykqkpsqapglvi*lnsvqssgipkkfsgsssgnmatltitgiqvedkadyycqswdssrths(seqidno:37)
iglv3-31*02
sselsqepavsvslg*taritcqgdsiedsvvnwykqkpsqapglvi*lnsvqssgipkkfsgsssgnmatltitgiqvedkadyycqswdssrths(seqidno:38)
iglv3-32*01
ssgptqvpavsvalgqmaritcqgdsmegsyehwyqqkpgqapvlviydssdrpsriperfsgsksgntttltitgaqaedeadyyyqlidnhat(seqidno:39)
iglv3-9*01
syeltqplsvsvalgqtaritcggnnigsknvhwyqqkpgqapvlviyrdsnrpsgiperfsgsnsgntatltisraqagdeadyycqvwdssta(seqidno:40)
iglv3-9*02
syeltqplsvsvalgqaaritcggnnlgyksvhwyqqkpgqapvlviyrdnnrpsgiperfsgsnsgntatltisraqagdeadyycqvwdsstahp(seqidno:41)
人源化抗体或其抗原结合部分可为表面重塑或cdr移植的抗体,或其抗原结合部分。
在另一个实施方案中,n末端丝氨酸或苏氨酸可经工程改造至蛋白质cba(例如抗体或其抗原结合部分)中。举例来说,所述抗体或其抗体结合部分可为本文所描述的本发明重组抗体中的任一种(参见下文)。
在某些实施方案中,n末端醛基是位于所述抗体或其抗原结合部分的一条或两条重链上,或所述抗体或其抗原结合部分的一条或两条轻链上,或其组合上。
在某些实施方案中,cba为抗体或其抗原结合部分。在某些实施方案中,抗原结合部分可为fab、f(ab)2、f(ab’)、f(ab’)2、f(ab’)3、fd、fv、二硫键连接的fv、dab或sdab(或纳米抗体)、cdr、scfv、(scfv)2、di-scfv、bi-scfv、tascfv(串联scfv)、avibody(例如双链抗体(diabody)、三链抗体(triabody)、四链抗体(tetrabody))、t细胞接合物(bite)、scfv-fc、fcab、mab2、小模块免疫药物(smip)、genmab/unibody或duobody、v-nar结构域、ignar、微型抗体、iggδch2、dvd-ig、probody、内抗体或多特异性抗体。在某些具体实施方案中,抗原结合部分可为单结构域抗体(sdab)或纳米抗体。
在某些实施方案中,cba为抗体模拟物,诸如darpin、centyrin、亲和体(affibody)、affilin、affitin、anticalin、avimer、fynomer、kunitz结构域肽、单抗体(或adnectin)、三链抗体或nanofitin。在某些具体实施方案中,cba为darpin。在其它具体实施方案中,cba为centyrin。在另一具体实施方案中,cba为单抗体或adnectin。在某些实施方案中,cba为双受体重靶向(dart)分子(p.a.moore等人,blood,2011;117(17):4542-4551;verimc等人,arthritisrheum.,2010年3月30日;62(7):1933-43;johnson,s等人,j.mol.biol.,2010apr9;399(3):436-49)或细胞穿透超荷电蛋白(methodsinenzymol.502,293-319(2012))。
在另一方面中,本发明提供一种重组抗体重链(hc)、轻链(lc)或其抗原结合部分,其包含具有seqidno:1的氨基酸序列的异源信号肽。
本发明的这一方面部分是基于意外地发现,seqidno:1,即抗体fr1-2.1的轻链信号肽可刚好在seqidno:1中最后一个ser之前天然地裂解,由此在所得到的加工多肽(例如,以seqidno:1作为信号肽表达的重组抗体重链(hc)、轻链(lc)或其抗原结合部分)中留下n末端丝氨酸。因此,seqidno:1的信号肽可与异源多肽(例如重组抗体重链(hc)、轻链(lc)或其抗原结合部分)重组融合,且用于通用方法中以产生具有n末端ser的多肽。
在某些实施方案中,异源信号肽是与重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列的n末端融合。
在某些实施方案中,异源信号肽是与重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列n末端的第2个氨基酸残基融合。因此,在该实施方案中,所述加工多肽因seqidno:1中的n末端ser而不具有一个额外的氨基酸残基。在其它相关实施方案中,异源信号肽是与重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列n末端部分的任何残基(例如第3个残基、第4个残基、第5个残基等)融合,引起一个或多个n末端残基的“缺失”,只要所述抗体或其抗原结合部分的结合能力基本上不受影响即可。或者或另外,可在n末端ser之后添加一个或多个另外的残基,只要n末端残基是ser,诸如来自seqidno:1最后一个残基的ser。
在一个相关方面中,本发明提供一种重组抗体重链(hc)、轻链(lc)或其抗原结合部分,其包含紧邻所述重链(hc)、轻链(lc)或其抗原结合部分的(天然)信号肽最后一个残基的c末端的ser或thr残基。此可通过紧接着所述天然信号肽的编码序列之后插入ser或thr的密码子来实现。举例来说,可在紧接着单株抗体humov19轻链或重链的天然信号肽序列之后插入ser残基,以产生序列mgwsciilflvatatgvhss(seqidno:42)。在天然信号肽序列的天然加工(裂解)之后,预期所得到的n末端残基为ser。
举例来说,在某些实施方案中,ser或thr残基可紧邻所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列第一个残基的n末端。
在另一个实施方案中,ser或thr残基置换所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列的一个或多个n末端氨基酸残基。或者或另外,可添加、缺失或置换另外的氨基酸残基,只要在信号肽加工后得到的多肽的第1个残基为ser/thr。
示例性重组抗体重链(hc)、轻链(lc)或其抗原结合部分可具有序列:seqidno:10或14。其它可包括包含seqidno:42的序列。
本发明的另一方面提供一种重组抗体,其包含源自于本文所描述的目标重组抗体重链(hc)、轻链(lc)或其抗原结合部分的重链、轻链或其抗原结合部分的成熟加工序列。
举例来说,所述重组抗体可为或可包含fab、f(ab)2、f(ab’)、f(ab’)2、f(ab’)3、fd、fv、二硫键连接的fv、dab或sdab(或纳米抗体)、cdr、scfv、(scfv)2、di-scfv、bi-scfv、tascfv(串联scfv)、avibody(例如双链抗体、三链抗体、四链抗体)、t细胞接合物(bite)、scfv-fc、fcab、mab2、小模块免疫药物(smip)、genmab/unibody或duobody、v-nar结构域、ignar、微型抗体、iggδch2、dvd-ig、probody、内抗体或多特异性抗体。在某些具体实施方案中,抗原结合部分可为单结构域抗体(sdab)或纳米抗体。
在某些实施方案中,所述重组抗体可包含1、2、3或4个各自源自于本文所描述的目标重组抗体重链(hc)、轻链(lc)或其抗原结合部分的重链、轻链或其抗原结合部分的成熟加工序列。
在某些实施方案中,所述重组抗体可为异二聚体抗体,其包含第一重链多肽和第二重链多肽,其中所述第一重链多肽的fc区和所述第二重链多肽的fc区在界面处接触,且所述第二重链多肽的fc区的界面包含凸起,所述凸起可定位于所述第一重链多肽fc区的界面中的空腔中。在某些实施方案中,可基于例如genentech/roche的crossmab技术,例如通过交换ch1和κ恒定区以进一步减少或消除轻链错配对来进一步改进结进孔(knob-into-hole)技术,所述技术用以促进双特异性抗体中重链的特异性配对。
或者,还可使用lc异二聚体,诸如zymeworksazymetrictm异二聚igg1轻链平台技术来达到类似结果,所述技术在开发完整双特异性抗体时完整地补充了多种其它生物方法,包括共有轻链、结构域抗体和单链形式。
在某些实施方案中,第二重链多肽的fc区已从模板/原始多肽改变以编码凸起,或第一重链多肽的fc区已从模板/原始多肽改变以编码空腔,或两者。
在某些实施方案中,所述凸起和所述空腔各自包含天然存在的氨基酸残基。
在某些实施方案中,构成凸起的第二重链多肽的fc区是通过用侧链体积大于原始残基的输入残基置换模板/原始多肽的界面中的原始残基来产生。
在某些实施方案中,构成凸起的第二重链多肽的fc区是通过以下方法产生,所述方法包括以下步骤,其中用编码侧链体积大于原始残基的输入残基的核酸置换编码所述多肽的界面中的原始残基的核酸。
本发明的另一方面提供一种经修饰抗体,其是由在重链、轻链或其抗原结合部分的成熟加工序列上具有n末端ser或thr的抗体氧化得到,其中在所述经修饰抗体中,所述n末端ser或thr已氧化成醛基。
在某些实施方案中,所述抗体是源自于重组抗体重链(hc)、轻链(lc)或其抗原结合部分,其包含:(1)具有seqidno:1的氨基酸序列的异源信号肽;(2)紧邻所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列第一个残基的n末端的ser或thr残基;或(3)置换所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列的一个或多个n末端氨基酸残基的ser或thr残基。
在某些实施方案中,所述抗体为包含seqidno:3的轻链序列的鼠类抗体或其抗原结合部分。
在某些实施方案中,所述抗体为包含seqidno:3的轻链序列的鼠类抗体或其抗原结合部分的嵌合抗体、人源化抗体或人类抗体,或其抗原结合部分。人源化抗体或其抗原结合部分可为表面重塑或cdr移植的抗体,或其抗原结合部分。
本发明的另一方面提供一种编码本文所描述的目标重组抗体重链(hc)、轻链(lc)或其抗原结合部分的多核苷酸。
在某些实施方案中,所述多核苷酸经密码子优化以在哺乳动物表达系统中表达。
本发明的另一方面提供一种产生目标重组抗体重链(hc)、轻链(lc)或其抗原结合部分的方法,所述方法包括在表达系统,诸如哺乳动物表达系统中表达本文所描述的目标多核苷酸。
如本文所使用,术语“细胞结合剂”或“cba”是指可结合细胞(例如,在细胞表面配体上)或结合与细胞相连或邻近细胞的配体(优选以一种特异性方式结合)的化合物。在某些实施方案中,与细胞或者细胞上或细胞附近的配体结合是特异性的。cba可包括肽和非肽。对于具有凸起性质的cba,如果天然n末端残基不为ser或thr,则可使用本文所描述的任何重组方法,例如通过使用seqidno:1的异源信号肽,或通过插入ser/thr密码子以编码n末端残基,对所述n末端残基进行工程改造。
适当细胞结合剂的选择是一个选择问题,其部分取决于欲靶向的特定细胞群,而在许多(但非全部)情形中,人源化单株抗体是良好的选择,如果适当抗体是可获得的。举例来说,单株抗体my9是特异性结合至cd33抗原的鼠类igg1抗体(j.d.griffin等人,leukemiares.,8:521(1984)),且在靶细胞表达cd33,如在急性骨髓性白血病(aml)中时可使用。
在某些实施方案中,细胞结合剂不为蛋白质。举例来说,在某些实施方案中,细胞结合剂可为结合至维生素受体(诸如细胞表面受体)的维生素。就此来说,维生素a结合至视黄醇结合蛋白(rbp),形成复合物,所述复合物又以高亲和力结合stra6受体且增加维生素a的摄入。在另一实施例中,叶酸/叶酸盐/维生素b9以高亲和力结合细胞表面叶酸受体(fr),例如frα。可使用叶酸或结合至frα的抗体靶向在卵巢肿瘤和其它肿瘤(包括过表达frα的实体肿瘤,包括非小细胞肺癌(nsclc))上表达的叶酸受体。此外,维生素d和其类似物结合至维生素d受体。
在其它实施方案中,细胞结合剂为一种蛋白质或多肽,或包含蛋白质或多肽的化合物,包括抗体、非抗体蛋白质或多肽。
举例来说,gm-csf,一种结合至骨髓细胞的配体/生长因子因子,可用作针对来自急性骨髓性白血病的患病细胞的细胞结合剂。结合至活化t细胞的il-2可用于预防移植物排斥反应,用于治疗和预防移植物抗宿主疾病,和用于治疗急性t细胞白血病。结合至黑素细胞的msh可用于治疗黑素瘤,如同可针对黑素瘤的抗体一般。表皮生长因子可用于靶向鳞状细胞癌,诸如肺和头颈部的鳞状细胞癌。生长抑素可用于靶向神经母细胞瘤和其它肿瘤类型。雌激素(或雌激素类似物)可用于靶向乳癌。雄激素(或雄激素类似物)可用于靶向睾丸。
因此,在某些实施方案中,细胞结合剂可为淋巴因子、激素、生长因子、集落刺激因子或养分转运分子。
在某些实施方案中,细胞结合剂为抗体模拟物,诸如锚蛋白重复序列蛋白、centyrin、或adnectin/单抗体。
在其它实施方案中,细胞结合剂为抗体、单链抗体、特异性结合至靶细胞的抗体片段、单株抗体、单链单株抗体、特异性结合至靶细胞的单株抗体片段(或“抗原结合部分”)、嵌合抗体、特异性结合至靶细胞的嵌合抗体片段(“抗原结合部分”)、结构域抗体(例如sdab),或特异性结合至靶细胞的结构域抗体片段。在某些实施方案中,细胞结合剂为人源化抗体、人源化单链抗体或人源化抗体片段(或“抗原结合部分”)。
在另一个实施方案中,细胞结合剂为抗cd33抗体或其片段,诸如美国专利号7,557,189、7,342,110、8,119,787和8,337,855以及wo2004/043344(以引用的方式并入本文中)中所描述的抗体或其片段。在一具体实施方案中,人源化抗体为humy9-6或另一相关抗体,如美国专利号7,342,110和7,557,189中所描述。在另一个实施方案中,抗cd33抗体为humy9-6抗体。
如本文所使用,带双下划线的序列表示重链或轻链序列的可变区(即,重链可变区或hcvr,和轻链可变区或lcvr),而粗体序列表示cdr区(即,从n末端至c末端,分别为重链或轻链序列的cdr1、cdr2和cdr3)。
在一个实施方案中,抗cd33抗体包含具有氨基酸序列
在另一个实施方案中,抗cd33抗体包含seqidno:43的重链cdr1-cdr3,和/或seqidno:44的轻链cdr1-cdr3,且优选特异性结合cd33。
在另一个实施方案中,抗cd33抗体包含与seqidno:43具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:44具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合cd33。
在另一具体实施方案中,人源化抗体为本文所描述的抗叶酸受体抗体。在另一具体实施方案中,所述抗体为美国专利号8,577,966中所描述的抗叶酸受体抗体。更具体地,抗叶酸受体抗体为特异性结合人叶酸受体1的人源化抗体或其抗原结合片段。除非另外指示,否则如本文所使用,术语“人叶酸受体1”、“folr1”或“叶酸受体α(fr-α)”是指任何天然人folr1。因此,所有这些术语均可指如本文所指示的蛋白质或核酸序列。术语“folr1”涵盖“全长”未加工的folr1以及由在细胞内加工得到的任何folr1形式。folr1抗体包含:(a)包含gyfmn(seqidno:45)的重链cdr1、包含rihpydgdtfynqxaa1fxaa2xaa3(seqidno:46)的重链cdr2,和包含ydgsramdy(seqidno:47)的重链cdr3;和(b)包含kasqsvsfagtslmh(seqidno:48)的轻链cdr1、包含rasnlea(seqidno:49)的轻链cdr2,和包含qqsreypyt(seqidno:50)的轻链cdr3;其中xaa1选自k、q、h和r;xaa2选自q、h、n和r;且xaa3选自g、e、t、s、a和v。优选地,重链cdr2序列包含rihpydgdtfynqkfqg(seqidno:51)。
在另一个实施方案中,抗叶酸受体抗体为特异性结合人叶酸受体1的人源化抗体或其抗原结合片段,其包含具有氨基酸序列qvqlvqsgaevvkpgasvkisckasgytft
在另一个实施方案中,抗叶酸受体抗体是由2010年4月7日保藏在atcc且atcc保藏号为pta-10772和pta-10773或pta-10774的质粒dna编码的人源化抗体或其抗原结合片段。
在另一个实施方案中,抗叶酸受体抗体为特异性结合人叶酸受体1的人源化抗体或其抗原结合片段,其包含具有氨基酸序列divltqsplslavslgqpaiisc
在另一个实施方案中,抗叶酸受体抗体为特异性结合人叶酸受体1的人源化抗体或其抗原结合片段,其包含具有氨基酸序列seqidno:52的重链,和具有氨基酸序列seqidno:53或seqidno:54的轻链。优选地,所述抗体包含具有氨基酸序列seqidno:52的重链和具有氨基酸序列seqidno:54的轻链(hufolr1)。
在另一个实施方案中,抗叶酸抗体是由2010年4月7日保藏在atcc且atcc保藏号为pta-10772和pta-10773或10774的质粒dna编码的人源化抗体或其抗原结合片段。
在另一个实施方案中,抗叶酸受体抗体是特异性结合人叶酸受体1且包含与qvqlvqsgaevvkpgasvkisckasgytftgyfmnwvkqspgqslewigrihpydgdtfynqkfqgkatltvdkssntahmellsltsedfavyyctrydgsramdywgqgttvtvss(seqidno:55)具有至少约90%、95%、99%或100%同一性的重链可变结构域,和与divltqsplslavslgqpaiisckasqsvsfagtslmhwyhqkpgqqprlliyrasnleagvpdrfsgsgsktdftlnispveaedaatyycqqsreypytfgggtkleikr(seqidno:56)或divltqsplslavslgqpaiisckasqsvsfagtslmhwyhqkpgqqprlliyrasnleagvpdrfsgsgsktdftltispveaedaatyycqqsreypytfgggtkleikr(seqidno:57)具有至少约90%、95%、99%或100%同一性的轻链可变结构域的人源化抗体或其抗原结合片段。
在另一个实施方案中,抗叶酸受体抗体为humov19或m9346a(参见例如,美国专利号8,709,432、美国专利号8,557,966,和wo2011106528,均以引用的方式并入本文中)。
在某些实施方案中,人源化抗体为美国专利号8,765,917中所描述的抗cd37抗体(例如抗cd37-3)。在另一个实施方案中,细胞结合剂为抗cd37抗体或其抗原结合片段,如美国专利号8,765,917和wo2011/112978(以引用的方式并入本文中)中所描述的那些。在一个实施方案中,抗cd37抗体为hucd37-3抗体。
在一个实施方案中,抗cd37抗体包含具有氨基酸序列
在另一个实施方案中,抗cd37抗体包含具有seqidno:58中陈述的氨基酸序列的免疫球蛋白轻链区,和具有seqidno:59中陈述的氨基酸序列的免疫球蛋白重链区。
在另一个实施方案中,抗cd37抗体包含具有seqidno:58中陈述的氨基酸序列的免疫球蛋白轻链区,和具有seqidno:60中陈述的氨基酸序列的免疫球蛋白重链区。
在另一个实施方案中,抗cd37抗体包含seqidno:59或60的重链cdr1-cdr3,和/或seqidno:58的轻链cdr1-cdr3,且优选特异性结合cd37。
在另一个实施方案中,抗cd37抗体包含与seqidno:59或60具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:58具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合cd37。
在另一个实施方案中,抗cd37抗体包含具有氨基酸序列
在另一个实施方案中,抗cd37抗体包含seqidno:62的重链cdr1-cdr3,和/或seqidno:61的轻链cdr1-cdr3,且优选特异性结合cd37。
在另一个实施方案中,抗cd37抗体包含与seqidno:62具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:61具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合cd37。
在另一个实施方案中,抗cd37抗体为hucd37-50抗体。
在某些实施方案中,人源化抗体为美国专利号8,790,649中所描述的抗egfr抗体。在另一个实施方案中,所述抗体为抗egfr抗体。在一个实施方案中,所述抗egfr抗体为非拮抗剂抗体,包括例如wo2012058592(以引用的方式并入本文中)中所描述的抗体。在另一个实施方案中,抗egfr抗体为非功能性抗体,例如人源化ml66或egfr-8。更具体地,抗egfr抗体为huml66。所有这些申请的教示内容以引用的方式整体并入本文中。
在另一个实施方案中,抗egfr抗体包含具有氨基酸序列seqidno:63的重链和具有氨基酸序列seqidno:64的轻链。
在另一个实施方案中,抗egfr抗体包含seqidno:63的重链cdr1-cdr3,和/或seqidno:64的轻链cdr1-cdr3,且优选特异性结合egfr。
在另一个实施方案中,抗egfr抗体包含与seqidno:63具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:64具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合egfr。
在另一个实施方案中,抗egfr抗体为8,790,649和wo2012/058588(以引用的方式并入本文中)所描述的抗体。在一个实施方案中,抗egfr抗体为huegfr-7r抗体。
在一个实施方案中,抗egfr抗体包含具有氨基酸序列
在另一个实施方案中,抗egfr抗体包含具有seqidno:65中陈述的氨基酸序列的免疫球蛋白重链区,和具有seqidno:66中陈述的氨基酸序列的免疫球蛋白轻链区。
在另一个实施方案中,抗egfr抗体包含具有seqidno:65中陈述的氨基酸序列的免疫球蛋白重链区,和具有seqidno:67中陈述的氨基酸序列的免疫球蛋白轻链区。
在另一个实施方案中,抗egfr抗体包含seqidno:65的重链cdr1-cdr3,和/或seqidno:66或67的轻链cdr1-cdr3,且优选特异性结合egfr。
在另一个实施方案中,抗egfr抗体包含与seqidno:65具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:66或67具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合egfr。
在另一个实施方案中,细胞结合剂为抗cd19抗体,诸如美国专利号8,435,528和wo2004/103272(以引用的方式并入本文中)中所描述的那些。在一个实施方案中,抗cd19抗体包含具有氨基酸序列qvqlvqpgaevvkpgasvklscktsgytft
在另一个实施方案中,抗cd19抗体为hub4抗体。
在另一个实施方案中,抗cd19抗体包含seqidno:68的重链cdr1-cdr3,和/或seqidno:69的轻链cdr1-cdr3,且优选特异性结合cd19。
在另一个实施方案中,抗cd19抗体包含与seqidno:68具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:69具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合cd19。
在另一个实施方案中,细胞结合剂为抗muc1抗体,诸如美国专利号7,834,155、wo2005/009369和wo2007/024222(以引用的方式并入本文中)中所描述的那些。在一个实施方案中,抗muc1抗体包含具有氨基酸序列
在另一个实施方案中,抗muc1抗体为huds6抗体。
在另一个实施方案中,抗muc1抗体包含seqidno:70的重链cdr1-cdr3,和/或seqidno:71的轻链cdr1-cdr3,且优选特异性结合muc1。
在另一个实施方案中,抗muc1抗体包含与seqidno:70具有至少约90%、95%、97%、99%或100%同一性的重链可变区(hcvr)序列,和/或与seqidno:71具有至少约90%、95%、97%、99%或100%同一性的轻链可变区(lcvr)序列,且优选特异性结合muc1。
在某些实施方案中,细胞结合剂为表面重塑的抗体、表面重塑的单链抗体、表面重塑的抗体片段(或“抗原结合部分”)或双特异性抗体。
在某些实施方案中,细胞结合剂为微型抗体、avibody、双链抗体、三链抗体、四链抗体、纳米抗体、probody、结构域抗体或unibody。
换句话说,示例性细胞结合剂可包括抗体、单链抗体、特异性结合至靶细胞的抗体片段、单株抗体、单链单株抗体、特异性结合至靶细胞的单株抗体片段、嵌合抗体、特异性结合至靶细胞的嵌合抗体片段、双特异性抗体、结构域抗体、特异性结合至靶细胞的结构域抗体片段、干扰素、淋巴因子(例如il-2、il-3、il-4和il-6)、激素(例如胰岛素、促甲状腺激素释放激素、黑素细胞刺激激素和类固醇激素(例如雄激素和雌激素))、维生素(例如叶酸)、生长因子(例如egf、tgf-α、fgf、vegf)、集落刺激因子、养分转运分子(例如转铁蛋白;参见o'keefe等人(1985)j.biol.chem.260:932-937,以引用的方式并入本文中)、centyrin(基于iii型纤维连接蛋白(fn3)重复序列的共同序列的蛋白质支架;参见美国专利公开案2010/0255056、2010/0216708和2011/0274623,以引用的方式并入本文中)、锚蛋白重复序列蛋白(例如经设计的锚蛋白重复序列蛋白,称为darpin;参见美国专利公开案号2004/0132028、2009/0082274、2011/0118146和2011/0224100,以引用的方式并入本文中;且另参见c.zahnd等人,cancerres.(2010)70:1595-1605;zahnd等人,j.biol.chem.(2006)281(46):35167-35175;和binz,h.k.,amstutz,p.&pluckthun,a.,naturebiotechnology(2005)23:1257-1268,以引用的方式并入本文中)、锚蛋白样重复序列蛋白或合成肽(参见例如,参见美国专利公开案号2007/0238667;美国专利号7,101,675;wo2007/147213;和wo2007/062466,以引用的方式并入本文中)、adnectin(纤维连接蛋白结构域支架蛋白;参见美国专利公开案号2007/0082365、2008/0139791,以引用的方式并入本文中)、avibody(包括双链抗体、三链抗体和四链抗体;参见美国公开案号2008/0152586和2012/0171115),和其它细胞结合分子或物质。
在某些实施方案中,细胞结合剂可为结合至靶细胞上的部分(诸如细胞表面受体)的配体。举例来说,所述配体可为生长因子或其结合至生长因子受体的片段,或可为细胞因子或其结合至细胞因子受体的片段。在某些实施方案中,所述生长因子受体或细胞因子受体为细胞表面受体。
在细胞结合剂为抗体或其抗原结合部分(包括抗体衍生物),或某些抗体模拟物的某些实施方案中,cba可结合至靶细胞上的配体,诸如细胞表面配体,包括细胞表面受体。
具体示例性抗原或配体可包括肾素;生长激素(例如人生长激素和牛生长激素);生长激素释放因子;副甲状腺激素;促甲状腺激素;脂蛋白;α-1-抗胰蛋白酶;胰岛素a链;胰岛素b链;胰岛素原;促卵泡激素;降钙素;促黄体激素;胰高血糖素;凝血因子(例如因子vmc、因子ix、组织因子和血管性血友病因子);抗凝血因子(例如蛋白质c);心房利钠因子;肺表面活性物质;纤溶酶原活化物(例如尿激酶、人尿或组织型纤溶酶原活化物);蛙皮素;凝血酶;造血生长因子;肿瘤坏死因子-α和肿瘤坏死因子-β;脑啡肽酶;rantes(即,正常t细胞表达和分泌的活性调控蛋白);人巨噬细胞炎性蛋白-1-α;血清白蛋白(人血清白蛋白);苗勒抑制物质(muellerian-inhibitingsubstance);松弛素a链;松弛素b链;松弛素原;小鼠促性腺激素相关肽;微生物蛋白(β-内酰胺酶);dna酶;ige;细胞毒性t-淋巴细胞相关抗原(例如ctla-4);抑制素;活化素;血管内皮生长因子;激素或生长因子受体;蛋白质a或d;类风湿因子;神经营养因子(例如骨源性神经营养因子、神经营养素-3、神经营养素-4、神经营养素-5或神经营养素-6)、神经生长因子(例如ngf-β);血小板源性生长因子;纤维母细胞生长因子(例如afgf和bfgf);纤维母细胞生长因子受体2;表皮生长因子;转化生长因子(例如tgf-α、tgf-β1、tgf-β2、tgf-β3、tgf-β4和tgf-β5);胰岛素样生长因子-i和胰岛素样生长因子-ii;des(1-3)-igf-i(脑igf-i);胰岛素样生长因子结合蛋白;黑素转铁蛋白;epcam;gd3;flt3;psma;psca;muc1;muc16;steap;cea;tenb2;epha受体;ephb受体;叶酸受体;folr1;间皮素;cripto;αvβ6;整合素;vegf;vegfr;egfr;转铁蛋白受体;irta1;irta2;irta3;irta4;irta5;cd蛋白(例如cd2、cd3、cd4、cd5、cd6、cd8、cd11、cd14、cd19、cd20、cd21、cd22、cd25、cd26、cd28、cd30、cd33、cd36、cd37、cd38、cd40、cd44、cd52、cd55、cd56、cd59、cd70、cd79、cd80、cd81、cd103、cd105、cd123、cd134、cd137、cd138和cd152)、一种或多种肿瘤相关抗原或细胞表面受体(参见美国公开案号20080171040或美国公开案号20080305044,以引用的方式整体并入);红细胞生成素;骨诱导因子;免疫毒素;骨形态发生蛋白;干扰素(例如干扰素-α、干扰素-β和干扰素-γ);集落刺激因子(例如m-csf、gm-csf和g-csf);介白素(例如il-1至il-10);超氧化物歧化酶;t细胞受体;表面膜蛋白;衰变加速因子;病毒抗原(例如hiv包膜蛋白的一部分);转运蛋白、归巢受体;地址素;调控蛋白;整合素(例如cd11a、cd11b、cd11c、cd18、icam、vla-4和vcam);肿瘤相关抗原(例如her2、her3和her4受体);内皮素;c-met;c-kit;1gf1r;psgr;ngep;psma;psca;tmeff2;lgr5;b7h4;和以上所列多肽中任一种的片段。
如本文所使用,术语“抗体”包括免疫球蛋白(ig)分子。在某些实施方案中,所述抗体为全长抗体,其包含四条多肽链,即,通过二硫键互连的两条重链(hc)和两条轻链(lc)。每一重链包含重链可变区(hcvr或vh)和重链恒定区(ch)。重链恒定区包含三个结构域,即ch1、ch2和ch3。每一轻链包含轻链可变区(lcvr或vl)和轻链恒定区(cl),所述轻链恒定区包含一个结构域,即cl。vh区和vl区可进一步细分为高变区,称为互补决定区(cdr)。在所述区域中间杂有保守性较强的构架区(fr)。每一vh和vl是由从氨基末端至羧基末端按以下次序排列的三个cdr和四个fr构成:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
在某些实施方案中,所述抗体为igg、iga、ige、igd或igm。在某些实施方案中,所述抗体为igg1、igg2、igg3或igg4;或iga1或iga2。
在某些实施方案中,细胞结合剂为单株抗体的“抗原结合部分”,其共有对于抗原与抗体结合至关重要的序列(诸如美国专利号7,342,110和7,557,189中所描述的humy9-6或其相关抗体,这些专利以引用的方式并入本文中)。
如本文所使用,术语抗体的“抗原结合部分”(或有时可互换称为“抗体片段”)包括抗体的保持特异性结合至抗原的能力的一个或多个片段。经证实,抗体的抗原结合功能可由全长抗体的某些片段执行。术语抗体的“抗原结合部分”内所涵盖的结合片段的实例包括(但不限于):(i)fab片段,一种由vl、vh、cl和ch1结构域组成的单价片段(例如,由木瓜蛋白酶消化的抗体得到三个片段:两个抗原结合fab片段,和一个不结合抗原的fc片段);(ii)f(ab’)2片段,一种包含在铰链区通过二硫桥连接的两个fab片段的二价片段(例如,由胃蛋白酶消化的抗体得到两个片段:二价抗原结合f(ab’)2片段,和不结合抗原的pfc’片段)和其相关f(ab’)单价单元;(iii)由vh和ch1结构域组成的fd片段(即,重链中包括在fab中的部分);(iv)由抗体单一臂的vl和vh结构域组成的fv片段,和相关二硫键连接的fv;(v)dab(结构域抗体)或sdab(单结构域抗体)片段(ward等人,nature341:544-546,1989),其由vh结构域组成;和(vi)分离的互补决定区(cdr)。在某些实施方案中,所述抗原结合部分为sdab(单结构域抗体)。
在某些实施方案中,抗原结合部分还包括某些工程改造或重组的衍生物(或“衍生物抗体”),所述衍生物除可能未见于天然存在的抗体中的组件或序列外,还包括抗体中保持特异性结合至抗原的能力的一个或多个片段。
举例来说,尽管fv片段的两个结构域vl和vh是由独立基因编码,但其可使用重组法由合成接头接合,所述接头能够使其制造成vl区与vh区配对形成单价分子的单一蛋白链(称为单链fv(scfv);参见例如,bird等人,science242:423-426,1988;和huston等人,proc.natl.acad.sci.usa85:5879-5883,1988)。
在本文所描述的所有实施方案中,scfv的n末端可为vh结构域(即,n-vh-vl-c)或vl结构域(即,n-vl-vh-c)。
二价(或双价)单链可变片段(di-scfv、bi-scfv)可通过连接两个scfv进行工程改造。由此产生具有两个vh区和两个vl区的单一肽链,得到串联scfv(tascfv)。可通过以头至尾的方式连接三个或更多个scfv,类似地产生更多串联重复序列,诸如tri-scfv。
在某些实施方案中,scfv可经由连接肽连接,所述连接肽过短(约五个氨基酸)而无法使两个可变区折叠在一起,迫使scfv二聚合,并形成双链抗体(参见例如,holliger等人,proc.natl.acad.sci.usa90:6444-6448,1993;poljak等人,structure2:1121-1123,1994)。双链抗体可为双特异性或单特异性的。经证实,双链抗体的解离常数比相应scfv低40倍,即对于靶具有高得多的亲和力。
此外,较短的接头(一个或两个氨基酸)导致形成三聚体,或所谓的三链抗体(triabody/tribody)。四链抗体还以类似的方式产生。其对其靶的亲和力甚至高于双链抗体。双链抗体、三链抗体和四链抗体有时统称为“avibodytm”细胞结合剂(或简称为“avibody”)。即,具有两个、三个或四个靶结合区(tbr)的avibody常称为双链抗体、三链抗体和四链抗体。有关详情,参见例如,美国公开案号2008/0152586和2012/0171115,其完整教示内容以引用的方式并入本文中。
所有这些形式均可由对两种或更多种不同抗原具有特异性的可变片段构成,在此情形中,其为双特异性或多特异性抗体类型。举例来说,某些双特异性串联di-scfv称为双特异性t细胞接合物(bite)。
在某些实施方案中,串联scfv或双链抗体/三链抗体/四链抗体中的每个scfv可具有相同或不同的结合特异性,且各自可独立地具有n末端vh或n末端vl。
单链fv(scfv)还可与fc部分,诸如人iggfc部分融合以获得类igg特性,但尽管如此,其仍由单一基因编码。由于此类scfv-fc蛋白质在哺乳动物体内的短暂产生可易于达到毫克量,故此衍生物抗体形式特别适合于许多研究应用。
fcab为由抗体的fc恒定区工程改造的抗体片段。fcab可表达为可溶性蛋白质,或其可重新工程改造成全长抗体,诸如igg,由此产生mab2。mab2是fcab代替正常fc区的全长抗体。利用这些另外的结合位点,mab2双特异性单株抗体可同时结合两种不同靶。
在某些实施方案中,所述工程改造的抗体衍生物具有减小的大小的抗原结合ig源性重组蛋白(“微型化”的完整大小mab),其是通过移除认为对功能不重要的结构域而产生。一个最佳实例为smip。
小模块免疫药物或smip是主要由抗体(免疫球蛋白)的部分构建的人工蛋白质且拟用作药物。smip具有与抗体类似的生物半衰期,但小于抗体,且因此可具有更佳的组织渗透特性。smip是包含一个结合区、作为接头的一个铰链区和一个效应子结构域的单链蛋白质。所述结合区包含经修饰的单链可变片段(scfv),且所述蛋白质的其余部分可由抗体(诸如igg1)的fc(诸如ch2和作为效应子结构域的ch3)和铰链区构造。经遗传修饰的细胞产生呈抗体样二聚体形式的smip,其比实际抗体小约30%。
此类工程改造的微型化抗体的另一实例为“unibody”,其中铰链区已自igg4分子移除。igg4分子不稳定且可彼此交换轻链-重链异二聚体。铰链区的缺失防止重链-重链完全配对,留下高度特异性的单价轻链/重链异二聚体,同时保持fc区以确保体内稳定性和半衰期。
单结构域抗体(sdab,包括但不限于ablynx称为纳米抗体的那些抗体)是由单一单体可变抗体结构域组成的抗体片段。与完整抗体相同,其能够选择性结合至特定抗原,但由于其分子量仅为12-15kda而小得多。在某些实施方案中,单结构域抗体是由重链抗体(hcigg)工程改造得到。首例此类sdab是基于在骆驼中发现的hcigg工程改造得到,称为vhh片段。在某些实施方案中,单结构域抗体是使用vnar片段,由ignar(“免疫球蛋白新抗原受体”,参见下文)工程改造得到。软骨鱼类(诸如鲨鱼)具有此类重链ignar抗体。在某些实施方案中,sdab是通过将来自常见免疫球蛋白g(igg),诸如来自人或小鼠的免疫球蛋白g的二聚体可变结构域分离成单体来进行工程改造。在某些实施方案中,纳米抗体是衍生自重链可变结构域。在某些实施方案中,纳米抗体是衍生自轻链可变结构域。在某些实施方案中,sdab是通过针对与靶抗原的结合筛选单结构域重链序列(例如人单结构域hc)文库来获得。
单一可变新抗原受体结构域抗体片段(vnar,或vnar结构域)是衍生自软骨鱼类(例如鲨鱼)免疫球蛋白新抗原受体抗体(ignar)。作为已知最小的基于免疫球蛋白的蛋白质支架之一,此类单结构域蛋白质展现出有利的大小和隐蔽表位识别特性。成熟ignar抗体由一个可变新抗原受体(vnar)结构域和五个恒定新抗原受体(cnar)结构域的同二聚体组成。此分子具有高度稳定性,且具有高效的结合特征。其固有稳定性可能归因于(i)潜在的ig支架,相较于鼠类抗体中所见的常规抗体vh和vl结构域,其呈现相当大数量的带电荷和亲水性表面暴露残基;和(ii)使包括环间二硫桥和环内氢键模式在内的互补决定区(cdr)环中的结构特征稳定。
微型抗体是包含连接至ch结构域,诸如ch3γ1(igg1的ch3结构域)或ch4ε(ige的ch4结构域)的scfv的工程改造的抗体片段。举例来说,癌胚抗原(cea)特异性scfv连接至ch3γ1,产生微型抗体,先前已证实,其结合体内快速清除作用而具有优良的肿瘤靶向性(hu等人,cancerres.56:3055–3061,1996)。scfv可具有n末端vh或vl。连接可为产生非共价、无铰链的微型抗体的短肽(例如,两个氨基酸的接头,诸如valglu)。或者,所述连接可为产生共价、铰链-微型抗体的igg1铰链和glyser连接肽。
天然抗体为单特异性但二价的,因为其表达两个相同的抗原结合结构域。相比之下,在某些实施方案中,某些工程改造的抗体衍生物为双特异性或多特异性分子,其具有两个或更多个不同的抗原结合结构域,各自具有不同的靶特异性。双特异性抗体可通过融合两个抗体产生细胞来产生,其各自具有不同的特异性。这些“四源杂交瘤”产生多种分子物质,因为两个不同的轻链与两个不同的重链在四源杂交瘤中以多种构型自由重组。自此,已使用多种技术(参见上文)产生双特异性fab、scfvs和完整大小的mab。
双可变结构域免疫球蛋白(dvd-ig)是一类同时靶向两个抗原/表位的双特异性igg(digiammarino等人,methodsmolbiol.899:145-56,2012)。所述分子含有fc区和恒定区,其构型类似于常规igg。然而,dvd-ig蛋白的独特性在于,所述分子的每个臂均含有两个可变结构域(vd)。一个臂内的vd是串联连接且可具有不同结合特异性。
还可通过例如表达具有两个不同fab和一个fc的双特异性抗体来产生三特异性抗体衍生物分子。一个实例为小鼠igg2a抗ep-cam、大鼠igg2b抗cd3四源杂交瘤(称为biuii),其被认为容许表达ep-cam的肿瘤细胞、表达cd3的t细胞和表达fcγri的巨噬细胞共定位,由此增强免疫细胞的共刺激和抗肿瘤功能。
probody为在健康组织中保持惰性,但在疾病环境中特异性活化(例如,经由疾病环境中富集或特有的蛋白酶的蛋白酶裂解)的完全重组的经掩蔽单株抗体。参见desnoyers等人,sci.transl.med.,5:207ra144,2013。可对本文所描述的任何抗体或其抗原结合部分使用类似掩蔽技术。
内抗体是经修饰以在细胞内定位,在细胞内作用以结合至细胞内抗原的抗体。内抗体可保留在细胞质中,或可具有核定位信号,或可具有供er靶向的kdel序列。内抗体可为单链抗体(scfv)、具有超稳定性的经修饰免疫球蛋白vl结构域、选择的对还原性较强的细胞内环境具有抗性的抗体,或以与麦芽糖结合蛋白或其它稳定细胞内蛋白质的融合蛋白形式表达。此类优化使内抗体的稳定性和结构得到改善,且可大体上适用于本文所描述的任何抗体或其抗原结合部分。
本发明的抗原结合部分或衍生物抗体与衍生/工程改造得到其的抗体相比较,可具有基本上相同或同一的(1)轻链和/或重链cdr3区;(2)轻链和/或重链cdr1、cdr2和cdr3区;或(3)轻链和/或重链区。在这些区域内的序列可含有保守性氨基酸取代,包括在cdr区内的取代。在某些实施方案中,存在不超过1、2、3、4或5个保守性取代。在一个替代方案中,所述抗原结合部分或衍生物抗体具有与衍生/工程改造得到其的抗体至少约90%、95%、99%或100%同一的轻链区和/或重链区。相较于所述抗体,这些抗原结合部分或衍生物抗体可对靶抗原具有基本上相同的特异性和/或亲和力。在某些实施方案中,所述抗原结合部分或衍生物抗体的kd和/或koff值在本文所描述的抗体的10倍(更高或更低)、5倍(更高或更低)、3倍(更高或更低)或2倍(更高或更低)内。
在某些实施方案中,所述抗原结合部分或衍生物抗体可衍生自/工程改造自完全人类抗体、人源化抗体或嵌合抗体,且可根据任何技术认可的方法制备。
单株抗体技术允许产生特异性极高的呈特异性单株抗体形式的细胞结合剂。本领域中尤其熟知的是通过用所关注的抗原,诸如完整靶细胞、从靶细胞分离的抗原、完整病毒、减毒的完整病毒和病毒蛋白(诸如病毒外壳蛋白)使小鼠、大鼠、仓鼠或任何其它哺乳动物免疫来产生单株抗体的技术。还可使用敏化的人类细胞。产生单株抗体的另一方法是使用scfv(单链可变区),尤其是人scfv的噬菌体文库(参见例如,美国专利号5,885,793和5,969,108;mccafferty等人,wo92/01047;liming等人,wo99/06587)。此外,还可使用美国专利号5,639,641中所公开的表面重塑抗体,以及嵌合抗体和人源化抗体。
细胞结合剂还可为由噬菌体呈现技术(参见例如,wang等人,proc.natl.acad.sci.usa(2011)108(17),6909-6914)或肽文库技术(参见例如,dane等人,mol.cancer.ther.(2009)8(5):1312-1318)得到的肽。
在某些实施方案中,本发明的cba还包括抗体模拟物,诸如darpin、亲和体、affilin、affitin、anticalin、avimer、fynomer、kunitz结构域肽、单抗体或nanofitin。
如本文所使用,术语“darpin”和“(经设计)锚蛋白重复序列蛋白”可互换使用,指典型地展现优先(有时特异性)靶结合的某些遗传工程改造的抗体仿真蛋白。所述靶可为蛋白质、碳水化合物或其它化学实体,且结合亲和力可相当高。darpin可衍生自含天然锚蛋白重复序列的蛋白质,且优选由这些蛋白质的至少三个、通常四个或五个锚蛋白重复基元(典型地,每一锚蛋白重复基元中约33个残基)组成。在某些实施方案中,darpin含有约四个或五个重复序列,且分子质量可分别为约14或18kda。可在dna层面上,使用多种技术,诸如核糖体呈现或信号识别颗粒(srp)噬菌体呈现来产生具有随机化潜在靶相互作用残基和超过1012个变异体的多样性的darpin文库,以用于选择以皮摩尔浓度的亲和力和特异性结合所希望靶的darpin(例如,充当受体促效剂或拮抗剂、反促效剂、酶抑制剂或简单的靶蛋白结合剂)。有关darpin制备,参见例如美国专利公开案号2004/0132028、2009/0082274、2011/0118146和2011/0224100;wo02/20565和wo06/083275(其完整教示内容以引用的方式并入本文中),且另参见c.zahnd等人(2010)cancerres.,70:1595-1605;zahnd等人(2006)j.biol.chem.,281(46):35167-35175;和binz,h.k.,amstutz,p.&pluckthun,a.(2005)naturebiotechnology,23:1257-1268(皆以引用的方式并入本文中)。有关相关锚蛋白样重复序列蛋白或合成肽,另参见美国专利公开案号2007/0238667;美国专利号7,101,675;wo2007/147213;和wo2007/062466(其完整教示内容以引用的方式并入本文中)。
亲和体分子是工程改造成以高亲和力结合至大量靶蛋白或肽,由此模拟单株抗体的小蛋白质。亲和体由含58个氨基酸的三个α螺旋组成且摩尔质量为约6kda。经证实,其可经受住高温(90℃)或酸性和碱性条件(ph2.5或ph11),且已通过原生文库选择获得亲和力低至亚纳摩尔浓度范围的结合剂,且已在亲和力成熟后获得具有皮摩尔浓度亲和力的结合剂。在某些实施方案中,亲和体与弱亲电子试剂缀合以共价结合至靶。
单抗体(又称为adnectin)是能够结合至抗原的遗传工程改造的抗体仿真蛋白。在某些实施方案中,单抗体由94个氨基酸组成且分子质量为约10kda。其是基于人纤连蛋白的结构,更具体地基于其iii型第十个细胞外结构域,其结构类似于抗体可变结构域,具有形成桶状的七个β折叠且在每一侧上具有对应于三个互补决定区的三个暴露的环。可通过修饰环bc(在第二个β折叠与第三个β折叠之间)和fg(在第六个折叠与第七个折叠之间)来定制对不同蛋白质具有特异性的单抗体。
三链抗体是基于小鼠和人软骨基质蛋白(cmp)的c末端卷曲螺旋区设计的自组装抗体模拟物,其自组装成为平行的三聚体复合物。其是通过使特定靶结合部分与衍生自cmp的三聚化结构域融合而产生的高度稳定的三聚体靶向配体。所得融合蛋白可高效地自组装成为充分确定的具有高稳定性的平行同源三聚体。关于所述三聚体靶向配体的表面电浆共振(spr)分析证实相较于相应单体明显增强的靶结合强度。细胞结合研究确定,此类三链抗体对于其对应受体具有优良结合强度。
centyrin是可使用基于共同fn3结构域序列的构架构建的文库获得的另一抗体模拟物(diem等人,proteineng.des.sel.,2014)。所述文库采用fn3结构域的c链、cd环、f链和fg环内的各种位置,且可针对特定靶选择高亲和力centyrin变异体。
用于引入n末端ser/thr且随后氧化得到醛基以与醛反应性基团反应的所有方法均适用于作为抗体和不为抗体的细胞结合剂,包括例如,centyrin、darpin、avibody、adnectin、抗体片段、微型抗体、双链抗体、三链抗体、四链抗体、纳米抗体、probody、duobody、结构域抗体或unibody等。
以下某些实例提及各种人源化抗cd123抗体,此类抗体的命名法在此简要描述。一类hucd123-6抗体是通过移植来自鼠类抗cd123抗体mucd123-6的重链和轻链的6个cdr进行人源化。在所述抗体中,字母“g”紧接着克隆名称(即,hucd123-6)之后,所述克隆名称又继之以版本号,其指定人轻链和重链可变区序列的起源。因此,hucd123-6gv4.6是指基于将来自相应mucdr123-6抗体的6个cdr区移植(“g”)至人轻链可变区gv4和重链可变区gv6上的人源化cd123抗体。类似地,-gv4.7包含人轻链可变区gv4和重链可变区gv7。
另一类hucd123-6抗体是借助于表面重塑进行人源化。具有表面重塑的重链序列hucd123-6rhv1.1和表面重塑的轻链序列hucd123-6rlv1.0的表面重塑抗体为hucd123-6rv1.1。
如本文所使用,nts#2或简称“s2”是指在重链n末端处具有工程改造的ser的抗体。因此,hucd123-6gv4.7抗体的s2变异体称为hucd123-6gv4.7s2。同样,nts#3或简称“s3”是指在轻链n末端处具有工程改造的ser的抗体。hucd123-6gv4.7抗体的s3变异体称为hucd123-6gv4.7s3。
当包含工程改造的n末端ser(s2或s3)的抗体经由氧化的n末端ser与细胞毒性药物/细胞毒性剂缀合时,所述缀合物的名称可含有“serimab”名称。举例来说,hucd123-6gv4.7s3-serimab-d8是指d8(有关d8或sd8结构,参见图17)与人源化cd123抗体hucd123-6gv4.7s3之间经由轻链上经氧化的n末端ser形成的缀合物。
应注意,实施例23-30,以及图17、18、22a-24、26a-26c和29中所使用的细胞毒性剂,诸如“d8”及其磺酸化形式“sd8”和相关“d2”、“d1”及其磺酸化形式“sd1”可在目标缀合物中不遵循药物分子“d”的通式,但这些细胞毒性剂的结构是以相关附图和文本描绘。
某些人源化抗cd123抗体描述于2015年6月29日提交的题为“anti-cd123antibodiesandconjugatesandderivativesthereof”的美国临时申请号62/186,161中,该62/186,161申请的完整教示内容以引用的方式整体并入本文中,包括所有蛋白质(例如,抗体及其cdr、hcvr、lcvr、全长hc和lc序列)和核酸序列,以及相关seqidno,特别是具有一个或多个工程改造的n末端ser/thr残基的cd123-serimab的那些序列。
细胞毒性剂
在第三实施方案中,本发明提供可共价连接至本文所描述的细胞结合剂以形成本发明的缀合物的细胞毒性剂(以d’表示)。
在一个实施方案中,所述细胞毒性剂为类美登素。更具体地,所述细胞毒性剂d’是由以下结构式表示:
其中所述变量是如第一实施方案的第5个具体实施方案中关于式(d1)所描述。更具体地,细胞毒性剂d’为dm1(d2’)或dm4(d3’):
在另一个更具体实施方案中,所述细胞毒性剂d’是由下式表示:
其中所述变量是如上文第一实施方案的第5个具体实施方案中关于式(d4)所描述。
在另一个更具体实施方案中,所述细胞毒性剂d’是由下式表示:
在另一具体实施方案中,细胞毒性剂d’是包含醛反应性基团的类美登素化合物,其可直接连接至细胞结合剂。更具体地,所述类美登素化合物是由下式表示:
在另一个实施方案中,所述细胞毒性剂为苯并二氮杂
在一个更具体实施方案中,细胞毒性剂d’是由以下结构式表示的苯并二氮杂
或其药学上可接受的盐,其中所述变量是如上文第一实施方案的第6个具体实施方案中关于式(d6)-(d17)所描述。
在一个更具体实施方案中,d’是由以下结构式表示:
或其药学上可接受的盐,其中y为-h或-so3m,且m为h+或阳离子。甚至更具体地,y为-so3m,且m为h+、na+或k+。
在另一个更具体实施方案中,细胞毒性剂d’是包含醛反应性基团的苯并二氮杂
或其药学上可接受的盐,其中:
ld’、ld”和ld”’之一是由下式表示:
-nr5-p-c(=o)-(crarb)r-zd1-(crarb)r′-jcb(a’)
且另两个相同或不同,且独立地选自-h;任选取代的具有1至10个碳原子的直链、支链或环状烷基、烯基或炔基;聚乙二醇单元-(och2ch2)n-rc;卤素;胍鎓[-nh(c=nh)nh2];-or;-nr’r”;-no2;-nr’cor”;-sr;-sor’;-so2r’;-so3h;-oso3h;-so2nr’r”;氰基;叠氮基;-cor’;-ocor’;和-oconr’r”;
jcb是如上文在第一实施方案中所描述的醛反应性基团;且其余变量是如上文在第一实施方案的第7个具体实施方案和其中所描述的任何更具体实施方案中关于结构式(d18)-(d23)中所描述。
更具体地,对于式(d18’)-(d23’),jcb为
在另一个更具体实施方案中,对于式(d18’)-(d23’),l’是由式(a)表示,且l”和l”’均为–h;且其余变量是如上文任何实施方案中所描述。
在另一个更具体实施方案中,对于式(d18’)-(d23’):
在n与c之间的双线
r1、r2、r3、r4、r1’、r2’、r3’和r4’均为-h;
r6为-ome;
x’和y’均为-h;
a和a’为-o-;且
m为h+、na+或k+;且其余变量是如上文任何实施方案中所描述。
在另一个更具体实施方案中,对于式(d18’)-(d23’),ra和rb均为h;且其余变量是如上文任何实施方案中所描述。
在另一个更具体实施方案中,对于式(d18’)-(d23’),r5和r9各自独立地为h或me;且其余变量是如上文任何实施方案中所描述。更具体地,r5和r9均为h。
在另一个更具体实施方案中,对于式(d18’)-(d23’),p为含有2至10个氨基酸残基的肽;且其余变量是如上文任何实施方案中所描述。更具体地,p为含有2至5个氨基酸残基的肽。甚至更具体地,p选自gly-gly-gly、ala-val、val-ala、val-cit、val-lys、phe-lys、lys-lys、ala-lys、phe-cit、leu-cit、lle-cit、trp、cit、phe-ala、phe-n9-甲苯磺酰基-arg、phe-n9-硝基-arg、phe-phe-lys、d-phe-phe-lys、gly-phe-lys、leu-ala-leu、ile-ala-leu、val-ala-val、ala-leu-ala-leu(seqidno:17)、β-ala-leu-ala-leu(seqidno:18)和gly-phe-leu-gly(seqidno:19)、val-arg、arg-val、arg-arg、val-d-cit、val-d-lys、val-d-arg、d-val-cit、d-val-lys、d-val-arg、d-val-d-cit、d-val-d-lys、d-val-d-arg、d-arg-d-arg、ala-ala、ala-d-ala、d-ala-ala和d-ala-d-ala。
在另一个更具体实施方案中,所述细胞毒性剂d’是由以下结构式表示:
或其药学上可接受的盐,其中y为h或-so3m,且m为h+、na+或k+。
细胞毒性剂-接头化合物
在第四实施方案中,本发明提供具有醛反应性基团的细胞毒性剂-接头化合物,其可共价连接至本文所描述的细胞结合剂。
在某些实施方案中,细胞毒性剂-接头化合物是由下式表示:
jcb-l-jd’-d(ii),
其中jcb是第一实施方案中所描述的醛反应性基团;且其余变量是如上文在第一实施方案或第一实施方案的第2或6个具体实施方案,或其中所描述的任何更具体实施方案中所描述。
更具体地,jcb为肼、酰肼或羟胺。
在另一个实施方案中,jcb选自:
其中:xa为ch2、o或nch3;u’为nh、o、s或ch2;u为h或供电子基团;xb和xb’各自独立地为–oh、-sh或–nh2;rz和rz’各自独立地为h或烷基(优选为–me);rz”为h或烷基;且xc为n或ch。更具体地,所述醛反应性基团为
在一个实施方案中,细胞毒性剂-接头化合物是由以下结构式表示:
或其药学上可接受的盐,且y为h或-so3m,且m为h+、na+或k+。
经修饰的细胞结合剂
在第五实施方案中,本发明提供通过使本文所描述的细胞结合剂与具有醛反应性基团的接头化合物反应所形成的经修饰的细胞结合剂。
在某些实施方案中,所述经修饰的细胞结合剂是由下式表示:
其中jd是可与细胞毒性剂d’形成共价键的反应性基团;且其余变量是如上文在第一实施方案或其中所描述的任何更具体实施方案中所描述。
在第1个具体实施方案中,对于具有结构式(iii)的经修饰细胞结合剂或其药学上可接受的盐,jcb’是由以下结构式之一表示:
其中:xa为ch2、o或nch3;u’为nh、o、s或ch2;u为h或供电子基团;xb1和xb1’各自独立地为–o-、-s-或–nh-;rz和rz’各自独立地为h或烷基(优选为–me);且rz”为h或烷基;s1为共价连接至所述细胞结合剂的位点;且s2为共价连接至基团l的位点。更具体地,jcb’为
在第2具体实施方案中,对于式(iii),-l-jd是由下式表示:
其中jd为-sh、-ssrd或–sc(=o)rg,其中rd为苯基、硝基苯基、二硝基苯基、羧基硝基苯基、吡啶基或硝基吡啶基;且rg为烷基;jcb’是如上文在第1个具体实施方案中所描述;且其余变量是如上文在第一实施方案的第2个具体实施方案和其中所描述的任何更具体实施方案中关于式(l1)所描述。更具体地,jd为-sh或–ssrd。
在一个更具体实施方案中,-l-jd是由以下结构式表示:
或其药学上可接受的盐,其中jcb’和jd是如上文在第2个具体实施方案中所描述。更具体地,jd为-sh或–ssrd。
在第3个具体实施方案中,对于式(iii),-l-jd是由下式表示:
其中jd为–oh或卤素;或–c(=o)-jd为反应性酯;jcb’是如上文在第1个具体实施方案中所描述;且其余变量是如上文在第一实施方案的第3个具体实施方案和其中所描述的任何更具体实施方案中关于式(l2)和(l3)所描述。更具体地,–c(=o)-jd为n-羟基琥珀酰亚胺酯。
在一个更具体实施方案中,-l-jd是由以下结构式表示:
其中jcb’和jd是如上文在第3个具体实施方案中所描述。更具体地,–c(=o)-jd为n-羟基琥珀酰亚胺酯。
在第4个具体实施方案中,对于式(iii),-l-jd是由下式表示:
其中jd为马来酰亚胺、x’-crbrc-c(=o)-、x’-crbrc-c(=o)-nre-、
在某些实施方案中,对于以上任一实施方案(诸如第五实施方案或第五实施方案的第1至4个具体实施方案,或其中所描述的任何更具体实施方案)中所描述的式(iii),cba可为第二实施方案中所描述的任何细胞结合剂。
双官能交联剂(或接头化合物)
在第六实施方案中,本发明提供具有醛反应性基团的双官能交联剂(即,接头化合物),其可与本文所描述的细胞毒性剂形成共价键。
在一个实施方案中,所述接头化合物是由下式表示:
jcb-l-jd(iv),
其中所述变量是如上文式(i)、(ii)和(iii)所描述。
在一个实施方案中,所述接头化合物是由下式表示:
或其药学上可接受的盐,其中jcb是第一实施方案中所描述的醛反应性基团;且其余变量是如上文关于结构式(l1’)所描述。更具体地,jd为-sh或–ssrd。甚至更具体地,jcb为
在一个更具体实施方案中,所述双官能交联剂是由以下结构式表示:
或其药学上可接受的盐,其中jcb和jd是如上文所描述。更具体地,jd为-sh或–ssrd。甚至更具体地,jcb为
在另一个实施方案中,所述接头化合物是由以下结构式表示:
其中jcb是第一实施方案中所描述的醛反应性基团;且其余变量是如上文关于结构式(l2’)和(l3’)所描述。更具体地,–c(=o)-jd为n-羟基琥珀酰亚胺酯。甚至更具体地,jcb为
在一个更具体实施方案中,所述双官能交联剂是由以下结构式表示:
其中jcb和jd是如上文所描述。更具体地,–c(=o)-jd为n-羟基琥珀酰亚胺酯。甚至更具体地,jcb为
在另一个实施方案中,所述双官能交联剂是由以下结构式表示:
其中jd为马来酰亚胺、x’-crbrc-c(=o)-、x’-crbrc-c(=o)-nre-、
细胞结合剂-药物缀合物的制备
在第七实施方案中,本发明提供用于制备本文所描述的细胞结合剂-细胞毒性剂缀合物的方法。
在一个实施方案中,本发明提供一种制备本文所描述的细胞结合剂-细胞毒性剂缀合物的方法,所述方法包括以下步骤:
(a)用氧化剂将细胞结合剂的2-羟基乙胺部分氧化以形成具有醛基的经氧化细胞结合剂;其中所述2-羟基乙胺部分为丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分,且由以下结构式表示:
(b)使所述经氧化细胞结合剂:
(i)与具有醛反应性基团的细胞毒性剂-接头化合物或具有醛反应性基团的细胞毒性剂接触,以形成所述细胞结合剂-细胞毒性剂缀合物;或
(ii)与具有醛反应性基团的接头化合物接触,以形成与接头结合的经修饰抗体或其经修饰抗原结合部分,随后使所述经修饰抗体或所述其经修饰抗原结合部分与细胞毒性剂反应,以形成所述细胞结合剂-细胞毒性剂缀合物;或
(iii)与细胞毒性剂接触,随后添加具有醛反应性基团和可与所述细胞毒性剂形成共价键的反应性基团的接头化合物,以形成所述细胞结合剂-细胞毒性剂缀合物。
在第1个具体实施方案中,所述细胞结合剂是抗体或其抗原结合部分且所述方法包括以下步骤:
(a)用氧化剂将抗体或其抗原结合部分的2-羟基乙胺部分氧化,以形成具有醛基的经氧化抗体或其经氧化抗原结合部分,
其中所述2-羟基乙胺部分是n末端丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分;和
(b)使所述经氧化抗体或所述其经氧化抗原结合部分与具有醛反应性基团的细胞毒性剂-接头化合物或具有醛反应性基团的细胞毒性剂反应,以形成所述抗体-细胞毒性剂缀合物
其中:
ab是本文所描述的抗体或其抗原结合部分;
jcb是如上文所描述的醛反应性基团;
l是如上文所描述的间隔基或键;
jd’是将所述细胞毒性剂d与基团l连接的连接部分,或当l是键时不存在;
d是经由所述连接部分jd’共价连接至l的细胞毒性剂;且
w是1、2、3或4。
在某些实施方案中,对于上文第1个具体实施方案中所描述的方法,可使用上文第四实施方案中所描述的任何细胞毒性剂-接头化合物或第三实施方案中所描述的细胞毒性剂。
在某些实施方案中,对于上文第1个具体实施方案中所描述的方法,在步骤(b)中与经氧化抗体或其经氧化抗原结合部分反应之前,使具有亚胺官能基(-c=n-)的细胞毒性剂-接头化合物或细胞毒性剂与亚胺反应性试剂反应,以形成经修饰的细胞毒性剂-接头化合物或经修饰的细胞毒性剂。在一个实施方案中,经修饰的细胞毒性剂-接头化合物或经修饰的细胞毒性剂是原位产生,且在不纯化情况下与经氧化抗体或其经氧化抗原结合部分反应。
在第2个具体实施方案中,所述细胞结合剂是抗体或其抗原结合部分且所述方法包括以下步骤:
(a)用氧化剂将抗体或其抗原结合部分的n末端2-羟基乙胺部分氧化,以形成具有n末端醛基的经氧化抗体或其经氧化抗原结合部分,
其中所述2-羟基乙胺部分是n末端丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分;和
(b)使所述经氧化抗体或所述其经氧化抗原结合部分与具有醛反应性基团的接头化合物反应以形成与接头结合的经修饰抗体或其经修饰抗原结合部分,随后使所述经修饰抗体或所述其经修饰抗原结合部分与细胞毒性剂反应,以形成所述抗体-细胞毒性剂缀合物,
其中d’为细胞毒性剂;jd为可与细胞毒性剂d’形成共价键的反应性基团;且其余变量是如第1个具体实施方案中所描述。
在某些实施方案中,对于上文第2个具体实施方案中所描述的方法,可使用上文第六实施方案中所描述的任何接头。
在某些实施方案中,对于第2个具体实施方案中所描述的方法,在步骤(b)中与结合至接头的经修饰抗体或其经修饰抗原结合部分反应之前,使具有亚胺官能基(-c=n-)的细胞毒性剂与亚胺反应性试剂反应,以形成经修饰的细胞毒性剂。在一个实施方案中,经修饰细胞毒性剂是原位产生且在与结合至接头的经修饰抗体或其经修饰抗原结合部分反应之前未经纯化。
在第3个具体实施方案中,所述细胞结合剂是抗体或其抗原结合部分且所述方法包括以下步骤:
(a)用氧化剂将抗体或其抗原结合部分的n末端2-羟基乙胺部分氧化,以形成具有n末端醛基的经氧化抗体或其经氧化抗原结合部分,
其中所述2-羟基乙胺部分是n末端丝氨酸、苏氨酸、羟基赖氨酸、4-羟基鸟氨酸或2,4-二氨基-5-羟基戊酸残基的一部分;和
(b)使所述经氧化抗体或所述其经氧化抗原结合部分与细胞毒性剂反应,随后添加具有醛反应性基团的接头化合物,以形成所述抗体-细胞毒性剂缀合物,
其中所述变量是如上文在第1和2个具体实施方案中所描述。
在某些实施方案中,对于上文第3个具体实施方案中所描述的方法,可使用上文第六实施方案中所描述的任何接头化合物或第三实施方案中所描述的细胞毒性剂。
任何适合氧化剂均可用于上文所描述的方法的步骤(a)中。在某些实施方案中,氧化剂为过碘酸盐。更具体地,氧化剂为过碘酸钠。
可使用相对于细胞结合剂(例如抗体)摩尔当量过量的氧化剂。在某些实施方案中,可使用约2-100、5-80、10-50、1-10或5-10摩尔当量的氧化剂。在某些实施方案中,可使用约10或约50当量的氧化剂。当使用大量氧化剂时,使用较短反应时间来避免过度氧化。举例来说,当使用50当量氧化剂时,氧化反应进行约5至约60分钟。或者,当使用10当量氧化剂时,氧化反应进行约30分钟至约24小时。在一个实施方案中,使用5-10摩尔当量的氧化剂且反应时间进行约5至约60分钟(例如约10至约30分钟、约20至约30分钟)。
在某些实施方案中,氧化反应不会导致显著非靶向氧化。举例来说,在n末端丝氨酸氧化产生具有n末端醛基的经氧化cd123/il-3rα-结合剂的氧化过程期间,无大量(例如,低于20%、低于10%、低于5%、低于3%、低于2%或低于1%)甲硫氨酸和/或聚糖被氧化。
在某些实施方案中,在上文所描述的方法中步骤(b)的反应中存在催化剂。本领域中的任何适合催化剂均可使用。在一个实施方案中,所述催化剂为苯胺或取代的苯胺。示例性苯胺催化剂包括但不限于苯胺、邻苯二胺、间苯二胺、3,5-二氨基苯甲酸、对苯二胺、2-甲基-对苯二胺、n-甲基-对苯二胺、邻氨基苯酚、间氨基苯酚、对氨基苯酚、对甲氧基苯胺、5-甲氧基-邻氨基苯甲酸、邻氨基苯甲酸和4-氨基苯乙醇。在一个实施方案中,所述催化剂为4-氨基苯乙醇。在某些实施方案中,步骤(b)的反应是在约ph5.0至约ph6.5下进行。在某些实施方案中,步骤(b)的反应是在约ph5.0下进行。
在某些实施方案中,对于本文所描述的方法的步骤(b),所使用的具有醛反应性基团的化合物(例如,本文所描述的细胞毒性剂-接头化合物、细胞毒性剂或接头化合物)是相对于经氧化细胞结合剂(例如经氧化抗体或经氧化抗原结合部分)摩尔过量。在某些实施方案中,具有醛反应性基团的化合物与经氧化细胞结合剂的比率介于约10:1与约1.1:1之间,介于约5:1至约2:1之间。在一个实施方案中,比率为约4:1。
在某些实施方案中,对于上文所描述的方法,诸如第三实施方案或第1至3个具体实施方案中的那些方法,可通过本文所描述的任何方法获得细胞结合剂,诸如抗体或其抗原结合部分。
在第4个具体实施方案中,本发明提供一种制备抗体-细胞毒性剂缀合物的方法,所述方法包括以下步骤:
(a)用氧化剂将抗体或其抗原结合部分的n末端丝氨酸或苏氨酸残基的2-羟基乙胺部分氧化,以形成具有n末端醛基的经氧化抗体或其经氧化抗原结合部分,其中所述2-羟基乙胺部分是由以下结构式表示:
(b)使所述经氧化抗体或所述其经氧化抗原结合部分:(i)与具有醛反应性基团的细胞毒性剂-接头化合物接触,以形成抗体-细胞毒性剂缀合物;或(ii)与具有醛反应性基团的接头化合物接触,以形成结合至接头的经修饰抗体或其经修饰抗原结合部分,随后使所述经修饰抗体或所述其经修饰抗原结合部分与细胞毒性剂反应以形成抗体-细胞毒性剂缀合物;或(iii)与细胞毒性剂接触,随后添加具有醛反应性基团和可与细胞毒性剂形成共价键的反应性基团的接头化合物,以形成抗体-细胞毒性剂缀合物。
在某些实施方案中,对于上文所描述的任何方法,诸如第七实施方案或第1至4个具体实施方案或任何更具体实施方案中的那些方法,抗体或其抗原结合部分是通过表达编码重组抗体重链(hc)、轻链(lc)或其抗原结合部分的多核苷酸来获得,所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分包含:(1)具有seqidno:1的氨基酸序列的异源信号肽;(2)紧邻所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列第一个残基的n末端的ser或thr残基;或(3)置换所述重组抗体重链(hc)、轻链(lc)或其抗原结合部分的成熟加工序列的一个或多个n末端氨基酸残基的ser或thr残基。
在某些实施方案中,对于上文所描述的任何方法,诸如第七实施方案或第1至4个具体实施方案或任何更具体实施方案中的那些方法,所述抗体或其抗原结合部分包含seqidno:3的轻链序列。
在某些实施方案中,对于上文所描述的任何方法,诸如第七实施方案或第1至4个具体实施方案或任何更具体实施方案中的那些方法,所述抗体或其抗原结合部分是包含seqidno:3的轻链序列的鼠类抗体或其抗原结合部分的嵌合抗体、人源化抗体或人类抗体,或其抗原结合部分。人源化抗体或其抗原结合部分可为表面重塑或cdr移植的抗体,或其抗原结合部分。
在某些实施方案中,根据上文所描述的任何方法制备的缀合物可接着经纯化。本领域中已知的任何纯化方法均可用于纯化本发明的缀合物(参见例如,bioconjugatetechniques,第2版,gregt.hermanson,academicpress,inc.出版,2008)。在一个实施方案中,本发明的缀合物可使用切向流过滤(tff)、非吸附色谱法、吸附色谱法、吸附过滤法、选择性沉淀法、高效液相色谱法(hplc)、透析或任何其它适合纯化方法,以及其组合来进行纯化。
任何适合的tff系统均可用于纯化,包括pellicon型系统(millipore,billerica,ma)、sartoconcassette系统(sartoriusag,edgewood,ny)和centrasette型系统(pallcorp.,easthills,ny)。
任何适合吸附色谱树脂均可用于纯化。优选的吸附色谱树脂包括羟基磷灰石色谱、疏水电荷诱导色谱(hcic)、疏水相互作用色谱(hic)、离子交换色谱、混合型离子交换色谱、固定化金属亲和色谱(imac)、染料配体色谱、亲和色谱、反相色谱和其组合。适合羟基磷灰石树脂的实例包括羟基磷灰石陶瓷(i型和ii型cht;bio-radlaboratories,hercules,ca)、haultrogel羟基磷灰石(pallcorp.,easthills,ny)和氟磷灰石陶瓷(i型和ii型cft;bio-radlaboratories,hercules,ca)。适合hcic树脂的实例为mephypercel树脂(pallcorp.,easthills,ny)。适合hic树脂的实例包括丁基-琼脂糖、己基-琼脂糖、苯基-琼脂糖和辛基琼脂糖树脂(均购自gehealthcare,piscataway,nj),以及macro-prep甲基树脂和macro-prep叔丁基树脂(bioradlaboratories,hercules,ca)。适合离子交换树脂的实例包括sp-琼脂糖、cm-琼脂糖和q-琼脂糖树脂(均购自gehealthcare,piscataway,nj),和unospheres树脂(bio-radlaboratories,hercules,ca)。适合混合型离子交换剂的实例包括bakerbondabx树脂(jtbaker,phillipsburgnj)。适合imac树脂的实例包括螯合性琼脂糖树脂(gehealthcare,piscataway,nj)和profinityimac树脂(bio-radlaboratories,hercules,ca)。适合染料配体树脂的实例包括蓝色琼脂糖树脂(gehealthcare,piscataway,nj)和affi-gel蓝色树脂(bio-radlaboratories,hercules,ca)。适合亲和树脂的实例包括蛋白质a琼脂糖树脂(例如,mabselect,gehealthcare,piscataway,nj)、his标记的金属亲和树脂、抗flag亲和树脂,和卵磷脂亲和树脂,例如lentil卵磷脂亲和树脂(gehealthcare,piscataway,nj),其中抗体带有适当卵磷脂结合位点。适合反相树脂的实例包括c4、c8和c18树脂(gracevydac,hesperia,ca)。
任何适合非吸附性色谱树脂均可用于纯化。举例来说,可使用尺寸排阻色谱法纯化本发明的缀合物。适合非吸附性色谱树脂的实例包括但不限于sephadextmg-10、g-25、g-50、g-100,sephacryltm树脂(例如s-200和s-300)、superdextm树脂(例如superdextm75和superdextm200)、bio-
在一个实施方案中,当细胞结合剂为表位点标记的avibody时,可使用羟基磷灰石色谱、尺寸排阻色谱、切向流过滤、凝胶电泳、透析和亲和色谱,优选使用亲和色谱,更优选使用his标记的金属亲和树脂和抗flagm2亲和树脂来纯化缀合物(参见例如,us2008/0152586和us2012/0171115)。
在另一个实施方案中,当细胞结合剂为centyrin时,可使用蛋白质a纯化、硫酸铵或乙醇沉淀、酸萃取、阴离子或阳离子交换色谱、磷酸纤维素色谱、疏水相互作用色谱、尺寸排阻色谱、切向流过滤、亲和色谱、羟基磷灰石色谱和卵磷脂色谱法来纯化缀合物。或者,可使用hplc来纯化缀合物。优选地,可通过使用亲和色谱,更优选使用his标记的金属亲和色谱来纯化缀合物。参见例如,美国专利公开案号us2010/0255056、us2010/0216708和us2011/0274623。
在另一个实施方案中,当细胞结合剂为darpin时,可通过亲和色谱、尺寸排阻色谱、羟基磷灰石色谱、切向流过滤,优选通过亲和色谱,更优选通过his标记的亲和色谱来纯化缀合物。参见例如,美国专利公开案号20040132028、2009/0082274、2011/0118146和2011/0224100;wo02/20565和wo06/083275。
细胞毒性的体外评价
可对本发明的细胞毒性化合物和细胞结合剂-药物缀合物在体外抑制各种癌细胞增殖的能力进行评价。可使待评价的细胞暴露于所述化合物或缀合物1-5天,且通过已知方法在直接测定中测量细胞的存活分数。接着,可由所述测定的结果计算ic50值。或者或另外,可使用体外细胞株敏感性筛选,诸如美国国家癌症协会(u.s.nationalcancerinstitute)所描述的筛选法(参见voskoglou-nomikos等人,2003,clinicalcancerres.9:42227-4239,以引用的方式并入本文中)作为一种指导以确定可能对本发明的化合物或缀合物治疗敏感的癌症类型。
组合物和使用方法
本发明包括一种组合物(例如医药组合物),其包含本文所描述的新颖苯并二氮杂
本发明包括一种在哺乳动物(例如人)中抑制异常细胞生长或治疗增生性病症的方法,所述方法包括向所述哺乳动物施用单独或与第二治疗剂组合的治疗有效量的本文所描述的新颖苯并二氮杂
在一个实施方案中,所述增生性病症为癌症。癌症可包括血液科癌症或实体肿瘤。更具体地,所述癌症为白血病(例如急性骨髓性白血病(aml);急性单核细胞性白血病、早幼粒细胞性白血病、嗜酸粒细胞性白血病、急性淋巴母细胞性白血病(all),诸如急性b淋巴母细胞性白血病(b-all);慢性骨髓性白血病(cml);慢性淋巴细胞性白血病(cll))或淋巴瘤(例如非霍奇金淋巴瘤、骨髓增生异常综合征(mds)、黑素瘤、肺癌(例如非小细胞肺癌(nsclc))、卵巢癌、子宫内膜癌、腹膜癌、胰腺癌、乳癌、前列腺癌、头颈部鳞状细胞癌和子宫颈癌。
本发明还提供治疗方法,所述方法包括向需要治疗的受试者施用有效量的上文所描述的任何缀合物。类似地,本发明提供一种用于诱导所选细胞群中细胞死亡的方法,所述方法包括使靶细胞或含有靶细胞的组织与有效量的本发明的包含细胞毒性剂的任何细胞毒性化合物-结合剂(例如连接至细胞结合剂的吲哚啉并苯并二氮杂
必要时,可与所述缀合物一起施用其它活性剂,诸如其它抗肿瘤剂。
适合药学上可接受的载体、稀释剂和赋形剂是熟知的且可由本领域技术人员依据临床情况所允许来确定。适合载体、稀释剂和/或赋形剂的实例包括:(1)杜伯克氏磷酸盐缓冲生理食盐水(dulbecco’sphosphatebufferedsaline),约ph7.4,含有或不含约1mg/ml至25mg/ml人血清白蛋白;(2)0.9%生理食盐水(0.9%w/vnacl);和(3)5%(w/v)右旋葡萄糖;且还可含有抗氧化剂(诸如色胺)和稳定剂(诸如tween20)。
用于诱导所选细胞群中细胞死亡的方法可在体外、体内或离体实行。
体外应用的实例包括自体骨髓移在植入同一患者体内之前进行处理以便杀死患病细胞或恶性细胞;骨髓在移植之前进行处理以便杀死胜任t细胞且防止移植物抗宿主疾病(gvhd);处理细胞培养物以便杀死除所需变异体外的不表达靶抗原的所有细胞;或杀死表达非所需抗原的变异体。非临床体外应用的条件易于由本领域普通技术人员决定。
临床上离体应用的实例是在自体移植以治疗癌症或治疗自身免疫疾病之前从骨髓移除肿瘤细胞或淋巴样细胞,或在移植之前由自体或异体骨髓移除t细胞和其它淋巴样细胞以便防止gvhd。治疗可进行如下。从患者或其它个体采集骨髓,且接着在约37℃下,在添加有浓度范围为约10μm至1pm的本发明细胞毒性剂的含血清培养基中孵育约30分钟至约48小时。浓度和孵育时间(即,剂量)的确切条件易于由本领域技术人员决定。在孵育之后,用含血清的培养基洗涤骨髓细胞且根据已知方法,将其经静脉内回输给患者。在患者接受在骨髓采集时间与经处理细胞回输之间接受其它治疗,诸如消融性化学疗法或全身照射疗程的情况下,使用标准医疗设备将经处理骨髓细胞冷冻储存在液氮中。
对于临床上体内应用,所供应的本发明的细胞毒性剂将是有关无菌性和内毒素水平进行测试的溶液或冻干粉。适合施用缀合物的方案的实例如下。缀合物是每周一次以静脉内推注给与,持续4周。推注剂量是在添加有5至10ml人血清白蛋白的50至1000ml标准生理食盐水中给与。每次静脉内施用的剂量将为10μg至2000mg(在每天100ng至20mg/kg范围内)。治疗四周之后,患者可每周继续接受治疗。关于施用途径、赋形剂、稀释剂、剂量、时间等具体临床方案可由本领域技术人员依据临床情况所允许决定。
可根据诱导所选细胞群中细胞死亡的体内或离体方法治疗的医学病状的实例包括任何类型的恶性疾病,包括例如,癌症;自身免疫疾病;诸如全身性狼疮、类风湿性关节炎和多发性硬化;移植物排斥,诸如肾移植排斥反应、肝移植排斥反应、肺移植排斥反应、心脏移植排斥反应和骨髓移植排斥反应;移植物抗宿主疾病;病毒感染,诸如cmv感染、hiv感染、aids等;和寄生虫感染,诸如贾第鞭毛虫病、阿米巴病、血吸虫病和普通本领域技术人员所确定的其它疾病。
癌症疗法和其剂量、施用途径和推荐剂量是本领域中已知的且已描述于如physician'sdeskreference(pdr)的文献中。pdr公开了用于治疗各种癌症的药剂的剂量。这些以上提及的在治疗上有效的化学治疗药物的给药方案和剂量将取决于所治疗的特定癌症、疾病程度和熟悉本领域的医师所熟悉的其它因素,且可由医师决定。pdr的内容是以引用的方式明确地整体并入本文中。本领域技术人员可评述pdr,使用以下一个或多个参数来确定可根据本发明的教示内容使用的化学治疗药物和缀合物的给药方案和剂量。这些参数包括:
·综合指数
·制造商
·产品(公司或商标药物名)
·种类索引
·通用名/化学物质索引(非商标通用药物名)
·药物的彩色图像
·产品信息,与fda标贴相符
·化学特性信息
·功能/作用
·适应症与禁忌症
·试验研究、副作用、警告
类似物和衍生物
细胞毒性剂领域的技术人员将易于了解,本文所描述的每一细胞毒性剂可通过使所得化合物仍保持起始化合物的特异性和/或活性的方式进行修饰。熟练技术人员还应了解,这些化合物中有许多可代替本文所描述的细胞毒性剂使用。因此,本发明的细胞毒性剂包括本文所描述的缀合剂的类似物和衍生物。
本文和以下实施例中引用的所有参考文献均以引用的方式明确地整体并入本文中。
实施例
实施例1构建带有n末端ser/thr的重组抗体
先前已描述带有n末端丝氨酸的鼠类抗叶酸受体α抗体fr1-2.1轻链(lc)的序列(美国专利申请号61/872,407,2013年8月30日提交;61/875,475,2013年9月9日提交;和61/940,184,2014年2月14日提交;和主张其优先权的wo2015/031815,全部以引用的方式并入)。此n末端ser是利用获得fr1-2.1轻链的igkv1-99*01鼠类生殖系序列(登录号cab46122;seqidno:2)的信号肽中的常用裂解位点,由信号肽酶得到。不同于在抗体表达期间裂解时完全移除的典型抗体信号肽,igkv1-99*信号肽的最后一个丝氨酸(kabat的1位)保留在fr1-2.1轻链的n末端。已证明,fr1-2.1抗体是用于评价本文所描述的丝氨酸氧化修饰方法的一种有用工具,且此外,fr1-2.1信号肽(表1;seqidno:1)提供一种用于产生在轻链或重链n末端具有丝氨酸的重组抗体的可能机制。使用天然抗体信号肽并入n末端丝氨酸能够避免抗体工程改造可能存在的负面结果,包括但不限于可能由非天然构建体引起的表达问题和裂解位点异质性。
为了展示fr1-2.1信号肽在经转染哺乳动物细胞株中表达的重组抗体的n末端留下丝氨酸残基,利用fr1-2.1轻链信号肽合成新抗体表达构建体。将先前在美国专利号8,557,966中描述的人源化mov19轻链(lc)的可变区氨基酸序列(表1:seqidno:3)与fr1-2.1信号肽组合以代替标准抗体信号肽(seqidno:6),产生humov19lcnts1序列(seqidno:10)。接着将所述轻链序列提供至blueheronbiotechnology,在此处对其进行密码子优化,合成且将其克隆至含有人κ恒定区序列的pabkzeo哺乳动物表达质粒的ecori和bsiwi位点中。
产生在n末端具有丝氨酸/苏氨酸残基的重组抗体的一种替代性方法是用丝氨酸或苏氨酸置换n末端残基(kabat的+1位)。为了展示这一技术,用丝氨酸置换人源化mov19重链(hc)(seqidno:8)n末端残基(谷氨酰胺)以产生humov19hcnts2序列(seqidno:11)。接着对重链序列进行密码子优化,合成且通过blueheronbiotechnology与人igg1恒定区同框克隆至pabg1neo质粒的hindiii和apa1位点。
使用以上描述的n末端丝氨酸添加与n末端丝氨酸置换方案的各种组合来产生带有至多4个n末端丝氨酸(例如,2个在重链上且2个在轻链上)的另外的重组抗体。合成上文所描述的构建体的反向序列,以使得人源化mov19轻链(lc)的n末端天冬氨酸经丝氨酸置换(humov19lcnts3,seqidno:12),或相反,合成fr1-2.1信号肽添加n末端丝氨酸的人源化mov19重链(humov19hcnts4;seqidno:14)。此外,将这些轻链和重链构建体混合在一起以产生在两个n末端带有丝氨酸的重组抗体,每个抗体总计带有4个n末端丝氨酸(例如humov19lcnts3和humov19hcnts4)。这些构建体局限于2个(轻链n末端丝氨酸)或4个(两条链均带有n末端丝氨酸)并入位点,而且利用异二聚体抗体技术,诸如“结进孔”突变(wo2005/063816a2,以引用的方式并入)。还可能构建带有1或3个n末端丝氨酸的抗体。
最后,尽管可遵循产生带有n末端丝氨酸的重组抗体的另外方法,诸如多氨基酸n末端连接或n末端截短,但所述方法提供附加益处,即,其不太可能影响至关重要的抗体属性,诸如结合特异性或结构完整性。
除丝氨酸外,可通过用苏氨酸简单地置换n末端残基(kabat的+1位)产生在n末端带有苏氨酸残基的重组抗体,以便通过本文所描述的方法缀合这些抗体。举例来说,用苏氨酸置换人源化mov19轻链(lc)的n末端天冬氨酸(humov19lcntt1,seqidno:15),或用苏氨酸置换人源化mov19重链(hc)的n末端谷氨酰胺(humov19hcntt2,seqidno:16)。接着,如上文所描述,将这些构建体克隆至对应哺乳动物表达质粒中。
表1.所选序列
实施例1a.构建带有n末端ser/thr的重组抗体
使用与以上实施例1中所描述基本上相同的方法,使用seqidno:6作为其天然humov19lc和hc的信号肽,或作为异源lc或hc的信号肽,其修饰在于紧接着seqidno:6之后插入ser或thr残基,以使得在加工信号肽的裂解产物之后,插入的ser/thr成为成熟lc或hc加工序列的第一个(n末端)残基。
实施例2重组抗体表达
在摇瓶中,在悬浮适应的hek-293t细胞中,使用修改的pei程序(durochery,perrets,&kamenahigh-levelandhigh-throughputrecombinantproteinproductionbytransienttransfectionofsuspension-growinghuman293-ebna1cells.nucleicacidsres.2002年1月15日;30(2):e9)短暂地产生嵌合抗体构建体和人源化抗体构建体。如先前所描述(durocher,见上文)进行pei短暂转染,不过使hek-293t细胞在freestyle293(invitrogen)中生长,且培养物体积在添加pei-dna复合物后保持未稀释。将贴壁和悬浮的短暂转染物孵育一周,接着依序通过如下文所描述的蛋白质a柱和cm柱离子交换色谱法纯化澄清的上清液。
实施例3重组抗体纯化
使用标准方法,诸如蛋白质a或蛋白质g色谱法(hitrap蛋白质a或蛋白质ghp,1ml,amershambiosciences)从澄清的细胞培养物上清液中纯化得到抗体。简而言之,通过添加1/10体积的1mtris/hcl缓冲液(ph8.0)来制备用于色谱法的上清液。使ph经调整的上清液滤过0.22μm滤膜且将其装载至用结合缓冲液(pbs,ph7.3)平衡的柱上。用结合缓冲液洗涤柱,直至获得在280nm下无吸光度的稳定基线。用含0.15mnacl的0.1m乙酸缓冲液(ph2.8),使用流速0.5ml/分钟对抗体进行洗脱。收集约0.25ml级分且通过添加1/10体积的1mtris/hcl缓冲液(ph8.0)进行中和。针对1×pbs将峰级分透析隔夜两次,且通过滤过0.2μm滤膜进行灭菌。通过在a280下的吸光度对纯化抗体进行定量。
使用离子交换色谱法(iex)和羧甲基(cm)色谱法进一步纯化经蛋白质a纯化的级分。简而言之,将由蛋白质a纯化得到的样品缓冲液更换成起始缓冲液(10mm磷酸钾、10mm氯化钠,ph7.5)并使其滤过0.22μm筛检程序。接着将所制备的样品以120cm/hr流速装载至经起始缓冲器平衡的cm快速流动树脂(gelifesciences)上。所选柱大小应具有足够容量以结合样品中的所有抗体。接着用结合缓冲液洗涤柱,直至获得在280nm下无吸光度的稳定基线。通过以20个柱体积(cv)起始10mm至500mm氯化钠梯度来洗脱抗体。收集uv读数高于50mau主峰的级分。使用agilenthplc1100系统(agilent,santaclara,ca),在tsk凝胶g3000swxl7.8×300mm和swxl保护柱6.0×40mm(tosohbioscience,montgomeryville,pa)上以尺寸排阻色谱法(sec)评估纯度(单体和可溶性高分子聚集体的百分比)。汇集具有所需纯度(>95%)的级分,使用tff系统缓冲液更换成pbs(ph7.4)且通过滤过0.2μm滤膜进行灭菌。通过sec进一步测试纯化抗体的纯度且使用消光系数1.47,通过在280nm下的吸光度测量值来测定igg浓度。必要时,进行稀释。或者,可使用羟基磷灰石陶瓷(cht)对具有改善的选择性的鼠类和人源化抗体进行精制。应用粒度为40μm的ii型cht树脂(bio-radlaboratories),以与iex色谱法类似的方案精制抗体。cht的起始缓冲液为20mm磷酸钠(ph7.0),且用20-160mm磷酸钠梯度经20cv洗脱抗体。
实施例4n末端抗体缀合—两步法
用5mm过碘酸钠水溶液处理(50当量,25℃,30分钟)工程改造成在重链上带有n末端丝氨酸的humov19-nts#2抗体([1],如图1中所示的方案1;3mg/ml于ph7.4的pbs中)。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
在反应容器中,用含有10%v/vdma(n,n-二甲基乙酰胺)共溶剂的4-氨基苯乙醇(100mm于dma[n,n-二甲基乙酰胺]中)处理所得溶液,达到10mm浓度。随后引入接头1([3],方案1;4或5当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成hepes(4-(2-羟乙基)-1-哌嗪乙烷磺酸)缓冲液,ph8.5。接着用dma(n,n-二甲基乙酰胺)共溶剂(10%v/v)调整溶液,且在25℃下用化合物a(或磺酸化dgn462(sdgn462)或磺酸化d1(或sd1))([5],方案1;游离硫醇;5当量)处理6小时。
使用nap过滤柱(illustrasephadexg-25dna级,gehealthcare)将所得缀合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖、0.01%tween-20、50μm亚硫酸氢钠配制缓冲液(ph6.2)。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([6],方案1)每个抗体均匀地平均连接有两个化合物a分子(经由q-tof质谱法,图2),具有>98%单体(经由尺寸排阻色谱法)、<2%游离药物(经由丙酮沉淀的反相hplc分析)和0.14mg/ml的最终蛋白质浓度(经由uv-vis,对于humov19-nts#2抗体,使用摩尔消光系数ε280=201400m-1cm-1)。
实施例5n末端抗体缀合—dmx直接连接
在25℃下,用5mm过碘酸钠水溶液(50摩尔当量)处理工程改造的含n末端ser的humov19-nts#2抗体([1],方案2,图3;3mg/ml于pbs中,ph7.4)达30分钟。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
在反应容器中,用含有10%v/vdma(n,n-二甲基乙酰胺)共溶剂的4-氨基苯乙醇(100mm于dma[n,n-二甲基乙酰胺]中)处理所得溶液,达到10mm浓度。随后引入氨氧基-乙酰基maynma([3],方案2;4或5摩尔当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖缓冲液,ph6.2。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([4],方案2)每个抗体均匀地平均连接有两个maynma分子(经由q-tof质谱法,图4),具有>98%单体(经由尺寸排阻色谱法)、<2%游离药物(经由hisep反相hplc分析)和0.31mg/ml的最终蛋白质浓度(经由uv-vis,对于humov19-nts#2抗体,使用摩尔消光系数ε280=201400m-1cm-1)。
实施例6n末端抗体缀合—针对mov19-nts#1的两步方案
在25℃下,用5mm过碘酸钠水溶液(50摩尔当量)处理经由前导肽序列工程改造成在轻链上含n末端丝氨酸的humov19-nts#1抗体([1],方案3,图5;3mg/ml于pbs中,ph7.4)达30分钟。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
在反应容器中,用含有10%v/vdma(n,n-二甲基乙酰胺)共溶剂的4-氨基苯乙醇(100mm于dma[n,n-二甲基乙酰胺]中)处理所得溶液,达到10mm浓度。随后引入接头1([3],方案3;4或5摩尔当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成hepes(4-(2-羟乙基)-1-哌嗪乙烷磺酸)缓冲液,ph8.5。接着用dma(n,n-二甲基乙酰胺)共溶剂(10%v/v)调整溶液,且在25℃下用化合物a([5],方案3;游离硫醇;5摩尔当量)处理6小时。
使用nap过滤柱(illustrasephadexg-25dna级,gehealthcare)将所得缀合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖、0.01%tween-20、50μm亚硫酸氢钠配制缓冲液(ph6.2)。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([6],方案3)每个抗体平均连接有1.4个化合物a分子(经由q-tof质谱法,图6),具有>98%单体(经由尺寸排阻色谱法)、<2%游离药物(经由丙酮沉淀的反相hplc分析)和0.14mg/ml的最终蛋白质浓度(经由uv-vis,对于humov19-nts#1抗体,使用摩尔消光系数ε280=201400m-1cm-1)。
实施例7t47d细胞上n末端ser缀合物的结合与对照物相当
使用t47d细胞分析n末端ser-药物缀合物(serimabadc)的结合亲和力,先前已证实,所述细胞每个细胞结合约1×105个叶酸受体α(fr-α)抗原。人源化单株抗体humov19特异性结合frα。
为了评价结合亲和力,在96孔盘(falcon,圆底)中,一式两份以facs缓冲液(1%bsa,1×pbs)稀释起始浓度为约3×10-8m的每孔约100μl的adc或对照抗体(例如未缀合的天然humov19,或m9346a),随后在4℃下以facs缓冲液进行连续3倍稀释。使人乳癌细胞株t47d细胞在补充有热灭活10%fbs(lifetechnologies)、0.1mg/ml庆大霉素(gentamycin)(lifetechnologies)和0.2iu牛胰岛素/ml(sigma)的rpmi-1640(lifetechnologies)中生长,且在pbs中洗涤一次,随后用versene(lifetechnologies)移除。接着将t47d细胞再悬浮于生长培养基(参见上文)中以中和胰蛋白酶,并在coulter计数器上计数。接着在冷facs缓冲液中洗涤细胞两次,在每次洗涤之间以1200rpm离心5分钟。
将约100μl/ml的2×104个细胞/孔添加至含adc、抗体或仅含facs缓冲液的孔中,且在4℃下孵育2小时。孵育之后,如先前所述对细胞进行离心,且在每孔200μl的冷facs缓冲液中洗涤一次。接着,在4℃下用每孔200μl缀合fitc的山羊抗人igg-fcγ二次抗体(所包括的对照物为未染色细胞和仅用二次抗体染色的所述细胞)对细胞染色,保持40分钟,离心且在每孔200μl的冷pbs-d中洗涤一次。将细胞固定于每孔200μl的1%甲醛/pbs-d中且在4℃下储存。
储存之后,使用流动式细胞测量术,在facscalibur(bdbiosciences)上检测缀合物或抗体的细胞表面染色。使用graphpadprism将几何平均值对adc或抗体的对数浓度作图,且经由非线性4参数逻辑斯蒂回归分析(non-linear4-parameterlogisticregressionanalysis)计算ec50。参见图8。
还使用以下各物进行类似实验:(1)humov19-nts#2-接头1-化合物a(又称为“serimab-sdgn462”),每个ab具有平均两个化合物a分子;(2)经由磺基-spdb接头连接至humov-19上赖氨酸残基的ε-氨基的humov19-sspdb-化合物a,每个humov19具有平均2.4个化合物a分子;(3)未缀合的天然humov19抗体(m9346a);和(4)具有工程改造的n末端ser的未缀合工程改造的humov19-nts#2抗体。参见图7a。
如图7a和7b中所示,serimabadc以与未缀合抗体(m9346a)对照物类似的方式结合至表达靶抗原的t47d细胞的表面。参见例如,图7b中的ec50值。在图8a和8b中所示的类似实验中获得基本上相同的结果。这些实验展示,抗原结合不受在n末端丝氨酸残基处的缀合过程影响。
对于humov19-nts#2-d8缀合物还观察到类似结果。这些缀合物以与未缀合对照物(m9346a抗体)或未缀合工程改造的humov19-nts#2抗体(或serimab)类似的方式结合至表达靶抗原的t47d细胞的表面。参见图23。
实施例8humov19nts#2-接头1-化合物a对kb子宫颈癌细胞株的细胞毒性的评价
本实验展示,与工程改造的n末端ser的位点特异性抗体缀合不仅提供可预测且可靠的每个抗体的药物负载,而且还意外地赋予所得adc缀合物比抗体连接至lys侧链的缀合物高的效力。
在环境温度下,在96孔盘(corning,平底)中,一式三份用补充有热灭活10%fbs(lifetechnologies)和0.1mg/ml庆大霉素(lifetechnologies)的rpmi-1640(lifetechnologies)稀释起始浓度为3.5x10-9m至3.5x10-8m的每孔100μl/各adc,并在上述培养基中进行3倍连续稀释。在pbs中洗涤在补充有热灭活10%fbs(lifetechnologies)和0.1mg/ml庆大霉素(lifetechnologies)的emem(atcc)中生长的kb细胞(口腔上皮肿瘤)一次,并用0.05%胰蛋白酶-edta(lifetechnologies)移除。所测试的其它细胞为在补充有热灭活10%fbs(lifetechnologies)和0.1mg/ml庆大霉素(lifetechnologies)的rpmi-1640(lifetechnologies)中生长的nci-h2110(nsclc)和t47d(乳房上皮细胞)。t47d培养基还补充有0.2iu/ml牛胰岛素。所有细胞再悬浮于生长培养基(参见上文)中以中和胰蛋白酶,并在coulter计数器上计数。将100μl/ml的1000-2000个细胞/孔添加至含有adc或仅含培养基的孔中,且在37℃且含5%co2的恒温箱中,在存在和不存在1μm阻断性humov19抗体情况下孵育5天。总体积为每孔200μl。孵育之后,通过添加每孔20μlwst-8(dojindo)并使其显影2小时来分析细胞活力。在板读取器上,在450和620nm下读取吸光度。用450nm下的吸光度减去620nm下的吸光度。进一步用经校正的吸光度减去仅含培养基的孔中的背景值且以excel计算未处理细胞的存活分数(sf)。使用graphpadprism创建adc浓度(m)对sf的xy曲线。
图9a中的数据显示,化合物a可连接至工程改造的n末端ser,且得到每一抗体分子精确地具有两个化合物a分子的adc。相比之下,经由lys侧链连接至相同humov19抗体的化合物a得到每一抗体具有平均2.4个化合物a分子的adc,表明连接不同数量化合物a的相对不均匀的adc群。
图7a和7b先前已证实,不管所用键联(经由工程改造的n末端ser,或经由天然lys侧链)如何,所得adc对抗原具有与未缀合抗体基本上相同的结合亲和力。
然而,尽管在lys缀合的adc中具有较高药物负载(即,2.4对比2.0个化合物a),但带有n末端ser键联的adc的效力基于抗体浓度比赖氨酸缀合的adc高约3倍,且基于化合物a的浓度比赖氨酸缀合的adc高约5倍。参见图9a的ic50测量值。
另外,添加过量(1μm)未缀合的humov19可阻断所观察的杀灭作用,不仅表明所观察的细胞毒性为特异性的且取决于humov19与靶细胞上其抗原的结合,而且还表明两种adc对靶细胞具有相同的不依赖于抗原的活性。
对于与humov19缀合的不同细胞毒素和其带有n末端ser缀合的工程改造形式还获得类似结果。参见图9b中的类美登素缀合物。带有n末端ser键联的adc具有与lys缀合的adc类似的效力,不过事实是lys缀合的adc具有较高药物负载(3.5对比2)。
对于humov19还观察到与不相关抗体类似的结果,如上文所描述。
实施例9.
dm4-spdb-酰肼和dm4-磺基-spdb-酰肼将通过使dm4-spdb或dm4-磺基-spdb与肼反应来制备,如上文所示。
实施例10.
可使先前所述的磺基-spdb(美国专利号8,236,319)与肼反应以得到磺基-spdb-肼接头。
在室温下,在快速搅拌下,向肼(0.015ml,0.242mmol)于dma中的0.24m溶液中逐滴添加1-((2,5-二氧代吡咯烷-1-基)氧基)-1-氧代-4-(吡啶-2-基二硫基)丁烷-2-磺酸(25.9mg,0.0635mmol)于dma中的0.06m溶液。在50℃下,在氩气下搅拌40分钟之后,通过反相hplc(c18,21.2x250mm),用含有0.1%甲酸的去离子水,使用5-25%的乙腈梯度经30分钟洗脱来纯化粗反应混合物。合并含有所需产物的级分,冷冻且冻干,得到3.1mg(产率15%)呈白色固体状的所需产物。ms(m+1)+实测值:324.05,计算值:324.01。1hnmr(400mhz,dmso-d6)δ2.13–2.26(m,2h),2.82–2.91(m,2h),3.52(t,j=7.8,6.1hz,1h),7.24(t,j=7.3,4.7hz,1h),7.76(d,j=8.0hz,1h),7.83(t,1h),8.45(d,j=3.5,2.0hz,1h)。
可使所得化合物与带有醛或酮的细胞结合剂反应,接着可任选还原酰肼键联。可使所得接头与带有醛或酮的细胞结合剂反应,接着与带有硫醇的类美登素(诸如dm1或dm4)反应,得到缀合物。
或者,一旦接头与细胞结合剂反应,便可使用诸如二硫苏糖醇或tcep的试剂还原所得分子的反应性二硫键,得到硫醇,可使硫醇与带有反应性二硫键的类美登素,诸如pys-dm1或pys-dm4反应。
实施例11.
boc-羟胺将与1,3-二溴丙烷反应,接着与硫代乙酸反应。通过依序用naoh和hcl处理来使硫醇和胺脱保护,接着使硫醇部分与2,2’-二吡啶基二硫化物反应,得到w1。使dm4与w1反应,得到w2。1,3-二溴丙烷可置换为其它对称性二溴化物,得到在dm与二硫化物部分之间的具有其它长度的间隔基。
接头w1还可用于使带有酮或醛的细胞结合剂衍生化,以引入反应性二硫化物。肟还可任选经还原。任一方法均允许添加带有硫醇的类美登素,诸如dm1或dm4以完成缀合。
实施例12.
将烷氧氨基乙酰基-cys(s-2-no2-苯基)--oh(1mg,2.88μmol,如先前org.biomol.biochem.2006,4:1313–1419中所描述制备)和dm4(6mg,7.7μmol)溶解于dmf(250μl)和去离子水(25μl)中且磁力搅拌1小时。反应混合物使用21x150mmc18柱,用含0.1%甲酸的95%去离子水和5%-95%乙腈梯度以20ml/分钟经30分钟洗脱来进行hplc纯化。收集所需产物,冷冻并冻干,得到约0.25mg(产率9%)呈白色固体状的所需产物。ms(m+h)+实测值972.5;计算值972.3;ms(m–1)实测值970.4;计算值970.3。
实施例13.
将磺基-spdb-肼(1mg,3.1μmol)和dm4(4mg,5.1μmol)溶解于dmf(300μl)和1/4饱和碳酸氢钠水溶液(100μl)中且磁力搅拌1小时。反应混合物使用21x150mmc18柱,用含0.1%甲酸的95%去离子水和5%-95%乙腈梯度以20ml/分钟经30分钟洗脱来进行hplc纯化。收集所需产物,冷冻并冻干,得到约1mg(产率19%)呈白色固体状的所需产物。ms(m+h)+实测值992.6,计算值992.3;ms(m-1)实测值990.5,计算值990.3。
实施例14.
boc保护的ala-ala-ala-oh(化合物25)可通过与n-羟基琥珀酰亚胺和edc偶合剂反应,随后与肼反应来活化。所得酰肼(化合物26)可通过与fmoc-cl反应而经fmoc保护,且boc保护基可通过与稀hcl反应来移除。所得化合物27可与1,4-二噁烷-2,6-二酮在dipea存在下反应,得到化合物28。dm’可使用edc而与化合物28偶合且fmoc保护基可通过与吗啉反应来移除,得到所需化合物29。
所述方案可通过用boc保护的氨基酸或肽置换boc-ala-ala-ala-oh(化合物25)而一般化且戊二酸酐还可通过不同环状酸酐或用单保护的二酸置换,得到在dm’与肽部分之间的其它间隔基。
实施例15.
boc保护的h-gly-gly-gly-oh(化合物8)可通过与9-芴甲醇dic偶合剂和二甲氨基吡啶(dmap)反应进行保护。所得化合物30可用三氟乙酸进行boc脱保护,得到化合物31,其可与1,4-二噁烷-2,6-二酮反应,随后与三甲基硅烷基乙醇在dic和dmap存在下进行保护反应,得到化合物32。接着,化合物32可用吗啉处理以使9-芴甲烷酯脱保护,得到化合物33。接着,dm’可利用edc偶合剂和hobt与化合物33偶合,得到化合物34。化合物34的三甲基硅烷基乙烷酯可通过用氟化叔丁基铵处理来移除,随后与n-羟基琥珀酰亚胺反应以活化羧酸基团且接着与肼反应,得到所需化合物35。
所述方法可通过用所选boc保护的氨基酸或肽置换boc-gly-gly-gly-oh来一般化。1,4-二噁烷-2,6-二酮还可被不同环状酸酐或单三甲基硅烷基乙烷保护的二酸置换,得到在dm’与肽部分之间具有其它间隔基的本发明的其它化合物。
实施例16.
boc保护的ala-ala-ala-oh(化合物25)可通过n-羟基琥珀酰亚胺(nhs)和edc反应,随后与1,2-二氨基乙烷反应来活化,得到化合物36。化合物36可在edc偶合剂存在下用fmoc-氨氧基乙酸处理,随后用稀hcl脱除boc。所得化合物37可与1,4-二噁烷-2,6-二酮反应,得到化合物38。dm’与化合物38在edc存在下偶合,随后用吗啉脱除羟胺保护,得到最终产物化合物39。
可以boc保护的氨基酸或boc保护的肽使用类似方法,以产生具有不同肽侧链的本发明化合物。1,4-二噁烷-2,6-二酮还可被不同环状酸酐或单保护的二酸置换,得到在dm’与肽部分之间的其它间隔基。
实施例17.
化合物36b的合成
在含有磁力搅拌棒的烧瓶中,将boc-gly3-oh(25b,6g,20.7mmol)溶解于dmf(40ml)中,向其中添加n-羟基琥珀酰亚胺(2.4g,20.7mmol)和edc(4g,20.7mmol)。磁力搅拌反应1小时,接着在室温下,在剧烈磁力搅拌下将其缓慢倾入磁力搅拌的乙二胺(8g,133mmol)于dmf(20ml)中的溶液中。添加乙醚(200ml)以沉淀固体。接着涡旋烧瓶且将其放入超声波浴中,保持15分钟。真空过滤所述物质,接着在室温下真空干燥,接着将其溶解于dmf(20ml)中且使用大致相等的注射体积在50mmx220mm装载锁定型c18柱上,前5分钟用含0.2%甲酸的去离子水和5%乙腈的乙腈梯度,接着从5分钟至32分钟用5%-95%乙腈的线性梯度以100ml/分钟洗脱进行三轮纯化,且在220nm下检测。合并含有纯所需产物的级分,冷冻并冻干,得到4.5g(产率65%)所需产物36b。
化合物36c的合成
将fmoc氨氧基乙酸(187mg,0.60mmol)溶解于无水dmf(1ml)中,向其中添加tbtu(243mg,0.76mmol)和dipea(95μl,0.54mmol)并磁力搅拌3分钟。接着在磁力搅拌下,添加boc-gly3nh-(ch2)2-nh2(200mg,0.54mmol)于无水dmf(1ml)中的溶液。1小时之后,在27mmx220mm装载锁定型c18柱上,前5分钟用含0.2%甲酸的去离子水和10%乙腈的乙腈梯度,接着从5分钟至32分钟用10%-95%乙腈的线性梯度以40ml/分钟洗脱来直接纯化反应物,且在254nm下检测。合并含有纯所需产物的级分,冷冻并冻干,得到60mg(产率17%)所需产物36c。1hnmr(400mhz,dmso-d6)δ1.37(s,9h),3.15(dt,j=10.0,5.6hz,4h),3.58(d,j=6.0hz,2h),3.67(d,j=5.8hz,2h),3.74(d,j=5.6hz,2h),4.16(s,2h),4.26(t,j=6.7hz,1h),4.43(d,j=6.7hz,2h),7.01(t,j=6.0hz,1h),7.33(td,j=7.4,1.2hz,2h),7.42(t,j=7.4hz,2h),7.68(d,j=7.4hz,2h),7.85(d,j=6.0hz,1h),7.89(d,j=7.5hz,2h),7.97(d,j=5.7hz,1h),8.05(t,j=5.6hz,1h),8.10(t,j=6.0hz,1h)。hrms计算值649.2592,实测值649.2588。
化合物37b的合成
在25ml圆底烧瓶中装入boc-gly3-nh(ch2)2nhcoch2-o-nh-fmoc(76mg,0.122mmol)且将其溶解于95/5三氟乙酸水溶液(10ml)中。在室温下磁力搅拌反应1小时。在真空中减少反应物体积且将粗残余物再溶解于1:1的二氯甲烷与甲苯的混合物(10ml)中,接着真空浓缩。重复共蒸发三次且所得产物(37b)不经进一步纯化即使用。ms(m+h+)实测值:527.4,计算值527.2;(m-1)。
化合物38b的合成
在10ml圆底烧瓶中装入叔丁基保护的h-gly3-nh(ch2)2nhcoch2onh-fmoc(64mg,0.122mmol)和dmf(3ml)。搅拌所述溶液,同时依序添加二甘醇酐(15.52mg,0.134mmol)和n,n-二异丙基乙胺(0.042ml,0.243mmol)。该烧瓶配备有隔膜且在室温下磁力搅拌1小时。通过半制备型c18hplc,用含0.1%甲酸的去离子水和5–95%乙腈的线性梯度经25分钟洗脱来分离所需产物。合并含产物的级分且真空浓缩,得到40mg(0.062mmol,产率51.2%)呈白色残余物形式的所需产物(38b)。ms(m+h+)实测值:643.4,计算值643.2;(m-1)实测值:641.2,计算值:641.2。
化合物38c的合成
在10ml圆底烧瓶中装入may-nma(5.06mg,7.78μmol)于乙酸乙酯(1.500ml)中的溶液。接着添加n-(3-二甲氨基丙基)-n′-乙基碳化二亚胺盐酸盐(edc,3.73mg,0.019mmol)和n,n-二异丙基乙胺(3.39μl,0.019mmol),随后添加hococh2och2co-gly3nh(ch2)2nhcoch2onh-fmoc(10mg,0.016mmol)于n,n-二甲基甲酰胺(1.5ml)中的溶液。在室温下搅拌反应1小时。将反应物体积在真空中减少一半且通过半制备型c18hplc,用含0.1%甲酸的去离子水和5–95%乙腈的线性梯度经25分钟洗脱来分离产物。合并含产物的级分,冷冻并冻干,得到1.4mg(产率13%)呈白色固体状的所需产物(38c)。ms(m+na+)实测值:1296.7,计算值:1296.5。
化合物39b的合成
将may-nma-coch2och2co-gly3nh(ch2)2nhch2onh-fmoc(1.4mg,1.098μmol)溶解于n,n-二甲基甲酰胺(1.5ml)中且将其转移至配备有搅拌棒的3ml玻璃小瓶中。搅拌溶液,同时添加20%v/v吗啉(300μl,3.44mmol)。反应在室温下在搅拌下进行,直至确定完成。粗反应混合物通过半制备型c18hplc,经3次注射来纯化。合并含产物的级分,将其转移至闪烁小瓶中,在干冰和丙酮浴中冷冻并冻干,得到1.1mg(产率95%)所需产物(39b)。ms(m+na+)实测值:1074.7,计算值:1074.4;高分辨率ms(m+h)+实测值:1052.4331,计算值:1052.4338;(m+cl-)实测值:1086.5,计算值:1086.4。
实施例18.
fmoc-gly3-maynma
在100ml烧瓶中装入maynma(200mg,0.308mmol)于乙酸乙酯(19ml)中的溶液。真空浓缩反应烧瓶以移除etoac。将所述物质再溶解于dmso(10ml)中,用fmoc-gly3-oh(165mg,0.400mmol)、hobt(12.25mg,0.080mmol)、edc(77mg,0.400mmol)和dipea(53.7μl,0.308mmol)处理。在室温下,在氩气下进行反应。1小时之后,反应物使用combiflashrf200i,使用c18高效金30g柱以35ml/分钟进行纯化。用含0.1%甲酸的去离子水和5–95%乙腈梯度经20分钟洗脱。合并含所需产物的级分,冷冻并冻干,得到所需产物296mg(产率93%)。ms(m)+实测值1043.4;计算值:1043.4
h-gly3-maynma
将fmoc-gly3-maynma(37.7mg,0.036mmol)溶解于20%吗啉的dmso溶液(5ml)中且磁力搅拌1小时。反应物使用combiflashrf200i,使用c18高效金30g柱以35ml/分钟进行纯化。用含0.1%甲酸的去离子水和2-95%乙腈梯度经25分钟洗脱。合并含所需产物的级分,冷冻并冻干,得到所需产物20mg(产率75%)。lrms(m)+实测值821.40,计算值:821.34
fmoc-氨氧基-gly3-maynma
将h-gly3-maynma(15mg,0.018mmol)溶解于dmso(2ml)中,向其中添加fmoc-氨氧基乙酸(11.44mg,0.037mmol)、dipea(3.19μl,0.018mmol)和edc(7.0mg,0.037mmol)。1小时之后,粗物质通过半制备型c18hplc,使用xb-c1821.2x150mm,5μm柱以21.2ml/分钟流速进行纯化。用含0.1%甲酸和5%乙腈的去离子水洗脱3分钟,接着在5–25分钟内以5%-95%乙腈的线性梯度洗脱。合并含所需产物的级分,冷冻并冻干,得到2mg(8%产率)所需产物。ms(m+na)+实测值1138.6,计算值:1138.4
氨氧基-gly3-maynma
在室温下,在磁力搅拌下用20%吗啉的dmso溶液(1ml)处理fmoc-氨氧基-gly3-maynma(2mg,18μmol)2小时。反应物通过半制备型c18hplc,使用xb-c1821.2x150mm,5μm柱以21.2ml/分钟流速进行纯化。用含0.1%甲酸和5%乙腈的去离子水洗脱5分钟,接着在5分钟至25分钟内用5%-95%乙腈的线性梯度洗脱。立即收集含所需产物的级分,冷冻并冻干,得到氨氧基-gly3-maynma(0.2mg,0.224μmol)。lrms(m+na)+实测值916.60,计算值:916.36;hrms(m+na)+实测值:916.3466;计算值:916.3466。
实施例19.
fmoc保护的氨氧基maynma
在100ml烧瓶中装入溶于乙酸乙酯(35ml)中的maynma(150mg,0.231mmol)。真空浓缩反应烧瓶以移除etoac。在磁力搅拌下,将所述物质再溶解于dmf(5ml)中,用fmoc-氨氧基乙酸(72.3mg,0.231mmol),随后edc(44.2mg,0.231mmol)处理。使反应在氩气下在室温下进行4小时,接着通过半制备型c18hplc,使用xb-c1821.2x150mm,5μm柱以21.2ml/分钟流速纯化。前5分钟用含0.1%甲酸的去离子水和5%乙腈梯度洗脱,接着从5分钟至25分钟用5%-95%乙腈梯度洗脱。合并含所需产物的级分,冷冻并冻干,得到24.2mg(11%产率)所需产物。lrms(m)+实测值945.35,计算值:945.36
氨氧基-maynma
用20%吗啉的dmf溶液(2ml)处理fmoc保护的氨氧基maynma(24.2mg,0.026mmol)。1小时之后,在磁力搅拌下,反应物通过半制备型c18hplc,使用xb-c1821.2x150mm,5μm柱以21.2ml/分钟流速进行纯化。前5分钟用含0.1%甲酸的去离子水和5%乙腈梯度洗脱,接着用5%-95%线性梯度经25分钟洗脱。合并含所需产物的级分,冷冻并冻干,得到10mg(54.0%产率)所需产物。ms(m)+实测值:723.3,计算值:723.3;高分辨率ms实测值:723.2995;计算值:723.3003。
实施例20.单次剂量的serimab位点特异性humov19nts#2-接头1-化合物a针对雌性scid小鼠中nci-h2110nsclc异种移植物的抗肿瘤活性
从charlesriverlaboratories获得6周龄的雌性cb.17scid小鼠。通过在右侧腹中皮下注射,用悬浮于0.1ml50%基质胶/无血清培养基中的1x107个nci-h2110肿瘤细胞接种小鼠。当肿瘤体积达到约100mm3(接种后第7天)时,基于肿瘤体积将动物随机分成4个组,每组6只小鼠。第1天(接种后第8天),小鼠接受单次静脉内施用的媒剂对照物(每只小鼠0.2ml)或基于化合物a浓度的10、25或50μg/kg的humov19nts#2-接头1-化合物a([6],方案1)缀合物。
每周两到三次使用测径器以三个尺寸测量肿瘤大小。肿瘤体积是使用式v=长度×宽度×高度×1/2计算,以mm3表示。当肿瘤体积减小50%或更多时,认为小鼠具有部分消退(pr),当无法检测到明显肿瘤时,认为具有完全肿瘤消退(cr)。肿瘤体积是通过studylog软件测定。
肿瘤生长抑制(t/c值)是使用下式测定:
t/c(%)=治疗组的中值肿瘤体积/对照组的中值肿瘤体积×100。
当媒剂对照组的肿瘤体积达到预定大小1000mm3时,同时测定治疗组(t)和媒剂对照组(c)的肿瘤体积。测定每一治疗组的每日中值肿瘤体积,包括无肿瘤小鼠(0mm3)。根据nci标准,t/c≤42%为抗肿瘤活性的最低水平。t/c<10%被视为高抗肿瘤活性水平。
如图13中所示,缀合物在25μg/kg和50μg/kg剂量下具有高活性。
实施例21.通过用蛋白质a树脂亲和力捕获来富集分解代谢物
在5xt150组织培养盘中培养表达叶酸受体α(frα)的kb细胞。37℃下,在用5%co2缓冲的潮湿恒温箱中将饱和量的frα靶向性humov19nts#2-接头1-化合物a(或serimab-sdgn462)缀合物与kb细胞一起孵育24小时。24小时之后,采集含有细胞流出的分解代谢物的培养基且汇集用于随后的测定。
通过在4℃下孵育隔夜,使饱和量的抗异吲哚啉并苯并二氮杂
在5xt150组织培养盘中培养表达叶酸受体α(frα)的kb细胞。37℃下,在用5%co2缓冲的潮湿恒温箱中将饱和量的frα靶向性humov19-nts#2-氨氧基-乙酰基-maynma(又称“serimab-may”)缀合物与kb细胞一起孵育24小时。24小时之后,采集含有细胞流出的分解代谢物的培养基且汇集用于随后的测定。
通过在4℃下孵育隔夜,使饱和量的抗美登素抗体结合至蛋白质a树脂的浆液。在端至端旋转器上,用20ml培养基孵育1ml预先结合的蛋白质a/抗美登素抗体复合物数小时。以1000rpm轻柔地离心树脂且倾析上清液。用pbs(5x)洗涤结合至类美登素分解代谢物的蛋白质a/抗美登素抗体树脂,以移除培养基组分。通过丙酮萃取将分解代谢物释放至有机相中。将分解代谢物真空干燥隔夜,直至有机溶液完全蒸发。分解代谢物用20%乙腈水溶液复水,且通过lc-ms进行分析。
ms分析
通过完整质量分析,使用waterslctesi-tof表征humov19-nts#2缀合物的药物分布特征。通过lc/ms/ms,使用watersqtof进行所述缀合物的胰蛋白酶酶解肽谱定位(样品经还原,烷基化,随后以胰蛋白酶消化)。通过uhplc/ms/ms,使用q-exactive高分辨率质谱仪(thermo)鉴别细胞分解代谢物。使用萃取离子色谱图(xic)鉴别并表征靶细胞分解代谢物。对含有特征性美登森(547m/z)和dgn(286m/z)质量特征的所有分解代谢物质进行鉴别。
在24小时处理之后,serimab-sdgn462和serimab-may缀合物均产生由靶细胞流出的分解代谢物。含有末端羧酸的dgn和类美登素代谢物与在抗体重链上的n末端丝氨酸或相邻缬氨酸是残基的蛋白水解一致。这些分解代谢物为serimab缀合平台所特有的,因为预期由半胱氨酸或赖氨酸缀合得到的代谢产物将为两性的。sdgn462缀合物产生另外的分解代谢物,与硫醇基(dgn-苯胺)的二硫键裂解(sdgn462)和自降解一致。赖氨酸连接的dgn462缀合物还产生这些代谢产物。
实施例22.旁观者活性
在96孔盘(falcon,圆底)中,一式六份在补充有热灭活的10%fbs(lifetechnologies)、0.1mg/ml庆大霉素(lifetechnologies)和βme(lifetechnologies)的rpmi-1640(lifetechnologies)中分别稀释浓度为1e-10m和4e-10m的每孔50μl缀合物。在血细胞计数器上对表达重组folr1(fr1#14)或无表达载体(亲本)的300.19细胞(小鼠)进行计数。将50μl/ml每孔1000个fr1#14细胞添加至含有adc或仅含培养基的孔中,将50μl/ml每孔2000个亲本细胞体积至含有adc或仅含培养基的孔中且将fr1#14与亲本细胞一起添加至含有adc或仅含培养基的孔中。所有盘在含5%co2的37℃恒温箱中孵育4天。总体积为每孔150μl。孵育之后,通过添加每孔75μlcelltiterglo(promega)且使其显影30分钟来分析细胞活力。在亮度计上读取发光度且从所有值减去仅含培养基的孔的背景值。使用graphpadprism绘制每一细胞处理的平均值的柱形图。
如图16中所示,经由赖氨酸或n末端丝氨酸缀合的二硫键连接的sdgn462adc显示对邻近抗原阴性细胞有效的旁观者杀灭作用。
对于丝氨酸连接的d8缀合物观察到类似结果。参看图27。
实施例23.合成化合物d8
步骤1:将羟氨基甲酸叔丁酯(1.490g,11.19mmol)溶解于无水dmf(22.38ml)中。添加2-(3-溴丙基)异吲哚啉-1,3-二酮(3g,11.19mmol)和碳酸钾(3.09g,22.38mmol)且在室温下搅拌反应隔夜。将其用冷水稀释且用etoac萃取。有机物用盐水洗涤,经硫酸钠干燥且粗残余物通过硅胶急骤色谱法(etoac/hex,梯度0%至45%)纯化,得到呈黏稠固体状的化合物8a(2.41g,67%产率)。lcms=4.99分钟(8分钟方法)。1hnmr(400mhz,cdcl3):δ7.86-7.83(m,2h),7.73-7.77(m,2h),7.28(bs,1h),3.92(t,2h,j=6.0hz),3.82(t,2h,6.9hz),2.05-1.98(m,2h),1.47(s,9h)。
步骤2:将化合物8a(2.41g,7.52mmol)溶解于无水dcm(18.81ml)中且在冰浴中冷却至0℃。添加dcm(9.40ml)与tfa(9.40ml)的新鲜混合的溶液。在室温下搅拌反应1小时且用dcm稀释,并用饱和碳酸氢钠洗涤。有机层用盐水洗涤,干燥,过滤并浓缩,得到化合物8b(1.32g,80%产率)。粗物质不经进一步纯化即使用。1hnmr(400mhz,cdcl3):δ7.85-7.82(m,2h),7.72-7.69(m,2h),3.78(t,2h,j=7.0hz),3.72(t,2h,6.0hz),1.99-1.93(m,2h)。
步骤3:将化合物8b(100mg,0.454mmol)溶解于无水dcm(4.5ml)中。添加tea(127μl,0.908mmol)和(2-(三甲基硅烷基)乙基)碳酸2,5-二氧代吡咯烷-1-基酯(177mg,0.681mmol)且在室温下搅拌反应隔夜。反应物用dcm稀释,用盐水洗涤,干燥,过滤并蒸发。粗残余物通过硅胶急骤色谱法(etoac/hex,梯度0%至40%)纯化,得到化合物8c(148mg,89%产率)。lcms=5.91分钟(8分钟方法)。1hnmr(400mhz,cdcl3):δ7.86-7.83(m,2h),7.73-7.69(m,2h),7.39(bs,1h),4.26-4.20(m,2h),3.94(t,2h,j=6.0hz),3.83(t,2h,6.9hz),2.06-1.98(m,2h),1.05-0.98(m,2h),0.04(s,9h)。
步骤4:将化合物8c(148mg,0.406mmol)溶解于乙醇(2.7ml)中且搅拌直至完全溶解。添加肼(63.7μl,2.030mmol)且在室温下搅拌反应,直至在1小时的时迅速形成白色沉淀。使反应物滤过硅藻土且再用乙醇冲洗。蒸发滤液且通过硅胶急骤色谱法(a=meoh,b=etoac梯度,100%至10%)纯化。通过质量检测产物级分且蒸发,得到呈黏稠固体状的化合物8d(67.5mg,71%产率)。1hnmr(400mhz,cdcl3):δ4.27-4.21(m,2h),3.98(t,2h,j=5.9hz),2.92-2.87(m,2h),1.85-1.77(m,2h),1.06-0.99(m,2h),0.04(s,9h)。
步骤5:将(s)-2-(((苯甲氧基)羰基)氨基)丙酸(5g,22.40mmol)和(s)-2-氨基丙酸叔丁基酯盐酸盐(4.48g,24.64mmol)溶解于无水dmf(44.8ml)中。添加edc·hcl(4.72g,24.64mmol)、hobt(3.43g,22.40mmol)和dipea(9.75ml,56.0mmol)。在氩气下,在室温下搅拌反应隔夜。反应混合物用二氯甲烷稀释且接着用饱和氯化铵、饱和碳酸氢钠、水和盐水洗涤。有机层经硫酸钠干燥且浓缩。粗油状物经由硅胶色谱法(己烷/乙酸乙酯)纯化,得到化合物2a(6.7g,85%产率)。1hnmr(400mhz,cdcl3):δ7.38-7.31(m,5h),6.53-6.42(m,1h),5.42-5.33(m,1h),5.14(s,2h),4.48-4.41(m,1h),4.32-4.20(m,1h),1.49(s,9h),1.42(d,3h,j=6.8hz),1.38(d,3h,j=7.2hz)。
步骤6:将化合物2a(6.7g,19.12mmol)溶解于甲醇(60.7ml)和水(3.03ml)中。用氩气净化溶液五分钟。缓慢添加钯/碳(潮湿,10%)(1.017g,0.956mmol)。在氢气氛围下搅拌反应隔夜。使溶液滤过硅藻土,用甲醇冲洗并浓缩。将其与甲醇和乙腈共沸,且将所得油状物直接放于高真空下,得到化合物2b(4.02g,97%产率),直接用于下一步骤。1hnmr(400mhz,cdcl3):δ7.78-7.63(m,1h),4.49-4.42(m,1h),3.55-3.50(m,1h),1.73(s,2h),1.48(s,9h),1.39(d,3h,j=7.2hz),1.36(d,3h,j=6.8hz)。
步骤7:将化合物2b(4.02g,18.59mmol)和己二酸单甲酯(3.03ml,20.45mmol)溶解于无水dmf(62.0ml)中。添加edc·hcl(3.92g,20.45mmol)、hobt(2.85g,18.59mmol)和dipea(6.49ml,37.2mmol)。在室温下,搅拌混合物隔夜。反应物用二氯甲烷/甲醇(150ml,5:1)稀释并用饱和氯化铵、饱和碳酸氢钠和盐水洗涤。其经硫酸钠干燥,过滤并汽提。使化合物与乙腈共沸(5x),接着在高真空下在35℃下泵浦,得到化合物2c(6.66g,100%产率)。粗物质不经纯化即用于下一步骤。1hnmr(400mhz,cdcl3):δ6.75(d,1h,j=6.8hz),6.44(d,1h,j=6.8hz),4.52-4.44(m,1h),4.43-4.36(m,1h),3.65(s,3h),2.35-2.29(m,2h),2.25-2.18(m,2h),1.71-1.60(m,4h),1.45(s,9h),1.36(t,6h,j=6.0hz)。
步骤8:在室温下,将化合物2c(5.91g,16.5mmol)在tfa(28.6ml,372mmol)和去离子水(1.5ml)中搅拌三小时。反应混合物在乙腈存在下浓缩且放于高真空下,得到呈黏稠固体状的粗化合物2d(5.88g,100%产率)。1hnmr(400mhz,cdcl3):δ7.21(d,1h,j=6.8hz),6.81(d,1h,j=7.6hz),4.69-4.60(m,1h),4.59-4.51(m,1h),3.69(s,3h),2.40-2.33(m,2h),2.31-2.24(m,2h),1.72-1.63(m,4h),1.51-1.45(m,3h),1.42-1.37(m,3h)。
步骤9:将化合物2d(5.6g,18.52mmol)溶解于无水二氯甲烷(118ml)和无水甲醇(58.8ml)中。添加(5-氨基-1,3-亚苯基)二甲醇(2.70g,17.64mmol)和eedq(8.72g,35.3mmol)且在室温下搅拌反应隔夜。汽提溶剂且添加乙酸乙酯。过滤所得浆液,用乙酸乙酯洗涤且在真空/n2下干燥,得到化合物2e(2.79g,36%产率)。1hnmr(400mhz,dmso-d6):δ9.82(s,1h),8.05,(d,1h,j=9.2hz),8.01(d,1h,j=7.2hz),7.46(s,2h),6.95(3,1h),5.21-5.12(m,2h),4.47-4.42(m,4h),4.40-4.33(m,1h),4.33-4.24(m,1h),3.58(s,3h),2.33-2.26(m,2h),2.16-2.09(m,2h),1.54-1.46(m,4h),1.30(d,3h,j=7.2hz),1.22(d,3h,j=4.4hz)。
步骤10:将化合物2e(0.52g,1.189mmol)和四溴化碳(1.183g,3.57mmol)溶解于无水dmf(11.89ml)中。添加三苯基膦(0.935g,3.57mmol)且在氩气下搅拌反应四小时。反应混合物用dcm/meoh(10:1)稀释且用水和盐水洗涤,经硫酸钠干燥,过滤且浓缩。粗物质通过硅胶色谱法(dcm/meoh)纯化,得到化合物2f(262mg,39%产率)。1hnmr(400mhz,dmso-d6):δ10.01(s,1h),8.11(d,1h,j=6.8hz),8.03(d,1h,j=6.8hz),7.67(s,2h),7.21(s,1h),4.70-4.64(m,4h),4.40-4.32(m,1h),4.31-4.23(m,1h),3.58(s,3h),2.34-2.26(m,2h),2.18-2.10(m,2h),1.55-1.45(m,4h),1.31(d,3h,j=7.2hz),1.21(d,3h,j=7.2hz)。
步骤11:将二溴化物化合物2f和ign单体化合物i-1溶解于dmf中。添加碳酸钾且在室温下搅拌隔夜。向反应混合物中添加水以移出产物。浆液在室温下搅拌5分钟且接着过滤,并在真空/n2下干燥1小时。粗物质通过硅胶色谱法(二氯甲烷/甲醇)纯化,得到化合物2g(336mg,74%产率)。lcms=5.91分钟(15分钟方法)。ms(m/z):990.6(m+1)+。
步骤12:将二亚胺化合物2g溶解于1,2-二氯乙烷中。向反应混合物中添加nabh(oac)3且在室温下搅拌1小时。反应物用ch2cl2稀释且nh4cl饱和水溶液淬灭。分离各层且用盐水洗涤,经na2so4干燥并浓缩。粗物质经由rphplc(c18柱,乙腈/水)纯化,得到化合物2h(85.5mg,25%产率)。lcms=6.64分钟(15分钟方法)。ms(m/z):992.6(m+1)+。
步骤13:将甲酯化合物2h溶解于1,2-二氯乙烷中。向反应混合物中添加三甲基氢氧化锡且在80℃下加热隔夜。将反应混合物冷却至室温且用水稀释。用1mhcl将水层酸化至约ph4。混合物用ch2cl2/meoh(10:1,3x20ml)萃取。合并的有机层用盐水洗涤且经na2so4干燥,并浓缩。使粗物质通过二氧化硅塞,得到化合物2i(48.8mg,80%产率)。lcms=5.89分钟(15分钟方法)。ms(m/z):978.6(m+1)+。
步骤14:将化合物2i(30mg,0.031mmol)悬浮于无水dcm(613μl)中。逐滴添加无水dmf,直至溶液变澄清。添加化合物8d(21.57mg,0.092mmol)、edc·hcl(29.4mg,0.153mmol)和dmap(0.749mg,6.13μmol)且在室温下搅拌反应1小时。将其用dcm/meoh10:1稀释,且接着用水洗涤。水层用dcm/meoh10:1萃取且干燥合并的有机物并浓缩,得到化合物8e(49mg),不经进一步纯化即使用。lcms=5.94分钟(8分钟方法)。ms(m/z):1194.4(m+1)+。
步骤15:将化合物8e(49mg,0.041mmol)溶解于thf(820μl)中且在冰浴中将反应物冷却到0℃。添加tbaf(205μl,0.205mmol)且搅拌反应15分钟,随后移除冰浴。在室温下搅拌,直至反应完成。将反应物冷却到0℃,用饱和氯化铵淬灭且用dcm/meoh10:1萃取。有机物用盐水洗涤,用硫酸钠干燥并蒸发。粗物质经由rphplc(c18柱,乙腈/水)纯化,得到化合物d8(17.6mg,经2个步骤54%产率)。lcms=5.1分钟(8分钟方法)。ms(m/z):1050.4(m+1)+。
实施例24.合成化合物d9
步骤1:将化合物9a(17mg,0.016mmol)溶解于dcm(328μl)中。在室温下添加化合物8d(5.76mg,0.025mmol)和dipea(5.71μl,0.033mmol),且搅拌反应直至完成。将其用10:1dcm:meoh稀释且用盐水洗涤。干燥有机物并浓缩,得到化合物9b,将其直接使用。
步骤2:化合物d9是以与实施例23中化合物d8类似地方式制备。粗物质经由rphplc(c18柱,乙腈/水)纯化,得到化合物d9(5mg,经2个步骤产率31%)。lcms=5.68分钟(8分钟方法)。ms(m/z):1012.5(m+1)+。
实施例25.制备hucd123-6抗体的serimab缀合物
a)n末端抗体缀合—两步法
用5mm过碘酸钠水溶液(50当量,25℃,30分钟)处理hucd123-6gv4.6/7s3抗体([1],方案3,如图5中所示;3mg/ml于pbs中,ph7.4)。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
用含有10%v/v共溶剂的4-氨基苯乙醇(100mm于dma[n,n-二甲基乙酰胺]中)处理所得溶液。随后引入异双官能接头1([3],方案3;5当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成hepes(4-(2-羟乙基)-1-哌嗪乙烷磺酸)缓冲液,ph8.5。接着用dma(n,n-二甲基乙酰胺)共溶剂(10%v/v)调整溶液,且在25℃下用磺酸化dgn462(sdgn462)([5],方案3;游离硫醇;5当量)处理6小时。
使用nap过滤柱(illustrasephadexg-25dna级,gehealthcare)将所得缀合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖、0.01%tween-20、50μm亚硫酸氢钠配制缓冲液(ph6.2)。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([6],方案3)每个抗体均匀地平均连接有两个dgn462分子(经由q-tof质谱法),具有>98%单体(经由尺寸排阻色谱法)、<2%游离药物(经由丙酮沉淀的反相hplc分析)和0.18mg/ml的最终蛋白质浓度(经由uv-vis,对于hucd123-6gv4.6/7s3抗体,使用摩尔消光系数ε280=213320m-1cm-1)。
b)n末端抗体缀合—ign直接连接
在25℃下,用5mm过碘酸钠水溶液(50摩尔当量)处理工程改造成在重链上具有n末端丝氨酸的工程改造的含n末端ser的hucd123-6gv4.7s2抗体([1],方案4,图17;3mg/ml于pbs中,ph7.4)达30分钟。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
用含有10%v/v共溶剂的对苯二胺(100mm于dma[n,n-二甲基乙酰胺]中)处理所得溶液。随后引入原位磺酸化-d8(或sd8)([3],方案4;5摩尔当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖缓冲液,ph6.2。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([4],方案4)每个抗体均匀地平均连接有两个d8分子(经由q-tof质谱法),具有>96%单体(经由尺寸排阻色谱法)、<3%游离药物(经由hisep反相hplc分析)和1.4mg/ml的最终蛋白质浓度(经由uv-vis,对于hucd123-6gv4.7s2抗体,使用摩尔消光系数ε280=213320m-1cm-1)。
以上描述的原位磺酸化-d8(或sd8)是根据以下程序制备:将冻干呈白色固体形式的d8试剂溶解于dma(n,n-二甲基乙酰胺)中,达到10-20mm储备液浓度。添加新制的亚硫酸氢钠(500mm水溶液,5摩尔当量)且使所得溶液在25℃下反应4-6小时,随后在4℃保持15小时。引入另一等分试样的新制亚硫酸氢钠(500mm水溶液,2摩尔当量)且使其在25℃下反应4小时,随后在-80℃下储存待用。
c)n末端抗体缀合—对于cd123-6gv4.7s3或s2的两步方案
在25℃下,用5mm过碘酸钠水溶液(50摩尔当量)处理工程改造成在轻链上具有n末端丝氨酸的hucd123-6gv4.7s3(或s2-ab的示意图针对s3,但所述方案还适用于s2)抗体([1],方案5,图18;3mg/ml于pbs中,ph7.4)达30分钟。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
用含有10%v/v共溶剂的4-氨基苯乙醇(100mm于dma[n,n-二甲基乙酰胺]中)处理所得溶液。随后引入异双官能接头1([3],方案5;5摩尔当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成hepes(4-(2-羟乙基)-1-哌嗪乙烷磺酸)缓冲液,ph8.5。接着用dma(n,n-二甲基乙酰胺)共溶剂(10%v/v)调整溶液,且在25℃下用磺酸化-d1(或sd1)([5],方案5;游离硫醇;5摩尔当量)处理6小时。
使用nap过滤柱(illustrasephadexg-25dna级,gehealthcare)将所得缀合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖、0.01%tween-20、50μm亚硫酸氢钠配制缓冲液(ph6.2)。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([6],方案5)每个抗体平均连接有2.0个sd1分子(经由q-tof质谱法),具有>96%单体(经由尺寸排阻色谱法)、<3%游离药物(经由丙酮沉淀的反相hplc分析)和0.4mg/ml的最终蛋白质浓度(经由uv-vis,对于hucd123-6gv4.7s3抗体,使用摩尔消光系数ε280=213320m-1cm-1)。
实施例26用于制备带有4个dar的缀合物的n末端抗体缀合
(a)两步法
用5mm过碘酸钠水溶液处理(50当量,25℃,30分钟)工程改造成在重链和轻链上带有n末端丝氨酸的humov19-nts2s3抗体([1],如图19中所示的方案6;3mg/ml于ph7.4的pbs中)。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
在反应容器中,用含有10%v/vdma(n,n-二甲基乙酰胺)共溶剂的4-氨基苯乙醇处理所得溶液,达到10mm浓度。随后引入接头1([3],方案6;10当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成hepes(4-(2-羟乙基)-1-哌嗪乙烷磺酸)缓冲液,ph8.5。接着用dma(n,n-二甲基乙酰胺)共溶剂(10%v/v)调整溶液,且在25℃下用化合物a(或磺酸化dgn462(sdgn462))([5],方案6;游离硫醇;10当量)处理6小时。
使用nap过滤柱(illustrasephadexg-25dna级,gehealthcare)将所得缀合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖、0.01%tween-20、50μm亚硫酸氢钠配制缓冲液(ph6.2)。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([6],方案6)每个抗体均匀地平均连接有四个化合物a分子(经由q-tof质谱法,图20),具有>93%单体(经由尺寸排阻色谱法)、<2%游离药物(经由丙酮沉淀的反相hplc分析)和0.1mg/ml的最终蛋白质浓度(经由uv-vis,对于humov19-nts2s3抗体,使用摩尔消光系数ε280=201400m-1cm-1)。
(b)dmx直接连接
在25℃下,用5mm过碘酸钠水溶液(50摩尔当量)处理工程改造的含n末端ser的humov19-nts2s3抗体([1],方案7,图21a;3mg/ml于pbs中,ph7.4)达30分钟。接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成乙酸钠缓冲液,ph5.0。
在反应容器中,用含有10%v/vdma(n,n-二甲基乙酰胺)共溶剂的4-氨基苯乙醇处理所得溶液,达到10mm浓度。随后引入氨氧基-乙酰基maynma([3],方案7;10摩尔当量),且密封反应容器,并在37℃下孵育24小时。
接着,经由nap脱盐柱(illustrasephadexg-25dna级,gehealthcare)将混合物缓冲液更换成250mm甘氨酸、10mm组氨酸、1%蔗糖缓冲液,ph6.2。在25℃下,利用slide-a-lyzer透析盒(thermoscientific10,000mwco)以相同缓冲液透析4小时。
发现纯化的缀合物([4],方案7)每个抗体均匀地平均连接有四个maynma分子(经由q-tof质谱法,图21b),具有>95%单体(经由尺寸排阻色谱法)、<2%游离药物(经由hisep反相hplc分析)和0.2mg/ml的最终蛋白质浓度(经由uv-vis,对于humov19-nts2s3抗体,使用摩尔消光系数ε280=201400m-1cm-1)。
实施例27hucd123-6抗体的位点特异性缀合物的体外细胞毒性
使用体外细胞毒性测定,将hucd123-6与各种ign化合物的位点特异性缀合物(hucd123-6rv1.1s2-serimab-d8)杀死在细胞表面上表达cd123的细胞的能力与含有相配抗体和有效负载的赖氨酸连接的缀合物(hucd123-6rv1.1-d2)杀死所述细胞的能力相比较。如以下所描述,进行并分析细胞毒性测定。
在由细胞供货商(atcc或dsmz)所推荐的细胞培养基中培养细胞株。将细胞以100μl培养基中2,000至10,000个添加至平底96孔盘的每个孔中。为了阻断细胞表面上的fc受体,细胞培养基补充有100nmchkti抗体(属于相同同型的抗体)。使用3倍连续稀释在培养基中稀释缀合物,且每孔添加100μl。为了确定不依赖于cd123的细胞毒性贡献,在测试缀合物之前,向一些孔中添加cd123阻断抗体(100nmchcd123-6抗体)。在每一测定盘中纳入含有细胞和培养基但无缀合物的对照孔,以及仅含培养基的孔。对于每一数据点,一式三份进行测定。在37℃下,在含6%co2的潮湿恒温箱中孵育所述盘4至7天。接着,使用基于wst-8的cellcountingkit-8(dojindomoleculartechnologies,inc.,rockville,md)测定每个孔中存活细胞的相对数量。通过首先针对培养基背景吸光度校正,且接着用每一值除以对照孔(未处理孔)中所述值的平均值来计算每个孔中细胞的表观存活分数。将细胞存活分数针对缀合物浓度以半对数曲线作图。
在多个细胞株上,hucd123-6rv1.1s2-serimab-d8缀合物保持靶(cd123)结合,且活性至少与赖氨酸连接的hucd123-6rv1.1-d2缀合物相同。使用aml细胞株shi-1和hnt-34,以及cml细胞株molm-1进行细胞毒性测定的若干实例分别显示于图22a-22c中。两种缀合物均以剂量依赖性方式杀死细胞,且shi-1细胞、hnt-34细胞和molm-1细胞的ic50值分别为约0.01nm、0.002nm和0.03nm。杀灭作用是cd123依赖性的,因为当cd123抗原经未缀合的hucd123-6抗体阻断时,所述缀合物对于所述细胞的毒性低至少100倍。
在另一实验中,带有接头1残基的hucd123-6-gv4.7s3-serimab-sd1缀合物(参见图18)在eol-1细胞中显示出与hucd123-6gv4.7s2(或s3)-serimab-d8缀合物(图24)类似的效力。
在另一实验中,发现在较高dar下,经ser连接hucd123抗体的dgn462化合物针对eol-1细胞的抗原特异性效力为赖氨酸连接形式的3倍(参见图25)。赖氨酸连接的缀合物的dar为2.9;而ser连接的缀合物的dar为2.0。相比之下,当使用抗原阴性namalwa细胞时,赖氨酸连接的缀合物与丝氨酸连接的缀合物均展现明显较低的活性,指示在eol-1细胞中的抗原特异性活性。
实施例28.serimab-d8缀合物的体外效力
使用与实施例8中所描述类似的测定方案,在kb细胞(图26a)、ishikawa细胞(人子宫内膜腺癌细胞)(图26b)和hec-1b细胞(人子宫内膜腺癌细胞)(图26c)上测试serimab-d8缀合物(humov19-nts#2-serimab-d8)的体外效力。
如图26a-26c中所示,serimab-d8缀合物具有与赖氨酸缀合物(humov19-d2)相当的抗原特异性效力和靶结合。
实施例29.具有肟键联的serimab缀合物的体内稳定性
亲和力捕获lc-ms
用洗涤缓冲液(50mmtris·hcl,0.15mnacl,ph8.0)洗涤可商购的xmag-streptavidinmicroparticles(biochain,ca)两次且将其再悬浮于相同缓冲液中达到其初始体积。接着,将生物素化的fc-frα(2.6个生物素/fc-frα;约114μg)添加至抗生蛋白链菌素颗粒(200μl)中且在室温下旋转2小时。用洗涤缓冲液洗涤珠粒3次,且将其再悬浮于含0.4%tween20的洗涤缓冲液中,达到其初始体积。
从在2分钟、1天和3天时给与10mg/kghumov19-nts#2-氨氧基-乙酰基-maynma缀合物的cd-1小鼠收集血浆样品,且将其连同最终20%洗涤缓冲液和0.2%tween-20一起添加至抗生蛋白链菌素-生物素-frα-fc颗粒(每一样品200μl)中。在室温下轻柔振荡2小时之后,用1ml洗涤缓冲液洗涤树脂3次且使用50μl的0.1m柠檬酸/柠檬酸钠(ph3.0)、50%乙二醇洗脱。含有纯化的humov19缀合物质的洗脱物立即用9μl1mtris·hcl(ph8.5)中和,且接着如先前所描述(lazar,wang等人,2005),通过sec或sec-lc/ms进行分析。
如图28中所示,在小鼠循环中,肟键联经3天仍稳定。标为d2的峰对应于完整缀合物。标为a和b的峰为由肟水解和美登森消除得到的裂解产物。在约17天的半衰期下,还观察到利用赖氨酸连接的ab-smcc-dm1缀合物已观察到的少量美登素消除。
实施例30.体内耐受性研究
从charlesriverlaboratories获得雌性cd-1小鼠(7周龄)。接收后,在研究开始之前,观察动物8天。动物在到达后或在治疗之前未显示疾病或不适迹象。
根据体重,将小鼠随机分成三组。体重在25.6至24.1克范围内,且平均值为25克。基于个体体重,八只小鼠给与100μg/kg和150μg/kg(d2药物剂量)的humov19-d2,且2只小鼠给与200μg/kg(d8药物剂量)的humov19-serimab-d8。所有缀合物的施用均以配备有27号1/2英寸针的1.0ml注射器经静脉内进行。在指定时间点测量个体的体重(图29)且将变化%对时间(天)作图。每条线表示一只小鼠的体重变化。将濒死或体重减轻>20%的动物处死,因为此被定义为不可耐受的剂量。
如图29中所示,赖氨酸连接的humov19-d2具有约100μg/kg的最大耐受剂量(mtd);而丝氨酸连接的缀合物humov19-serimab-d8在200μg/kg下耐受性良好,且经2周具有极少体重减轻迹象。
实施例31.合成化合物d11
将nhs酯11a(10.5mg,9.47μmol)溶解于dmf(0.316ml)中。在室温下将肼(1.2μl,38μmol)添加至所述溶液中且搅拌2小时。粗反应混合物直接通过rphplc(c18柱,ch3cn/h2o,40%至55%梯度)纯化,得到呈白色固体状的酰肼d11(6.5mg,68%产率)。lcms=4.923分钟(8分钟方法)。质量观测值(esi+):992.70(m+h)。
实施例32.
可使用与实施例25中所描述类似的程序,制备humov19nts2抗体与sd11或sd1的缀合物(参见图30、31a和31b)。
本文引用的所有出版物、专利、专利申请、网际网站和登录号/数据库序列(包括多核苷酸和多肽序列)均以引用的方式整体并入本文中用于所有目的,其引用程度就如同特定且个别地指示每一个别出版物、专利、专利申请、互联网站或登录号/数据库序列如此以引用的方式并入一般。
- 还没有人留言评论。精彩留言会获得点赞!