高效诱导人多能干细胞向心肌细胞分化的小分子化合物组合物的制作方法
本发明涉及生物技术领域,具体地,本发明涉及用于高效诱导人多能干细胞向心肌细胞分化的小分子化合物组合。
背景技术:
心肌疾病是现代社会发病率和致死率最高的重大疾病之一,心肌缺血等疾病造成的心肌损伤属于不可逆的细胞死亡,至今仍缺少有效的治疗方式。自从人胚胎干细胞(hesc)和人诱导多能干细胞(hips)被发现以来(统称人多能干细胞hpsc),人多能干细胞来源心肌细胞成为心肌疾病治疗领域的新希望。除了用于细胞治疗以外,干细胞来源心肌细胞还可以用于心肌疾病治疗性药物筛选和药物心脏特异性毒性检测等重要方面。20年来,人多能干细胞定向分化和应用领域取得了突飞猛进的发展。早期获得心肌细胞的主要方法是将人胚胎干细胞与小鼠的内脏中胚层样细胞(mousevisceralendoderm-likecell,end-2)共培养,或者通过拟胚体的(embryonicbody,eb)的方法获得。这些诱导方法不但需要动物源性的血清,而且分化效率低下产量也非常低。2007年,charlesmurry实验室建立了单层细胞分化系统,通过在rpmi1640和b27组成的基础分化液中添加促心肌分化细胞因子activina和bmp4,在人胚胎干细胞系h7中达到30%的分化效率,但在人胚胎干细胞系h9中效率并不理想,只有不到5%。后期经过优化,即在分化早期加入wnt3a,随后加入dkk1来调控wnt信号通路的活性(先促进后抑制),使分化效率有一定的提升,尤其是在h9中也达到30%的分化效率。
虽然经过多年的发展,人胚胎干细胞心肌分化方法获得了长足的提升,然而分化效率仍有提升空间,分化的稳定性和在不同细胞系中的一致性也需要进一步提升,更重要的是分化成本和产量这些影响大规模生产的因素还需要进一步完善。
因此,本领域迫切需要开发一种能大幅提高心肌细胞分化率的小分子化合物及其方法。
技术实现要素:
本发明的目的是提供一种能大幅提高心肌细胞分化率的小分子化合物及其方法。
本发明第一方面提供了一种小分子化合物组合物,所述的小分子化合物组合物包括以下组分:
(i)mtor信号通路抑制剂;
(ii)wnt通路促进剂;和
(iii)任选的,药学上可接受的载体。
在另一优选例中,所述小分子化合物组合物包括以下组分:
(i)mtor信号通路抑制剂;和
(ii)wnt通路促进剂。
在另一优选例中,所述组分(i)与组分(ii)的摩尔比为1-5000:5000-15000;较佳地为2-500:10000-12000;较佳地5-100:10000-12000;最佳地8-60:10000-12000。
在另一优选例中,所述的组合物的使用浓度包括:
组分(ii)wnt通路促进剂的使用浓度为1-40um,较佳地5-25μm,更佳地10-20μm。
在另一优选例中,所述的组合物的使用浓度包括:
组分(i)mtor信号通路抑制剂的使用浓度为1-200nm,较佳地5-100nm,更佳地10-50nm。
在另一优选例中,所述mtor信号通路抑制剂选自下组:雷帕霉素(rapamycin)、依维莫司(rad001)、ku-0063794、azd8055、西替罗莫司(temsirolimus)、ink128、地磷莫司(ridaforolimus)、或其组合。
在另一优选例中,所述wnt通路促进剂包括:chir99021、bio、或其组合。
在另一优选例中,所述小分子化合物组合物还包括其他的心肌细胞分化促进剂。
在另一优选例中,所述其他的心肌细胞分化促进剂包括akt信号通路抑制剂ly99021。
在另一优选例中,所述小分子化合物组合物为液态组合物,各组分的有效浓度如下所示:
mtor信号通路抑制剂:雷帕霉素(rapamycin):1nm-0.2μm,较佳地,5nm-0.1 μm,更佳地,10nm-50nm;依维莫司(rad001):1nm-0.2μm,较佳地,5nm-0.1μm,更佳地,10nm-50nm;ku-0063794:1nm-0.2μm,较佳地,5nm-0.1μm,更佳地,10nm-50nm;azd8055:1nm-0.2μm,较佳地,5nm-0.1μm,更佳地,10nm-50nm;
wnt通路促进剂:chir99021:1μm-12μm,较佳地,3μ-12μm,更佳地,10μm-12μm;bio:0.5μm-2μm,更佳1μm—2μm。
本发明第二方面提供了一种小分子化合物组合物的用途,用于(i)促进干细胞分化为心肌细胞。
在另一优选例中,所述小分子化合物组合物还可用于(ii)提高干细胞的增殖水平;和/或(iii)抑制干细胞凋亡。
在另一优选例中,所述增殖水平包括干细胞的增殖数量和干细胞的活性。
在另一优选例中,所述干细胞选自下组:人诱导多能干细胞、胚胎干细胞、或其组合。
在另一优选例中,所述干细胞不包括全能干细胞。
在另一优选例中,所述干细胞来源于哺乳动物,较佳地为人、啮齿动物(如小鼠、大鼠)。
在另一优选例中,所述干细胞包括人类多能干细胞(humaninducedpluripotentstemcells,hipsc)。
在另一优选例中,所述人类多能干细胞来源:皮肤成纤维细胞、尿液细胞、外周血细胞、或其组合。
本发明第三方面提供了一种体外诱导干细胞分化为心肌细胞的方法,所述方法包括:
(a)在分化诱导化合物的组合的存在下,在培养体系中培养干细胞系,从而获得所述的心肌细胞,其中所述的分化诱导化合物的组合包括(i)mtor信号通路抑制剂;和(ii)wnt通路促进剂。
在另一优选例中,在所述培养体系中,所述组分(i)与组分(ii)的摩尔比为1-5000:5000-15000;较佳地为2-500:10000-12000;较佳地5-100:10000-12000;最佳地8-60:10000-12000。
在另一优选例中,所述干细胞系包括多能干细胞系或专能干细胞。
在另一优选例中,所述多能干细胞系包括人多能干细胞系。
在另一优选例中,所述干细胞系选自下组:人胚胎干细胞系h9-ctnt-egfp、h9、h7、人多能干细胞系u-q1、或其组合。
在另一优选例中,所述的培养为至少培养10代,较佳地,至少20代,更佳地,至少30-40代。
在另一优选例中,在中胚层形成初始阶段(约为-3天)加入所述的分化诱导化合物的组合,并加以维持。
在另一优选例中,所述的加入包括先后、同时加入(i)mtor信号通路抑制剂;和(ii)wnt通路促进剂。
在另一优选例中,所述的“加入”包括先加入(ii)wnt通路促进剂,然后加入(i)mtor信号通路抑制剂。
在另一优选例中,所述的“加入”使得所述培养体系中,(i)mtor信号通路抑制剂的浓度为1-200nm,较佳地5-100nm,更佳地10-50nm;和/或(ii)wnt通路促进剂的浓度为1-40μm,较佳地5-25μm,更佳地10-20μm。
在另一优选例中,所述方法具有选自下组的一个或多个特征:
(i)高心肌细胞分化率,所述分化率为85-99.9%,较佳地,90-98.5%;
(ii)在培养过程中,每0.5ml的培养液中接种105个干细胞,可产生24×105个心肌细胞;
在另一优选例中,所述方法还包括:(b)对步骤(a)得到的心肌细胞进行富集纯化。
在另一优选例中,所述纯化条件包括:
(a1)纯化培养液:所述培养液为碳源基本上或全部由乳糖构成的基础培养基,并且补加2-15%(w/w)胎牛血清;
在另一优选例中,所述的培养液为含0.1mm-10mm的乳糖(较佳地,0.5mm-5mm,更佳地,1mm-4mm)且补加2-15%(w/w)胎牛血清的dmem/f12培养基;
在另一优选例中,所述的培养液中不含葡萄糖(即葡萄糖含量≤0.05wt%,按培养液总重量计)
(a2)培养时间:5-8天,较佳地,7-8天;
在另一优选例中,纯化后得到的心肌细胞具有99.9%的纯度。
在另一优选例中,所述方法包括治疗性和非治疗性的。
在另一优选例中,所述的培养体系中,干细胞系的密度为0.1-10×105细胞/ml,较佳地,0.5-2×105细胞/ml。
在另一优选例中,所述的培养体系为体积0.1-1000ml,较佳地0.2-100ml, 更佳地0.3-10ml,最佳地为0.4-0.6ml。
在另一优选例中,所述的获得的心肌细胞数量m2与所述干细胞数量m1之比m2/m1为8-36,较佳地12-30,更佳地16-28。
本发明第四方面提供了一种心肌细胞,所述心肌细胞由本发明第三方面所述的方法制备。
在另一优选例中,所述的心肌细胞具有选自下组的个或多个特征:
(i)心肌细胞特异结构基因高表达;
(ii)离子通道基因高表达。
本发明第五方面提供了一种用于促进心肌细胞分化的试剂盒,所述试剂盒包括本发明第一方面所述的小分子化合物组合物。
在另一优选例中,所述试剂盒还包括其他的心肌细胞分化促进剂。
在另一优选例中,所述其他的心肌细胞分化促进剂选自下组:p38mapk信号通路的抑制剂sb203580、维生素c(ascorbicacid)、全反式维甲酸(retinoidacid)、akt信号通路抑制剂ly99021、或其组合。
本发明第六方面提供了一种本发明第四方面所述的心肌细胞的用途,用于制备预防和/或治疗心脏疾病的药物组合物。
在另一优选例中,所述的心脏疾病包括:缺血性心力衰竭、心肌梗塞、或其组合。
本发明第七方面提供了一种组合物,所述的组合物包括:本发明第四方面所述的心肌细胞。
在另一优选例中,所述的组合物包括药物组合物、食品组合物、保健品组合物。
本发明第八方面提供了一种治疗心脏疾病的方法,向需要的对象施用安全有效量的本发明第四方面所述的心肌细胞,和/或本发明第七方面所述的组合物。
在另一优选例中,所述的施用包括局部注射施用。
在另一优选例中,所述对象包括人或非人哺乳动物。
在另一优选例中,所述非人哺乳动物包括啮齿动物,如小鼠、大鼠。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示了rapamycin促进干细胞向心肌细胞分化。
其中,(a)显示了分别单用雷帕霉素、chir、联用雷帕霉素和chir对心肌细胞分化率的影响。具体地,利用带有心肌特异荧光报告基因的人胚胎干细胞系在无细胞因子单层诱导条件下,筛选发现在心肌分化全程加入雷帕霉素(rapamycin,简写rapa)可显著提高心肌细胞的分化效率(左图为荧光显微镜下观察表达gfp细胞的比例图,右图为流式分析统计的gfp阳性细胞数量比例,n=8,**p<0.01,比例尺,200μm)。(b)通过在指定时间点加入和撤掉rapamycin处理来检测其发挥作用的具体时间窗口(n=4,**p<0.01)。(c)延长rapamycin处理时间会影响干细胞来源心肌细胞的产量(n=3,**p<0.01)。(d)为了检测rapamycin促心肌分化作用以及该小分子诱导方法在不同人多能干细胞系之间的普遍适应性,采用相同的培养方法和条件我们在另外3株人多能干细胞(人胚胎干细胞h7、h9和人诱导多能干细胞u-q1)上重复之前的分化,并通过流式检测心肌肌钙蛋白t(ctnt)阳性细胞比例的方法确定心肌分化的效率(n=7,**p<0.01)。(e)分化方法详细示意图。
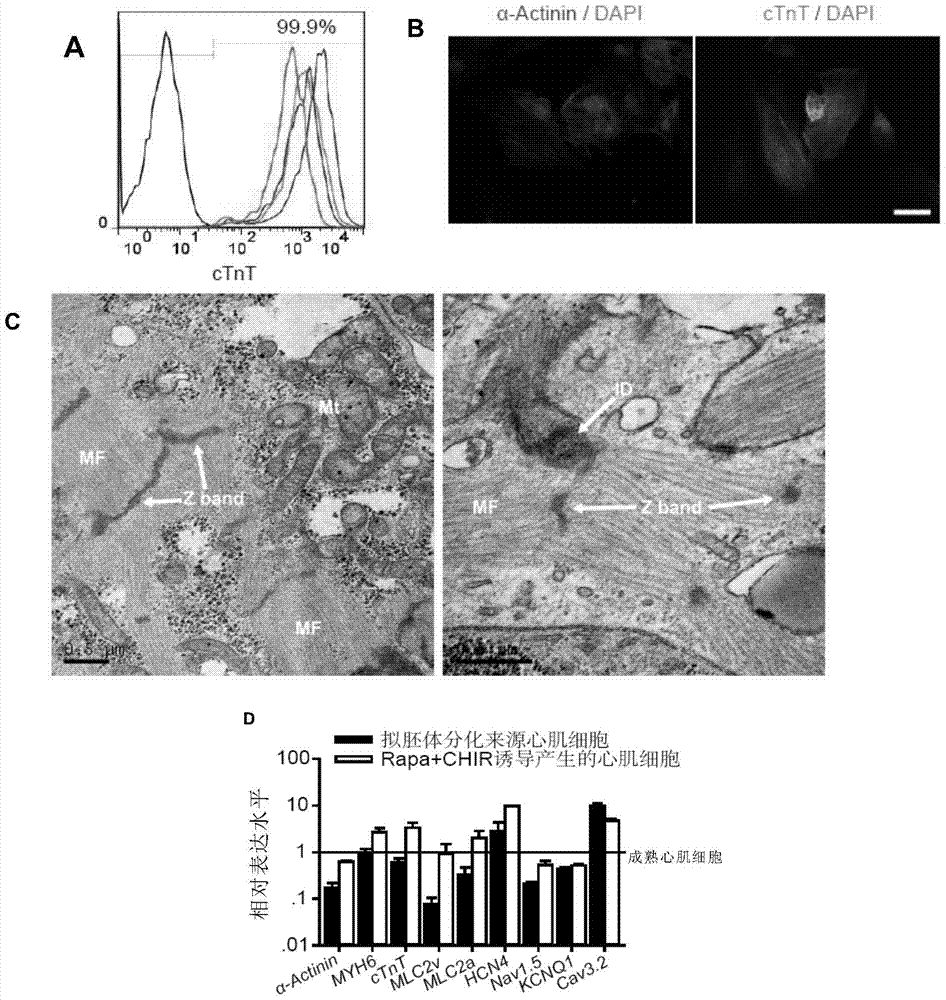
图2显示了rapamycin诱导分化的心肌细胞具有成熟心肌细胞的特征。
其中,(a)分化得到的心肌细胞培养在乳糖为唯一碳源的培液中7天,流式检ctnt-egfp显示心肌细胞的纯度超过99.9%,所示结果为四次独立重复实验。(b)α辅肌动蛋白(α-actinin)和ctnt免疫荧光检测显示分化得到的心肌细胞拥有典型的肌小节结构(比例尺,10μm)。(c)透射电镜显示分化得到的心肌细胞拥有正常的肌原纤维、肌小节、润盘和成熟线粒体结构(mf、z-band、id和mt,scalebars,0.5μm)。(d)rapamycin诱导单层分化获得的心肌细胞具有同经典eb分化产生的心肌细胞和正常人成熟心肌细胞相似的功能和结构基因表达(n=3)。
图3显示了rapamycin促进人胚胎干细胞在高密度培养条件下细胞数量的增加。
图中,人胚胎干细胞以5×104/cm2接种于24孔板,加不同小分子化合物刺激,每个一天检测细胞数量或细胞活性(cck-8检测细胞活性法),记录不同小分子化合物的处理对干细胞数量和细胞活性的影响。
图4显示了rapamycin通过mtor抑制干细胞凋亡。
其中,图(a和b),通过细胞周期分析和brdu增殖检测实验判断不同小分子对干细胞增殖速率的影响。图(c),westernblot检测细胞内parp蛋白的剪切从而判断细胞在不同处理条件下的死亡情况。图(d),通过荧光素酶报告系统检测rapamycin对细胞内凋亡执行蛋白caspase3/7活性的影响。图(e),分别在第三天和第四天培养结束时,通过annexinv/pi染色,检测有无rapamycin处理条件下细胞死亡的比例。图(f),检测在添加caspase抑制剂z-vad-fmk条件下,凋亡是否被完全抑制。以上实验结果均为至少3次独立重复实验的统计结果(*p<0.05,**p<0.01)。
图5显示了其它小分子组合物对心肌细胞分化的影响。其中,图5a显示了rapamycin类似物rad001、ku0063794及azd8055与chir联用对心肌分化效率的影响;图5b显示了wnt信号通路激活剂bio与rapamycin或其类似物联用对心肌细胞分化效率的影响。
其中,在上述各图中,ctnt+%为阳性心肌细胞分化率。
具体实施方式
本发明人经过广泛而深入的研究,经过大量的化合物筛选,首次意外地发现了特定小分子化合物的组合能够高效地诱导多能干细胞转分化为心肌细胞,初筛的心肌细胞分化率达到86%,优化后的心肌细胞分化率高达98.3%,并且乳糖富集纯化后的心肌细胞具有高达99.9%的纯度。
实验表明,将mtor信号通路抑制剂和wnt通路促进剂这两类化合物联合应用于多能干细胞(如人多能干细胞)时,使多能干细胞转分化的心肌细胞成熟度较高,拥有发挥正常的心肌功能的结构基础,即具有相似的心肌特异结构基因和离子通道基因的表达水平。并且本发明的促进心肌分化的方法还能节省一半的培养液和添加剂,极大降低了成本。在此基础上,发明人完成了本发明。
mtor信号通路抑制剂
mtor是一种丝氨酸-苏氨酸蛋白酶,根据调控组分不同,它分为mtorc1和mtorc2两个复合体。mtorc1主要通过激活性磷酸化ribosomalproteins6kinase1(s6k1或p70s6k1)和抑制性磷酸化4e-bindingprotein(4e-bp)来调控细胞内蛋白质合成的速率。
mtor信号通路抑制剂通常包括:雷帕霉素(rapamycin)、依维莫司(rad001)、 ku-0063794、azd8055、temsirolimus、ink128、ridaforolimus等。
在本发明中,本发明检测了rapamycin、依维莫司(everolimus/rad001)、ku-0063794(garcía-martínezjmetal.,biochemj.2009,421(1):29-42)、azd8055(chrestacm,etal.cancerres,2010,70(1),288-298.)等mtor信号通路抑制剂对心肌细胞分化的效果。
wnt通路促进剂
wnt信号通路是已知调控心脏发育的最重要信号通路。wnt蛋白如wnt3属于分泌型糖蛋白,通过旁分泌或自分泌作用与位于细胞膜上的受体相结合,激活胞内的各级信号传导分子,主要是β-catenin的入核,调节靶基因的表达。wnt通路促进剂通常包括:chir99021以及bio。
在本发明中,本发明检测了chir99021(bennettcn,etal.jbiolchem,2002,277(34),30998-31004.)、bio(6-溴靛玉红-3'-肟(6-bromoindirubin-3'-oxime))两个wnt通路促进剂对心肌细胞分化的影响。
小分子化合物组合物
如本文所用,术语“小分子化合物组合物”指的是含有以下组分的组合物:(i)mtor信号通路抑制剂;和(ii)wnt通路促进剂。此外,所述的小分子化合物组合物还可以含有药学上可接受的载体,在这样的情况下,所述的小分子化合物组合物即为具有诱导多能干细胞转分化为心肌细胞活性的药物组合物。
其中,所述的mtor信号通路抑制剂包括:雷帕霉素(rapamycin)、依维莫司(rad001)、ku-0063794、azd8055、temsirolimus、ink128、ridaforolimus。
所述wnt通路促进剂包括:chir99021、bio、或其组合。
可用于本发明小分子组合物的各组分之间的比例没有任何限制。通常,各组分应当满足其最低的有效浓度。在一优选例中,所述小分子化合物组合物中各组分的最低有效浓度如下所示:
mtor信号通路抑制剂:雷帕霉素(rapamycin):1nm-0.2μm,较佳地,1nm-0.1μm,更佳地,10nm-50nm;依维莫司(rad001)::1nm-0.2μm,较佳地,1nm-0.1μm,更佳地,10nm-50nm;ku-0063794:1nm-0.2μm,较佳地,1nm-0.1μm,更佳地,10nm-50nm;azd8055:1nm-0.2μm,较佳地,1nm-0.1μm,更佳地,10nm-50nm;
wnt通路促进剂:chir99021:1μm-12μm,较佳地,3μ-12μm,更佳地,10μm-12μm;bio:0.5μm-2μm,更佳1μm—2μm。
在本发明中,验证了雷帕霉素(rapamycin)和chir99021的组合具有良好的诱导多能干细胞分化心肌细胞的活性。当然,本领域技术人员也可以根据本发明的启示,对以上两类抑制剂进行任意的组合,开发新的具有诱导多能干细胞转分化心肌细胞活性的小分子化合物组合物。
如本文所用,术语“人类多能干细胞”、“多能干细胞”、“hipsc”能互换使用,均指衍生自人类的分离的多能干细胞。在本发明中,本发明的hipsc可以来源于人成肾上皮细胞。
心肌细胞
心肌细胞(cardiomyocyte)具备成体心肌细胞的基本特征,包括肌纤维、肌小节、胞间联系(润盘)、成熟线粒体、心肌特异离职通道。
在本发明中,人多能干细胞经本发明的小分子化合物组合物(药物组合物)诱导分化产生心肌细胞,分化产生的心肌细胞可继续分为心室肌细胞、心房肌细胞和窦细胞三种细胞亚型。
心肌细胞特异结构基因和离子通道基因
如本文所用,术语“心肌细胞特异结构基因”和“离子通道基因”指的是较非心肌细胞而言,在心肌细胞中高表达的基因(或其蛋白)。通常,所述的心肌细胞特异结构基因和离子通道基因包括ctnt、αmhc、nkx2.5、hcn4、nav1.5、cav3.2和kcnq1等。
诱导方法
本发明诱导多能干细胞(如人多能干细胞)转分化为心肌细胞的方法通常指的是体外的诱导方法,当然也可以根据体外诱导实验进行进一步的体内诱导,这可以根据本领域常规技术或方法进行研究获得。
通常,可在本发明小分子化合物组合物存在的条件下,培养多能干细胞。
此外,还可以采用本领域常规的心肌细胞培养基对所述的多能干细胞(如人多能干细胞)进行进一步的培养。优选的,所述的心肌细胞培养基中可以含 有wnt信号通路的激活剂chir99021、mtor信号通路的抑制剂rapamycin、或其组合。
在一优选的实施方式中,本发明的诱导方法还包括心肌细胞的富集纯化。
药物组合物
本发明提供了一种包括本发明所述心肌细胞的组合物。
优选地,所述的组合物为药物组合物、食品组合物、保健品组合物等。
本发明的药物组合物,包括药学上可接受的载体和有效量活性成分:本发明所述的心肌细胞。
如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。
如本文所用,“药学上可接受的载体”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以约0.00001mg-50mg/kg动物体重(较佳的0.0001mg-10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载 体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。
本发明还提供了所述药物组合物的用途,用于预防和/或治疗心脏疾病。
本发明的主要优点包括:
(1)本发明方法能够利用特定信号通路的抑制剂的组合,诱导多能干细胞转分化为心肌细胞,分化得到的心肌细胞成熟度较高,拥有发挥正常的心肌功能的结构基础,即具有相似的心肌特异结构基因和离子通道基因的表达水平。
(2)本发明的促进心肌分化的方法还能节省一半的培养液和添加剂,极大降低了成本。
(3)本发明的促进心肌分化的方法具有较高的心肌细胞分化率,1个干细胞可产生24个心肌细胞,初筛的心肌细胞分化率达到86%,优化后的心肌细胞分化率高达98.3%(h7人胚胎干细胞系),对心肌细胞进行富集纯化后所得到的心肌细胞的纯度更高,能够达到99.9%。
因此,本发明为相关细胞治疗提供了一个更好的备选策略。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
通用方法
人多能干细胞培养
三株人胚胎干细胞系h9-ctnt-egfp、h9和h7购自美国wicell干细胞库(h9-htnntz-pgz-d2、wa09和wa07)。人诱导多能干细胞系hips-u-q1是本实验室根据裴端卿实验室已报道方法,利用dox(sigma-aldrich)诱导表达oksm四因子慢病毒系统重编程人尿液细胞(肾上皮脱落细胞)获得。所有人多能干细胞系都培养在cf1小鼠胚胎成纤维细胞组成的滋养层上,培养基为标准的人胚胎干细胞培养基:在dmem/f12基础培养基中添加20%的knockoutserumreplacer、10ng/ml人bfgf,1mml-glutamine,0.1mmneaa(以上均来自invitrogen)and0.1mmβ-mercaptoethanol(sigma-aldrich).对于无滋养层培养,我们利用mtesr1培养 基(stemcelltechnologies)配合humanqualifiedmatrigel(bdbiosciences)的组合维持人多能干细胞克隆和单层的生长。
促进干细胞向心肌细胞分化小分子筛选
基于murry实验室建立的单层分化系统,本发明保持基础培养液mtesr1和rpmi/b27不变,换液和添加诱导因子的时间点不变,然后结合wnt信号通路在心肌分化中的先促进后抑制功能,利用chir99021(selleck)代替wnt3a、activina和bmp4,再用xav939(enzo)和ky02111(tocris)代替dkk1(peprotech)。利用这个原始的分化方法,我们在h9-ctnt-egfp上获得大约10%心肌分化效率。接下来,以该方法为基础,筛选促心肌分化的小分子化合物。h9-ctnt-egfp接种在48孔板中,候选小分子按合适的浓度梯度从第3天加入,第12天撤出。在第15天,通过观察每孔中绿色荧光的亮度来比较分化效率。
本次实验筛选的小分子化合物均为干细胞基本信号通路的抑制剂或激活剂及已报道的和干细胞分化相关的小分子,包括:licl,hn4cl,rapamycin,ly294002,wortmannin,pd98059,pd0325901,sb431542,sb203580,sp600125,retinoicacid,asiaticacid,y27632,thiazovivin,z-vad-fmk,vpa,tsa,vo-ohpic,sf1670,ku-55933,resveratrol,str1720,cx-4945,abt-737,nutlin-3,pifithrin-α,pifithrin-μ,gsk1904529a,fg-4592。
人多能干细胞单层诱导心肌细胞分化方法
准备做分化前,干细胞克隆需要在无饲养层条件下培养一代,然后用分散酶(accutase)(invitrogen)消化为单细胞,单层培养至少一代。准备分化时,将消化分散为单细胞的人多能干细胞以5x104/cm2的密度接种于预包被基质胶(matrigel)的培养板中,人多能干细胞培养基(mtesr1)培养2天,接下来3天在人多能干细胞培养基(mtesr1)中添加10nm雷帕霉素(geneoperation)(基因操作公司)和12μmchir,培养液使用体积为24孔板0.5ml、12孔板1ml以此类推,每天换液。接下来,换为添加10nm雷帕霉素和12μmchir的不含胰岛素的rpmi/b27培养基(rpmi/b27minusinsulin)培养液,培养1天后,换为添加10μmxav939和10μmky02111的不含胰岛素的rpmi/b27培养液,连续培养4天并且在这4天内不更换培液。利用不添加任何小分子的不含胰岛素的rpmi/培养基(invitrogen)基础培养液继续培养两天后,用含胰岛素的rpmi/b27培养基 (invitrogen)基础培养液维持培养,每3天换一次液。模式图见图1e。
心肌细胞免疫荧光
1.抗体
anti-ctnt、anti-α-actinin(cst)抗体
alexa-488-anti-mouse、alexa-555-anti-mouse(invitrogen)的二抗
2.实验步骤
(1)移去完全培养基,用pbs清洗一次细胞;
(2)用4%的多聚甲醛(sigma-aldrich)在室温固定15分钟;
(3)用pbs在室温漂洗三次,每次5分钟;
(4)用含0.1%triton-x-100(sigma-aldrich)的pbs在室温通透化处理15分钟。
(5)用pbs在室温漂洗三次,每次10分钟;
(6)用含5%山羊血清(invitrogen)的pbs在室温封闭1小时;
(7)加入anti-ctnt、anti-α-actinin抗体1:250,4℃孵育过夜;
(8)用pbs在室温漂洗三次,每次10分钟;
(9)加入对应的荧光二抗1:1000,室温下避光孵育一小时;
(10)吸去二抗,用pbs在室温漂洗三次,每次10分钟;
(11)加入dapi染色液1:2000室温孵育5分钟,用pbs在室温漂洗一次,每次10分钟;
(12)用封片剂封片,在荧光显微镜下观察结果,免疫荧光照片用奥林巴斯荧光显微镜拍摄。
心肌细胞电镜实验
(1)移去培养液,加入1ml用2%戊二醛,并将细胞刮下,4℃固定过夜;
(2)用0.25%osmium/0.25%k4fe(cn)6在4℃固定15-30分钟;
(3)用pbs在4℃漂洗三次,每次10分钟;
(4)用系列丙酮在室温下脱水。
50%丙酮溶液1次,10分钟。
70%丙酮溶液1次,10分钟。
90%丙酮溶液2次,每次10分钟。
100%丙酮溶液3次,每次10分钟。。
(5)浸透:吸弃瓶中脱水剂,加3ml纯丙酮-epon812包埋剂(1:1体积比),室温下放置30分钟后,弃去稀释的包埋剂,加纯包埋剂1ml,室温放置2小时或过夜。
(6)包埋:吸取混合包埋剂滴于胶囊模块孔的底部直到注满,把细胞团块移入胶囊底部贴近两端,放60℃烤箱烘烤2小时,使之固化成硬块;
(7)修块:将包埋块安装在特制的夹具上,在显微镜下用单刃刀片修整去除表面的包埋剂;
(8)切片:先将包埋块固定在超薄切片机上,切厚约1μm的半薄切片,用苏木素-伊红染色法染色。镜下观察细胞图像,确定进行超薄切片的部位,并作标记。准备φ3mm,150~200目的铜网,用清洗液清洗,并用无水乙醇脱水干燥。制备好支持膜,小心放在铜网上。在超薄切片机上安装三角形玻璃刀,固定包埋块,切取50~70nm厚度的超薄切片,用睫毛笔挑选切片并用钢丝环套取切片,贴在铜网有支持膜的一侧,保存在干燥器皿中待染色。;
(9)电子染色:用一干净培养皿,内放干净的牙科石蜡片。在石蜡片上加1至数滴醋酸钠染色液,用镊子夹住载网边缘,把贴有切片的一面朝下,使载网浮在液滴上,盖上培养皿染色5~30分钟,染色后尽快用双蒸水清洗三次。用滤纸吸去载网多余的水分,置培养皿内自然干燥。再将载网放在另一只备有蜡片的培养皿中以同样方法进行柠檬酸铅的染色及清洗。片染后凉干待观察。;
(10)最终在徕卡feitecnaig2spirittem透射显微镜上观察拍照。
实施例1筛选促进人干细胞向心肌细胞分化的小分子化合物
利用h9-ctnt-egfp人胚胎干细胞系作为报告系统,在无细胞因子及高密度单层培养诱导条件下,筛选能促进干细胞向心肌细胞高效率分化的小分子化合物。
经过大量的筛选,发现mtor信号通路抑制剂—雷帕霉素(rapamycin)与wnt通路促进剂chir99021组合可以显著促进人干细胞向心肌细胞分化。
实施例2雷帕霉素与chir99021联用能够促进人干细胞向心肌细胞分化
初筛结果:
结果如图1a所示。结果表明,mtor信号通路抑制剂—雷帕霉素(rapamycin) 与wnt通路促进剂chir99021联用可以显著提高人胚胎干细胞(h9细胞系)向心肌细胞分化的效率,可达到86%。而单独使用chir99021所得到的心肌细胞分化率很低,只有约15%,单独使用雷帕霉素所得到的心肌细胞分化效率几乎为0。
优化结果:
用chir(10nm)对人的胚胎干细胞处理过后,经过对rapamycin(10nm)处理时间窗口的优化,发明人按指定时间点加入和撤出rapamycin。按照单层分化的特点和心肌分化的阶段性,把整个分化分为三个阶段,即-3至第1天中胚层形成阶段(第0天定义为诱导分化的初始时间,即以诱导分化培养液rpmi1640-b27代替多能干细胞培养液mtesr1的时间点),第1-5天心肌前体细胞诱导阶段,第5天以后心肌细胞出现和扩增阶段。在第30天,通过检测h9-ctnt-egfp分化得到心肌细胞的比例,发明人发现在心肌分化初始阶段加入rapamycin可以产生93.5±2.1%的心肌细胞(图1b),高于之前全程都加入rapamycin的诱导效率。同时,还发现延长rapamycin的处理时间不但减少最终心肌细胞的比例,还显著降低心肌细胞的产量(图1c)。如果只在1-5天或5-8天加入rapamycin,产生心肌细胞的比例非常低,并且很多时候细胞在第5天后就全部死亡了,导致无法获得心肌细胞。
为了检测雷帕霉素(rapamycin)与chir联用的促心肌分化作用和该分化方法在不同人多能干细胞系之间的普遍适应性,发明人将上述优化的分化方法移植到另外三株人多能干细胞系(人胚胎干细胞系h9、h7和人ips干细胞系u-q1)上,并分别检测h9、h7、u-q1细胞系的心肌细胞分化效率。
结果发现,这三株干细胞系的分化效率稳定在非常高的水平。其中,h7细胞系在上述优化的分化体系中可达到98.3±0.76%的分化效率;人胚胎干细胞系h9在上述优化的分化体系中的分化效率为93.3±2.1%;而人ips细胞在上述优化的分化体系中也达到了90.6±3.6%的高分化效率(图1d)。
除此之外,本发明的分化方法可以有效的节省了一半的培养液和添加剂消耗,即24孔板一个孔每天所需培液从1ml下降到0.5ml(每0.5ml的培养液里接种10万个干细胞),同时保持非常高的心肌细胞的产出效率,1个干细胞可产生24个心肌细胞(分化第15天计数)。每0.5ml培养液中产生24×105个心肌细胞。最终优化的分化方法如图1e所示。
实施例3化合物诱导产生的心肌细胞的富集纯化
分化15天时,将心肌细胞培养液换成不含葡萄糖的dmem/f12培养液加10%(v/v)的胎牛血清(fbs)培养中添加1mm乳糖作为唯一碳源,每两天换一次液,连续培养7天。流式检测ctnt阳性心肌细胞比例。
结果表明,将干细胞来源的心肌细胞在1mm乳糖(唯一碳源)培养液中培养7天,可以使心肌细胞纯度达到99.9%(图2a),统计发现1个干细胞投入可产生24个心肌细胞,而且只需要消耗一半的培养液和添加因子。
实施例4化合物诱导产生的心肌细胞的特异性指标的鉴定
通过免疫荧光染色技术,本发明发现分化得到的心肌细胞都表达这两种蛋白,有部分细胞还有明显的肌小节结构(图2b)。有得到的心肌细胞拥有心肌细胞样成熟的线粒体(干细胞线粒体较少且大多呈球形,线粒体内膜嵴结构不明显);有丰富的肌丝结构,可看到明显的z线;心肌细胞间有明显的类似润盘样的细胞连接(图2c)。
结果表明,本发明的诱导方法产生的心肌细胞成熟度较高,拥有发挥正常的心肌功能的结构基础。
除此之外,心肌细胞特异基因表达谱检测发现,用本发明的方法分化得到的心肌细胞的ctnt、αmhc、nkx2.5、hcn4、nav1.5、cav3.2和kcnq1等心肌特异结构基因和离子通道基因的表达水平与经典的eb分化方法得到的心肌细胞和成年人心肌组织的十分相似(图2d)。
实施例5雷帕霉素通过抑制细胞凋亡促进人胚胎干细胞在高密度单层培养条件下的生长
人胚胎干细胞向心肌细胞分化是一个非常复杂而脆弱的过程,它对各种环境因素的改变和细胞状态的变化都非常敏感。尤其是单层高密度分化方法,相对于eb分化法,更依赖于精确的调控,也更依赖自分泌细胞因子的浓度水平,任何干扰都有可能导致分化效率的降低甚至是彻底失败。
分化过程中,加雷帕霉素处理的细胞相对于chir处理组在形态上显得更加紧密而且酶消化时需要更久的时间,并且长时间培养过程中漂浮的死亡细胞更少。为了确认这个现象,发明人对培养过程中细胞数和细胞活性的变化进行检测。
分别在dmso、chir和chir+rapamycin三种处理条件下进行相关检测。细胞计数显示,相对于dmso溶剂处理的对照细胞,chir可以在前3天加快干细胞数量的增加,而在第4天可以减少细胞数量的急剧减少(第4天由于更换培液,干细胞会因为培养环境的急剧改变而大量死亡)。结果发现,rapamycin可以进一步增加细胞数量和降低细胞数量的减少(图3a)。
用cck-8试剂盒通过检测细胞内脱氢酶活性来评测细胞增殖水平和细胞活性也显示出相似的结果,即rapamycin可以显著的提高细胞数量及活性(图3b)。
实施例6雷帕霉素对干细胞的影响
6.1通过细胞周期分析和brdu细胞增殖实验检测干细胞在不同小分子组合物处理下的增殖速率
brdu细胞增殖检测:
收细胞前加入10μmbrdu(sigma-aldrich)孵育1小时;消化细胞,300g离心5分钟,收集细胞,用含0.5%bsa的pbs(洗液)室温漂洗一次,用1mlpbs重悬;边振荡边加入3ml预冷的乙醇,室温固定20分钟,离心去上清;pbs洗一次,离心去上清,轻弹几下使沉淀变松散;加1ml现配的变性液(2mhcl),混匀,室温放置20分钟;加1ml0.1m硼酸钠(ph8.5)室温中和2分钟;漂洗一次,加入anti-brdu抗体(bdbiosciences1:50稀释),抗体由含有0.5%tween20/0.5%bsa(sigma-aldrich)的pbs配制;吸去一抗,用1ml洗液漂洗一遍,加入alexa-488-anti-mouse(1:1000),室温孵育20分钟;吸去二抗,漂洗一遍,用0.5ml10μg/mlpi溶液重悬,室温孵育30分钟;离心去上清,用洗液漂洗一遍,流式检测。
结果显示,相对于dmso对照组,chir可以轻微的增加处于s期细胞的比例和brdu阳性细胞的比例,而rapamycin减弱了这种促进作用,使干细胞增殖速率和dmso组相似(图4a、4b)。这和mtor支持细胞增殖,而rapamycin抑制细胞增殖的经典观念是相符的。
6.2检测rapamycin对细胞凋亡水平的影响
caspase3/7活性检测:本实验使用caspase-glo3/7试剂盒(promega)。细胞接种于96孔板,相应小分子处理2天后,加入预混好的反应液,充分裂解后,22℃孵育20分钟,上机检测荧光强度,详细细节请见说明书。
annexinv/pi染色:本实验使用annexinv/pi试剂盒(roche)。细胞培养 于24孔板中,在制定时间点accutase消化为单细胞,pbs洗一遍,加入含annexinv和pi的染色液孵育10分钟,注意避光,加入5倍体积的孵育液稀释,来终止反应,立即流式检测,激发光488nm和518nm,发射光为488-540nm和617nm。
细胞凋亡最下游标志蛋白parp的剪切显示,在前4天chir处理过程中随培养时间的延长,parp的剪切条带逐渐增加,第4天达到最高值。然而,rapamycin处理明显抑制了parp的剪切,在前3天几乎检测不到,只有在第4天才出现(图4c)。caspase3、6、7是细胞凋亡的执行蛋白,主要负责切割细胞核内、细胞质中的结构蛋白和调节蛋白。
通过caspase3/7荧光素酶报告试剂盒检测干细胞内源caspase3/7的活性,结果显示,rapamycin处理可以使细胞内caspase3/7的活性降低到chir单独处理的一半水平(图4d)。
annexinv/pi双染实验显示,在第3天培养结束时,dmso处理组有平均31.4%annexinv阳性的凋亡细胞,而chir处理组有25.8%annexinv阳性的凋亡细胞,然而chir+rapamycin处理组只有大约15.5%的annexinv阳性细胞(图4e)。在第4天,更换rpmi/b27分化培养基培养24小时后,发现之前一直只添加dmso的细胞组出现严重的死亡,大约80%细胞都死亡了。chir处理组也有将近一半的死亡,而另外添加rapamycin同样可以显著的减小细胞死亡的比例(图4f)。
上述结果表明,rapamycin可以在分化过程中对干细胞起保护作用,减少细胞凋亡对高效率分化的阻碍,这同时也是rapamycin能提高心肌细胞产量的原因。
实施例7其它化合物组合诱导心肌细胞
分别将mtor信号通路抑制剂rapamycin类似物rad001、ku0063794及azd8055与wnt信号通路促进剂chir组合,将wnt信号通路促进剂bio与rapamycin或rapamycin类似物rad001组合,观察心肌细胞的分化情况。
方法同实施例2诱导的实验方案,结果发现,在同样的实验条件下,化合物组合chir与rad001、chir与ku0063794、chir与azd8055能够产生心肌细胞,心肌细胞分化率分别为78.8%、68.75%、74.43%(图5a)。
并且,化合物组合bio与rapamycin、bio与rad001也能够产生心肌细胞, 心肌细胞分化率分别为83.47%、82.9%(图5b)。
这些纯化的化合物诱导的心肌细胞具有成熟的心肌细胞的形态,以及拥有发挥正常的心肌功能的结构基础。
因此,其他的mtor信号通路抑制剂与wnt信号通路促进剂(如chir、bio)组合也能高效的诱导心肌细胞的分化,并且分化出的心肌细胞具有成熟心肌细胞得到特征。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!