Cas9融合蛋白及其编码序列的制造方法与工艺
本发明属于生物技术领域,涉及一种融合蛋白及编码融合蛋白的DNA序列。技术背景动物疾病模型在研究人类疾病致病机理和药物筛选中起到了关键作用。非人灵长类动物在生物学、遗传学上与人类高度相似,如猕猴与人类基因组同源性高达93%(Gibbsetal.,2007),因而成为人类重大疾病研究和药物筛选的重要动物模型。然而,由于缺乏大动物的胚胎干细胞系,传统的基因打靶技术难于用来建立灵长类动物疾病模型。而近年来发展的基因编辑新技术CRISPR/Cas9在定向对基因进行精确修饰上展现出了巨大的潜力,已被广泛用于不同种属进行基因组改造和基因修饰。同时,该新型技术也被尝试用来治疗一些因基因缺陷导致的疾病(Schwanketal.,2013;Wuetal.,2013)。然而,CRISPR/Cas9技术在基因修饰的精准度上仍有待于提高。CRISPR/Cas9是一种来源于细菌获得性免疫的由RNA指导Cas蛋白对基因进行编辑和修饰的新技术。Jinek等对CRISPR/Cas9系统进行人工改造使得该系统能够更简单方便地用于基因编辑(Jineketal.,2013)。Cas9内切酶在向导RNA分子的引导下对特定位点的DNA进行切割,形成双链DNA缺口,然后细胞会借助同源重组机制或者非同源末端连接机制对断裂的DNA进行修复。若细胞通过同源重组机制进行修复,会用另外一段DNA片段填补断裂的DNA缺口,因而会引入一段“新的”遗传信息。目前,RNA介导的Cas9系统能够成功介导细菌、植物细胞、斑马鱼胚胎、小鼠、人源细胞、非人灵长类动物食蟹猴胚胎、甚至人类废弃胚胎等的基因组编辑(Choetal.,2013;Congetal.,2013;Jineketal.,2013;Malietal.,2013;Niuetal.,2014;Plattetal.,2014;Shanetal.,2013;Chenetal.,2015)。且该技术还可通过基因敲入成功纠正疾病动物的缺陷基因(Schwanketal.,2013;Wuetal.,2013)或者改组为病毒载体建立癌症动物模型(Plattetal.,2014)等,先前的研究成果都为该技术未来应用于人类遗传缺陷疾病的治疗提供了希望。CRISPR/Cas9系统的飞速发展使得动物疾病模型的建立不再局限于少数的模式生物,使得在所有物种中实现基因组编辑成为可能。该技术使用方便、简单且打靶效率较高,能够实现将一对等位基因进行剪切得到纯合突变,还可在目的基因的多个位点设计多种gRNA以达到完全敲除目的。但该技术目前也存在潜在基因突变嵌合多态性、脱靶效应、基因敲入同源重组效率较低等不足之处。针对基因打靶的嵌合效应问题,由于小动物模型生长周期较短,可通过胚胎干细胞筛选或不断杂交传代而得到纯合突变体,但对于与人类较为接近的灵长类动物而言,其性成熟时间就需要4到5年,妊娠时间高达165天,且目前尚缺乏猴胚胎干细胞系,因此嵌合效应在建立纯合基因突变猴模型上具有巨大挑战性。嵌合突变效应的发生可能由于注射的Cas9mRNA和sgRNA在受精卵胚胎分裂后仍持续表达,且注射Cas9蛋白也出现此嵌合现象(Plattetal.,2014;Sungetal.,2014)(SungYH,2014;KimS,2014),表明Cas9蛋白在细胞内的半衰期较长从而导致受精卵细胞分裂成四细胞、八细胞甚至囊胚时期时,每个细胞因随机分配不同程度的Cas9蛋白而形成不同程度的多种基因修饰类型,所形成的胚胎组织及新生的动物会在不同的细胞或组织中携带不同的基因修饰类型或有不同程度(单链或双链DNA)的基因修饰。此外,细胞自身的DNA损伤修复机制或DNA非同源重组修复等也会影响基因打靶效率及嵌合效应。在原核和真核生物体内的每种蛋白质都有其寿命特征,又称为半衰期。蛋白质的半衰期与其多肽链N-端特异的氨基酸有关,即N-端法则(Bachmairetal.,1986)。因此可利用N-端法则和带有不同种类氨基酸的泛素融合蛋白(ubiquitinfusiondegradation,UFD)降解信号来改变依赖于泛素化降解途径的蛋白质半衰期,比如N端连有Arginine(Ub-R-tragetedprotein),Leucine(Ub-L--tragetedprotein),Proline(Ub-P--tragetedprotein)或者Lys(Ub-K--tragetedprotein)会明显降低目的蛋白的稳定性从而加速降解,而连有Met,Ser,Ala则使得目的蛋白更加稳定(Johnsonetal.,1995)。且符合N-端规则的蛋白其降解依赖于第15位或者17位的氨基酸为赖氨酸,因此可在去稳定降解信号和目的蛋白之间插入一段随机氨基酸序列使得目的蛋白的赖氨酸出现在第十七位。而在连接去稳定降解信号和目的蛋白之间的linker上的第三位若为赖氨酸则可进一步增强泛素化效率(Bachmairetal.,1986;Dantumaetal.,2000)。
技术实现要素:
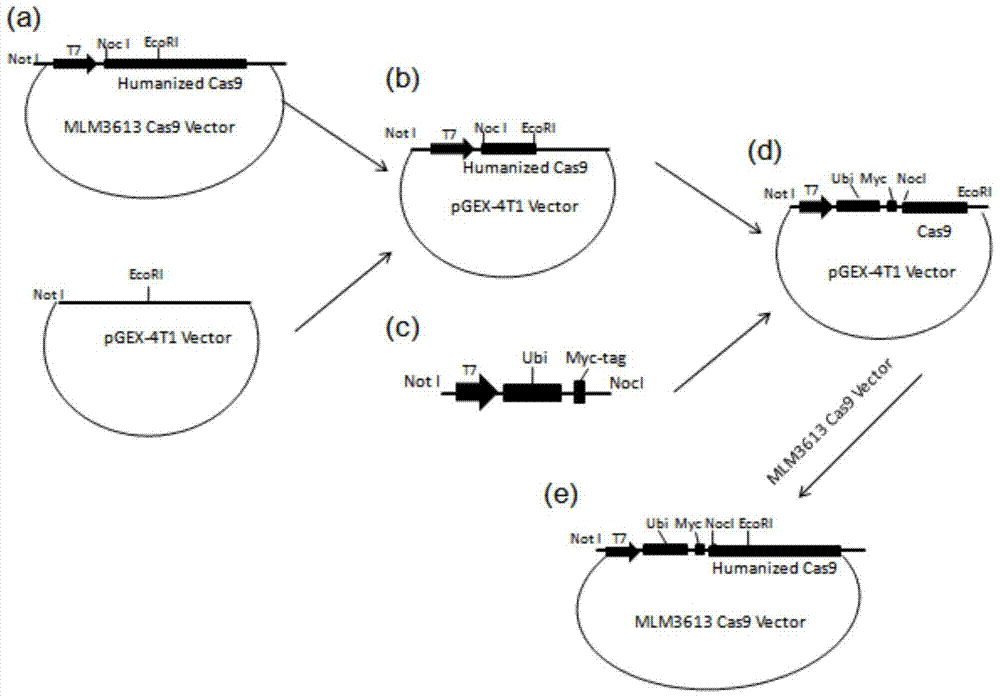
本发明目的在于提供一种Cas9融合蛋白、其编码序列、含有编码序列的质粒及表达载体。本发明提供的Cas9融合蛋白包括Cas9片段及Ubiquitin片段。Ubiquitin与Cas9的连接子第1位氨基酸不同可获得不同的实验效果。所述的Ubiquitin为Ubiquitin-L、Ubiquitin-P或Ubiquitin-R(L,P,R为Ubiquitin与Cas9的连接子第1位氨基酸的缩写)。通过质粒改造的方式将Ubiquitin的DNA编码序列连接至Cas9的DNA编码序列上,从而达到加速Cas9蛋白降解的效果。Ubiquitin与Cas9的连接子第1位氨基酸不同可获得不同的实用效果,通过测试我们发现Ubiquitin-R(R表示Ubiquitin与Cas9的连接子第1位氨基酸为精氨酸)效果最佳,Ubiquitin-L、Ubiquitin-P次之。在本发明的一个优选的实施方案中,Ubiquitin为Ubiquitin-R。作为优选的实施例,所述的融合蛋白含有如SEQIDNO.1所示氨基酸序列。发明同时提供了一种Cas9融合蛋白编码序列,其特征在于含有Cas9DNA片段及UbiquitinDNA片段。通过测试我们发现Ubiquitin-R(R表示Ubiquitin与Cas9的连接子第1位氨基酸为精氨酸)效果最佳,Ubiquitin-L、Ubiquitin-P次之。在本发明的一个优选的实施方案中,所述的Ubiquitin为Ubiquitin-R。作为优选的实施例,所述的编码序列含有如SEQIDNO.2所示DNA序列。发明同时提供了包含上述编码序列的质粒、表达载体、或宿主细胞;优选地,所述的载体为Ubiquitin-R-Cas9。一种基因打靶方法,利用所述融合蛋白或所述编码序列进行基因打靶。优选地,所述基因为哺乳动物基因;更优选地,所述基因为非人类哺乳动物基因;进一步优选地,所述基因为非人类灵长类动物基因。一种降低动物细胞基因打靶嵌合效应的方法,其利用上述融合蛋白或编码序列进行基因打靶;优选地,所述的细胞为哺乳动物细胞;更优选地,所述的细胞为非人类哺乳动物细胞;进一步优选地,所述的细胞为非人类灵长类动物细胞作为本发明的一种实施方式,本发明提供了一种显著降低CRISPR/Cas9在非人灵长类动物食蟹猴基因打靶嵌合效应的新方法:即通过添加泛素化降解信号Ubiquitin缩短Cas9蛋白的半衰期以定量控制其仅在受精卵发育早期(二细胞时期或者四细胞时期)发挥基因打靶作用。在本发明一个特别优选的实施例中,公开了一种含有Ubiquitin特异降解信号的Cas9蛋白序列的改造载体及其在灵长类动物食蟹猴中的应用。具体包括:制备上述改造后的Cas9蛋白序列、构建改造后的质粒载体;设计特异性识别、切割食蟹猴基因组指定位点序列的基因组编辑工具sgRNA,使用共显微注射的方法将所述基因组编辑工具sgRNA、所述改造前(WT-Cas9)和改造后(Ub-i-Cas9)的质粒载体经体外转录生成的Cas9mRNA导入猴单细胞受精卵胚胎,利用单卵裂球分离技术及优化的单细胞PCR技术鉴定基因打靶效率、纯合突变效率。在下文中,以Ubiquitin-i表示Ubquitin-L、Ubquitin-P或Ubquitin-R任意一种。基于CRISPR/Cas9介导基因打靶方法,利用本发明提供的融合蛋白进行基因打靶,可以解决CRISPR/Cas9技术存在的基因打靶嵌合效应的问题。我们将此方法具体应用在敲除食蟹猴PINK1,Parkin和ASPM基因的载体构建过程中。我们的实验包括1)改造前Cas9蛋白表达载体MLM3613-Cas9,2)改造后Ubiquitin-i-Cas9蛋白表达载体和携带有PINK1,Parkin和ASPM基因打靶序列的sgRNA表达载体;3)以及使用共具显微注射的方法将所述基因组编辑工具{包括:sgRNA、由所述改造前(WT-Cas9)和改造后(Ub-i-Cas9)的质粒载体经体外转录生成的Cas9mRNA}导入猴单细胞受精卵胚胎;4)利用单卵裂球分离技术及优化的单细胞PCR技术鉴定基因打靶效率、纯合突变效率。由于嵌合效应的发生与注射后所表达的Cas9蛋白较长的半衰期具有重要联系。通过本发明的方法能够实现在不影响Cas9切割效率的同时通过缩短Cas9蛋白半衰期以定量定时控制其仅在受精卵胚胎发育早期发挥基因打靶作用,从而减少嵌合突变效应,对高效建立非人灵长类动物纯合突变的疾病模型以及基因缺陷修复治疗具有重要意义。本发明一方面可以使得Cas9蛋白在胚胎细胞中发挥打靶作用之后迅速降解,从而降低了胚胎发育的嵌合突变效应。尤其是特别优选的Ubiquitin-R-Cas9蛋白,纯合打靶突变率比野生型Cas9提高了3.51倍。更重要的是,本发明所提供的Ubiquitin-i-Cas9蛋白可以提高胚胎基因打靶纯合性。尤其是特别优选的Ubiquitin-R-Cas9蛋白,其对野生型Cas9蛋白胚胎基因打靶纯合性效率提高了350%。这是技术人员预期之外的。与现有技术相比,本发明的重要性在于:第一,本发明公开了一种含有Ubiquitin特异降解信号的Cas9蛋白序列的改造载体及其在灵长类动物食蟹猴中的应用,实验证明该改造后的Cas9能够对PINK1,Parkin和ASPM基因进行有效基因打靶,打靶率高达73.83%;并且,与WT-Cas9(8.25%)比较,改造后的Ub-R-Cas9基因打靶纯合突变率高达28.97%,其纯合打靶突变率比WT-Cas9提高了3.51倍。第二,利用整个胚胎的基因组DNA并不能精确分析Cas9打靶后胚胎中各个细胞的嵌合突变类型和突变率,本发明将注射有打靶RNA的四细胞或者八细胞胚胎分离出单卵裂球,并利用单细胞PCR技术更为精确地分析鉴定同一胚胎来源的不同细胞突变状况和突变率,可靠地证实了Ubiquitin-Cas9融合蛋白在提高打靶纯合突变率方面的显著效果。第三,为验证本发明所使用的Ub-i-Cas9蛋白因快速降解能力使得受精卵发育至四细胞或者在该时期更早之前便不再发挥打靶作用,本发明利用胚胎单卵裂球分离技术将四细胞胚胎分离而来的单卵裂球再次培养发育为四细胞时进行单细胞PCR,鉴定结果进一步证明Ub-i-Cas9的快速降解可保证四细胞胚胎后期的基因修饰类型的均一性。本发明所提供的Ub-i-Cas9的使用能够明显降低CRISPR/Cas9所介导的基因打靶嵌合效应,提高其基因修饰精准度,为基因缺陷修复治疗及为高效建立具有纯合突变的大动物模型提供了新方法,具有潜在的重要经济价值和意义。附图说明图1为包含有不同氨基酸降解信号(黑体)的Ub-i-Cas9结构示意图。图2为Ub-i-Cas9质粒构建流程图。图3为Ub-i-Cas9在293细胞中的表达及半衰期检测;其中,A.Ub-i-Cas9在293细胞中的表达;B.WT-Cas9和UbR-Cas9半衰期;C.图B的相对定量统计。图4为WT-Cas9和Ub-R-Cas9在食蟹猴胚胎中的表达;其中,a.WT-Cas9和Ub-R-Cas9在食蟹猴胚胎中的表达;b.Ub-R-Cas9在293细胞中基因打靶PCR鉴定及测序结果。图5为WT-Cas9和Ub-R-Cas9在食蟹猴胚胎中的Parkin基因打靶效率比较;其中,a.WT-Cas9和Ub-R-Cas9在食蟹猴胚胎中打靶效率统计表;b.WT-Cas9和Ub-R-Cas9在食蟹猴胚胎中打靶的PCR代表性结果;c.Ub-R-Cas9在食蟹猴胚胎中打靶测序结果。图6为单细胞PCR酶切鉴定打靶结果;注射有WT-Cas9和Ub-R-Cas9的受精卵胚胎细胞发育至四细胞时期经单卵裂球分离再培养发育成新四细胞后所分离的单细胞。具体实施方式以下对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的原理或理念所作的等同的变化或变通都应视为本发明保护的范畴。发明涉及的泛素蛋白降解信号Ubiquitin-R-myc序列如SEQIDNO.3;Ubiquitin-R序列如SEQIDNO.4;Myc序列如SEQIDNO.5;Cas9蛋白序列如SEQIDNO.6。在具体的实施例中编码本发明的Ubquitin-R-Cas9融合蛋白的编码序列如SEQIDNO.2.而Ubquitin-L-Cas9、Ubquitin-P-Cas9则是SEQIDNO.2.第229~231位上的cgc分别替换为cuc、ccc。实施例1构建包含不同蛋白降解信号的目的质粒Ub-i-Cas9(i代表R,L,P)表达载体,示意图如图1,所述构建流程方法如下(图2)。为便于构建,首先用MLM3613Cas9(Addgene,Plasmid#42251,称为WT-Cas9)骨架质粒上的NotI和EcoRI的两酶切位点将含有T7启动子、NcoI克隆酶切位点、翻译起始位点和部分Cas9蛋白序列的片段剪切后连接在pGEX4T-1质粒上(图2a,b),pGEX4T1-NotI-T7-NcoI-Cas9-EcoRI-。随后,设计带有NotI酶切位点以及T7启动子序列I的上游引物和带有Myc-标签序列、L/P/L位点以及NocI酶切位点的下游引物(序列分别如SEQIDNO.22、SEQIDNO.23-25所示),在下游引物同时引入L/P/R氨基酸的DNA序列,从HEK293细胞cDNA中扩增出Ubiquitin序列;,将T7-Ubiquitin-L/P/R-myc(由人HEK293细胞cDNA中扩增)序列通过NotI和NcoI克隆酶切位点连接到pGEX4T1-NotI-T7-NcoI-Cas9-EcoRI-载体,如图2c,2d。再将NotI-T7-ubiquitin-L/P/R-Myctag-Cas9-EcoRI-片段再连接到用NotI和EcoRI两酶切位点线性化的MLM3613-Cas9骨架质粒,成功构建了Ubquitin-R/L/P-Myctag-Cas9表达载体(图2e)。SEQIDNO.22:Ub5’-1Not1:5’-ATCCGCGGCCGCTAATACGACTCACTATAGGGCCATGCAGATCTTCGTGAAGAC-3’T7promoter3’Primers:UbR3’-204Nco1(SEQIDNO.23):5’-ATCCATGGTCTTAGCATGTACCAGATCTTCTTCAGAAATAAGTTTTTGTTCTTTACCTCGCCCACCTCTGAGACGGAG-3’UbL3’-204Nco1(SEQIDNO.24):5’-ATCCATGGTCTTAGCATGTACCAGATCTTCTTCAGAAATAAGTTTTTGTTCTTTACCTAGCCCACCTCTGAGACGGAG-3’UbP3’-204Nco1(SEQIDNO.25):5’-ATCCATGGTCTTAGCATGTACCAGATCTTCTTCAGAAATAAGTTTTTGTTCTTTACCTGGCCCACCTCTGAGACGGAG-3’构建好的含有Ub-i-Cas9的表达质粒载体使用引物扩增法对其序列进行测序验证,测序结果验证了构建成功。实施例2构建含有PINK1,Parkin和ASPM基因靶序列的CRISPR/Cas9的sgRNA载体。表1.靶序列位点注:划线部分序列为sgRNA的PAM序列,即其与目标DNA序列的结合位点。将上述所构建的sgRNA靶序列载体及改造前、改造后的Cas9质粒载体用PmeI酶线性化后胶回收,体外转录合成RNA。所述的sgRNA表达载体,含有一个T7启动子控制sgRNA的表达,在用BbsI限制酶切消化后可插入20bpsgRNA的特异靶序列,该特异靶序列的识别位点位于PINK1基因第二外显子,Parkin基因第二外显子,ASPM基因第三外显子和第十外显子。为了筛选能够进行基因编辑且脱靶效应较小的PINK1和ASPM基因的sgRNA序列,申请人利用NCBI的Blast软件在猕猴的PINK1基因和食蟹猴的ASPM基因序列上分别筛选了脱靶效应低且符合CRISPR/Cas9结合基因组特征(5’-G(19N)-NGG3’)或者(5’-CCN(19N)-C-3’)的靶序列位点,如表1,构建方法参考已有文献(Changetal.,2013)。实施例3构建的Ub-i-Cas9(i代表LP,R)质粒半衰期检测。首先,将WT-Cas9和Ub-i-Cas9质粒转染至293细胞,转染48小时后,Westernblot检测Cas9蛋白表达量结果显示,以WT-Cas9为100%计,Ub-L-Cas9、Ub-P-Cas9、Ub-R-Cas9分别降解至84.76%、80.92%和63.89%。尤其是其中的Ub-R-Cas9,其序列上与Ub-L-Cas9、Ub-P-Cas9相交虽然只有一个碱基的差别,然而惊奇的发现是其降解速率显著地快于其他融合蛋白,达到了非常难得的程度。随后,我们比较了WT-Cas9和Ub-R-Cas9的半衰期,即在质粒转染24小时后,添加50微摩尔放线菌酮至培养基中,分别在0h,2h,4h,8h,12h,24h收集细胞,Westernblot检测结果如图3B,C所示,与WT-Cas9相比,Ub-R-Cas9蛋白半衰期显著缩短,在4小时便降解了约百分之五十。其次,将WT-Cas9和Ubquitin-R-Cas9体外转录合成mRNA显微注射于食蟹猴胚胎,如表2所示,免疫组化结果显示Ubquitin-R-Cas9在食蟹猴胚胎中比WT-Cas9降解速度明显加快。Ub-R-Cas9在注射48小时后的胚胎中含量比WT-Cas9少了69.18%。表2.Ubquitin-R-Cas9与WT-Cas9在胚胎中的Cas9残留量比较注射24h后残留量注射48h后残留量Ub-R-Cas963.3818.96WT-Cas9100%61.53实施例4所述成功构建的Ub-R-Cas9基因打靶功能及效率检测。首先,将WT-Cas9/Pink2-2sgRNA和Ub-R-Cas9/Pink2-2sgRNA质粒分别转染至293细胞,48小时后通过逐级稀释方法挑选单个细胞或者多个细胞进行PCR鉴定,经T7E1检测及测序确认Ub-R-Cas9具有正常基因打靶功能,如图4b。其次,将WT-Cas9或者Ub-R-Cas9mRNA与sgRNA共显微注射入猴单细胞胚胎。待胚胎发育至四细胞或八细胞时期分出单卵裂球进行单细胞PCR鉴定(PCR扩增引物序列见表3)。此外,可利用胚胎单卵裂球分离方式将注射有WT-Cas9和Ub-R-Cas9的四细胞胚胎分离而来的单卵裂球再次培养发育为四细胞时进行单细胞PCR,鉴定结果如图6。表3.扩增引物序列结果表明:该改造后的Ub-R-Cas9载体能够对PINK1,Parkin和ASPM基因进行基因打靶,打靶率高达73.83%。且Ub-R-Cas9与WT-Cas9(8.25%)相比能够明显提高纯合基因敲除的概率高达28.97%,提高了约3.5倍,如图5。此外,图6结果也进一步证明Ub-R-Cas9因具有快速降解能力从而保证四细胞胚胎后期的基因修饰类型的同一性,明显降低了WT-Cas9因半衰期较长而导致的持续打靶所引起的嵌合效应。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均未脱离本发明的内容,都包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1