牛膝粗多糖、多糖组分和均一多糖、其制备方法及其用途与流程
本发明属于医药
技术领域:
,具体地,涉及疫苗和免疫领域。具体地,本发明涉及从牛膝中提取的粗多糖、多糖组分以及均一多糖。本发明还涉及含有它们的药物组合物、其制备方法、以及其用于疫苗佐剂、免疫调节剂或制备疫苗辅料、疫苗制剂、疫苗组合物或抗体的用途。
背景技术:
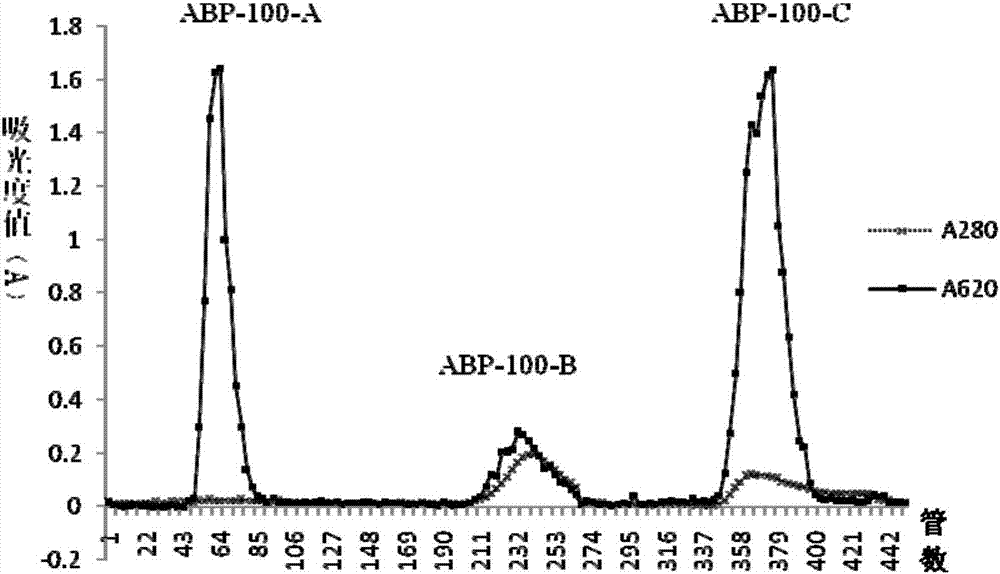
:牛膝(achranthisbidentata和cyathulaofficinalis)是苋科植物牛膝的干燥根,具有活血、通经、补肝肾、强筋骨之功用。牛膝含有多种次生代谢产物,如齐墩果酸及其皂苷、蒽醌类化合物等,还含有较高含量的多糖[李金亭,等.牛膝类药材的生物学与化学成分的研究进展.中草药,2006,37(6):952-956]。近年来与本发明领域相关的研究和报道归纳如下:(1)牛膝多糖制备方法及化学成分的研究许海丹等将牛膝粉末用80%乙醇加热回流,残渣加水煎煮提取,合并滤液、浓缩。浓缩液中加入乙醇至含醇量达到80%。静置12h后分离沉淀,再水溶解,采用sevage方法去除蛋白。收集清液,再加入4倍乙醇醇析,沉淀部分用乙醚、丙酮反复洗涤,干燥,制备牛膝粗多糖。(许海丹,等.牛膝多糖的提取与含量测定.科学技术与工程,2009,9(1):107-109.)刘传敏等首先将纤维素酶和牛膝粉末一起加水在恒温摇床上保持一段时间,然后沸水浴煎煮10min,再超声20min,离心,上清合并、浓缩,然后加乙醇至含醇量为80%。静置、离心,沉淀加蒸馏水溶解, 三氯乙酸脱蛋白,上清液挥干溶剂,即得牛膝多糖粗品(刘传敏,等.酶解超声法提取川牛膝多糖的正交试验研究.中兽医医药杂志,2009,5:51-53)。魏涛等采用以下工艺制备牛膝粗多糖:怀牛膝→70℃干燥→粉碎过40目筛→石油醚脱脂,体积分数80%乙醇回流→超声波辅助水浸提→离心取上清液→sevage法除蛋白→浓缩→乙醇沉淀→过滤洗涤→低温干燥→怀牛膝粗多糖(魏涛,等.怀牛膝多糖的超声波辅助提取工艺及其抗氧化性活性.食品与发酵工业,2011,37(2):191-194)。方积年等将牛膝水煎煮、去除游离蛋白、透析、乙醇醇沉、再水溶解后,依次进行cellexd和sephadexg-150柱层析,得到一个肽多糖abab,abab分子量为2.3×104,有d-葡萄糖酸、d-半乳糖、d-半乳糖酸、l-阿拉伯糖和l-鼠李糖组成,摩尔比为12:2:3:1:1。多糖主链结构为(1→4)-d-葡萄糖酸和(1→4)-d-半乳糖酸组成。肽含量为24.7%,主要有甘氨酸、谷氨酸、门冬氨酸和丝氨酸组成(方积年,张志花,刘柏年.牛膝多糖的化学研究.药学学报,1990,25(7):526-529)。刘颖华等采用水提、醇沉法提取川牛膝粗多糖cpc(无具体操作方法),cpc再经685弱碱阴离子交换柱层析分离和bio-gelp2凝胶柱层析纯化,得到川牛膝均一多糖rcp。rcp的分子量(mr)主要分布在1000-2200,单糖组成为d-果糖和d-葡萄糖(刘颖华,何开泽,张军峰,蒙义文.川牛膝多糖的分离、纯化及单糖组成.应用与环境生物学报,2003,9(2):141-145)。陈晓明等将牛膝粗多糖abps(具体制备方不详)经deae-cellulose和sephadexg-50两次柱色谱纯化得到一小分子量的果聚糖。单糖组成分析表明牛膝多糖由果糖和葡萄糖组成,单糖摩尔比为8:1,其数均分子量为1400u,含有4至21糖。糖链中含有1,2-连接和2,6-连接的果糖残基(陈晓明,等.牛膝多糖的理化性质研 究及结构确证.药学学报,2005,40(1):32-35)。chen等牛膝水煎煮3次,水煎液采用sevage方法(正丁醇:氯仿=4:1)脱色素和蛋白后、透析、醇沉(乙醇终浓度80%)。沉淀部分水溶解、h2o2脱色、透析、再醇沉(乙醇终浓度75%)。沉淀部分水溶解部分进行deae-纤维素和sephadexg-50柱层析,获得牛膝多糖(abp)。该abp有甘露糖和葡萄糖组成,单糖摩尔比为8:1(chen,etal.achyranthesbidentatapolysaccharideenhancesimmuneresponseinweanedpiglets.immunopharmimmunotoxicol,2009,31(2):253-260)。(2)牛膝粗多糖免疫活性的研究倪青松等采用水煎、醇沉法制备川牛膝粗多糖(具体操作不详),给7日龄仔鸡饲喂400mg/kg的川牛膝多糖,在14、21和28日龄采颈静脉血,分别检测血清抗体(igg、iga、igm)和血液生化指标(谷丙转氨酶、谷草转氨酶、碱性磷酸酶、钙、白蛋白)。结果显示:川牛膝多糖400mg/kg剂量组与对照组相比,igg、iga和igm差异均显著(0.01<p≤0.05),而白蛋白、谷草转氨酶、谷丙转氨酶、碱性磷酸酶、钙的差异均不显著(倪青松,等.川牛膝多糖对鸡血清抗体和血液生化指标的影响.四川畜牧兽医,2011,248:27-28)。王宇学等研究牛膝根多糖abps(本院中药研究所,纯度99.9%,理化性质不详)在体外对单核细胞活性的调节及诱导单核细胞hla-dra表面分子的表达。结果显示abps能诱导单核细胞胞浆溶酶体和胞浆量增多和吞噬能力增强,同时上调单核细胞hla-dra表面分子的表达(王宇学,等.牛膝根多糖上调单核细胞免疫功能实验.中国医院药学杂志,2005,25(10):940-942)。封海波等采用超声辅助下水提、醇沉法(具体方法不详)制备川牛膝粗多糖(rcps),硫酸苯酚法-测定其糖含量为78.9%。rcps和o型口蹄疫灭活疫苗协同免疫icr小鼠,研究了其对免疫小鼠体内树突状细胞成熟的影响。小鼠在二次免后2周处死,无菌取脾,制 备脾细胞悬液,测定共刺激信号分子(cd40,cd80,cd86)的表达水平,检测了mhcⅰ、mhcⅱ类分子,cxc型趋化因子受体4(cxcr4)和cc趋化因子受体7(ccr7)mrna表达水平。结果显示:与对照组相比,在二次免疫后14d,rcps明显增强了共刺激信号分子cd40,cd80,cd86的表达水平,同时提高了mhc-i,mhc-ii,cxcr4和ccr7mrna表达水平(封海波,等.川牛膝多糖对口蹄疫疫苗受免小鼠树突状细胞成熟的影响.中国兽医杂志,2014,50(3):18-21)。邱妍等采用水煎煮、乙醇沉淀方法提取怀牛膝粗多糖,硫酸-蒽酮法测定其多糖含量为54%(理化性质不详)。14d龄蛋在鸡新支二联弱毒苗点眼滴鼻免疫的同时,分别肌肉注射怀牛膝粗多糖3和6mg/ml二个剂量(每羽注射0.3ml),每天注射1次,连续注射3次。分别于免疫后第7、14、21、28、35和42天静脉采血,测定新城疫血凝抑制(hi)抗体效价及免疫功能。结果表明怀牛膝多糖高剂量组的hi抗体效价、cd4+/cd8+比值和免疫器官指数都明显高于对照组,并且可以显著促进t淋巴细胞增殖(邱妍,等.怀牛膝多糖对雏鸡疫苗免疫效果的影响.畜牧兽医学报,2007,38(7):723-727)。牛膝多糖经水煎、醇沉方法提取牛膝粗多糖(具体制备方法不详),研究对雏鸡进行禽流感灭活苗免疫的影响。肉仔鸡于2和6周龄分别进行禽流感灭活苗的首免和二免。免疫同时每羽鸡肌肉注射0.5ml4mg/ml和8mg/ml牛膝粗多糖。结果表明二免后联用牛膝多糖-禽流感组雏鸡血凝抑制抗体的滴度显著升高,脾、胸腺和法氏囊指数均显著提高(刘永华,等.牛膝多糖对雏鸡禽流感免疫效果的影响.饲料研究,2014,9:52-53)。孙丽莎等研究牛膝多糖(质量分数50%,购自山东泰安医药有限公司)与锌单用及合用体外在负载人食管癌ec9706制备的冻融抗原条件下对小鼠树突状细胞(dc)增殖分化和抗原提呈能力的影响。结果表明小鼠骨髓细胞体外在粒细胞-巨噬细胞刺激因子(gm-csf)和白细 胞介素-4(il-4)诱导下骨髓细胞生成dc,同时培养液中加入不同质量浓度的牛膝多糖(200、300、400μg/ml)、锌(0.02μg/ml)。结果表明牛膝多糖和锌单用在肿瘤抗原负载下能够促进小鼠骨髓源性dc的分化、成熟及表面标记cd86、cd11a的表达,增强dc诱导的细胞毒性t淋巴细胞反应,能够使荷瘤小鼠免疫器官脾脏和胸腺的质量增加,明显抑制肿瘤的生长。牛膝多糖和锌合用并不协同增强效应(孙丽莎,等.牛膝多糖与锌对小鼠树突状细胞增殖分化和抗原提呈能力的影响.中草药,2010,41(8):1319-1322)。(3)牛膝成分的免疫活性研究chen等牛膝水煎煮3次,水煎液采用sevage方法(正丁醇:氯仿=4:1)脱色素和蛋白后、透析、醇沉(乙醇终浓度80%)。沉淀部分水溶解、h2o2脱色、透析、再醇沉(乙醇终浓度75%)。沉淀部分水溶解部分进行deae-纤维素和sephadexg-50柱层析,获得牛膝多糖(abp)。该abp有甘露糖和葡萄糖组成,单糖摩尔比为8:1。该多糖口服给3-4周龄幼猪,每天按500、1000和1500mg/kg剂量掺入食物中,连续喂养至14天和28天时,采血,测定对免疫功能的影响。结果显示abp1000和1500mg/kg剂量能提高外周血淋巴细胞的增殖及血清igg、iga,、igm、c3、c4、il-2和ifn-γ(chen,etal.achyranthesbidentatapolysaccharideenhancesimmuneresponseinweanedpiglets.immunopharmimmunotoxicol,2009,31(2):253-260)。zhou等研究了从牛膝中分离纯化的一种多糖abp,分子量1400da,由果糖和葡萄糖构成,摩尔比为8:1。果糖连接方式有:1,2-fru、1,2,6-fru以及末端1-fru和1-glc。该abp能刺激小鼠树突细胞成熟(dc)和增殖,增加cd86、cd40和mhc-ii的表达。功能评价试验显示当dc细胞内的acp酶下调时,dc的胞吞作用下降,抗原呈递能力升高,促进il-12的分泌(zou,etal.modulationofphenotypicandfunctionalmaturationofmurinedendriticcells(dcs)bypurifiedachyranthesbidentatapolysaccharide(abp).inter immunopharm,2011,11:1103-1108)。zhu等将牛膝多糖abps(分子量1400da,由果糖和葡萄糖构成,摩尔比为8:1)按50mg/kg剂量腹腔注射小鼠,连续10天和15天,然后感染p.y17xl疟原虫。感染3天和5天时,预先注射abps能提高th1免疫反应,增加f4/80+cd36+巨噬细胞数量,提高ifn-γ、tnf-α和no的水平,抵抗疟原虫的感染。另外abps还能增加骨髓cd11c+cd11b+树突细胞和cd11c+cd45r+/b220+类浆细胞,调节cd11c+树突细胞表达mhc-ii、cd86和tlr-9。预处理abps不影响中性treg的数量或抗炎因子il-10的生成(4.zhu,etal.polysaccharidesfromthechinesemedicinalherbachyranthesbidentataenhanceanti-malarialimmunityduringplasmodiumyoelii17xlinfectioninmice.malariaj,2012,11:49-55)。陈清华等采用水煎煮、sevage法脱蛋白、h2o2脱色、透析和醇沉制备牛膝粗多糖。粗多糖经deae-纤维素和sephadexg-50柱色谱纯化后,获得分子量均一多糖abp。abp由果糖和葡萄糖组成,两者的摩尔比为8:1。断奶乳猪在饲喂基础日粮中添加500、1000、1500mg/kgabp,试验第14和28天外周血淋巴细胞转化率和血清中细胞因子tnf、il-1b、il-2、il-6的含量。结果表明与对照组相比,试验第14天和28天abp三个剂量组的淋巴细胞si值分别提高了8.04%(p>0.05)、11.32%(p<0.01)和24.11%(p<0.01);19.81%(p<0.01)、69.64%(p<0.01)和43.40%(p<0.01)。试验第14天时,abp中剂量和高剂量组细胞因子tnf、il-1β、il-2和il-6含量极显著高于对照组(p<0.01),低剂量组的tnf和il-2含量显著高于对照组(陈清华,等.牛膝多糖对仔猪淋巴细胞增殖作用和细胞因子分泌量的影响.动物营养学报,2008,20(6):712-717)。何桂萍等从牛膝根中分离提取得到的一种小分子水溶性的多糖(abps,制备方法不详),由果糖和葡萄糖组成,摩尔比为8.7:1.0,平均分子量为1400。牛膝多糖浓度分别为0.1mmol/l、0.05mmol/l、 0.025mmol/处理成熟dc细胞72h。结果:牛膝多糖处理组dc的同种mlr能力明显增强(p<0.05),il-12p70、il-17、tnf-α的分泌能力有显著提高(何桂萍,等.牛膝多糖对人树突状细胞功能影响的体外研究.九江学院学报,2011,(3):49-52)。王剑等从川牛膝(cyathulaofficinali)中分离一种多糖cp(具体制备方法不详)。cp主要由d-β-果糖组成,含有少量的d-α-葡萄糖,平均相对分子量(mr)为1.6×103-2.7×103。体外研究表明,川牛膝多糖cp在10-300μg/ml浓度范围内能够促进b淋巴细胞增殖(p<0.01),增强小鼠nk细胞活性(p<0.05)和腹腔巨噬细胞吞噬中性红活性(p<0.01),且随多糖浓度增高而增强;但对t淋巴细胞的增殖无促进作用(p>0.05)。王剑等又将该川牛膝多糖cp按25、50和100mg/kg.d的剂量腹腔注射小鼠,连续注射10d后,能增强正常小鼠迟发型变态反应和nk细胞活性,提高小鼠碳粒廓清速率、抗体生成细胞数量和腹腔巨噬细胞吞噬鸡红细胞百分率,且随多糖浓度增高而增强。cp还能显著改善由环磷酰胺导致的白细胞数减少,但其对脾淋巴细胞转化率无促进作用(王剑,等.川牛膝多糖的体外免疫活性研究.应用与环境生物学报,2008,14(4):481-483;王剑,等.川牛膝多糖的体内免疫活性研究.中药药理与临床,2007,23(6):31-33)。xiang等评价牛膝多糖abp(制备方法不详),其分子量1.34kda,单糖组成为葡萄糖:甘露糖=2:1。该多糖体外100-800μg/ml能协同lps刺激外周血巨噬细胞和腹腔巨噬细胞分泌il-1。abp按50和100mg/kg剂量灌胃小鼠5d,也能刺激腹腔巨噬细胞分泌il-1(xiang,etal.effectsofachyranthesbidentatpolysaccharidesoninterleukin-1andtumornecrosisfactor-alphaproductionfrommouseperitonealmacrophages.中国药理学报,1993,14(4):332-336)。向道斌等研究怀牛膝多糖abp(制备方法不详)对体内外t淋巴细胞和天然杀伤(nk)细胞功能的影响。abp相对分子量为1360da, 由d-β-葡萄糖和d-α-甘露糖组成,摩尔比为2:1。结果表明abp50-800mg/l在体外增强天然杀伤(nk)细胞活性和促进伴刀豆球蛋白a(cona)诱导的tnf-β产生,但不能提高cona诱导的t淋巴细胞增殖反应和il-2的产生。abp按50和100mg/kg剂量腹腔注射小鼠,能明显提高正常小鼠nk细胞活性和tnf-β生成,增强二硝基氟苯诱导的迟发型超敏反应和对抗环磷酞胺对nk活性的抑制作用,但时cona诱导的t淋巴细胞增殖反应和il-2的产生无明显影响(向道斌,等.牛膝多糖对t淋巴细胞和天然杀伤细胞功能的影响.中国药理学与毒理学杂志,1994,8(3):209-212)。向道斌等又研发现该abp按50mg/kg剂量腹腔注射小鼠5天能明显提高血清总igg及特异性抗体溶血素的含量,增加脾脏空斑形成细胞含量。abp体外0.2-0.8g/l能刺激小鼠脾细胞增殖,也能增强lps刺激的b淋巴细胞的增殖(向道斌,等.牛膝多糖对小鼠体液免疫反应的增强作用.上海免疫学杂志,1994,14(3):134-136)。吕建新等研究牛膝多糖(中科院上海有机化学研究所提供,具体制备方法和理化性质不详)对巨噬细胞的激活作用。0.312、0.625、1.250、2.500和5.000mg/ml牛膝多糖体外与人胸腔巨噬细胞诱导培养24h,测定胸腔巨噬细胞内tnf-α与il-6的含量。结果表明牛膝多糖能上调胸腔巨噬细胞内乳酸脱氢酶和酸性磷酸酶活性,显著诱导胸腔巨噬细胞表达tnf-α和il-6(吕建新,等.牛膝多糖对人胸腔巨噬细胞的激活作用.中国免疫学杂志,1999,15:422-424)。王德成等研究牛膝多糖abps(中科院上海有机化学研究所提供,具体制备方法和理化性质不详)对小鼠巨噬细胞的活化作用。结果显示,浓度为100、200μg/ml的abps对巨噬细胞tnf-α分泌均有显著的促进作用,200μg/ml的abps对巨噬细胞il-12分泌也有明显的促进作用。abps能明显上调巨噬细胞tlr-4mrna的表达(王德成,等.牛膝多糖对小鼠腹腔巨噬细胞的活化作用.微生物学杂志,2013,33(4):59-61)。王德成等又研究该牛膝多糖对巨 噬细胞细胞毒作用及机制。以200mg/l浓度的abps体外刺激小鼠腹腔来源巨噬细胞,结果表明浓度为200mg/l的abps对巨噬细胞细胞毒作用和no表达有显著的促进作用,对inosmrna和蛋白表达均有明显的促进作用(王德成,等.牛膝多糖对小鼠腹腔巨噬细胞的细胞毒作用影响及机制.微生物学杂志,2014,34(6):70-73)。季敬璋等研究牛膝多糖abps(中国科学院上海有机化学研究所提供,具体制备方法和理化性质不详)体外在终浓度为0、100、200、400、800μg/ml或在不同时间内对人t细胞培养上清液的ifn-γ及il-4的蛋白表达影响。结果表明人t细胞ifn-γ分泌水平随abps浓度递增,在400μg/ml时,ifn-γ表达量最高(p<0.05),而il-4的分泌无明显影响。人t细胞在abps刺激不同时间后,ifn-γ分泌水平逐步增高,在48小时分泌最高(季敬璋,等.牛膝多糖体外诱导人t细胞表达ifn-c和il-4蛋白的机制探讨.中国免疫学杂志,2003,19:611-613)。综上所述,上述文献中牛膝粗多糖主要采用水煎煮、乙醇沉淀方法制备粗多糖,结合采用sevage方法脱蛋白、h2o2除色素等。从牛膝中主要分离3个成分:(1)肽多糖,分子量为2.3×104,由d-葡萄糖酸、d-半乳糖、d-半乳糖酸、l-阿拉伯糖和l-鼠李糖组成,摩尔比为12:2:3:1:1。(2)寡糖,由果糖和葡萄糖组成,单糖摩尔比为8:1,其数均分子量为1400u。(3)多糖,由甘露糖和葡萄糖组成,单糖摩尔比为8:1,分子量不详。(4)寡糖,其分子量1.34kda,单糖组成为葡萄糖:甘露糖=2:1。免疫活性文献中所提及的牛膝寡糖或均一多糖均无详细的制备方法及理化性质的描述。有2篇文献将牛膝粗多糖作为佐剂应用于禽流感灭活苗、o型口蹄疫灭活疫苗和鸡新支二联弱毒苗。粗多糖主要采用水煎煮和乙醇沉淀方法,其具体制备条件和理化性质不详)。另外,目前亦尚未见牛膝寡糖或均一多糖作为疫苗佐剂的相关研究。技术实现要素:本发明人经过深入的研究和创造性的劳动,从中药材牛膝中分离得到了2个牛膝粗多糖abp-50和abp-100。进一步地,从abp-50中得到多糖组分abp-50-a和abp-50-b,从abp-100中得到多糖组分abp-100-a、abp-100-b和abp-100-c。更进一步地,从abp-50-a中得到均一多糖abp-50-a-1,从abp-100-c中得到均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3。本发明人还分别对上述牛膝粗多糖、多糖组分和均一多糖的理化性质和化学结构进行分析,评价其疫苗佐剂和免疫调节活性。本发明人惊奇地发现,牛膝粗多糖abp-50和abp-100,多糖组分abp-50-a和abp-100-c,以及均一多糖abp-50-a-1、abp-100-c-1和abp-100-c-2均具有良好的免疫佐剂活性和免疫调节作用,具有制备疫苗佐剂和免疫调节药物的潜力。由此提供了下述发明:(一)牛膝粗多糖及其制备方法本发明的一个方面涉及一种牛膝粗多糖,其选自如下的牛膝粗多糖1-2:牛膝粗多糖1:主要由果糖组成,分子量为1000-3000da;优选地,还含有少量葡萄糖;优选地,峰高分子量为1900da;牛膝粗多糖2:主要由阿拉伯糖、葡萄糖、鼠李糖、半乳糖和半乳糖醛酸组成,分子量为1.0×104-2.0×105da;优选地,峰高分子量为66000da(宽峰)。分子量可以采用本领域技术人员知悉的方法测定,例如采用hplc方法测定多糖分子量,依据多糖分子量与保留时间相关性,计算分子量。本发明的另一方面涉及一种制备牛膝粗多糖(粗多糖1)的方法,包括下述步骤:(1)将牛膝药材(例如怀牛膝或川牛膝)用水进行浸泡,保持温度为4℃-80℃,得到水提液;(2)将水提液进行减压浓缩,浓缩液进行乙醇沉淀,沉淀部分加入水溶解,得到上清液;(3)取上清液进行水透析或膜过滤;(4)取透析液或滤液进行浓缩,浓缩液进行冷冻干燥,得到牛膝粗多糖。在本发明的一些实施方案中,所述的制备牛膝粗多糖的方法,其特征在于如下的[1]-[13]项中的任意一项或者多项:[1]将所述药材牛膝进行粉碎;[2]步骤(1)中所用水为蒸馏水或去离子水;[3]步骤(1)中,所述温度为20℃-80℃;优选为25℃-60℃、40℃-55℃、45℃-55℃、48℃-52℃、45℃、46℃、47℃、48℃、49℃、50℃、51℃、52℃、53℃、54℃或55℃;[4]将步骤(1)中的操作重复一次或者多次,合并水提液;[5]步骤(1)中水的用量为1-50倍量(l/kg),优选为5-30倍量,优选为50-20倍量或者10-20倍量,例如15倍量;[6]步骤(1)中的浸泡时间为至少1小时、至少2小时、2-24小时、3-12小时或者5小时;[7]步骤(2)中,醇沉后乙醇的终浓度为60%-90%,例如70%-80%;[8]步骤(2)中所用乙醇的量为浓缩液的1-5倍体积,例如3-5倍体积;[9]步骤(2)中醇沉的时间为至少12小时、至少24小时、24-72小时或者48小时;[10]步骤(2)中,乙醇沉淀后离心,得到的沉淀用水进行一次或多次溶解,离心,合并上清液;[11]步骤(2)和/或(4)中减压浓缩的温度为50℃-55℃;[12]步骤(3)中透析或者膜过滤的截留分子量>1000;[13]步骤(3)中的膜过滤为超滤。本发明还涉及另外一种制备牛膝粗多糖(粗多糖2)的方法,包括下述步骤:1)将牛膝药材(例如怀牛膝或川牛膝)或者前面步骤(1)中提取后得到的牛膝药材残渣用水进行浸泡或者煎煮,保持温度为81-100℃,得到水提液;2)将水提液进行减压浓缩,浓缩液进行乙醇沉淀,沉淀部分加入水溶解,得到上清液;3)取上清液进行水透析或膜过滤;4)取透析液或滤液进行浓缩,浓缩液进行冷冻干燥;在本发明的一些实施方案中,所述的制备牛膝粗多糖的方法,其特征在于如下的[1]-[13]项中的任意一项或者多项:[1]将所述药材牛膝或者所述牛膝药材残渣进行粉碎;[2]步骤(1)中所用水为蒸馏水或去离子水;[3]步骤(1)中,所述温度为82℃-100℃;优选为85℃-100℃、90℃-100℃、95℃-100℃、96℃-100℃、97℃-100℃、98℃-100℃、99℃-100℃、95℃、96℃、97℃、98℃、99℃或100℃;[4]将步骤(1)中的操作重复一次或者多次,合并水提液;[5]步骤(1)中水的用量为1-50倍量(l/kg),优选为5-30倍量,优选为50-20倍量或者10-20倍量,例如15倍量;[6]步骤(1)中的浸泡或煎煮的时间为至少1小时、至少2小时、2-24小时、3-12小时或者5小时;[7]步骤(2)中,醇沉后乙醇的终浓度为60%-90%,例如70%-80%;[8]步骤(2)中所用乙醇的量为浓缩液的1-4倍体积;[9]步骤(2)中醇沉的时间为至少12小时、至少24小时、24-72小时或者48小时;[10]步骤(2)中,乙醇沉淀后离心,得到的沉淀用水进行一次或多次溶解,离心,合并上清液;[11]步骤(2)和/或(4)中减压浓缩的温度为50℃-55℃;[12]步骤(3)中透析或者膜过滤的截留分子量>1000;[13]步骤(3)中的膜过滤为超滤。本发明还涉及一种牛膝粗多糖,其由前面本发明中任一项所述的制备牛膝粗多糖的方法制得。本发明的牛膝粗多糖含有下面的本发明的牛膝多糖组分以及牛膝均一多糖。(二)牛膝多糖组分及其制备方法本发明的再一方面涉及一种牛膝多糖组分,其选自如下的牛膝多糖组分1-5:牛膝多糖组分1:主要由果糖组成;含有或者为一个均一多糖(一种果聚糖),分子量为1900±1000da;优选地,还含有少量葡萄糖;优选地,多糖的峰高分子量为1860da;牛膝多糖组分2:主要由阿拉伯糖(ara)、木糖(xyl)、葡萄糖(glc)和半乳糖(gal)组成;含有峰高分子量大于200,000da的多糖i、分子量为48,300±25,000da的多糖ii以及寡糖(1000-5000da)等成分;优选地,多糖ii的峰高分子量48,300da。牛膝多糖组分3:主要由阿拉伯和葡萄糖组成;含有分子量为3300±2000da的多糖;优选地,多糖的峰高分子量为3300da;牛膝多糖组分4:主要由阿拉伯糖、鼠李糖(rha)、半乳糖和半乳糖醛酸(gala)组成;含有二个多糖,分子量分别为55,000±30,000da、7300±4000da;优选地,多糖的峰高分子量分别为55,000da和7300da;牛膝多糖组分5:主要由鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸组成;为不对称糖分布,主要峰的分子量为97,100±40,000da;优 选地,主要峰的峰高分子量为97,100da。本发明还涉及一种制备牛膝多糖组分的方法,包括下述步骤:将本发明的牛膝粗多糖1用水溶解后,通过选自deae-纤维素柱层析、葡聚糖凝胶柱层析、琼脂糖凝胶柱层析和丙烯葡聚糖凝胶柱层析中的至少一种进行分离,采用水或盐洗脱。例如采用deae-纤维素柱层析,依次用水和nahco3溶液洗脱,检测糖峰并收集含糖流份,分别得到水洗脱的多糖组分1和nahco3溶液洗脱的多糖组分2。在本发明的一个实施方案中,所述deae-纤维素柱为deae-纤维素(hco3-)柱。优选地,nahco3溶液的浓度为0.1-0.4mol/l,0.2-0.3mol/l,进一步优选为0.25mol/l。优选地,用苯酚-硫酸法或蒽酮法检测糖峰。本发明还涉及另外一种制备牛膝多糖组分的方法,包括下述步骤:将本发明的牛膝粗多糖2用水溶解后进行deae-纤维素柱层析,依次用水、0.2-0.3mol/lnahco3溶液和0.4-0.6mol/lnahco3溶液洗脱,检测糖峰并收集含糖流份,分别得到水洗脱的多糖组分3、0.2-0.3mol/lnahco3溶液洗脱的多糖组分4(优选使用0.25mol/lnahco3溶液洗脱)0.4-0.6mol/lnahco3溶液洗脱的5(优选使用0.5mol/lnahco3溶液洗脱)。在本发明的一个实施方案中,所述deae-纤维素柱为deae-纤维素(hco3-)柱。优选地,用苯酚-硫酸法检测糖峰。本发明还涉及一种牛膝多糖组分,其由前面本发明中任一项所述的制备牛膝多糖组分的方法制得。本发明的牛膝多糖组分含有下面的本发明的牛膝均一多糖。(三)牛膝均一多糖及其制备方法本发明的再一方面涉及一种牛膝均一多糖,其选自如下的牛膝多糖1-4:牛膝均一多糖1:分子量2.0×103±1.0×103da,是一种果聚糖,主要含有果糖,即为一种果聚糖,还含有少量葡萄糖;优选地,峰高分子量为1860da。牛膝均一多糖2:分子量1.05×106±0.50×106da,由鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸组成,单糖摩尔比为鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.80-1.20):(4.00-6.50):(4.00-5.50):(6.00-9.00);优选地,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.90-1.10):(5.10-5.50):(4.50-4.90):(8.00-8.50);更优选地鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=1.00:5.26:4.86:8.27;优选地,峰高分子量为1.05×106da;在本发明的一个实施方案中,所述的牛膝均一多糖2,其中,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.80-1.20):(5.00-5.50):(4.50-5.00):(8.00-8.50);优选地,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.90-1.10):(5.10-5.30):(4.70-4.90):(8.10-8.40)。牛膝均一多糖3:分子量5.35×105±2.50×105da,由鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸组成,单糖摩尔比为鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.80-1.20):(1.50-3.00):(2.00-3.50):(40.00-70.00);优选地,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.90-1.10):(1.80-2.20):(2.30-2.60):(50.00-60.00);更优选地,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=1.00:2.06:2.42:56.02;优选地,峰高分子量为5.35×105da;在本发明的一个实施方案中,所述的牛膝均一多糖3,其中,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.80-1.20):(1.8-2.30):(2.20-2.70):(52.00-60.00);优选地,鼠李糖:阿拉伯糖:半乳糖:半乳糖醛酸=(0.90-1.10):(1.9-2.20):(2.30-2.60):(54.00-58.00)。牛膝均一多糖4:分子量2.78×105±1.50×105da,由鼠李糖、阿拉伯糖、葡萄糖、半乳糖和半乳糖醛酸组成,单糖摩尔比为鼠李糖:阿拉伯糖:葡萄糖:半乳糖:半乳糖醛酸=(0.80-1.20):(0.50 -1.50):(0.20-0.80):(0.50-2.00):(12.00-20.00);优选地,鼠李糖:阿拉伯糖:葡萄糖:半乳糖:半乳糖醛酸=(0.90-1.10):(0.80-1.00):(0.30-0.50):(0.80-1.50):(13.00-18.00);更优选地,鼠李糖:阿拉伯糖:葡萄糖:半乳糖:半乳糖醛酸=1.00:0.93:0.34:0.91:16.67;优选地,峰高分子量为2.78×105da;在本发明的一个实施方案中,所述的牛膝均一多糖4,其中,鼠李糖:阿拉伯糖:葡萄糖:半乳糖:半乳糖醛酸=(0.80-1.20):(0.70-1.20):(0.25-0.55):(0.70-1.20):(12.00-20.00);优选地,鼠李糖:阿拉伯糖:葡萄糖:半乳糖:半乳糖醛酸=(0.90-1.10):(0.80-1.00):(0.30-0.40):(0.80-1.00):(15.00-18.00)。本发明还涉及一种制备牛膝均一多糖的方法,包括下述步骤:将本发明的多糖组分1用水溶解后进行sephadexg-25或sephadexg-50凝胶柱层析,采用水洗脱,检测糖峰并收集含糖流份分,得到均一多糖1。优选地,用蒽酮-硫酸或苯酚-硫酸法检测糖峰。本发明还涉及另外一种制备牛膝均一多糖的方法,包括下述步骤:将本发明的多糖组分5用水溶解后进行sephadexg-75或sephadexg-100凝胶柱层析,采用h2o或0.05-0.25mol/lnacl洗脱,检测糖峰并收集含糖流份,得到均一多糖2、均一多糖3和均一多糖4。优选地,用苯酚-硫酸法检测糖峰。优选地,用0.1mol/lnacl洗脱。本发明还涉及一种牛膝均一多糖,其由前面本发明中任一项所述的制备牛膝均一多糖的方法制得。本发明的再一方面涉及一种药物组合物,其包含选自本发明的一种或几种牛膝粗多糖、一种或几种牛膝多糖组分和/或一种或几种牛膝均一多糖,以及任选的药学上可接受的辅料。在本发明的一个实施方案中,所述药物组合物为疫苗制剂。在本发明的一个实施方案中,所述药物组合物为疫苗佐剂。在本发明的一个实施方案中,所述药物组 合物为免疫调节剂(用于上调或者下调免疫活性)或者提高免疫力的药物。本发明的再一方面涉及本发明牛膝粗多糖、牛膝多糖组分或者牛膝均一多糖在制备疫苗、疫苗佐剂、抗体、调节细胞免疫活性的药物或者提高动物免疫力的药物中的用途;所述调节例如为上调或者下调;优选地,所述调节细胞免疫活性选自如下:促进脾脏细胞增殖,促进脾脏b细胞、ctl细胞、t细胞和/或th细胞的分化,以及提高cd3+、cd4+细胞、cd19+和/或cd8+细胞的比例。所述抗体例如为单克隆抗体或多克隆抗体。在本发明的一个实施方案中,所述动物为哺乳动物,例如鼠(例如小鼠或者大鼠)、猪、牛、羊、兔、狗、猴或人,优选为人。在本发明的一个实施方案中,所述动物为家禽,例如鸡、鸭或鹅。本发明的再一方面涉及一种在体内或体外调节细胞免疫活性或者提高动物免疫力的方法,包括使用有效量的本发明的牛膝粗多糖、牛膝多糖组分或者牛膝均一多糖的步骤;所述调节例如为上调或者下调;优选地,所述调节细胞免疫活性选自如下:促进脾脏细胞增殖,促进脾脏b细胞、ctl细胞、t细胞和/或th细胞的分化,以及提高cd3+、cd4+细胞、cd19+和/或cd8+细胞的比例。在本发明的一个实施方案中,所述动物为哺乳动物,例如鼠(例如小鼠或者大鼠)、猪、牛、羊、兔、狗、猴或人,优选为人。在本发明的一个实施方案中,所述动物为家禽,例如鸡、鸭或鹅。本发明还涉及一种制备抗体的方法,其包括使用有效量的本发明 的一种或几种牛膝粗多糖、一种或几种牛膝多糖组分和/或一种或几种牛膝均一多糖的步骤。本发明中,术语“粗多糖”(crudepolysaccharides)是指将药材或者植物水提和醇沉后得到的产物,本领域中有时也称为“总多糖”。本领域技术人员知悉,如果药材中含有多糖,药材经过水提取、乙醇沉淀获得的沉淀部分中一定含有多糖,但可能还含有其他非糖成分。本领域技术人员能够理解,总多糖并非是指药材或者植物的全部多糖,因为无论怎样提取也很难获得植物的全部多糖。术语“均一多糖”(homogeneouspolysaccharide)具有本领域公知的含义,是指分子量和电荷均一的多糖。可以采用本领域技术人员知悉的方法来测定分子量均一和电荷均一。例如,分子量均一可以通过hpgpc图谱对称峰型来确定;电荷均一可以经过离子交换柱层析测定,一般电泳图谱为单一对称峰。术语“多糖组分”(polysaccharidecomponent,有时在具体实验中也称为fraction)是指含有一种以上均一多糖的混合物。在特殊的情况下,多糖组分只含有一种均一多糖甚至即为一种均一多糖。本发明中的粗多糖、均一多糖、多糖组分亦分别称为牛膝粗多糖、牛膝均一多糖、牛膝多糖组分。这样命名的考虑是其可以从药材牛膝中提取得到,但是并不排除以其它方式或者来源获得。所述牛膝包括但不限于怀牛膝(achyranthesbidentata)、川牛膝(cyathulaofficinalis)等。本发明中,对于涉及粗多糖、均一多糖、多糖组分的结构、组成、成分或者含量等的描述中,术语“主要”是指含量≥50%,例如≥55%、≥60%、≥65%、≥70%、≥75%、≥80%、≥85%、≥90%、≥91%、≥92%、≥93%、≥94%、≥95%、≥96%、≥97%、≥98%或者≥99%。术语“少量”是指含量≤50%、≤45%、≤40%、≤35%、≤ 30%、≤25%、≤20%、≤15%、≤10%、≤9%、≤8%、≤7%、≤6%、≤5%、≤4%、≤3%、≤2%或者≤1%。上述百分比是指质量百分比。在本发明中,所述疫苗为减毒疫苗、灭活疫苗、蛋白质亚单位疫苗、嵌合载体疫苗、dna疫苗、rna疫苗、多肽疫苗或小分子-蛋白偶合物疫苗。在本发明的一个实施方案中,所述疫苗为h1n1流感疫苗;在本发明的另一个实施方案中,所述疫苗为乙肝疫苗。在本发明的再一个实施方案中,所述疫苗为小分子-蛋白偶合物疫苗。在本发明中,疫苗佐剂是指能够用于疫苗的佐剂,其它疫苗佐剂例如氢氧化铝或磷酸铝或白油等佐剂。在本发明中,疫苗与疫苗制剂含义相同,是指所有用减毒或杀死的病原生物(细菌、病毒、立克次体等)或其它抗原性物质所制成,可使机体产生特异性免疫,用于预防接种或治疗的生物制剂。本发明中,所述乙醇的浓度,如果没有特别说明,均指重量百分比浓度(w/w%)。本发明中,术语“宽峰”一般指多糖在色谱柱中保留时间间隔长,而且峰型对称性不好的色谱峰。发明的有益效果本发明的牛膝粗多糖、多糖组分、以及均一多糖均具有良好的免疫佐剂活性和免疫调节作用,为疫苗佐剂和免疫调节功能提供了新的选择。附图说明下面的附图5、6、7、9、11、13、15、17、19、21中纵坐标mv均是指电信号毫伏。图1:牛膝粗多糖abp-50在deae-纤维素柱层析洗脱曲线。图2:牛膝粗多糖abp-100在deae-纤维素柱层析洗脱曲线。图3:多糖组分abp-50-a在sephadexg50柱层析洗脱曲线。图4:多糖组分abp-100-c在sephadexg100的洗脱曲线。图5:牛膝粗多糖abp-50的gpc图谱。图6:牛膝粗多糖abp-100的gpc图谱。图7:多糖组分abp-50-a的gpc图谱。图8:多糖组分abp-50-a的ce图谱。图9:多糖组分abp-50-b的gpc图谱。图10:多糖组分abp-50-b的ce图谱。图11:多糖组分abp-100-a的gpc图谱。图12:多糖组分abp-100-a的ce图谱。图13:多糖组分abp-100-b的gpc图谱。图14:多糖组分abp-100-b的ce图谱。图15:多糖组分abp-100-c的gpc图谱。图16:多糖组分abp-100-c的ce图谱。图17:均一多糖abp-100-c-1的gpc图谱。图18:均一多糖abp-100-c-1的ce图谱。图19:均一多糖abp-100-c-2的gpc图谱。图20:均一多糖abp-100-c-2的ce图谱。图21:均一多糖abp-100-c-3的gpc图谱。图22:均一多糖abp-100-c-3的ce图谱。图23:图23a,牛膝粗多糖abp-50对乙肝抗原免疫小鼠初次免疫抗体滴度的影响。图23b,牛膝粗多糖abp-50对乙肝抗原免疫小鼠二次免疫抗体滴度的影响。图24:图24a,牛膝粗多糖abp-100对乙肝抗原免疫小鼠初次免疫抗体滴度的影响。图24b,牛膝粗多糖abp-100对乙肝抗原免疫小鼠二次免疫抗体滴度的影响。图25:图25a,牛膝多糖组分abp-50-a对h1n1流感疫苗免疫小鼠初次免疫抗体滴度的影响。图25b,牛膝多糖组分abp-50-a对 h1n1流感疫苗免疫小鼠二次免疫抗体滴度的影响。图26:图26a,多糖组分abp-100-a、abp-100-b和abp-100-c对乙肝抗原免疫小鼠初次免疫的抗体滴度影响。图26b,多糖组分abp-100-a、abp-100-b和abp-100-c对乙肝抗原免疫小鼠二次免疫的抗体滴度影响。图27:图27a,均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对乙肝抗原免疫小鼠初次免疫抗体滴度的影响。图27b,均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对乙肝抗原免疫小鼠二次免疫抗体滴度的影响。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1:牛膝粗多糖abp-50和abp-100的制备1.牛膝粗多糖abp-50的制备取中药材怀牛膝(购于北京同仁堂药店)1kg,粉碎,向其中加入蒸馏水15l,50℃条件下浸泡5小时,期间不时搅拌;然后二层纱布过滤,滤液离心(3000r/min×20min),浸提后的残渣在同样条件下进行第二次提取,得到牛膝药材残渣(残渣用于后面abp-100的制备)和水提液。合并两次提取的水提液,50-55℃减压浓缩获得水提浓缩液。然后加入浓缩液的4倍体积95%乙醇进行醇沉48小时(上清液乙醇浓度80%)。离心,分离沉淀部分,向沉淀部分中加入水搅拌溶解,离心,再将沉淀同样操作3次;合并溶解的上清液,装入透析袋,截留分子量>1000,用水透析;将得到的袋内透析液减压浓缩后,进 行冷冻干燥,获得牛膝粗多糖abp-50。2.牛膝粗多糖abp-100的制备向前面得到的牛膝药材残渣中加入蒸馏水15l,100℃条件下煎煮1.5小时,期间不时搅拌;然后放凉,二层纱布过滤,滤液离心(3000r/min×20min),上清液50℃-55℃减压浓缩,获得水提浓缩液。然后加入浓缩液的3倍体积95%乙醇进行醇沉48小时(上清液乙醇浓度70%)。离心,分离沉淀部分,向沉淀部分中加入水搅拌溶解,离心,再将沉淀同样操作3次;合并溶解的上清液,装入透析袋,截留分子量>1000,用水透析;将得到的袋内透析液减压浓缩后,进行冷冻干燥,获得牛膝粗多糖abp-100。实施例2:牛膝多糖组分abp-50-a、abp-50-b,以及abp-100-a、abp-100-b、abp-100-c的制备1.牛膝多糖组分abp-50-a、abp-50-b的制备称取实施例1得到的牛膝粗多糖abp-501g,加入20ml水溶解后上样于deae-纤维素层析柱(φ7.0cm×50cm),依次用h2o和0.25mol/lnahco3洗脱,洗脱速度1ml/min,每只试管收集10ml,蒽酮-硫酸法检测流出的糖吸收峰(od620nm)。分别获得abp-50-a(h2o洗脱)和abp-50-b(0.25mol/lnahco3洗脱)二个多糖组分,洗脱曲线见图1。abp-50-b流份蒸馏水透析除盐。2.牛膝多糖组分abp-100-a、abp-100-b、abp-100-c的制备称取实施例1得到的牛膝粗多糖abp-1001g,加入20ml水溶解后上样于deae-纤维素层析柱(φ7.0cm×50cm),依次用h2o、0.25和0.5mol/lnahco3洗脱,洗脱速度1ml/min,每只试管收集10ml,苯酚-硫酸法检测流出的糖吸收峰(od620nm)。分别获得abp-100-a(h2o洗脱)、abp-100-b(0.25mol/lnahco3洗脱)和abp-100-c(0.5mol/lnahco3洗脱)三个 多糖组分,洗脱曲线见图2。分别收集三个含糖流份,用蒸馏水透析除盐,在减压浓缩和冷冻干燥制得。实施例3:牛膝均一多糖abp-50-a-1,以及abp-100-c-1、abp-100-c-2、abp-100-c-3的制备1.牛膝均一多糖abp-50-a-1的制备称取多糖组分abp-50-a200mg,加入2ml水溶解,上样sephadexg50凝胶层析柱(ф2.0cm×120cm),蒸馏水洗脱(洗脱曲线见图3),硫酸-蒽酮法检测流出的糖吸收峰(od620nm),减压浓缩和冷冻干燥,获得均一多糖abp-50-a-1。2.牛膝均一多糖abp-100-c-1、abp-100-c-2、abp-100-c-3的制备称取多糖组分abp-100-c200mg,加入3ml水溶解,上样sephadexg100凝胶层析柱(ф2.0cm×120cm),0.1mol/lnacl洗脱(洗脱曲线见图4),硫酸-苯酚法检测流出的三个含糖吸收峰(od490nm),分别收集、蒸馏水、减压浓缩和冷冻干燥,获得三个均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3。实施例4:牛膝粗多糖abp-50和abp-100的理化性质研究1.实验用品实施例1方法制备得到牛膝粗多糖abp-50和abp-100。2.实验方法采用硫酸-苯酚法测定糖含量(以葡萄糖计算);采用hpgpc方法测定多糖组分分子量分布(仪器:hplc,waters公司;色谱柱:tsksw3000;流动相:0.1mna2so4;流速:0.6ml/min;检测器:示差)。3.实验结果牛膝粗多糖abp-50的糖含量为94.29%,abp-100的糖含量为 29.03%。abp-50主要含有峰高分子量为2000da的寡糖,分子量2000±1000da;abp-100主要含有一个峰高分子量为6.60×104da的宽色谱峰,分子量6.60×104±3.50×104da。abp-50和abp-100的分子量分布见图5和图6。实施例5:多糖组分abp-50-a、abp-50-b以及abp-100-a、abp-100-b和abp-100-c的理化性质研究1.实验样品实施例2方法制备得到牛膝粗多糖abp-50的两个多糖组分(abp-50-a、abp-50-b)及abp100的三个多糖组分(abp-100-a、abp-100-b和abp-100-c)。2.实验方法采用hpgpc方法测定多糖组分分子量分布(仪器:hplc,waters公司;色谱柱:tsksw3000;流动相:0.1mna2so4;流速:0.6ml/min;检测器:示差)。多糖完全酸水解和pmp衍生化,采用毛细管电泳方法测定单糖的摩尔比(仪器:美国贝克曼公司,缓冲盐溶液:50mmol/l硼砂溶液(ph=10.57);毛细管柱:φ50μm×60cm;分离电压:15kv;检测波长:245nm;进样压力:0.5psi;进样时间:10s;柱温:25℃)。3.实验结果(1)abp-50-a:是一个分子量均一的均一多糖,峰高分子量为1,860da,主要含有果糖,即为一种果聚糖,还含有少量葡萄糖,结果见图7和图8。(2)abp-50-b:分子量分布较宽,其中含有峰高大于200,000da的多糖、峰高48,300da及高含量寡糖成分。该组分由阿拉伯糖(ara)、木糖(xyl)、葡萄糖(glc)和半乳糖(gal)组成,结果见图9和图10。(3)abp-100-a:主要含有一个峰高分子量为3,300da的多糖, 主要由阿拉伯和葡萄糖组成,单糖摩尔比为:ara:glc=1.00:0.90,结果见图11和图12。(4)abp-100-b:含有二个多糖峰,峰高分子量分别为55,000da和7,300da,主要由阿拉伯糖、鼠李糖(rha)、半乳糖和半乳糖醛酸(gala)组成,单糖摩尔比为:ara:rha:gal:gala=1.00:0.24:0.54:1.71,结果见图13和图14。(5)abp-100-c:为不对称糖分布,主要峰的峰高分子量为97,100da,主要由鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸组成,单糖摩尔比为rha:ara:gal:gala=1.00:2.85:3.37:8.90,结果见图15和图16。实施例6:牛膝均一多糖abp-50-a-1、abp-100-c-1、abp-100-c-2和abp-100-c-3的理化性质研究1.实验样品实施例3方法制备得到牛膝均一多糖abp-50-a-1、abp-100-c-1、abp-100-c-2和abp-100-c-3。2.实验方法采用hpgpc方法测定多糖组分分子量分布(仪器:hplc,waters公司;色谱柱:tsksw3000;流动相:0.1mna2so4;流速:0.6ml/min;检测器:示差)。多糖完全酸水解和pmp衍生化后,采用毛细管电泳方法测定单糖的摩尔比(仪器:美国贝克曼公司,缓冲盐溶液:50mmol/l硼砂溶液(ph=10.57);毛细管柱:φ50μm×60cm;分离电压:15kv;检测波长:245nm;进样压力:0.5psi;进样时间:10s;柱温:25℃)。3.实验结果(1)均一多糖abp-50-a-1:与abp-50-a相同。(2)均一多糖abp-100-c-1:峰高分子量为1.05×106da,分子量1.05×106±0.50×106da,由鼠李糖、阿拉伯糖、半乳糖和半乳糖 醛酸组成,单糖摩尔比为rha:ara:gal:gala=1.00:5.26:4.86:8.27,结果见图17和图18。(3)均一多糖abp-100-c-2:峰高分子量为5.35×105da,分子量5.35×105±2.50×105da,由鼠李糖、阿拉伯糖、半乳糖和半乳糖醛酸组成,单糖摩尔比为rha:ara:gal:gala=1.00:2.06:2.42:56.02,结果见图19和图20。(4)均一多糖abp-100-c-3:峰高分子量为2.78×105da,分子量2.78×105±1.50×105da,由鼠李糖、阿拉伯糖、葡萄糖、半乳糖和半乳糖醛酸组成,单糖摩尔比为rha:ara:glc:gal:gala=1.00:0.93:0.34:0.91:16.67,结果见图21和图22。实施例7:牛膝粗多糖abp-50和abp-100对乙肝抗原佐剂活性评价实施例1制备的牛膝粗多糖abp-50和abp-100作为佐剂,以乙肝蛋白亚单位(hbsag)为抗原(大连汉信生物制药有限公司生产),abp-50和abp-100按照0.2mg/鼠剂量分别与乙肝抗原(2μg/鼠)配伍肌肉注射免疫小鼠。实验分为生理盐水对照组、单独hbsag抗原组、hbsag+abp-50组(0.2mg/鼠)、hbsag+abp-100组(0.2mg/鼠)和hbsag+铝佐剂组(0.2mg/鼠)。配伍肌肉注射免疫小鼠。小鼠初次免疫后14天,elisa方法测定乙肝抗原特异性抗体滴度。初次免疫后28天进行二次免疫,剂量同初次。二次免疫后14天测定乙肝抗原特异性抗体滴度。采用elisa测定血清中抗体滴度,具体操作如下:elisa法所用试剂配制:(1)抗原包被液:50mmol/l碳酸盐缓冲液ph9.6。称取无水na2co31.696g,nahco32.856g加水溶解到1000ml,调节ph至9.6。(2)洗涤液(10×pbst,ph7.4):称取nacl80g,kcl2g,na2hpo429g,kh2po42g,tween-2010ml,双蒸水至1000ml,调节ph7.4,10倍稀释使用。(3)封闭液:1%bsa,用50mmol/lpbsph7.4溶解。(4)底物液(tmb-h2o2):使用时将底物液a和b等体积混合,加入30%h2o2,终浓度0.5%。底物液a(tmb):称取tmb200mg,无水乙醇100ml,加双蒸水至1000ml。底物液b(0.1mol/l柠檬酸-0.2mol/lna2hpo4缓冲液):na2hpo424.8g,柠檬酸19.33g,加双蒸水至1000ml,调节ph5.0-5.4。(5)2nh2so4。(6)hbsag溶解于抗原包被液,浓度为4μg/ml,包被96孔板(costa)100μl/孔,4℃过夜。pbst洗3遍,1%bsa-pbs37℃封闭1小时。pbst洗3遍后加入以pbst稀释的小鼠血清样品,100μl/孔,37℃孵温1小时。pbst洗3遍,加入hrp-羊抗小鼠igg(1:1000,pbst)37℃孵温1小时,pbst洗6遍,加入100μl底物液显色后,加入50μl2nh2so4终止反应测定a450。实验结果:初次免疫后14天,各免疫组小鼠的抗体滴度均较低,各组之间无明显差异(图23a和24a)。二次免疫后14天,与生理盐水组相比,单独抗原免疫组小鼠抗体滴度明显升高(p<0.01),联用牛膝粗多糖abp-50或abp-100组小鼠血清抗体滴度显著高于单独抗原组(p<0.01),但二者之间佐剂效果相似(图23b和图24b)。结果显示,abp-50和abp-100对乙肝抗原有明显的佐剂活性,但活性低于铝佐剂。实施例8:牛膝多糖组分abp-50-a对h1n1流感疫苗的佐剂活性评价按实施例2制备牛膝多糖组分abp-50-a,研究对h1n1流感灭活疫苗(病毒裂解液,北京科兴生物制品有限公司生产)的佐剂活性。h1n1流感疫苗剂量3μg/鼠,以上四个多糖佐剂的剂量均为0.2mg/鼠,采用肌肉注射免疫小鼠。实验分为生理盐水对照组、单独h1n1抗原组、h1n1+abp-50-a组和h1n1+铝佐剂组。小鼠初次免疫后14天,elisa方法测定h1n1流感抗原特异性抗体滴度。初次免疫后28天进行二次免疫,剂量同初次免疫。二次免疫后14天测定h1n1流感抗原特异性抗体滴度。具体测定方法参考实施例7。实验结果:初次免疫后14天,单独抗原组及联用所有多糖组分组小鼠的特异性抗体滴度均较低,各组之间无明显差异(图25a)。二次免疫后14天,与生理盐水组相比,单独h1n1抗原组小鼠血清抗体滴度明显升高(p<0.01)(图25b)。结果显示,抗原联用abp-50-a能更显著升高抗体滴度(p<0.01),表明abp-50-a对h1n1流感疫苗具有显著佐剂活性。实施例9:牛膝粗多糖abp-100的三个多糖组分abp-100-a、abp-100-b和abp-100-c对乙肝抗原佐剂活性评价实施例2制备的牛膝粗多糖abp-100的三个多糖组分abp-100-a、abp-100-b和abp-100-c分别与乙肝蛋白亚单位(hbsag)为抗原联用(大连汉信生物制药有限公司生产)免疫小鼠。多糖佐剂按照0.2mg/鼠剂量与乙肝抗原(2μg/鼠)配伍肌肉注射免疫小鼠。实验分为生理盐水对照组、单独hbsag抗原组、hbsag+abp-100-a组、hbsag+abp-100-b组、hbsag+abp-100-c组和hbsag+铝佐剂组(0.2mg/鼠)。小鼠初次免疫后14天,elisa方法测定乙肝抗原特异性抗体滴 度。初次免疫后28天进行二次免疫,剂量同初次。第二次免疫后14天测定乙肝抗原特异性抗体滴度。实验结果:abp-100的三个多糖组分分别与乙肝抗原联用免疫小鼠初次免疫后14天,各组血清特异性抗体滴度均较低。(图26a)。经过二次免疫后,三个多糖组分均能提高免疫小鼠血清特异性抗体滴度水平(p<0.05),但佐剂活性弱于铝佐剂(图26b)。实施例10:均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对乙肝抗原免疫小鼠体液免疫的评价实施例3制备的三个牛膝均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3作为佐剂,以乙肝重组蛋白(hbsag)为抗原(2μg/鼠,大连汉信生物制药有限公司生产),abp-50和abp-100按照0.2mg/鼠剂量分别与乙肝抗原(2μg/鼠)配伍肌肉注射免疫小鼠。实验分为生理盐水对照组、单独hbsag抗原组、hbsag+abp-100-c-1组(0.2mg/鼠)、hbsag+abp-100-c-2组(0.2mg/鼠)、hbsag+abp-100-c-3组(0.2mg/鼠)和hbsag+铝佐剂组(0.2mg/鼠)。配伍肌肉注射免疫小鼠。小鼠初次免疫后14天,elisa方法测定乙肝抗原特异性抗体滴度。初次免疫后28天进行二次免疫,剂量同初次。二次免疫后14天测定乙肝抗原特异性抗体滴度。采用elisa测定血清中抗体滴度,具体操作同实施例7。结果如图27a和27b所示。结果表明:abp-100-c的三个多糖组分中的abp-100-c-1和abp-100-c-2成分与乙肝抗原联用,均能显著提高乙肝抗原特异性抗体滴度,佐剂活性优于铝佐剂,abp-100-c-3佐剂效果与铝佐剂相近。实施例11:牛膝粗多糖abp-50和abp-100对免疫小鼠细胞免疫功能的评价按实施例7方法分别将实施例1制备的牛膝粗多糖abp-50和abp-100与乙肝疫苗抗原联用免疫小鼠二次。二次免疫后14天处死小鼠,无菌去脾脏,制备脾细胞,调整细胞密度为5×109个/l。将计数后的脾细胞悬液按每孔100μl加入到96孔细胞培养板,各孔分别加入100μl细胞培养液,然后各孔再分别加入100μl细胞培养液,每组设3复孔。将培养板置于含5%co2培养箱中,37℃孵育48h。加入20μlmtt(5mg/ml),继续孵育4h。弃上清液后,每孔中加入150μldmso酶标仪检测a570nm,测定脾细胞增殖能力。实验结果见表1。表1:牛膝多糖abp-50和abp-100对乙肝免疫小鼠脾细胞增殖的影响组别od570nmsaline(生理盐水)0.482±0.058hbsag0.417±0.087*hbsag+abp-500.484±0.037#hbsag+abp-1000.589±0.045###hbsag+al(oh)30.465±0.021#注:与抗原对照组比较,#p<0.05,###p<0.01,n=6.结果表明:与生理盐水组相比,单独hbsag抗原组小鼠脾脏细胞增殖能力降低(p<0.05);与抗原组相比,abp-100能显著促进小鼠脾脏细胞的增殖(p<0.001),abp-50也能提高增殖能力,达到生理盐水组增殖水平。实施例12:牛膝均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对免疫小鼠细胞免疫功能的评价按实施例10方法将乙肝抗原分别与实施例3制备的牛膝均一多糖abp-100-c-1、abp-100-c-2或abp-100-c-3联用,免疫小鼠二次后14d,颈椎脱臼处死。无菌条件下取出脾,制备脾细胞悬液,调整细胞 密度为5×109个/l。将计数后的脾细胞悬液按每孔100μl加入到96孔细胞培养板,各孔分别加入100μl细胞培养液,然后各孔再分别加入100μl细胞培养液,每组设3复孔。将培养板置于含5%co2培养箱中,37℃孵育48h。加入20μlmtt(5mg/ml),继续孵育4h。弃上清液后,每孔中加入150μldmso酶标仪检测a570nm,测定脾细胞增殖能力。另取脾细胞悬液100μl(2×107/ml),加入100μl混合抗体(含percp-仓鼠抗小鼠cd3e抗体0.25μg,apc-大鼠抗小鼠cd19抗体0.5μg,pe-大鼠抗小鼠cd4抗体0.125μg,fitc-大鼠抗小鼠cd8a抗体0.5μg),每组设3个平行管。另外设4个相应的单标抗体对照。室温下避光孵育25min,然后各管加入洗液1.5ml,混匀。4℃离心10min(600×g),弃上清,再离心和洗涤3次,重悬细胞,然后加入pbs500μl,摇匀,进行流式细胞仪分析,测定cd3+、cd19+、cd4+和cd8+细胞的百分率。实验结果如表2、表3以及表4所示。表2:牛膝均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对乙肝免疫小鼠脾细胞增殖的影响注:与抗原对照组比较,##p<0.01,n=6.表3:牛膝均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对免疫小鼠脾脏cd3+和cd19+细胞的影响注:与正常对照组相比,**p<0.01,***p<0.001;与模型组相比,#p<0.05,##p<0.01,###p<0.001。表4:牛膝均一多糖abp-100-c-1、abp-100-c-2和abp-100-c-3对免疫小鼠脾脏cd4+和cd8+细胞的影响注:与正常对照组相比,**p<0.01,***p<0.001;与模型组相比,#p<0.05,##p<0.01,###p<0.001。结果表明:abp-100-c-2与乙肝抗原联用免疫小鼠,能显著提高脾脏细胞的增殖活性(见表2)。进一步流式细胞仪分析表明abp-100-c-1能提高受免小鼠脾脏cd3+和cd4+细胞比例,升高及cd3+/cd19+和cd4+/cd8+的比值,提示abp-100-c-1能促进脾脏t细胞及th细胞分化;abp-100-c-2减少能提高受免小鼠脾脏cd19+和cd8+细胞比例,降低cd3+/cd19+和cd4+/cd8+的比值,提示abp-100-c-2能促进脾脏b细胞及ctl细胞分化(见表3和表4)。上述实验结果显示,本发明的牛膝均一多糖特别是abp-100-c-1和abp-100-c-2能提高免疫小鼠细胞免疫的能力。尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1