用于捕获循环肿瘤细胞的微流控芯片及其捕获和鉴定方法与流程
本发明涉及微流控芯片,具体涉及一种用于捕获循环肿瘤细胞的微流控芯片及其捕获和鉴定方法。
背景技术:
循环肿瘤细胞(circulating tumor cells,CTCs)是脱离原发病灶,侵袭并进入循环系统的癌细胞,可以作为诊断患者预后或肿瘤复发、揭示肿瘤转移行为、合理指导临床个体化治疗的指标,是目前肿瘤学的研究热点。但是肿瘤病人血液中CTCs的数目非常稀少,每毫升血液中仅含有1~100个CTCs,而每毫升血液中的有上百万个白细胞及数目更多的红细胞,因此从外周血中快速、高效的检测CTCs是此领域面临的挑战。
微流控芯片技术具有样品试剂消耗量少、分析检测灵敏度高、高通量及高效率等优点,当前已经有研究利用微流控芯片技术检测循环肿瘤细胞,在微流芯片中使用较多的捕获方法是利用针对某些肿瘤细胞上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)进行特异性分选。但是EpCAM作为一种上皮细胞表面标记物,在不同类型的肿瘤细胞中的表达程度不同,容易导致假阳性和假阴性的检测结果。此外依据肿瘤细胞与血细胞在粒径和变形能力方面的差别,可以用不同的物理方法对CTCs进行分选。目前最常用的物理尺度筛选方法是,根据血细胞与CTCs大小的不同,采用类似滤膜过滤的方法将较小的血细胞过滤掉,截留住粒径较大的CTCs,从而达到CTCs分选富集的目的。该方法的优点是CTCs回收率可以达到80%~95%;缺点是分选速度太慢,效率偏低,芯片易被血细胞阻塞,造成分选操作无法进行。
专利文献CN102360010A公开了“一种全血癌细胞捕获集成微流控芯片”,但该技术方案的混合流道是呈S形的,也存在分选速度太慢,效率偏低,芯片易被血细胞阻塞,造成分选操作无法进行等缺陷。
专利文献CN103409371A根据细胞尺寸大小不同,通过设计圆盘状的结构,利用隔挡部顶端与盖片间距离,使小尺寸细胞顺利通过,而使大尺寸肿瘤细胞留在凹陷部里面,达到捕获细胞的目的。该专利的缺点是该芯片实际捕获面积只有流道周围一圈结构,当外围一圈铺满目标细胞后在流体压力作用下,目标细胞也容易被挤出,导致捕获效率较低。
另外,现有利用微流芯片捕获CTCs的方法,大部分捕获肿瘤细胞后通过转移到离心管进行CTCs的分析,该转移过程会造成大量细胞损失,另外在离心管中完成后续鉴定也包含损失目标细胞的高风险操作(例如,离心、冲洗和孵育),因此存在着难以克服的缺陷。
技术实现要素:
针对现有技术的不足,本发明的目的旨在提供一种用于捕获循环肿瘤细胞的微流控芯片及其捕获和鉴定方法,该芯片操作方便,能快速高效率捕获循环肿瘤细胞,且可直接在芯片内直接进行循环肿瘤细胞的后续分析鉴定。
为实现上述目的,本发明采用如下技术方案:
用于捕获循环肿瘤细胞的微流控芯片,包括样品细胞溶液进口,与样品细胞溶液进口相连通、将样品细胞溶液进行逐级分流的分流结构,与分流结构的出口相连通、将样品细胞溶液中的细胞进行聚焦的细胞聚焦结构,与细胞聚焦结构的出口相连通、将样品细胞溶液中的循环肿瘤细胞进行捕获的细胞栅栏结构,以及与细胞栅栏结构的出口相连通的废液出口。
所述细胞栅栏结构的出口和废液出口之间通过呈树杈状的汇流结构相连通,汇流结构将细胞栅栏结构流出的样品细胞废液逐级汇集至废液出口中。
所述细胞栅栏结构由正六棱柱或正三棱柱的微柱排列而成。
所述细胞栅栏结构包括内圈细胞栅栏结构和外圈细胞栅栏结构;所述外圈细胞栅栏结构包括与细胞聚焦结构的出口相连通的连通部以及和连通部相衔接的通道部,所述连通部沿着样品细胞溶液的流向呈喇叭状逐步扩大,通道部设置于内圈细胞栅栏结构的外围,内圈细胞栅栏结构的进口位于连通部内且与细胞聚焦结构的出口相对。
所述内圈细胞栅栏结构由1-3排平行间隔排列的微柱构成,微柱间的间隙为6-8um。
所述外圈细胞栅栏结构由4-6个微柱组成的微柱列平行排列而成,微柱列与水平方向呈20°-40°夹角,微柱间的间隙为6-8μm。
所述分流结构由多级分流通道组成并呈树杈状分布,每级分流通道中的两分流通道之间的夹角为30°-45°。
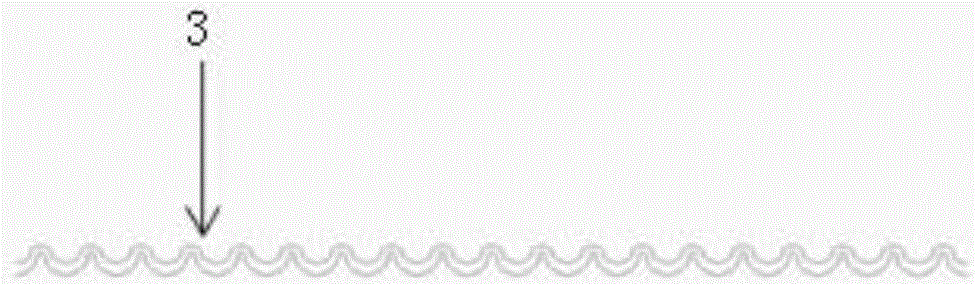
所述细胞聚焦结构呈蛇形波纹状。
一种捕获循环肿瘤细胞的方法,包括如下步骤:
(1)采用缓冲液冲洗权利要求1所述的微流控芯片,除去微流控芯片内部气泡;
(2)将Kolliphor P188的水溶液通入权利要求1所述的微流控芯片,包被2-10min,减少细胞和微流控芯片间非特异性吸附;—
(3)将测试液通入权利要求1所述的微流控芯片,进行循环肿瘤细胞捕获,循环肿瘤细胞和部分白细胞捕获至细胞栅栏结构,其他血液细胞从废液出口流出。
一种循环肿瘤细胞的免疫荧光染色鉴定方法,包括如下步骤:
(1)将固定液通入权利要求1所述的微流控芯片,进样后固定细胞10-30min;
(2)将缓冲液通入权利要求1所述的微流控芯片,替换微流控芯片中的固定液;
(3)将Triton X-100通入权利要求1所述的微流控芯片10-30min;
(4)将缓冲液通入权利要求1所述的微流控芯片,替换微流控芯片中的Triton X-100溶液;
(5)取CK18-FITC、CD45-PE和DAPI,加一抗稀释液,得稀释液,接着将稀释液通入权利要求1所述的微流控芯片,在4-37℃的条件下孵育2-12小时;
(6)将缓冲液通入权利要求1所述的微流控芯片,替换微流控芯片中未结合到细胞的抗体染色液,染色完毕,显微镜下进行鉴定。
本发明的有益效果在于:
本发明用于循环肿瘤细胞捕获的微流控芯片通过分流结构可将样品细胞溶液进行多级分流,以减少样品细胞溶液的堵塞,为实现快速分选做好充足的准备,同时在细胞聚焦结构的作用下,循环肿瘤细胞将直线排列于流道中央,可直接快速地流入细胞栅栏结构中,以实现对循环肿瘤细胞的快速捕获。
附图说明
图1为本发明用于循环肿瘤细胞捕获的微流控芯片的结构示意图;
图2为细胞聚焦结构的结构放大示意图;
图3为细胞栅栏结构的结构放大示意图;
图4为本发明用于循环肿瘤细胞捕获的微流控芯片捕获H1299-GFP细胞的效果图;
图中:1、样品细胞溶液进口;2、分流结构;3、细胞聚焦结构;4、细胞栅栏结构;5、废液出口;6、汇流结构;21、分流通道;41、内圈细胞栅栏结构;42、外圈细胞栅栏结构;420、连通部;421、通道部。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述:
实施例1
如图1所示,本发明用于循环肿瘤细胞捕获的微流控芯片包括样品细胞溶液进口1,与样品细胞溶液进口1相连通、将样品细胞溶液进行逐级分流的分流结构2,也就是说,通过分流结构2能够将样品细胞溶液逐级分流成多股流体,以减少样品细胞溶液的堵塞;与分流结构2的出口相连通、将样品细胞溶液中的细胞进行聚焦的细胞聚焦结构3,也就是说,经分流后的样品细胞溶液可直接进入到细胞聚焦结构3中,细胞聚焦结构3对尺寸较大的细胞(比如循环肿瘤细胞和部分尺寸较大的白细胞)聚焦效果较好,聚焦后的细胞在细胞聚焦结构3出口位置呈直线排列于流道中央;与细胞聚焦结构3的出口相连通、将样品细胞溶液中的循环肿瘤细胞进行捕获的细胞栅栏结构4,细胞栅栏结构4形成捕获区,也就是说,经过细胞聚焦结构3聚焦后的循环肿瘤细胞可直接进入到细胞栅栏结构4中,细胞栅栏结构4即可对循环肿瘤细胞进行直接地捕获,捕获后的样品废液即可从废液出口5直接排出。
由上述可知,本发明用于循环肿瘤细胞捕获的微流控芯片通过分流结构2可将样品细胞溶液进行多级分流,以减少样品细胞溶液的堵塞,为实现快速分选做好充足的准备,同时在细胞聚焦结构3的作用下,循环肿瘤细胞将直线排列于流道中央,可直接快速地流入细胞栅栏结构4中,以实现对循环肿瘤细胞的快速捕获。
此外,为了进一步提高本微流控芯片对循环肿瘤细胞的捕获速度,上述的细胞栅栏结构4的出口和废液出口5之间通过呈树杈状的汇流结构6相连通,汇流结构6将细胞栅栏结构4流出的样品细胞废液逐级汇集至废液出口5中,也就是说,通过汇流结构6可将样品细胞废液逐级汇聚,避免样品细胞废液突然汇聚而导致堵塞,以实现样品细胞溶液的快速流通,从而进一步提高对循环肿瘤细胞的捕获速度。
其中,在发明人的一次实验中偶然发现,当上述的细胞栅栏结构4由正六棱柱或正三棱柱的微柱排列而成时,在相同柱子间隙,相同流速条件下,这两种柱子的间隙流体压力较小,细胞较不容易被挤出。
另外,为了进一步提高本发明微流控芯片对循环肿瘤细胞的捕获率,如图3所示,上述细胞栅栏结构4包括内圈细胞栅栏结构41和外圈细胞栅栏结构42,其中,内圈细胞栅栏结构41组成核心捕获区,外圈细胞栅栏结构42组成辅助捕获区;该外圈细胞栅栏结构42包括与细胞聚焦结构的出口相连通的连通部420以及和连通部420相衔接的通道部421,其中,该连通部420沿着样品细胞溶液的流向呈喇叭状逐步扩大,如此,即可便于提高样品细胞溶液的流速。而通道部421则设置于内圈细胞栅栏结构41的外围,这样,由于外圈细胞栅栏结构42的存在可以防止样品细胞溶液中的循环肿瘤细胞不被挤出,起到双重保护的作用,从而可实现对循环肿瘤细胞的高效、准确捕获。内圈细胞栅栏结构41的进口则位于连通部420内且与细胞聚焦结构3的出口相对,如此,即可使得绝大部分的样品细胞溶液快速地流入内圈细胞栅栏结构41中,以实现对循环肿瘤细胞的高效、准确捕获。
由于循环肿瘤细胞的直径介于12~25μm,白细胞的直径介于8~14μm,红细胞直径介于6~8μm,且和循环肿瘤细胞对比,红细胞和白细胞较容易发生形变,因此上述的内圈细胞栅栏结构41由1-3排平行间隔排列的微柱构成,微柱间的间隙为6-8um,上述的外圈细胞栅栏结构42由4-6个微柱组成的微柱列平行排列而成,微柱列与水平方向呈30°夹角(微柱列呈30°夹角可以在一定程度上减小流体流出外圈细胞栅栏结构的速度,从而减少了细胞被挤出),微柱间的间隙为6-8μm,如此,通过上述的设计,可以将样品细胞溶液中的红细胞和白细胞溢出捕获区,使得捕获区所捕获的细胞绝大数为循环肿瘤细胞,捕获的准确率高达95%以上。
其中,上述的分流结构2由多级分流通道组成并呈树杈状分布,每级分流通道中的两分流通道21之间的夹角为30-45°,当两分流通道21之间的夹角为30-45°时,能够进一步提升样品细胞溶液的流速。当然,上述的分流结构2不仅仅限于本实施例中所描述的呈树杈状的方式,也可以采用其他多级分流的方式,只要能够对样品细胞溶液进行分流,避免发生堵塞的现象即可。
如图2所示,上述的细胞聚焦结构3呈蛇形波纹状,如此,在流体惯性力的作用下,经过蛇形波纹流道后,流体中的细胞会自动聚集于流体的中间位置。当然细胞聚焦结构3也可以采用其他形状的方式,只要能够实现将流体中的细胞会自动聚集于流体的中间位置即可。
同时,在本实施例中,为了进一步提高本发明微流控芯片捕获效率和捕获准确性,上述的分流通道21设置有16条,也就是说,细胞聚焦结构3以及细胞栅栏结构4也均设置有16条。
实施例2
一种捕获循环肿瘤细胞的方法,包括如下步骤:
(1)将PBS溶液通入实施例1中的微流控芯片,废液出口12连接15ml离心管,开启气压泵,冲洗微流控芯片3min,除去微流控芯片内部气泡;
(2)将1%P188的水溶液通入实施例1中的微流控芯片,开启进样泵进样包被3min,这样可以减少细胞和实施例1中的微流控芯片表面的非特异性吸附;
(3)将血液经PBS稀释5倍后从,循环肿瘤细胞和部分细胞直径的较大白细胞捕获至实施例1中微流控芯片的捕获区,其他血液细胞会从废液出口流出;
如图4所示:将1ml细胞浓度为104cell/ml的H1299细胞悬液通入实施例1中的微流控芯片后,在微流控芯片的捕获区域被捕获下来,检测结果显示:95%的H1299-GFP细胞被捕获区截留。
实施例3
一种循环肿瘤细胞的免疫荧光染色鉴定方法,包括如下步骤:
(1)将4%多聚甲醛以500mbar压力下通入实施例1中的微流控芯片,进样固定细胞10min;
(2)将PBS缓冲液以500mbar压力下通入实施例1中的微流控芯片,替换微流控芯片中的多聚甲醛溶液;
(3)将体积分数为0.2%的Triton X-100以500mbar压力下通入上述的微流控芯片,通入微流控芯片10min,以增加循环肿瘤细胞膜对染色试剂的通透性;
(4)将PBS缓冲液以500mbar压力下通入实施例1中的微流控芯片,替换微流控芯片中的Triton X-100溶液;
(5)取10ul CK18-FITC、10ul CD45-PE和0.5ul浓度为1mg/ml的DAPI,加一抗稀释液补至100ul,得稀释液,接着将稀释液通入上述的微流控芯片,在4℃的条件下孵育12小时;
(6)将PBS缓冲液以500mbar压力下通入实施例1中的微流控芯片,替换微流控芯片中未结合到细胞的抗体染色液;
(7)将完成抗体免疫反应的微流控芯片在荧光显微镜下观察,记录观察结果。
对本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及形变,而所有的这些改变以及形变都应该属于本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!