分子靶向氮杂芳香环轴向取代酞菁配合物及制备方法与流程
本发明属于药物化学领域,具体涉及一种分子靶向氮杂芳香环轴向取代酞菁配合物及其制备方法。
背景技术:
目前癌症的治疗方法众多,而光动力治疗因其独特的优点逐渐成为了一个热门研究领域。光动力治疗是指利用光敏剂在一定波长光的激发下产生光动力效应从而进行疾病的诊断和治疗。
其作用过程是将一定剂量的光敏剂注入人体,经过一定时间后光敏剂在一定程度上选择性富集于病变组织,然后用一定波长的光照射病变组织,光敏剂会在光的激发下进行一系列的光物理、光化学反应,产生活性氧,进而杀死病变细胞,达到治疗疾病的目的。光敏剂是光动力治疗中的核心物质,而酞菁类化合物被认为是最具潜力的第二代光敏剂。分子靶向治疗是近年来肿瘤学科研究的热点,其中分子靶点药物备受关注,它是指利用肿瘤细胞与正常细胞之间分子生物学上的差异,从而抑制肿瘤细胞的生长、繁殖,最后导致其死亡的一类药物,长期以来,为了克服细胞毒类抗肿瘤药物选择性差,毒性大的弊端,科研人员一直在努力寻找能特异识别并杀伤肿瘤细胞的药物。随着肿瘤细胞分子生物学的迅速发展,针对肿瘤发生、发展机制的分子靶点药物逐渐成为研究的焦点。
近年来,光动力治疗开始尝试将光敏剂与其他抗癌药物偶联来提高治疗的效果,目前与普通化疗抗癌药物的联合的有顺铂,他莫昔芬等。N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉丙氧基)喹唑啉-4-胺是一种4-苯胺基喹唑啉类抗癌新药,它是一种选择性表皮生长因子受体酪氨酸激酶抑制剂,通过抑制EGFR酪氨酸激酶活性而妨碍肿瘤的生长、转移和血管的生成,并增加肿瘤细胞的凋亡,此药目前正在临床上推广应用。
基于分子靶点药物治疗和光动力治疗机制,本发明提出了构建光敏剂与分子靶点药物活性结构域轭合得到配合物的构想,即利用靶点药物的靶向性、光动力治疗的高杀伤力及酞菁化合物低消除速率的特点,探索N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺—酞菁配合物的构效关系。
技术实现要素:
本发明的目的在于提供一种分子靶向氮杂芳香环轴向取代酞菁配合物,该配合物结构单一,组成确定,不存在异构体,产品容易提纯;同时该配合物不容易聚集,有利于提高细胞摄取率。
为实现上述目的,本发明采用如下技术方案:
一种分子靶向氮杂芳香环轴向取代酞菁配合物化学结构式如下:
,其中M为Si、Al、Ti或Sn,
R1,R2取如下任意结构之一:
, 或Cl,
其中 n=2-8。
该分子靶向氮杂芳香环轴向取代酞菁配合物的制备方法包括如下具体步骤:
(1)将化合物1 ;n=2-8和对甲苯磺酰氯按摩尔比4:1加入到250mL的圆底烧瓶中,然后加入溶剂CH2Cl2,充分搅拌溶解后,再加入三乙胺,室温反应8-12h;反应结束后,分别用1mol/L盐酸溶液、饱和氯化钠溶液萃取三次,将CH2Cl2旋蒸干,随后以二氯甲烷和甲醇为洗脱剂,硅胶柱层析分离得到化合物2 ;n=2-8;
(2)将N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺和化合物2按摩尔比为1:1~3加入100mL的圆底烧瓶中,然后依次加入无水碳酸钾和DMF溶剂,在氮气保护下,温度为70℃~90℃反应3-10h,反应结束后旋蒸除去溶剂,再用二氯甲烷和饱和氯化钠混合溶液萃取三次,旋干除去二氯甲烷,再以二氯甲烷、甲醇为洗脱剂,硅胶柱层析分离得到化合物3;
(3)将1,3-二亚氨基异吲哚啉和四氯化硅按摩尔比4:1加入100mL三口圆底烧瓶中,再向其中加入喹啉溶剂,在220℃下回流1.5-2h,反应结束后,旋蒸除去溶剂,过滤;将滤饼用喹啉、甲苯、甲醇和丙酮的混合溶液洗涤,抽滤,干燥后得到化合物4;
(4)将化合物4和化合物3按摩尔比为1:2~6加入 100mL的圆底烧瓶中,然后加入氢化钠,再向其中加入甲苯溶剂,温度为120℃回流1-2d,反应结束后旋蒸除去溶剂,再以用乙酸乙酯和甲醇为洗脱剂,中性氧化铝分离得到分子靶向抗癌氮杂芳香环轴向取代酞菁配合物。
所得分子靶向氮杂芳香环轴向取代酞菁配合物用于制备抗肿瘤药物。
酞菁类化合物被认为是最具潜力的第二代光敏剂。但是由于其在靶细胞及靶组织中的缺乏靶向性,在实际应用中仍存在缺陷。本发明中设计的分子靶向氮杂芳香环轴向取代酞菁配合物是利用第二代光敏剂可化学剪裁和嫁接的特征,在其分子上键联某些生物特性的活性结构单元,期望利用分子靶向药物提高酞菁光敏剂对肿瘤组织的靶向性。该方案既解决N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺的耐药性问题,也提高酞菁配合物靶向性不强问题,使N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺可以对残留或零星分布在肿瘤组织周围的病变细胞进行长期抑制、灭活,大大降低治疗后肿瘤复发的风险。
本发明的显著优点在于:
(1)目标化合物结构单一,不存在异构体,产物容易纯化;
(2)所合成的化合物中引入聚乙二醇链,提高了光敏剂的生物相溶性,有利于作为光动力临床用药的使用;
(3)合成方法简单,反应容易实现,副反应少,原料低廉,成本低,有利于工业化生产;
(4)明显增强了光敏剂的靶向性,光动力活性较高。
附图说明:
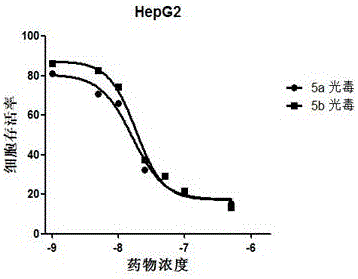
图1:无光照条件下对HepG2细胞的剂量依赖曲线。
图2:在光照条件下对HepG2细胞的剂量依赖曲线。
具体实施方式
实施例1(M=Si,n=4)
(1)在装有磁力搅拌装置、导气管装置和回流冷凝装置的250mL圆底烧瓶中依次加入称好的23.29 g(0.12 mol)三缩四乙二醇、15.18 g(0.15 mol)三乙胺和50 mL二氯甲烷,然后将5.72 g(0.03 mol)对甲苯磺酰氯溶解100 mL的二氯甲烷中,并装在恒压滴液漏斗中,在氮气保护下将对甲苯磺酰氯溶液缓慢滴加至反应瓶中,然后在室温下,搅拌反应8 h。反应结束后,先用1 mol/L的盐酸溶液和饱和的氯化钠溶液分别萃取三次,收集有机层,再减压蒸馏除去二氯甲烷;所得粗产物用干法上样过硅胶柱,所用展开剂为石油醚:乙酸乙酯=1:1的混合溶液,得到淡黄色粘稠状的液体(即化合物2a)约8.35 g,产率为80%;
(2)在装有磁力搅拌装置、导气管装置和回流冷凝装置的100mL圆底烧瓶中依次加入2.01 g(4.50 mmol) N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺、2.35 g(6.75 mmol)化合物2,及2.48 g(18.00 mmol)无水碳酸钾,再向其中加入15 mL DMF溶剂,90 ℃下反应6 h,反应结束后,旋干;向粗产物中加入二氯甲烷和饱和食盐水萃取,再用二氯甲烷萃取三次后,收集有机层减压旋干,得到化合物3a的粗产品,然后再以CH2Cl2:CH3OH=30:1的混合溶液为展开剂过硅胶柱,收集得到淡黄色粘稠状的液体(即化合物3a)0.98 g,产率为35%。1H NMR (400 MHz,CDCl3):δ 7.79 (s,1H,Ar-H),7.75 (s,1H,Ar-H),7.17-7.15 (m,1 H,Ar-H),,7.05-7.00 (m,1 H,Ar-H),6.95-6.93 (m,1 H,Ar-H),6.61 (s,1 H,Ar-H),4.18(t,J=12.0 Hz,2 H,CH2),4.09(t,J=8.0 Hz,2 H,CH2),3.92(s,3 H,CH3),3.75(t,J=8.0 Hz,2 H,CH2),3.67(t,J=8.0 Hz,4 H,CH2),3.59-3.57 (m,2 H,CH2),3.53-3.50(m,8H,CH2),3.49-3.46(m,2 H,CH2),3.21(s,1H,OH),2.50-2.43 (m,2H,CH2),2.43(s,4H,CH2),2.04-2.00 (m,2 H,CH2);HRMS (ESI):C30H40ClFN4O7 理论计算值(m/z [M]2+)为623.2632,实际测得值为623.2634;
(3)在装有磁力搅拌装置、导气管装置和回流冷凝装置的100mL三口圆底烧瓶中依次加入称好的3.7g 1,3-二亚氨基异吲哚啉,4.2mL四氯化硅及42mL喹啉;在220℃下回流1.5h,过滤,将滤饼用喹啉、甲苯、甲醇和丙酮的混合溶液洗涤,干燥后得到紫红色的二氯硅酞菁(即化合物4)3.5g,产率为65%;
(4)在装有磁力搅拌装置、导气管装置和回流冷凝装置的100mL圆底烧瓶中依次将0.21g化合物3a和0.052g化合物4, 20mL甲苯和0.032g氢化钠,升温至120℃反应1.5d;反应结束后用二氯甲烷:甲醇=100:1为洗脱过剂中性氧化铝柱,然后过四氢呋喃的凝胶柱,再用乙酸乙酯为洗脱剂过中性氧化铝柱,收集得到蓝紫色的固体(即化合物5a)5.69mg,产率为15%;1H NMR (400 MHz,CDCl3): δ 9.59-9.37(m,8H; Pc-1,4-Har),8.31-8.22 (m,8H; Pc-2,3-Har),7.89 (s,2 H,Ar-H),7.40(s,1 H,Ar-H),7.28(s,1 H,Ar-H),7.21(s,2H,Ar-H),7.04-7.02(m,4 H,Ar-H),6.37-6.23(m,2 H,Ar-H),4.26(s,4H,CH2),3.74-3.58 (m,16H,CH2),3.38(s,4H,CH2),3.10(s,3H,CH3),2.84(s,3H,CH3),2.57-2.50(m,10H,CH2),2.41-2.36(m,4H,CH2),2.09-2.03(m,6H,CH2),1.70-1.64(m,4H,CH2),1.28(s,2H,CH2),0.92-0.90(m,2H,CH2), 0.46-0.31(m,4H,CH2),−1.90-−2.05ppm (m,4H; Si-OCH2CH2O);HRMS (ESI):C86H80N14O14Si 理论计算值(m/z [M]2+)为1783.6281,实际测得值为1783.6284。
实施例2(M=Si,n=5)
(1)在装有磁力搅拌装置、导气管装置和回流冷凝装置的250mL圆底烧瓶中依次加入称好的10.76 g(0.12 mol)五甘醇、4.57 g(0.15 mol)三乙胺和50 mL二氯甲烷,然后将2.15 g(0.03 mol)对甲苯磺酰氯溶解100 mL的二氯甲烷中,并装在恒压滴液漏斗中,在氮气保护下将对甲苯磺酰氯溶液缓慢滴加至反应瓶中,然后在室温下,搅拌反应10 h。反应结束后,先用1 mol/L的盐酸溶液和饱和的氯化钠溶液分别萃取三次,收集有机层,再减压蒸馏除去二氯甲烷;所得粗产物用干法上样过硅胶柱,所用展开剂为石油醚:乙酸乙酯=1:1的混合溶液,得到淡黄色粘稠状的液体(即化合物2b)约6.15 g,产率为83%;
(2)在装有磁力搅拌装置、导气管装置和回流冷凝装置的100mL圆底烧瓶中依次加入1.01 g(4.50 mmol) N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉丙氧基)喹唑啉-4-胺、1.14 g(6.75 mmol)化合物2,及1.24 g(18.00 mmol)无水碳酸钾,再向其中加入15 mL DMF溶剂,80 ℃下反应8h,反应结束后,旋干;向粗产物中加入二氯甲烷和饱和食盐水萃取,再用二氯甲烷萃取三次后,收集有机层减压旋干,得到粗产品,然后再以CH2Cl2:CH3OH=30:1的混合溶液为展开剂过硅胶柱,收集得到淡黄色粘稠状的液体(即化合物3b)0.53 g,产率为32%;1H NMR (400 MHz,CDCl3):δ 7.84(s,1H,Ar-H),7.77(s,1H,Ar-H),7.18-7.20 (m,1 H,Ar-H),7.05-7.09(t,J=16 Hz,1 H,Ar-H),6.97(m,1 H,Ar-H),6.65(s,1 H,Ar-H),4.23(t,J=8.0 Hz,2 H,CH2),4.13(t,J=8.0 Hz,2 H,CH2),3.96(s,3 H,CH3),3.80 (t,J=8.0 Hz,2 H,CH2),3.68(t,J=8.0 Hz,4 H,CH2),3.57-3.62(m,15H,CH2+OH),2.54(t,J=12.0Hz,2 H,CH2),2.48 (s,4H,CH2),2.05-2.09 (m,2 H,CH2);HRMS (ESI):C30H40ClFN4O7 理论计算值(m/z [M]2+)为623.2632,实际测得值为623.2634。
(3)在装有磁力搅拌装置、导气管装置和回流冷凝装置的100mL三口圆底烧瓶中依次加入称好的3.7g 1,3-二亚氨基异吲哚啉,4.2mL四氯化硅及42mL喹啉;在220℃下回流2h,过滤,将滤饼用喹啉、甲苯、甲醇和丙酮的混合溶液洗涤,干燥后得到紫红色的二氯硅酞菁(即化合物4)3.5g,产率为65%.
(4)在装有磁力搅拌装置、导气管装置和回流冷凝装置的100mL圆底烧瓶中依次将0.23g化合物3b和0.052g化合物4,20mL甲苯和0.032g氢化钠,升温至120℃反应1.8d;反应结束后用二氯甲烷:甲醇=100:1为洗脱过剂中性氧化铝柱,然后过四氢呋喃的凝胶柱,再用乙酸乙酯为洗脱剂过中性氧化铝柱,收集得到蓝紫色的固体(即化合物5b)4.83mg,产率为12%;1H NMR (400 MHz,CDCl3): δ 9.65-9.47(m,8H; Pc-1,4-Har),8.35-8.32(m,8H; Pc-2,3-Har),7.80-7.74(m,2 H,Ar-H),7.54(s,2H,Ar-H),7.19(s,2H,Ar-H),7.07(t,J=16.0 Hz,2H,Ar-H),6.95 (s,2H,Ar-H),6.35(s,2H,Ar-H),4.24-4.21(m,4H,CH2),3.74-3.72(m,12H,CH2),3.53-3.49(m,2H,CH2),3.38-3.32(m,4H,CH2),3,24(s,3H,CH3),3,12(s,3H,CH3),2.97-2.86(m,4H,CH2),2.55(t,J=16.0 Hz,4H,CH2),2.48-2.43(m,8H,CH2),2.11-2.06(m,4H,CH2),1.70-1.63(m,10H,CH2),1.28(s,6H,CH2),0.41-0.37(m,4H,CH2),−1.88- −1.97ppm (m, 4H; Si-OCH2CH2O);HRMS (ESI):C86H80N14O14Si 理论计算值(m/z [M]2+)为1783.6281,实际测得值为1783.6284。
应用实例1
对(化合物5a,其中n=4)和(化合物5b,其中n=5)两种酞菁硅配合物的离体光动力抗癌活性进行了初步探索,为今后在体(小鼠)实验能够提供一定的参考价值,主要内容包括酞菁硅配合物作为光敏剂进行细胞毒性和靶向性的研究。
光敏剂的细胞毒性实验通常包括光毒性和暗毒性实验两部分,采用MTT法 (四氮唑盐还原法)测定。MTT( 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)检测原理是活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞中并无琥珀酸脱氢酶,因此不会产生甲瓒。用DMSO(二甲基亚砜)溶解活细胞产生的甲瓒,用酶标仪在570nm波长处测定其吸收值,可间接反映活细胞数量。在一定细胞数范围内,MTT甲瓒形成的量与活细胞数成正比。
细胞处理过程:用0.25%胰酶将生长状态良好的贴壁细胞消化后,再用RPMI 1640培养基(含10%小牛血清)配制成2×104cells/ mL细胞悬液,将每孔100μL(约含4000个肿瘤细胞)接种于96孔培养板内,置于37℃,5% CO2培养箱内培养过夜,贴壁后加药;
受试样品组:酞菁预先配制为DMSO(含5%蓖麻油)储备液,所有药液配制后均经有机膜过滤(0.22µm),使用时酞菁用DMSO稀释为不同浓度,最终浓度中 DMSO的含量为1%;每浓度设定6个平行孔,每孔加入20µL不同浓度的药后置于培养箱内孵育。
溶剂对照是指对照组不加细胞,其他条件与受试样品组一致。
空白对照是指除了不加酞菁外,其他条件与受试样品组一致。
暗毒实验:24小时后,去除含药液的培养基,在换上新鲜培养基后直接放入培养箱中继续培养,操作过程尽量避免光照,24h后,每孔加入10μL,4 mg·ml-1MTT的PBS溶液,37℃下孵育4h,然后小心弃去上清,每孔加入100μLDMSO溶解甲瓒颗粒,轻度震荡使甲瓒完全溶解后,用酶标仪测定570nm波长下OD值。
光毒实验:24小时后,去除含药液的培养基,换上100μL新鲜培养基,然后用激光器对细胞进行照射,670nm波长激光,照射能量密度为 1.5 J·cm-2;光照完毕,将96孔板重置于37℃,5% CO2的培养箱内,继续培养。
采用MTT法测定了两种酞菁对HepG2人体肝癌细胞的杀伤曲线;即在光照和无光照条件下对HepG2细胞的剂量依赖曲线,如图1和图2。光照波长为670 nm,光照能量密度为1.5 J·cm-2,数据由三次独立的平行实验得到,以Mean±SEM方式处理。
由实验数据可知,两种酞菁在无光照条件下对HepG2人体肝癌细胞没有任何杀伤作用(这说明没有光的时候,没有效果),而在一定的光照条件下,杀伤HepG2细胞的IC50值(半数抑制率)分别为0.071 μM、0.035 μM。而且只需要0.1 μM的酞菁就几乎可以杀死全部癌细胞,因此它们都表现出非常高的光动力抗癌活性。极低的暗毒性和较高的光毒性说明这两种酞菁都达到了理想光敏剂的要求,有望开发为高效的光敏药物。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!