环状RNAcirc‑NFATC3及其用途的制作方法
本发明属于分子生物学和肿瘤学领域,具体涉及一种环状RNAcirc-NFATC3及其用途。
背景技术:
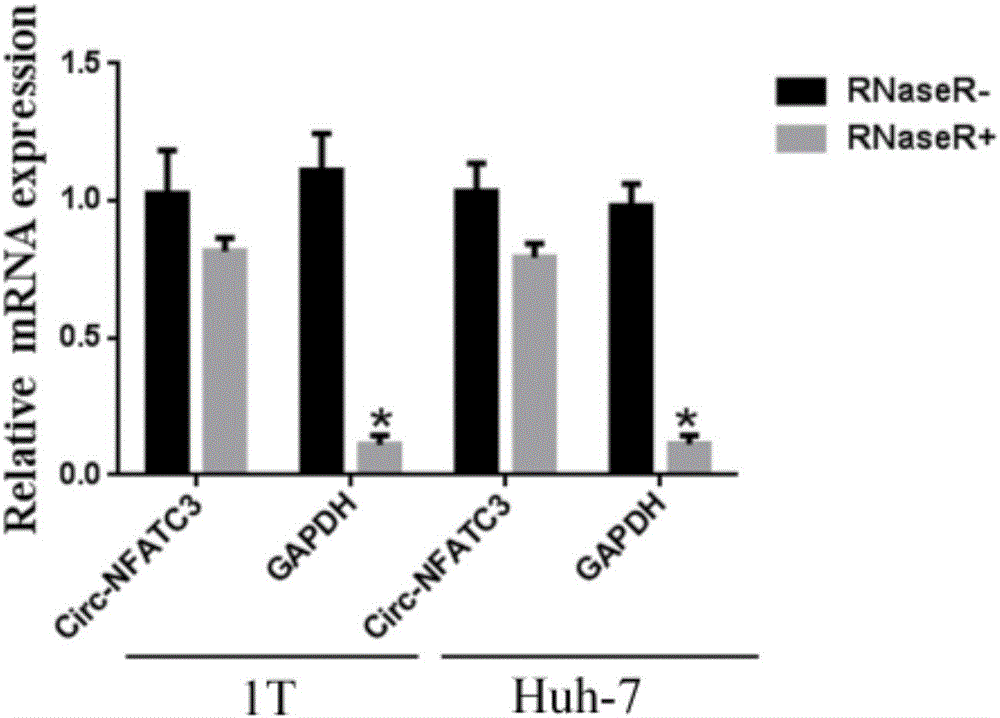
:原发性肝细胞癌(Hepatocellularcarcinoma,HCC,以下简称肝癌)是全球范围内最常见的恶性肿瘤之一。全球每年约有74万患者被新诊断为肝细胞癌,同时约有69万患者死于肝癌。其中我国占到了全球每年新发病例的55%,成为全世界肝癌最高发的地区之一。迄今,以手术治疗为核心的综合治疗仍然是原发性肝癌患者获得长期生存的唯一希望,但是目前肝癌治疗状况存在早期诊断困难,手术根治率低、复发率高、预后差的困扰。主要原因之一是早期诊断困难,AFP作为唯一被广泛接受用于肝癌诊断或检测的血清学标记物,其诊断肝癌的敏感度只能达到约50%,众多因素最终导致超过70%的患者在首次就诊时便已进入肝癌晚期,从而丧失了包括手术切除或肝移植的外科根治性治疗的机会。故深入研究肝癌发生和发展中的分子机制、开发新的诊断标志物和治疗靶点成为当前肿瘤研究的热点和重点领域。环状RNA(ciucularRNA,circRNA)是区别于传统线性RNA的RNA家族新成员,不具有5'末端帽子和3'末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子。最新研究表明circRNA具有闭合环状结构,主要通过非典型可变剪切加工产生,广泛存在于各种生物细胞中,具有结构稳定,难以被RNA酶降解、表达丰度高、物种间保守性好,表达具有组织及时空特异性等特征,这些特点使得circRNA在新型疾病诊断与治疗方法的开发应用上具有广阔的前景。Circ-NFATC3(CircBaseID:hsa_Circ_0000711),其在基因组上的定位为:chr16:68155889-68160513,相应的线性基因为NFATC3(NM_173165),环化序列有1298个碱基,包含NFATC3基因的第二和第三个外显子。申请人研究发现肝组织中NFATC3基因的RNA存在环化现象,且环状RNAcirc-NFATC3在肝癌组织中表达量显著下调,过表达circ-NFATC3抑制肝癌细胞的增殖、迁移、侵袭,提示circ-NFATC3可能成为肝癌诊断和治疗的新途径。技术实现要素:本发明的目的在于根据发明人对环状RNAcirc-NFATC3在人肝癌中的表达及其对肝癌细胞生物学功能的调节作用的研究,提供基于circ-NFATC3基因及其表达产物在肝癌的诊断和治疗方面的用途。为实现上述目的,本发明所采取的技术方案为:一种环状RNAcirc-NFATC3,所述环状RNAcirc-NFATC3的基因的核苷酸序列如SEQIDNO:1所示。所述环状RNAcirc-NFATC3的结构是由如SEQIDNO:1所示的核苷酸序列转录后经剪接形成的首尾相连的环状RNA结构。本发明还提供了一种药物组合物,所述药物组合物包含上述环状RNAcirc-NFATC3。本发明还提供了一种肝癌诊断试剂盒,所述试剂盒包含能够扩增如上所述的环状RNAcirc-NFATC3的引物。优选地,所述扩增引物为由如SEQIDNO:2和SEQIDNO:3所示的DNA序列组成的引物对或由如SEQIDNO:4和SEQIDNO:5所示的DNA序列组成的引物对。本发明还提供了上述所述的环状RNAcirc-NFATC3在制备治疗肝癌的药物中的用途。本发明还提供了circ-NFATC3基因作为靶基因在制备治疗肝癌的药物中的用途,所述circ-NFATC3基因的核苷酸序列如SEQIDNO:1所示。与现有技术相比,本发明的有益效果在于:(1)本发明首先通过设计特异的环状RNA引物进行RT-PCR、一代测序、RNA酶降解实验证实circ-NFATC3基因的客观存在;(2)本发明通过检测肝癌病人中circ-NFATC3基因表达情况,发现其表达水平明显降低,因此,可作为肝癌的诊断标志;(3)本发明对circ-NFATC3基因进行了体外细胞功能学的研究,通过将circ-NFATC3基因序列构建到LVminiCirc慢病毒载体上,以构建过表达circ-NFATC3基因的Huh7稳定肝癌细胞系。过表达circ-NFATC3基因的肝癌细胞与转染空载体的对照肝癌细胞相比,其增殖速度、细胞迁移率及细胞侵袭能力等均显著降低。circ-NFATC3基因及其表达产物可以应用在制备治疗肝癌的药物中。circ-NFATC3基因及其表达产物作为诊断肝癌的标志物,使肝癌诊断更加准确、快速,作为制备治疗肝癌药物的靶基因为治疗肝癌提供了新的治疗靶点和治疗途径。附图说明图1为本发明实施例1中circ-NFATC3基因表达产物的琼脂糖凝胶电泳图;图2为反映本发明实施例2中RNaseR对circ-NFATC3和GAPDH影响情况的柱状图。图3为本发明实施例2中QPCR检测肝癌组织中circ-NFATC3表达结果对比图;图4为本发明实施例3中构建好的稳定细胞株荧光显微镜图和表达结果图;图5为本发明实施例4中在肝癌细胞Huh7中特异性过表达circ-NFATC3基因后的细胞增殖曲线示意图,其中横坐标为天数,纵坐标为酶标仪检测的490nm吸光值;图6为本发明实施例5中在肝癌细胞Huh7中特异过表达circ-NFATC3基因后的细胞迁移实验结果示意图,其中横坐标为处理组名称,纵坐标为发生迁移的细胞数目。图7为本发明实施例6中在肝癌细胞Huh7中特异过表达circ-NFATC3基因后的细胞侵袭实验结果示意图,其中横坐标为处理组名称,纵坐标为发生侵袭的细胞数目。具体实施方式本发明首先通过设计能扩增环状RNA的特异性引物,PCR扩增出来NFATC3基因的环状RNA,接着进行RNaseR降解实验,确定了NFATC3基因表达一种由1298个核苷酸组成的,具有闭合环状结构的环状RNA分子。进一步,本发明通过采用荧光定量PCR的方法检测circ-NFATC3基因在肝癌样本中的表达差异,结果显示circ-NFATC3基因在肝癌组织中的表达水平明显低于癌旁组织中的表达水平。故可制作检测该基因表达变化的试剂盒以用于诊断肝癌。接着,我们对circ-NFATC3基因进行了体外细胞功能学的研究,通过将可以过表达circ-NFATC3基因序列的特异载体转染到Huh7肝癌细胞系,以建立该基因表达上调的细胞株。过表达circ-NFATC3基因的肝癌细胞与转染空载体的对照肝癌细胞相比,其增殖速度、细胞迁移率及细胞侵袭能力等均显著降低。因此,circ-NFATC3基因及其表达产物可以应用在制备治疗肝癌的药物中。本发明所涉及的技术均为分子克隆常规技术手段,其中涉及的酶、引物、试剂以及反应条件在未作说明的情况下均可根据本领域技术人员的经验进行合理选择,其中涉及试剂耗材属于市售的普通产品,其中涉及的检测手段以及仪器也均为本领域技术人员所熟知并熟练掌握。下面通过实施例和试验例对本发明的技术方案做进一步的说明,但不应理解为对本发明的限制。实施例1:RT-PCR反应检测circ-NFATC3基因在肝癌组织中的表达。具体实验方案如下:1.RNA提取1)组织处理:取10mg左右组织加入1mlTrizol,用匀浆机匀浆;离心15分钟,12000g,取上清。2)向上清中加入200ul氯仿,上下用力颠倒混匀半分钟,静置3分钟。3)4℃,12000g离心15分钟,此时可见裂解液分三层:上层为水相的RNA;中层为DNA,脂类等;下层为细胞残渣,蛋白,多糖等。4)取上清到新的EP管内;加入等体积的异丙醇,混匀,静置10分钟后,4℃,12000g离心10分钟。5)小心去掉上清,注意不要丢失RNA沉淀,加入1ml75%乙醇,上下颠倒,使沉淀块重悬起。6)4℃,12000g离心10分钟,小心去掉上清,尽量吸干管壁的液体,注意不要丢失RNA沉淀,若沉淀松动可再次离心。晾干约15分钟,至管壁无液体。7)加入适量体积(20-30ul)的DEPC水溶解RNA,58℃水浴10分钟。8)取出2ul定量,测量buffer:10mMTrisCl(pH7.8),根据定量结果进行逆转录。(1A260=40μg/ml,A260/A280=1.8~2.1)。2.cDNA逆转录1)实验体系M-MLVReverseTranscriptase:3.引物:环状RNA引物为反向引物,同时设计一对正向引物做对照,RT-PCR时设立一组gDNA模板对照,证实circRNA来自转录后剪切,而不是基因融合等突变。同时检测线性基因GAPDH作为阴性对照。使用的引物如下所列:SEQIDNO:2Circ-NFATC3_FdivergentGTGACTTTGGAGCTGAAACGATGGSEQIDNO:3Circ-NFATC3_RdivergentAAGGTAGCCGAGGGGCAGTAASEQIDNO:4Circ-NFATC3_FconvergentCCATCGTTTCAGCTCCAAAGTCACSEQIDNO:5Circ-NFATC3_RconvergentTTACTGCCCCTCGGCTACCTTSEQIDNO:6hsaGAPDHconvergent_FGAGTCAACGGATTTGGTCGTSEQIDNO:7hsaGAPDHconvergent_RGACAAGCTTCCCGTTCTCAGSEQIDNO:8hsaGAPDHdivergent_FTCCTCACAGTTGCCATGTAGACCCSEQIDNO:9hsaGAPDHdivergent_RTGCGGGCTCAATTTATAGAAACCGGG4.PCR:以GAPDH作为内对照。PCR的反应体系:每个反应管中分别加入2μl10×Buffer,分别加入2μldNTP,1μl正向引物,1μl反向引物,1μlcDNA模板,0.2μlTaq酶,加水至20μl。PCR反应条件如下:94℃,5分钟预变性;94℃,30秒变性;55℃,30秒退火;72℃,30秒延伸;35个循环,琼脂糖凝胶电泳检测PCR扩增产物,结果见图1,图1中环状RNA引物为反向引物(黑色三角形符号),同时设计一对正向引物做对照(白色三角形符号),RT-PCR时设立一组gDNA模板对照,证实circRNA来自转录后剪切,而不是基因融合等突变,同时检测线性基因GAPDH作为阴性对照。实施例2:QPCR检测肝癌中circ-NFATC3的表达情况1.RNA提取:同实施例1;2.cDNA逆转录:同实施例1;3.QPCR扩增实验1)实验体系:选用实施例1的circ-NFATC3divergent引物用于扩增环状RNAcirc-NFATC3,实施例1的hsaGAPDHconvergent引物用于扩增内参基因。2)反应条件:第一步:95℃2min第二步(40个循环):95℃3秒,60℃30秒第三步60–95℃溶解曲线3)上机进行目标基因扩增4)qPCR相对定量结果目标基因的相对表达量计算公式为:2-△△Ct=2-【(△Ct)Test-(△Ct)Control】。Ct目的为目标基因Ct值,Ct管家为管家基因Ct值。△Ct=Ct目的-Ct管家,表示各样本目的基因相对管家基因的相对Ct值,△△Ct=(△Ct)Test-(△Ct)Control,表示处理组相对对照组进行归一化,2-△△Ct表示处理组相对对照组的相对表达量,表示目标基因相对表达倍数。TotalRNA按3U/ug的比例加入RNaseR进行消化,QPCR检测加与不加RNaseR对circ-NFATC3和GAPDH的影响,结果见图2,RNaseR消化证实circ-NFATC3对RNA酶不敏感。RNaseR是一个能消化线性RNA,但对环状RNA没有影响的RNA酶,将totalRNA用RNaseR消化后再进行QPCR检测,结果显示加与不加RNaseR对circ-NFATC3表达没有明显影响,但是线性基因GAPDH经RNaseR消化后表达显著降低。QPCR检测肝癌和相应癌旁组织中circ-NFATC3和GAPDH的表达水平,结果见图3,在24对肝癌临床组织样本中检测circ-NFATC3的表达,结果显示circ-NFATC3在癌组织中显著下调。Control:癌旁组织,Tumor:肝癌组织。实施例3:过表达circ-NFATC3慢病毒及其稳定细胞系构建1.过表达circ-NFATC3慢病毒载体构建:在上海捷瑞公司合成circ-NFATC3线性全序列,序列经过退火成双链DNA片段,通过多克隆位点插入到LVminiCirc载体,重组质粒通过测序进行鉴定,Control阴性对照为未插入序列的LVminiCirc空载体。2.慢病毒包装(1)转染前24h,用胰酶消化对数生长期的293T细胞,传代到10cm细胞培养皿,37℃、5%CO2培养箱内培养。24h待细胞密度达70%~80%时即可用于转染。细胞状态对于病毒包装至关重要,因此需要保证良好的细胞状态和较少的传代次数。(2)转染前将细胞培养基更换为无血清培养基。(3)向一灭菌离心管中加入所制备的各DNA溶液(LVminiCirc-Circ-NFATC3/LVminiCirc载体10μg,pGag/Pol载体5μg、pRev载体5μg、pVSV-G载体5μg),与相应体积的Opti-MEM混合均匀,调整总体积为1.5ml。(4)将Lipofectamine2000试剂轻柔摇匀,取60μlLipofectamine2000试剂在另一管中与1.5mlOpti-MEM混合,在室温下温育5分钟。(5)把稀释后的DNA与稀释后的Lipofectamine2000进行混合,轻轻地颠倒混匀,不要振荡。(6)混合后,在室温下温育20分钟,以便形成DNA与Lipofectamine2000稀释液的转染复合物。(7)将DNA与Lipofectamine2000混合液转移至293T细胞的培养液中,混匀,于37℃,5%CO2细胞培养箱中培养。(8)培养6小时后吸去含有转染混和物的培养基,每瓶细胞中加入含10%血清的细胞培养基10ml,于37℃、5%CO2培养箱内继续培养48小时。3.病毒的收获及浓缩(1)收集转染后48小时和72小时(转染即可为0小时计起)的293T细胞上清液。(2)于4℃,4000g离心10min,除去细胞碎片。(3)以0.45μm滤器过滤上清液于50ml离心管中。(4)把病毒粗提液样品加入到过滤杯中(最多19ml),盖上盖子。将过滤杯插到滤过液收集管中。(5)组合好后,做好平衡,放在转头上。(6)在5000×g离心,至需要的病毒浓缩体积。通常需要的时间为10-15分钟。(7)离心结束后,过滤杯中的即为病毒浓缩液。(8)将病毒浓缩液移出,分装后保存在病毒管中,可在4℃保存一周,或-80℃长期保存。取其中一支进行病毒生物学滴度测定。4.慢病毒感染细胞:(1)根据细胞的量将细胞在1.5ml管中离心收集然后用100-200ul的无血清培养液稀释细胞沉淀,以细胞完全浸没在培养基中为准。(2)吸取过表达的circ-NFATC3病毒液加入细胞中,将1.5ml管放在37℃度培养箱中孵育30分钟。另取LVminiCirc空载体对照病毒感染做对照细胞系。(3)将管中混合溶液吸出加到培养皿中或孔里。(4)加入足够量的新鲜培养液。(5)12小时后换液。(6)48小时后加入2ug/mlpuromycin进行稳定细胞株筛选。5.稳定细胞株鉴定:构建好的稳定细胞株荧光显微镜下拍照观察,GFP阳性率>95%,同时收取部分细胞QPCR检测,证实circ-NFATC3的过表达效率>2倍。结果见图4,将circ-NFATC3基因特异的序列构建到LVminiCirc慢病毒载体上,通过慢病毒构建过表达circ-NFATC3的Huh7-circ-NFATC3稳定细胞株,结果显示GFP阳性率>95%,QPCR检测证实circ-NFATC3成功过表达,过表达效果达到2倍。实施例4:过表达circ-NFATC3基因的肝癌细胞增殖能力测定(1)将Huh7-circ-NFATC3细胞株及对照细胞消化成单细胞悬液,计数,调整细胞浓度为1×105个/ml,分到96孔板,每孔100ul,即每孔细胞为1×104个,各9孔。(2)分别在不同的时间点(24h、48h、72h)加入MTS试剂,比例为1:10,即100μl培养液加入10μl检测液。(3)37℃孵育4h后,酶标仪检测490nm吸光值。结果见图5,过表达circ-NFATC3的肝癌细胞株生长速度减慢,在肝癌细胞Huh7中特异性过表达circ-NFATC3基因后的细胞增殖曲线示意图,其中横坐标为天数,纵坐标为酶标仪检测的490nm吸光值。实施例5过表达circ-NFATC3基因的肝癌细胞迁移能力检测(1)胰酶消化成单细胞悬液,计数,用无血清培养基调整细胞浓度至1×106/ml。(2)加入100μl细胞悬液至小室上室,在下室中加入600μl含不同浓度胎牛血清的完全培养基。37℃、5%CO2培养箱中孵育24h。(3)取出小室,用棉签擦去上室的细胞,4%多聚甲醛固定10min,PBS洗涤一次,结晶紫染色10min,PBS洗涤一次,显微镜观测并拍照。结果见图6,过表达Circ-NFATC3的肝癌细胞株迁移率增加,在肝癌细胞Huh7中特异过表达circ-NFATC3基因后的细胞迁移实验结果示意图,其中横坐标为处理组名称,纵坐标为发生迁移的细胞数目。实施例6:过表达circ-NFATC3基因的肝癌细胞细胞侵袭实验(1)将Matrigel置于4℃中过夜溶解,用预冷的基础培养基按Matrigel:培养基=1:3的比例稀释,取40μl加入预冷的Transwell小室中,动作要慢,避免产生气泡。(2)37℃孵育2小时使Matrigel凝固。(3)分别在上下室加入100μl和600μl基础培养基,37℃水合过夜。次日吸去培养基。(4)实验细胞胰酶消化后,取适量细胞悬液,800rpm离心5分钟。(5)吸去上清,用基础培养基重悬细胞后,细胞计数并用基础培养基调整细胞浓度至1×106/ml,取100μl加入至Transwell小室上室,在下室加入600μl完全培养基。(6)放入培养箱中培养24、48小时后,取出小室,用棉签擦去上室的细胞,4%多聚甲醛固定15分钟,PBS洗涤一次,1%结晶紫染色10分钟,PBS洗涤一次,显微镜下观察细胞是否穿过小孔。如有穿过,终止其他实验组,拍照并统计穿过的细胞数。结果见图7,过表达Circ-NFATC3的肝癌细胞株侵袭率增加,在肝癌细胞Huh7中特异过表达circ-NFATC3基因后的细胞侵袭实验结果示意图,其中横坐标为处理组名称,纵坐标为发生侵袭的细胞数目。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1