一种基于双芘的pH响应自组装的多肽纳米材料及其制备方法和应用与流程
本发明属于纳米材料技术领域,涉及一种多肽纳米材料及其制备方法和应用,尤其涉及一种基于双芘的pH响应自组装的多肽纳米材料及其制备方法和应用。
背景技术:
近年来,纳米材料在临床疾病的诊断和治疗的应用受到了极大的重视。多肽自组装纳米材料由于其良好的生物兼容性和化学多样性,被广泛用于生物成像和治疗。而不同尺寸和形貌的纳米材料对于生物成像和治疗具有极大的影响。如纳米颗粒,相关研究表明,当纳米颗粒尺寸在10-100nm时,会增加纳米颗粒在体内的循环时间;而当纳米尺寸在15-350nm时,纳米颗粒会靶向聚集到心肌梗塞、肿瘤及其它炎症部位;但是这样的纳米颗粒会被靶向组织快速清除。而且纳米颗粒的结构本身就是一个亚稳态,会随着时间及其它因素(酶、温度、pH等)的改变而发生形貌转变。其次,相比于纳米颗粒,纳米纤维具有更好的稳定性而且在生物体内不容易被清除,能延长材料的滞留时间。利用纳米纤维的这个性质,可以用于生物长效成像和治疗。另一方面,小分子成像剂和治疗药物具有一定的疏水性,限制了其生物应用。目前对于小分子成像剂和治疗药物的使用方法是用聚合物纳米材料对其进行密封,这种方法对于小分子成像剂和药物的可控释放还具有一定挑战性。因此开辟一种新的策略用于肿瘤的检测和治疗十分必要。
因此,在本领域中,期望能够结合纳米纤维的稳定性和小分子药物的疏水性,设计一种可以原位转化形成纤维的多肽纳米材料,用于招募疏水性的小分子材料并用于生物成像和治疗,这种具有潜力的新型诊疗策略,具有广泛研究意义。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种基于双芘的多肽纳米材料及其制备方法和应用,特别是提供一种基于双芘的pH响应自组装的多肽纳米材料及其制备方法和应用。
为达到此发明目的,本发明采用以下技术方案:
一方面,本发明提供一种基于双芘的多肽纳米材料,所述纳米材料具有如下式I-IV所示结构:
其中R1为具有分子内多重氢键的多肽序列,R2为组氨酸组成的多肽序列,R3为亲水性的聚乙二醇链,R1、R2和R3之间由酰胺键相连。
本发明所述结构的多肽纳米材料具有pH响应性,可以原位转化形成纤维,用于招募疏水的小分子成像剂和药物,大大提高小分子成像剂和治疗药物的利用率。
优选地,所述基于双芘的多肽纳米材料中双芘化合物基团的供体为具有式V所示结构的双芘化合物:
在基于双芘的多肽纳米材料中双芘化合物基团与R1或R2形成酰胺键而连接在一起。
优选地,R1为:
其中表示基团连接位点。即在本发明中,R1的供体结构为:
(可以KLVFF表示)或(可以LPFFD表示)。
优选地,R2的供体为由4-10个组氨酸构成的多肽,例如R2的供体为由4、5、6、7、8、9或10个组氨酸构成的多肽,优选由6个组氨酸构成的六肽。
优选地,R3的供体为羧基封端的聚乙二醇,其重均分子量为300-2000,例如300、400、500、600、700、800、900、1000、1200、1400、1600、1800或2000。
另一方面,本发明提供了所述基于双芘的多肽纳米材料的制备方法,所述方法以树脂为载体,以式V所示双芘化合物和氨基酸作为原料,利用固相合成方法制备得到所述基于双芘的多肽纳米材料。
另一方面,本发明提供了所述基于双芘的多肽纳米材料的pH响应性自组装方法,所述方法包括以下步骤:
(1)将基于双芘的多肽纳米材料溶于有机溶剂中,得到多肽纳米材料溶液;
(2)将步骤(1)得到的多肽纳米材料溶液加入缓冲溶液中,在1.0≤pH<8.0的缓冲液中,所述多肽纳米材料自组装为纳米纤维;在pH≥8.0的缓冲液中,所述多肽纳米材料自组装为纳米球。
优选地,步骤(1)所述有机溶剂为DMSO、DMF或1,4-二氧六环中的任意一种或至少两种的组合,优选DMSO。
优选地,步骤(1)所述多肽纳米材料溶液的浓度为10-4-10-2M,例如1×10-4M、3×10-4M、5×10-4M、8×10-4M、1×10-3M、3×10-3M、5×10-3M、8×10-3M或1×10-2M。
优选地,步骤(2)所述自组装在超声下进行,所述超声的时间为1-10min,例如1min、2min、3min、4min、5min、6min、7min、8min、9min或10min。
优选地,步骤(2)所述超声后在20-40℃(例如22℃、25℃、28℃、30℃、32℃、35℃或38℃)保持0.5-12h(例如0.8h、1h、3h、5h、8h、10h、11h或12h)。
本发明的基于双芘的多肽纳米材料具有pH响应性,在不同pH值下可以自组装成不同的形态,本发明制备得到的纳米纤维或纳米球,相对于纳米颗粒,具有更好的稳定性,在生物体内不容易被清除,在生物体内具有较长的滞留时间,并且具有良好的生物兼容性、EPR效应、良好的pH敏感性以及对疏水的小分子药物招募的能力。
另一方面,本发明提供了所述基于双芘的多肽纳米材料在制备癌症治疗药物以及生物成像剂中的应用。
本发明所提供的pH响应性多肽纳米材料,基于其对pH的良好敏感性,可以原位转化形成纤维,用于招募疏水的小分子成像剂和药物,大大提高小分子成像剂和治疗药物的利用率,具有广泛的应用前景。
相对于现有技术,本发明具有以下有益效果:
本发明的基于双芘的多肽纳米材料具有pH响应性,在1.0≤pH<8.0的环境下自组装形成纳米纤维,在pH≥8.0的环境下组装成纳米球,可以招募疏水的小分子成像剂和药物,大大提高小分子成像剂和治疗药物的利用率,该纳米材料可在疾病组织或细胞部位原位转化为纤维,可以大大延长滞留时间,可用于生物成像和治疗,为疾病(尤其是癌症)治疗提供可靠诊断以及靶向治疗方法,具有广泛的应用前景。
附图说明
图1是实施例1制备的基于双芘的多肽纳米材料的质谱图;
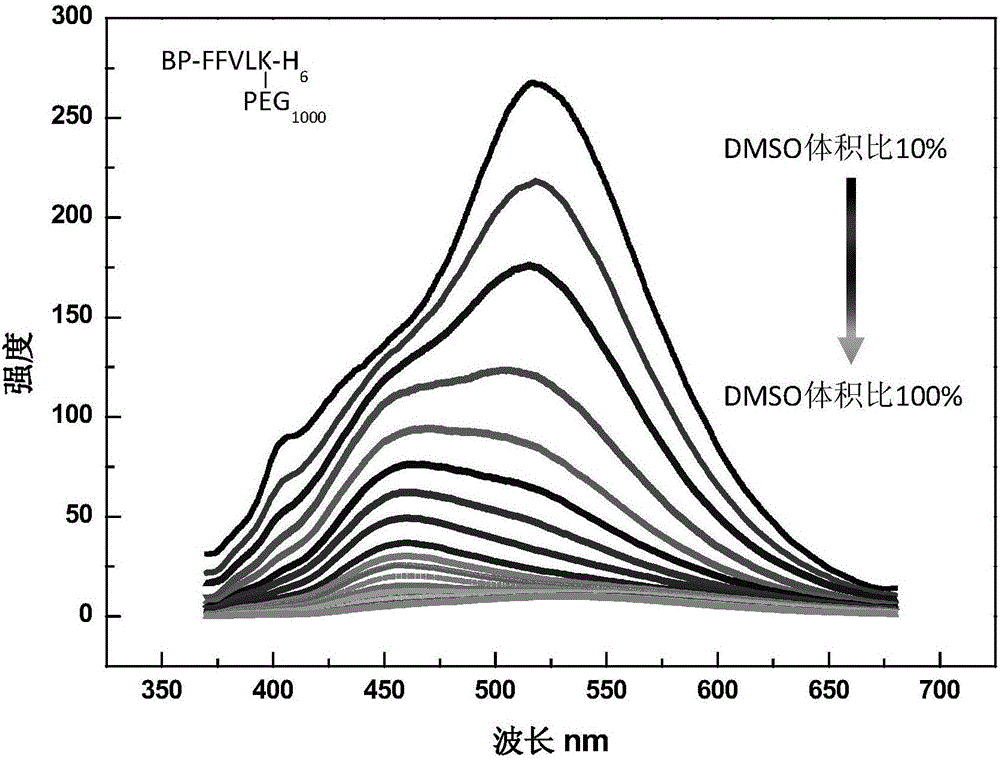
图2是实施例1制备的基于双芘的多肽纳米材料自组装能力测试得到的荧光强度曲线图;
图3是实施例1制备的基于双芘的多肽纳米材料在超纯水(A图)和pH=6.0的缓冲液(B图)中自组装后的透射电镜图,A图和B图中的标尺均为100nm;
图4是利用实施例1制备的基于双芘的多肽纳米材料与尼罗红对细胞进行共孵育后的单光子激光共聚焦照片,其中A图为细胞球在405nm激光激发条件下的明场共聚焦结果图,B图为细胞球405nm激光激发条件下收集450-550nm时呈双芘绿光的结果图,C图为细胞球405nm激光激发条件下收集550-700nm时呈尼罗红红光的结果图;
图5是实施例1制备的基于双芘的多肽纳米材料在癌症细胞表面发生原位形貌转化的扫描电镜照片,其中B图为A图中所选位置的放大图,A图标尺为50μm,B图标尺为5μm;
图6是实施例1制备的基于双芘的多肽纳米材料用于招募荧光染料尼罗红的小动物成像实验结果图;其中A图为静脉注射基于双芘的多肽纳米材料与尼罗红4h后的成像结果图,B图为静脉注射基于双芘的多肽纳米材料与尼罗红96h后的成像结果图;
图7是实施例6制备的基于双芘的多肽纳米材料的质谱图;
图8是实施例6制备的基于双芘的多肽纳米材料自组装能力测试得到的荧光强度曲线图;
图9是实施例6制备的基于双芘的多肽纳米材料在(A图)和pH=6.0的缓冲液(B图)中自组装后的透射电镜图,A图和B图中的标尺均为100nm;
图10是实施例6制备的基于双芘的多肽纳米材料与尼罗红对细胞进行共孵育后的单光子激光共聚焦照片,A图为细胞球在405nm激光激发条件下的明场共聚焦结果图,B图为细胞球405nm激光激发条件下收集450-550nm时呈双芘绿光的结果图,C图为细胞球405nm激光激发条件下收集550-700nm时呈尼罗红红光的结果图;
图11是实施例6中的基于双芘的多肽纳米材料在癌症细胞表面发生原位形貌转化的扫描电镜照片,其中B图为A图中所选位置的放大图,A图标尺为50μm,B图标尺为5μm;
图12是实施例6制备的基于双芘的多肽纳米材料用于招募荧光染料尼罗红的小动物成像实验结果图,其中A图为静脉注射基于双芘的多肽纳米材料与尼罗红4h后的成像结果图,B图为静脉注射基于双芘的多肽纳米材料与尼罗红96h后的成像结果图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
在本实施例中,基于双芘的多肽纳米材料的结构如下所示:
即在本发明所提供的式II中,R1的供体为KLVFF,R2的供体为由6个组氨酸构成的六肽,R3的供体为羧基封端的聚乙二醇,其分子量为1000g mol-1。
所述基于双芘的多肽纳米材料以多肽的固相合成方法来合成,采用王氏树脂,按照多肽顺序,通过偶联剂(氮甲基吗啉:DMF=5:95,体积比)进行偶联,其中带有羧基的PEG及双芘化合物也同样按照氨基酸的偶联方法进行反应,最后经三氟乙酸裂解、旋蒸、乙醚纯化而得。
对本实施例合成的基于双芘的多肽纳米材料进行质谱表征,结果如图1所示,由该图可知,图中所出现的离子峰满足材料分子的分子量的特征峰,而且峰形完全符合PEG聚合链的特征峰。
实施例2
在本实施例中对实施例1制备得到的基于双芘的多肽纳米材料进行自组装,考察该材料的pH响应性。
首先,测试基于双芘的多肽纳米材料的自组装能力,将实施例1制备得到的基于双芘的多肽纳米材料溶于DMSO中,测试其荧光强度,而后加水进行组组装,每加一定量的水后使水与有机相充分混合,之后静置一分钟测试其荧光强度,测试结果如图2所示。
从图2中可以看出,在向基于双芘的多肽纳米材料的DMSO溶液中加入H2O时荧光增强,表明材料从单分散变为聚集态。
所述基于双芘的多肽纳米材料的pH响应性自组装方法如下:
称取基于双芘的多肽纳米材料5mg溶于10mL DMSO溶剂中,将此溶液用注射器分别快速注射到90mL的超纯水中和pH=6.0的缓冲液中,超声30分钟,静置两小时,分别得到荧光纳米颗粒和纳米纤维分散液。
图3是实施例1制备得到的基于双芘的多肽纳米材料在超纯水和pH=6.0的缓冲液中自组装后的透射电镜图,由图3可知,基于双芘的多肽纳米材料具有pH响应性,在pH逐渐变为酸性条件下,形貌会由纳米颗粒变为纤维状。
实施例3
对实施例1制备得到的基于双芘的多肽纳米材料进行细胞共聚焦测试,考察其对药物或成像剂的招募情况,方法如下:
准备细胞悬浮液,每个共聚焦培养皿1mL,培养过夜。取出培养基,加入基于双芘的多肽纳米材料浓度20μM的培养基1mL,过夜;用20μM的Nile Red(尼罗红)替换药品,培养2小时,用PBS清洗3遍,进行共聚焦成像实验,采用405nm激光通道,收集绿光波段450-550nm,红光波段550-700nm。
结果如图4所示,细胞球与材料、尼罗红共孵育,单光子共聚焦实验,在405nm激发时,当采集450-550nm范围时,呈双芘的绿光;当采集550-700nm范围时,呈尼罗红的红光,即发生FRET(荧光能量共振转移),证明材料能在细胞表面大量聚集,有效招募尼罗红荧光染料。
实施例4
在该实施例中考察实施例1制备得到的基于双芘的多肽纳米材料在癌症细胞表面的转化情况,方法如下:
配制1%的琼脂糖凝胶溶液(0.1g琼脂糖溶于10mL水),加热至沸腾,迅速转移至超净台,96孔板每孔加入100μL琼脂糖溶液。然后打开紫外灯照射30min。准备好MCF-7细胞悬浮液每孔加入2000个细胞,每孔200μL。培养7天,取出培养基,每个孔加入基于双芘的多肽纳米材料浓度为20μM培养基,体积为200μL,培养24h。取出细胞球,20%的戊二醛溶液(戊二醛:PBS缓冲液=1:4)固化2-3h,再依次用PBS稀释好的30%、50%、70%、90%、100%的乙醇溶液脱水处理,每个浓度脱水三次,每次10分钟。然后用叔丁醇溶液置换出水和乙醇,置换3次,每次10分钟。最后将处理好的细胞团实验滴加到硅片,干燥,扫描观察。
结果如图5所示,可见实施例1制备得到的基于双芘的多肽纳米材料在癌细胞表面发生原位转化,形成纤维。
实施例5
在本实施例中考察实施例1制备得到的基于双芘的多肽纳米材料在小动物体内的成像情况,方法如下:
小鼠皮下注射约106个MCF-7细胞,用于肿瘤生长建立老鼠模型。当小鼠肿瘤长至直径约5.0mm左右时,开始用于成像实验。首先,静脉注射200μL药物,浓度为200μM;8小时后,静脉注射20μM的Nile Red溶液200μL,立即进行小动物成像实验,收集波段550-600nm。
结果如图6所示,该图表明:静脉注射药品之后,再注射尼罗红,4h能检测到尼罗红信号,表明材料能具有招募荧光分子的能力;在96h后,在小鼠肿瘤部位还能检测到尼罗红的信号,表明材料在肿瘤部位能够超长时间滞留,且能招募荧光分子用于癌症的检测。
实施例6
在本实施例中,基于双芘的多肽纳米材料的结构如下所示:
即在本发明所提供的式IV中,R1的供体为KLVFF,R2的供体为由6个组氨酸构成的六肽,R3的供体为羧基封端的聚乙二醇,其分子量为1000g mol-1。
所述基于双芘的多肽纳米材料利用如实施例1中所述的多肽的固相合成方法来合成。
对本实施例合成的基于双芘的多肽纳米材料进行质谱表征,结果如图7所示,由该图可知,图中所出现的离子峰满足材料分子的分子量的特征峰,而且峰形完全符合PEG聚合链的特征峰。
实施例7
在本实施例中对实施例6制备得到的基于双芘的多肽纳米材料进行自组装,考察该材料的自组装能力和pH响应性。
首先,测试基于双芘的多肽纳米材料的自组装能力,将实施例6制备得到的基于双芘的多肽纳米材料溶于DMSO中,测试其荧光强度,而后加水进行组组装,每加一定量的水后使水与有机相充分混合,之后静置一分钟测试其荧光强度,测试结果如图8所示。
从图8中可以看出,在向基于双芘的多肽纳米材料的DMSO溶液中加入H2O时荧光增强,表明材料从单分散变为聚集态。
所述基于双芘的多肽纳米材料的pH响应性自组装方法如下:
称取化合物5mg溶于10mL DMSO溶剂,将此溶液用注射器分别快速注射到90mL到超纯水中和pH=6.0的缓冲液中,超声30分钟,静置两小时,分别得到荧光纳米颗粒和纳米纤维分散液。
图9是实施例6制备得到的基于双芘的多肽纳米材料在超纯水和pH=6.0的缓冲液中自组装后的透射电镜图,由图9可知,基于双芘的多肽纳米材料具有pH响应性,在pH逐渐变为酸性条件下,形貌会由纳米颗粒变为纤维状。
实施例8
对实施例6制备得到的基于双芘的多肽纳米材料进行细胞共聚焦测试,考察其对药物或成像剂的招募情况,方法如下:
准备细胞悬浮液,每个共聚焦培养皿1mL,培养过夜。取出培养基,加入基于双芘的多肽纳米材料浓度20μM的培养基1mL,过夜;用20μM的Nile Red(尼罗红)替换药品,培养2小时,用PBS清洗3遍,进行共聚焦成像实验,采用405nm激光通道,收集绿光波段450-550nm,红光波段550-700nm。
结果如图10所示,细胞球与材料、尼罗红共孵育,单光子共聚焦实验,在405nm激发时,当采集450-550nm范围时,呈双芘的绿光;当采集550-700nm范围时,呈尼罗红的红光,即发生FRET(荧光能量共振转移),证明材料能在细胞表面大量聚集,有效招募尼罗红荧光染料。
实施例9
在该实施例中考察实施例6制备得到的基于双芘的多肽纳米材料在癌症细胞表面的转化情况,方法如下:
配置1%的琼脂糖凝胶溶液(0.1g琼脂糖溶于10mL水),加热至沸腾,迅速转移至超净台,96孔板每孔加入100μL琼脂糖溶液。然后打开紫外灯照射30min。准备好MCF-7细胞悬浮液每孔加入2000个细胞,每孔200μL。培养7天,取出培养基,每个孔加入药品浓度为20μM培养基,体积为200μL,培养24h。取出细胞球,20%的戊二醛溶液(戊二醛:PBS缓冲液=1:4)固化2-3h,再依次用PBS稀释好的30%、50%、70%、90%、100%的乙醇溶液脱水处理,每个浓度脱水三次,每次10分钟。然后用叔丁醇溶液置换出水和乙醇,置换3次,每次10分钟。最后将处理好的细胞团实验滴加到硅片,干燥,扫描观察。
结果如图11所示,可见实施例6制备得到的基于双芘的多肽纳米材料在癌细胞表面发生原位转化,形成纤维。
实施例10
在本实施例中考察实施例6制备得到的基于双芘的多肽纳米材料在小动物体内的成像情况,方法如下:
小鼠皮下注射约106个MCF-7细胞,用于肿瘤生长建立老鼠模型。当小鼠肿瘤长至直径约5.0mm左右时,开始用于成像实验。首先,静脉注射200μL药物,浓度为200μM;8小时后,静脉注射20μM的Nile Red溶液200μL,立即进行小动物成像实验,收集波段550-600nm。
结果如图12所示,该图表明:静脉注射药品之后,再注射尼罗红,4h能检测到尼罗红信号,表明材料能具有招募荧光分子的能力;在96h后,在小鼠肿瘤部位还能检测到尼罗红的信号,表明材料在肿瘤部位能够超长时间滞留,且能招募荧光分子用于癌症的检测。
申请人声明,本发明通过上述实施例来说明本发明的基于双芘的pH响应自组装的多肽纳米材料及其制备方法和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!