一种新的内酯化合物及其制备方法和医药用途与流程
本发明属于药物领域,具体涉及从干燥的杜仲叶中分离得到的一种新的内酯化合物及其制备方法和医药用途。
背景技术:
杜仲Eucommia ulmoidesOliv.属被子植物门,杜仲科,杜仲属,落叶乔木,高达20m,树皮灰褐色,连同枝、叶、根均含胶,折断有银白色细丝。叶椭圆或椭圆伏卵型,长6~18cm,边缘有锯齿,下边脉上有毛,叶柄长1~2cm,果为翅果扁平而薄,内含一种子。杜仲作为中药在我国已有2000多年的药用历史,《神农本草经》和《本草纲目》均将其列为上品,其具有多种功效,主要用于治疗肾虚腰痛,筋骨无力,妊娠漏血,胎动不安,高血压症。
近年来,各国学者对杜仲化学成分进行了大量研究,目前分离得到并经鉴定的有机化合物有70种以上,无机矿物元素不少于15种。研究发现,杜仲皮、花、叶和枝条等各部分中含有相似的化学成分,主要包括木脂素类、环烯醚萜类、黄酮类和甾体类等有机化合物。现代药理学证明,杜仲具有多种功能活性,如降血压、抗衰老、抗癌、抗菌、镇痛、消炎,利尿、镇静、安神,抗病毒作用,增强机体非特异免疫力,并能对细胞免疫进行双相调节等功效,另外对神经中枢也有一定作用。杜仲也因其显著的生理活性得到了众多学者的关注。
现代研究表明,有些植物不但具有调节机体的免疫功能,还具有非特异性的抗病毒功能。S-腺苷-L-高半胱氨酸水解酶(S-Adenosyl-L-homocysteine hydrolase,SAH水解酶)是一类具有独特广谱抗病毒活性的腺苷衍生物的作用靶,尤其是抗出血热病毒抑制剂的目的靶,广泛存在于脊椎动物(如人、牛、狗、兔、大鼠、小鼠)、植物、真菌及其他微生物细胞内,具有重要的生理功能。SAH水解酶与转甲基作用密切相关,真核细胞及病毒mRNA 5’-末端必须具有甲基化的帽状结构,才能进行翻译。mRNA 5’-末端甲基化依赖于腺苷甲硫氨酸的多种甲基转移酶催化,SAH是酶反应产物,亦是该酶的竞争性反馈抑制剂。SAH水解酶可将SAH水解成腺苷及L-高半胱氨酸,该反应是可逆的,体外趋向合成,体内趋向水解。体内转甲基化产生的SAH被SAH水解酶不断水解,使转甲基反应继续进行,无SAH的累积。如SAH水解酶被抑制,细胞内SAH积累,抑制转甲基酶,进而影响mRNA功能,病毒蛋白不能合成,也就不能生成子代病毒,病毒复制受到抑制。大多数病毒mRNA需甲基化的帽状结构,且对转甲基酶的抑制比细胞mRNA敏感,细胞内SAH浓度稍有增加,便首先受到波及,此特点赋于SAH水解酶抑制剂有选择性。因此,SAH水解酶在国际上被用于作为筛选抗出血热病毒抑制剂的体外筛选模型。
技术实现要素:
本发明的目的在于提供一种从干燥的杜仲叶中分离得到的一种新的内酯化合物;
本发明的另一目的在于提供该新化合物的制备方法;
本发明的再一目的在于提供该化合物用于制备抗病毒药物的医药用途。
本发明的上述目的是通过下面的技术方案得以实现的:
具有下述结构式的化合物(Ⅰ),
所述的化合物(Ⅰ)的制备方法,包含以下操作步骤:(a)干燥的杜仲叶用75%乙醇热回流提取,合并提取液,浓缩至无醇味,依次用石油醚、乙酸乙酯和水饱和的正丁醇萃取,分别得到石油醚萃取物、乙酸乙酯萃取物和正丁醇萃取物;(b)步骤(a)中乙酸乙酯萃取物用大孔树脂除杂,依次用10%乙醇和75%乙醇洗脱,收集75%乙醇洗脱液,减压浓缩得75%乙醇洗脱物浸膏;(c)步骤(b)中75%乙醇洗脱浸膏用正相硅胶分离,依次用体积比为90:1、45:1、20:1、10:1和1:1的二氯甲烷-甲醇梯度洗脱得到5个组分;(d)步骤(c)中组分3用正相硅胶进一步分离,依次用体积比为25:1、20:1和10:1的二氯甲烷-甲醇梯度洗脱得到3个组分;(e)步骤(d)中组分2用十八烷基硅烷键合的反相硅胶分离,用体积百分浓度为65%的甲醇水溶液等度洗脱,收集9-12个柱体积洗脱液,洗脱液减压浓缩得到纯的化合物(Ⅰ)。
进一步地,所述大孔树脂为AB-8型大孔吸附树脂。
药物组合物,其中含有治疗有效量的所述的化合物(Ⅰ)和药学上可接受的载体。
所述的化合物(Ⅰ)在制备抗病毒药物中的应用。
所述的药物组合物在制备抗病毒药物中的应用。
本发明化合物用作药物时,可以直接使用,或者以药物组合物的形式使用。
该药物组合物含有治疗有效量的本发明化合物(Ⅰ),其余为药物学上可接受的、对人和动物无毒和惰性的可药用载体和/或赋形剂。
所述的可药用载体或赋形剂是一种或多种选自固体、半固体和液体稀释剂、填料以及药物制品辅剂。将本发明的药物组合物以单位体重服用量的形式使用。本发明药物可通过口服或注射的形式施用于需要治疗的患者。用于口服时,可将其制成片剂、缓释片、控释片、胶囊、滴丸、微丸、混悬剂、乳剂、散剂或颗粒剂、口服液等;用于注射时,可制成灭菌的水性或油性溶液、无菌粉针、脂质体或乳剂等。
说明书附图
图1为化合物(Ⅰ)结构式;
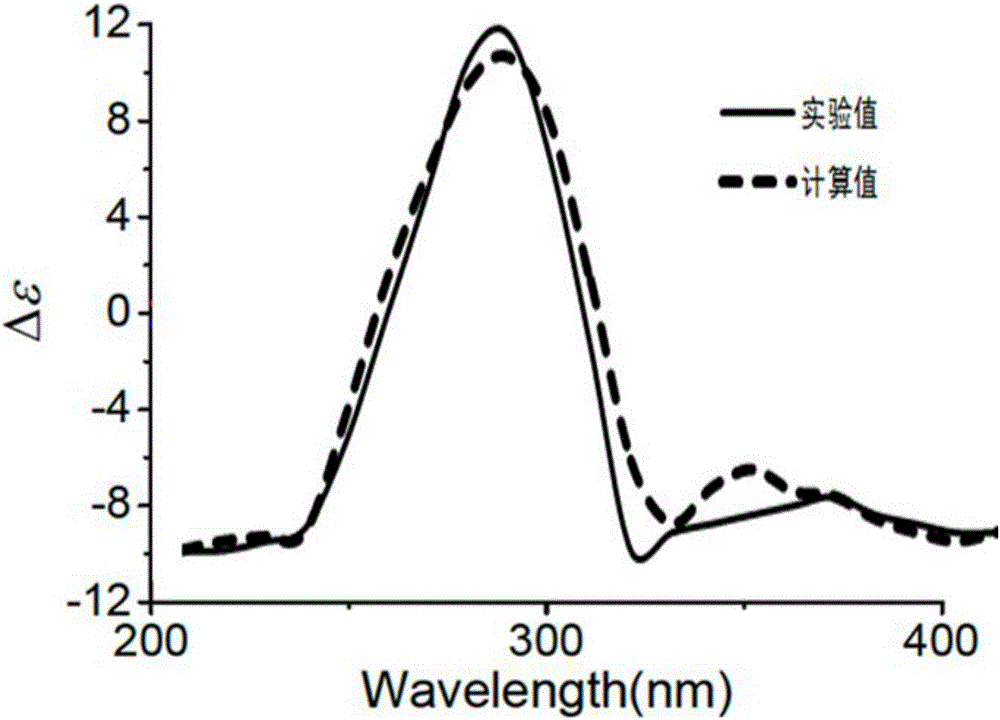
图2为化合物(Ⅰ)理论ECD值与实验ECD值比较;
图3为化合物(Ⅰ)二维ROESY谱;
图4为空白对照曲线及SAH水解酶活性测定结果;
图5为化合物(Ⅰ)对SAH水解酶的抑制作用。
具体实施方式
下面结合实施例进一步说明本发明的实质性内容,但并不以此限定本发明保护范围。尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
实施例1:化合物(Ⅰ)分离制备及结构确证
药材和试剂来源:乙醇、石油醚、乙酸乙酯、正丁醇、二氯甲烷为分析纯,购自上海凌峰化学试剂有限公司,甲醇,分析纯,购自江苏汉邦化学试剂有限公司。干燥的杜仲叶购自安徽亳州中药材市场,产地湖北。
制备方法:(a)干燥的杜仲叶(8kg)用75%乙醇热回流提取(25L×3次),合并提取液,浓缩至无醇味(6L),依次用石油醚(6L×3次)、乙酸乙酯(6L×3次)和水饱和的正丁醇(6L×3次)萃取,浓缩,分别得到石油醚萃取物、乙酸乙酯萃取物(288g)和正丁醇萃取物;(b)步骤(a)中乙酸乙酯萃取物用纯净水溶解至1.5L,医用脱脂棉过滤,滤液用AB-8型大孔树脂(1.5kg)分离,依次用10%乙醇(12L)和75%(15L)乙醇洗脱,收集75%乙醇洗脱液,减压浓缩得75%乙醇洗脱物浸膏(126g);(c)步骤(b)中75%乙醇洗脱浸膏用200-300目正相硅胶分离,依次用体积比为90:1(10个柱体积)、45:1(10个柱体积)、20:1(8个柱体积)、10:1(9个柱体积)和1:1(4个柱体积)的二氯甲烷-甲醇梯度洗脱得到5个组分;(d)步骤(c)中组分3(28g)用200-300目正相硅胶进一步分离,依次用体积比为25:1(5个柱体积)、20:1(8个柱体积)和10:1(5个柱体积)的二氯甲烷-甲醇梯度洗脱得到3个组分;(e)步骤(d)中组分2(8g)用十八烷基硅烷键合的反相硅胶ODS-C18分离,用体积百分浓度为65%的甲醇水溶液等度洗脱,收集9-12个柱体积洗脱液,洗脱液减压浓缩得到纯的化合物(Ⅰ)(22mg)。
结构确证:淡黄色针状结晶,易溶于氯仿、乙酸乙酯、丙酮和甲醇;HR-ESIMS显示[M+Na]+为m/z 581.2442,结合核磁特征可得分子式为C30H38O10,不饱和度为12。核磁共振氢谱数据δH(ppm,CDCl3,400MHz):H-1(6.65,d,J=12.4),H-2(6.05,d,J=12.4),H-5(2.53,m),H-6(2.56,m),H-6(2.96,m),H-9(2.61,s),H-11(5.36,s),H-12(5.15,s),H-15(3.72,s),H-16(2.07,m),H-16(2.31,m),H-17(2.89,m),H-18(0.81,s),H-19(1.57,s),H-21(7.12,s),H-22(6.07,s),H-23(7.33,s),H-28(1.53,s),H-29(1.44,s),H-30(1.43,s),OAc-11(2.22,s),OAc-12(1.96,s);核磁共振碳谱数据δC(ppm,CDCl3,100MHz):151.5(CH,1-C),120.9(CH,2-C),166.3(C,3-C),83.6(C,4-C),48.3(CH,5-C),39.6(CH2,6-C),206.8(C,7-C),51.3(C,8-C),56.4(CH,9-C),44.0(C,10-C),75.0(CH,11-C),79.9(CH,12-C),44.7(C,13-C),67.6(C,14-C),56.0(CH,15-C),32.3(CH2,16-C),41.7(CH,17-C),15.6(CH3,18-C),18.6(CH3,19-C),122.0(C,20-C),140.4(CH,21-C),111.2(CH,22-C),142.7(CH,232-C),25.7(CH3,28-C),31.5(CH3,29-C),21.0(CH3,30-C),169.4(C,OAc-11),21.0(CH3,OAc-11),169.3(C,OAc-12),21.3(CH3,OAc-12)。1H和13C NMR谱的进一步分析可知该合物母核为A-seco环柠檬苦素类母核,结构与文献报道的Surenone相似。两个化合物之间化学位移的差异主要是由于羟基信号的缺失以及两个乙酰基(δH2.22,s,1.96,s;δC169.4,21.0,169.3,21.3)和羰基碳信号(δC206.8)引起的。HMBC谱中,H-11与OAC-11(δC169.4,21.0)以及H-12与OAC-12(δC169.3,21.3)的相关性表明两个乙酰基分别位于C-11和C-12上。H-5与H-6和C-7的相关性可知酮羰基(δC206.8)位于C-7位上。图3所示ROESY谱中,Me-19与Me-30和H-12以及H-12与H-17的相关性表明这些基团为β-构型。反过来,H-5与H-9,H-9与Me-18,Me-18与H-15,Me-18与H-11之间的相关性表明这些基团为α构型,确定该化合物结构如图1所示,并通过ECD实验得到确证,实验值与理论值基本一致(图2)。
实施例2:化合物(Ⅰ)药理作用试验
一、材料和试剂
Ado,Sigma公司;L-Hey,Sigma公司;DTNB,Sigma公司;二硫苏糖醇(DTT),分析纯,上海伯奥生物科技有限公司;乙二胺四乙酸(EDTA),分析纯,天津市远航化学品有限公司);硫酸铵,分析纯,天津市东丽区天大化学试剂厂;磷酸二氢钾,分析纯,天津市东丽区天大化学试剂厂;磷酸氢二钾,分析纯,天津市东丽区天大化学试剂厂;wistar大鼠,哈尔滨医科大学实验动物中心。
二、试验方法
2.1SAH水解酶的提取
4℃下取新鲜大鼠肝脏,用2倍于肝脏重量的10mmol/L pH7.6磷酸缓冲液(含2mmol/L DTT,1mmol/L EDTA)制成匀浆。肝浆在4℃10,000rad/min离心30min,取上清液,4℃10,000rad/min离心60min,取上清液,上清液用38%硫酸铵沉淀,于4℃10,000rad/min离心后,弃上清,取沉淀冻干备用。
2.2SAH水解酶活性测定
用比色法测定SAH水解酶的活性。SAH水解酶能可逆性地催化S-腺苷-L-高半胱氨酸(SAH)分解为腺苷(Ado)、高半胱氨酸(Hcy),半胱氨酸可与二硫硝基苯甲酸(DTNB)发生硫醇-二硫化物交换反应,反应中1分子的半胱氨酸引起1分子的硫硝基苯甲酸的释放。它在PH 8.0时,在412nm波长处有强烈的吸收,因此可利用比色法定量测定-SH基,测定吸收光度值以检测SAH水解酶活性。
空白对照曲线绘制:将100μl反应混合物(含DTT 2mM,EDTA 1mM,腺苷2mM,D,L-高半胱氨酸2mM,磷酸钾缓冲液pH 7.6120mM)6份,分别在37℃水浴中培养0秒、10秒、20秒、30秒、40秒、50秒,然后各取20μl,分别加入到盛有60μl Tris-Cl缓冲液(PH 8.0)的离心管中混匀,再各取20μl分别加入到6支盛有100μl DTNB分析液的离心管中,准确静置5min,使其充分显色,在412nm处检测吸光值。
SAH水解活性曲线绘制:将100μl反应混合物(含DTT 2mM,EDTA 1mM,腺苷2mM,D,L-高半胱氨酸2mM,磷酸钾缓冲液pH 7.6120mM,SAH水解酶3μl)6份,实验方法同上。
2.3化合物(Ⅰ)对SAH水解酶活性的抑制作用
将化合物(Ⅰ)用蒸馏水配制成浓度为0.05mg/ml的样品溶液。将100μl反应混合物(含DTT 2mM,EDTA 1mM,腺苷2mM,D,L-高半胱氨酸2mM,磷酸钾缓冲液pH 7.6120mM,SAH水解酶3μl,化合物(Ⅰ)样品溶液3μl)6份,实验方法同上。
三、结果及结论
3.1空白对照曲线及SAH水解酶活性测定
图4中可见,反应底物腺苷和高半胱氨酸在不加SAH水解酶的情况下,会缓慢的向合成的方向反应,空白对照曲线中底物的吸光度逐渐降低。SAH水解酶是该反应的催化剂,在底物腺苷和高半胱氨酸浓度非常高的情况下,SAH水解酶催化腺苷和高半胱氨酸迅速反应,但是10秒后,该反应合成和水解达到平衡,反应体系中高半胱氨酸的量趋于稳定。图4中酶活性检测曲线前10秒底物吸光度迅速降低,10秒后底物的吸光度逐渐趋于稳定,反应就达到了平衡。
3.2化合物(Ⅰ)对SAH水解酶的抑制作用
图5中可见,加入化合物(Ⅰ)后,腺苷和高半胱氨酸持续向合成的方向反应,并没有出现SAH水解酶加速反应并迅速达到反应平衡的现象。说明化合物(Ⅰ)抑制了SAH水解酶的活性。分析可能具有抗病毒的活性。
实施例3
片剂的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按其与赋形剂重量比为1:9的比例加入赋形剂,制粒压片。
实施例4
口服液的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按常规口服液制法制成口服液。
实施例5
胶囊剂或颗粒剂的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按其与赋形剂重量比为1:9的比例加入赋形剂,制成胶囊或颗粒剂。
实施例6
注射液的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按常规加注射用水,精滤,灌封灭菌制成注射液。
实施例7
无菌粉针的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,将其溶于无菌注射用水中,搅拌使溶,用无菌抽滤漏斗过滤,再无菌精滤,分装于安瓿中,低温冷冻干燥后无菌熔封得粉针剂。
- 还没有人留言评论。精彩留言会获得点赞!