化合物10058‑F4的新用途的制作方法
本发明涉及一种化合物10058-F4新用途。
背景技术:
神经系统的结构复杂性及神经元死亡后的不可替代性决定了在所有神经系统疾病治疗的终极目标都是尽可能的挽救神经元的存活,其直接关系到临床疗效和病人长期生存的质量。目前,缺血性中风,神经退行性病的发病率很高,常会严重剥夺患者的劳动和生活自理能力,已成为困扰国民生活和国家医疗财政的重大健康问题。在这些神经系统疾病的发生和进展中神经元死亡无疑是重要的病理改变。因此目前对于神经元死亡的分子机制的研究是国内外研究的一个热点, 同时研究如何阻止神经元的死亡也是治疗上述疾病的重要手段。缺血性中风和神经退行性疾病是两大类主要致死和致残性神经系统疾病,前者治疗的关键是挽救缺血-再灌注损伤区域的神经元,后者亦是阻止新病灶的发展并以挽救神经元为最终目的。目前发现脑缺血再灌注损伤,谷氨酸兴奋性毒性及各种炎性反应导致的神经死亡的主要原因之一是由聚腺苷酸二磷酸核糖转移酶-1(PARP-1)过度激活介导的区别于凋亡和坏死的细胞死亡,又称Parthanatos(PARP-1依赖性细胞死亡)。发生在神经细胞的parthanatos,可以用DNA 烷化剂甲基硝基亚硝基胍(N-Methyl-N′-nitro-N-nitrosoguanidine,MNNG) 处理肿瘤细胞Hela 细胞得到相同的结果,所有的细胞都通过PARP-1 的过度激活而造成parthanatos 死亡。我们利用这个细胞模型筛选化合物库发现化合物10058-F4可以阻止MNNG处理的Hela的死亡, 化合物10058-F4的分子式及英文描述分别为C12H11NOS2, (Z,E)-5-(4-Ethylbenzylidine)-2-thioxothiazolidin-4-one。进而我们发现其同样能阻止神经细胞的死亡,因为NMDA(N-methyl-D-aspartic acid,N-甲基-D-天冬氨酸)处理神经细胞可以在培养细胞水平上模拟缺血性中风及神经退行性病神经细胞死亡的过程,而500uM的NMDA处理不能杀死加了化合物10058-F4的神经细胞。因此化合物10058-F4可以通过阻止缺血性中风、神经退行性疾病等疾病中的parthanatos 细胞死亡来治疗这些神经系统疾病。
技术实现要素:
本发明目的之一在于提供一种化合物10058-F4在制备治疗神经系统疾病药物中的应用。
本发明的目的之二在于提供化合物10058-F4在制备阻止神经细胞的PARP-1依赖性细胞死亡药物中的应用。
本发明的目的之三在于提供化合物10058-F4作为神经细胞保护剂在制备治疗缺血性中风药物中的应用。
本发明的目的之四在于提供化合物10058-F4作为神经细胞保护剂在制备治疗神经退行性疾病药物中的应用。
化合物10058-F4的结构式为:。
试验表明,该化合物10058-F4具有明显的保护神经细胞,促进神经细胞在各种神经系统疾病损害情况下的存活作用。因此,可以用于制备治疗神经系统疾病的药物。所制备的药物可以是以该化合物为活性成分,且含有药学上可以接受的载体的组合物,活性成分的重量含量为0.1-99.95%。药物剂型可以是片剂、粉剂、粒剂和注射剂等。
附图说明
图1, MNNG处理Hela细胞(10倍相差显微镜)。左侧为二甲基亚砜(DMSO)对照组,细胞正常存活。中间为Hela细胞经50uM MNNG处理15分钟再培养24小时后,100%的细胞都已经死亡并悬浮在培养基中。
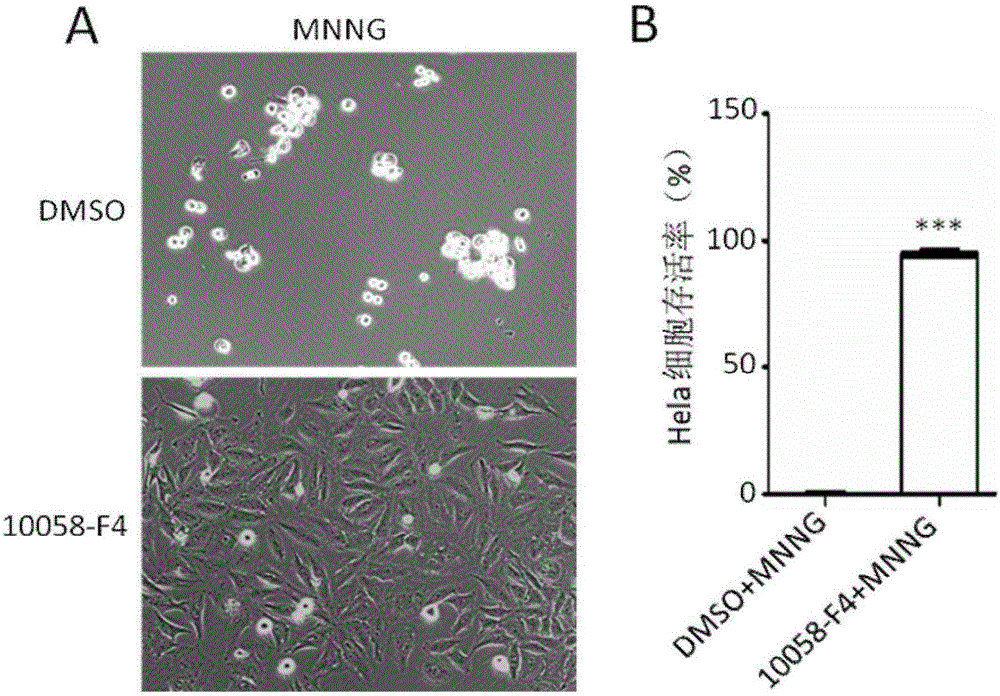
图2, MNNG处理不能杀死加了化合物10058-F4的Hela细胞。(A) 20倍相差显微镜下典型图片显示加了10uM的化合物10058-F4的Hela细胞经50uM MNNG处理15分钟再培养24小时后细胞基本不死(右上图),对照组的Hela细胞经同样条件处理后细胞完全死亡(右下图)。(B)柱状统计图说明经4次重复实验后统计经50uM MNNG处理15分钟再培养24小时后,加了100uM的化合物10058-F4的Hela细胞与对照组的存活率,差异极其显著,Mean±SEM, P<0.001。
图3, 500uM的NMDA(N-methyl-D-aspartic acid,N-甲基-D-天冬氨酸)处理不能杀死加了化合物10058-F4的神经细胞。
(A) PI/Hochest活细胞染色典型图片显示加了100uM的化合物10058-F4的神经细胞经500uM NMDA处理15分钟再培养24小时后细胞基本不死,对照组(加DMSO组)的神经细胞经同样条件处理后细胞大部分完全死亡,显示为PI染色细胞增多。(B)柱状统计图说明经4次重复实验后统计经500uM NMDA处理15分钟再培养24小时后,加了100uM的化合物10058-F4的神经细胞与对照组的存活率,差异极其显著,Mean±SEM, P<0.001。
具体实时方式
下面的实施例可以使本专业技术人员更全面地理解本发明,但不以任何方式限制本发明。
实施例1:Hela细胞的培养及MNNG的处理
Hela细胞用含10%胎牛血清的DMEM正常传代培养,待其长到90%融合度时,用50uM MNNG 37度细胞培养箱中处理15分钟(对照组加等体积二甲基亚砜DMSO,筛选组或处理组加溶于DMSO的化合物),换回正常培养基再培养24小时后,对照组100%的细胞都已经死亡并悬浮在培养基中。
实施例2:神经细胞的培养
C57BL6小鼠,胎鼠(E12-14)取出大脑皮层组织,在解剖液中先剪碎,用0.125%胰蛋白酶在37℃孵育30min,移入接种液(MEM含1%谷氨酰胺,另加入10%马血清),停止消化,并洗去胰蛋白酶液,用细口吸管吹打细胞悬液,使其充分分散,如此多次,待沉淀后吸出上层细胞悬液,计数,预置细胞密度,移入接种液接种于预先涂有多聚赖氨酸的康宁12孔培养板,隔夜换维持培养液(MEM中含5%马血清,1%谷氨酰胺)每周换液两次,每次换1/2。培养3-5天后,用阿糖胞苷,或5-FU抑制神经胶质细胞的生长。
实施例3: 神经细胞存活实验
具体实验过程为:取实施例2中的小鼠神经细胞,培养两周后,用500uM NMDA 37度细胞培养箱中处理15分钟(对照组加等体积二甲基亚砜DMSO,处理组加溶于DMSO的化合物),换回正常培养基再培养24-48小时。
实施例3:Hoechst/PI双染检测神经细胞坏死
因为坏死细胞细胞膜的完整性被破坏,细胞膜的通透性增强,因此进入坏死细胞中的Hoechst 33342与PI染料比正常细胞的多。而PI等染料是不能进入细胞膜完整的活细胞中,即正常细胞在不经固定的情况下对这些染料是拒染,坏死细胞由于膜完整性在早期即已破损,可被这些染料染色。根据这些特性,用Hoechst 33342结合PI等染料对坏死细胞进行双染色,就可在荧光显微镜上将正常细胞和坏死细胞区别开来,并可以标定细胞总数目与坏死细胞数目。正常细胞为高蓝色/低红色(Hoechst 33342+/PI-),坏死细胞为高蓝色/高红色(Hoechst 33342+/PI++)。通过这种方法对坏死神经细胞进行检测,并统计存活率。
具体实验过程为:取实施例3中的小鼠神经细胞,使用凯基生物的“KGA-212荧光Hoechst33342/PI双染检测试剂盒。终止培养后吸除培养液,用冷Buffer A洗涤细胞二次,滴加150 μlhoechst33342工作液和75ulPI工作液(原液稀释10倍),室温避光染色10 min,在相应波长激发荧光倒置显微镜下观察细胞核形态。
- 还没有人留言评论。精彩留言会获得点赞!