一种氮杂螺酮类化合物及其制备方法与流程
技术领域:
本发明涉及一种氮杂螺酮类化合物,具体涉及坦度螺酮硫酸盐及其制备方法和用途。属于药物化学领域。
背景技术:
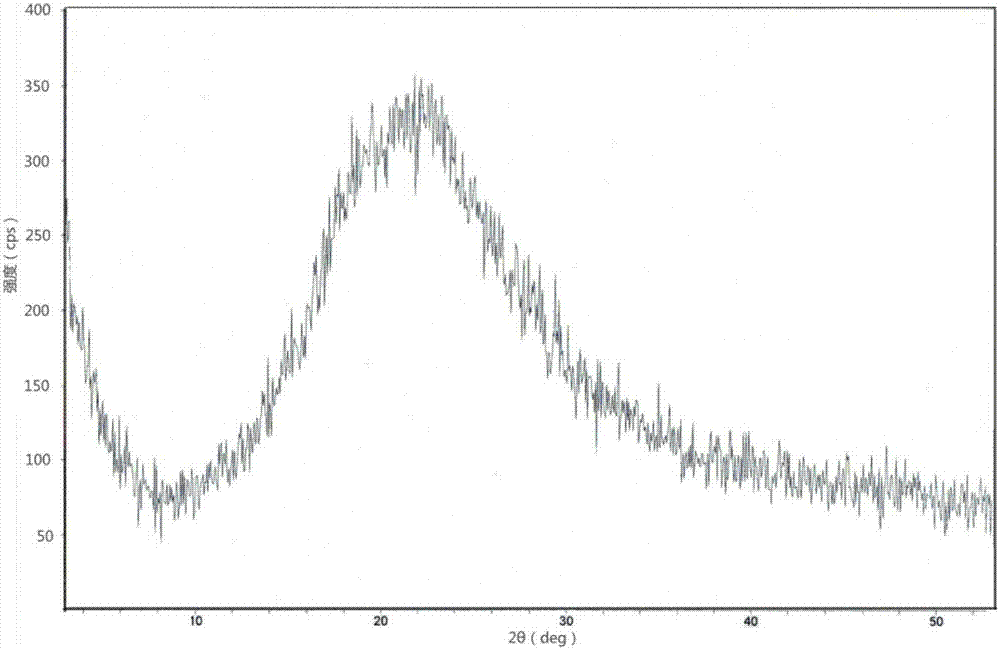
:坦度螺酮属于氮杂螺酮类药物,化学名为(3aα,4β,7β,7aα)-六氢-2-[4[4-(2-嘧啶基)-1-(哌嗪基)-丁基]-4,7-亚甲基-1H-异吲哚-1,3(2H)-二酮,分子结构式如下:坦度螺酮最早是由日本住友制药株式会社研制而成,于1996年在日本获准上市。它是一种5-羟色胺受体激动剂,属于第3代抗焦虑药,主要用于治疗焦虑或其他伴焦虑状态的疾病。在脑内,它能与集中分布在情感中枢的海马、中隔、脚间核、杏仁核等大脑边缘系统以及缝腺核的5-HT1A受体选择性地结合,通过激动5-HT1A自身受体,调节从中缝核投射至海马的5-羟色胺,抑制行动抑制系统的5-羟色胺效应,发挥抗焦虑作用。相较于原形药物氮杂螺酮和同类衍生物丁螺环酮,坦度螺酮具有更高的选择性抗焦虑作用,这种作用与地西泮相近,但在神经运动性功能损害和药物滥用等方面的毒副作用却比地西泮小。由于作用机制的特异性,坦度螺酮及其盐在临床上用于治疗焦虑症时,具有用药安全性高、副反应少、无松弛肌肉和镇静作用、无依赖性和停药戒断现象、长期应用后在体内无蓄积等优点。还有研究表明,坦度螺酮及其盐除了抗焦虑的作用外,在其他神经系统疾病的治疗或辅助性治疗方面也具有相当好的应用。坦度螺酮及其盐具有一定的抗抑郁作用,对于混合有焦虑和抑郁的病人疗效十分显著,并且可以通过抗焦虑和抗抑郁效应改善植物神经症状,如肠激惹综合征、功能性消化不良、术后恶心和呕吐等。它还是治疗中枢性神经系统共济失调的有效药物,可以明显改善患者小脑共济失调的症状。对于患有神经衰弱、老年痴呆或者精神分裂的患者,它还能有效提高记忆力,治疗增龄性记忆障碍,显著改善精神分裂症患者的陈述性记忆、逻辑记忆和口语成对联想等。此外,有研究表明作为5-羟色胺受体激动剂的坦度螺酮及其盐还具有降眼压的活性,可以用于治疗由于内皮细胞增殖、炎症、血管渗透性提高或血管生成等引起的眼部疾病,例如糖尿病性视网膜病、年龄相关性黄斑变性、视网膜水肿、青光眼等等。可见,坦度螺酮及其盐具有非常良好的临床治疗优势和广阔的市场前景。在临床用药中,有近一半的药物分子都是以盐的形式存在和给药的。用带相反电荷的分子或离子与药物进行成盐,可以有效改善药物某些不理想的物理化学或生物药学性质,例如改变药物的溶解度、降低吸湿性、提高稳定性、改变熔点、改善研磨性能、便于制备纯化、提高渗透性等等。坦度螺酮的水溶性差,成盐后可以有效改善其水溶性和物理化学稳定性,提高生物利用度,因此,坦度螺酮盐在医学应用中往往比其原形药物坦度螺酮更具有优势,有利于最大限度的发挥出药物的作用。例如目前市场上销售的主要为枸橼酸坦度螺酮,它通常以片剂或胶囊剂的形式广泛应用于焦虑症等相关疾病的治疗,具有比较成熟的临床应用研究。目前,针对坦度螺酮盐的研究主要集中在枸橼酸盐。例如,US4507303、US4818756、CN101362751A等文献中报道了枸橼酸坦度螺酮的制备方法。目前还未见坦度螺酮硫酸盐晶型的相关报道。众所周知,对于药物而言,不同成盐形式的化合物可能具有不同的晶型,同一种成盐形式的化合物还可能存在多晶型。而不同的晶型又有可能具有不同的颜色、熔点、稳定性、表观溶解度、溶解速率等等,这些性质会直接影响到药物制剂的稳定性、溶解度、吸湿性、生物利用度等,并由此导致药品质量和临床药效的差异。无定型是一种特殊的晶型状态,是多晶型药物的一种存在形式。药物以无定型的形态存在时,其理化性质及临床药效特征常有别于一般的晶型药物。无定型状态的固体药物往往具有较好的体外溶出和体内吸收性质,并有可能起到更好的临床效果。因此,对于坦度螺酮硫酸盐的相关晶型的制备与研究是非常有意义的。技术实现要素:本发明的目的在于提供性质稳定,水溶性良好的硫酸坦度螺酮无定型和晶型I以及它们的制备方法、药物组合物和用途。本发明提供了一种无定型硫酸坦度螺酮化合物,采用CuKα辐射源对本化合物进行X射线粉末衍射,其X射线粉末衍射图中无特征峰;优选地,该化合物具有基本如图1、图2或者图3所示的X射线粉末衍射图特征。本发明无定型硫酸坦度螺酮化合物的结构式为:本发明还提供了上述无定型硫酸坦度螺酮的制备方法,它包括如下操作工序:A、取坦度螺酮,加入溶剂1,加热溶解,再加入硫酸溶液,待反应完全,反应液备用;B、反应液浓缩,即得无定型硫酸坦度螺酮;或者,C、反应液浓缩后,再加入溶剂2溶解,浓缩得到无定型硫酸坦度螺酮。其中,步骤A中所述硫酸溶液是硫酸水溶液、硫酸甲醇溶液、硫酸乙醇溶液中的任意一种。进一步地,所述硫酸水溶液质量分数为10%-40%,更优选为20%-30%。进一步地,所述硫酸甲醇溶液质量分数为5%-25%,更优选为10%-20%。进一步地,所述硫酸乙醇溶液质量分数为5%-25%,更优选为10%-20%。进一步地,步骤A中,所述溶剂1选自醇类溶剂、酮类溶剂、醚类溶剂、酯类溶剂、乙腈的任意一种或其组合,优选甲醇、乙醇、丙酮、乙腈、异丙醇、四氢呋喃的任意一种或其组合。进一步地,步骤A中,加热溶解温度为30-100℃,优选30-80℃。进一步地,步骤A中,坦度螺酮与硫酸的摩尔比小于等于1∶1。进一步地,步骤A中,坦度螺酮与溶剂1的质量体积比为1∶1-30g/mL。进一步地,步骤A中,坦度螺酮与硫酸的摩尔比为1:1-2。进一步地,步骤A中,坦度螺酮与溶剂1的质量体积比为1∶3-20g/mL。进一步地,步骤C中,所述溶剂2选自醇类溶剂、酮类溶剂、醚类溶剂、酯类溶剂、乙腈的任意一种或其组合,优选甲醇、乙醇、丙酮、乙腈、异丙醇、四氢呋喃的任意一种或其组合。进一步地,步骤C中,溶剂2的用量体积(mL)为步骤A中坦度螺酮质量(g)的1-30倍。进一步地,步骤C中,溶剂2的用量体积(mL)为步骤A中坦度螺酮质量(g)的1-20倍。本发明还提供了另一种制备上述无定型硫酸坦度螺酮的方法,它包括如下操作工序:A、用硫酸和坦度螺酮成盐,制备得到硫酸坦度螺酮;B、取硫酸坦度螺酮,加入有机溶剂,加热溶解后,制得硫酸坦度螺酮溶液;C、自然冷却至室温,静置,取沉淀,干燥,即得无定型硫酸坦度螺酮;或者,D、自然冷却至室温下放置,再置于-5±5℃下静置,取沉淀,干燥,即得无定型硫酸坦度螺酮;或者,E、自然冷却至室温,浓缩脱除溶剂,干燥,即得无定型硫酸坦度螺酮。进一步地,步骤B中,加热溶解温度为30-100℃,硫酸坦度螺酮与有机溶剂的质量体积比为1:1-30g/mL,所述有机溶剂选自醇类溶剂、酮类溶剂、醚类溶剂、酯类溶剂、乙腈的任意一种或其组合。其中,加热溶解温度优选为35-85℃。其中,坦度螺酮与有机溶剂的质量体积比优选为1:3-20g/mL。其中,所述有机溶剂优选为甲醇、乙醇、丙酮、乙腈、四氢呋喃、乙酸乙酯、乙醚的任意一种或其组合。进一步地,步骤C中,静置时间为1-16小时,优选为2-12小时;步骤D中,室温下放置1-16小时,优选为2-12小时,-5±5℃下静置12小时以内,优选为8小时以内。本发明还提供了上述无定型硫酸坦度螺酮在制备治疗5-羟色胺或/和去甲肾上腺素再摄取相关疾病的药物中的用途。其中,所述的药物为治疗中枢神经系统疾病和眼部疾病的药物,优选为治疗焦虑症、抑郁症、恐慌症、孤独症、自闭症、失眠症、精神分裂症、增龄性记忆障碍、神经衰弱、老年痴呆、青光眼、糖尿病性视网膜病、年龄相关性黄斑变性、视网膜水肿等疾病的药物。进一步地,上述无定型硫酸坦度螺酮在制备5-羟色胺调节剂中的用途。其中,所述5-羟色胺调节剂为治疗焦虑症、抑郁症或失眠症的药物。本发明还提供了一种药物组合物,它是以上述无定型硫酸坦度螺酮为活性成分,加上药学上可接受的辅料或辅助性成分制备而成的制剂。本发明所述药学上可接受的辅料或辅助性成分,为本领域熟知的用于制备上述制剂的常用赋形剂或辅料。口服制剂或外用制剂常用的赋形剂或辅料包括但不仅限于填充剂(稀释剂)、润滑剂(助流剂或抗粘着剂)、分散剂、润湿剂、粘合剂、调节剂、增溶剂、抗氧剂、抑菌剂、乳化剂、崩解剂等。粘合剂如糖浆、阿拉伯胶、明胶、淀粉浆、聚维酮、纤维素类衍生物等等;填充剂如乳糖、糊精、淀粉及其衍生物、纤维素类衍生物、无机钙盐、甘露醇、琼脂粉等等;润滑剂如微粉硅胶、硬脂酸及其盐类、滑石粉、氢化植物油、聚乙二醇类等等;崩解剂如淀粉及其衍生物、交联聚维酮、纤维素类衍生物等等;润湿剂如水、醇类或其他有机溶剂等等。所述注射剂常用的赋形剂或辅料包括但不仅限于:抗氧剂如亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、硫代硫酸钠等等;抑菌剂如苯酚、苯甲醇、羟丙甲酯、三氯叔丁醇等等;调节剂如盐酸、枸橼酸、氢氧化钾(钠)、缓冲剂等等;乳化剂如聚山梨酯80、卵磷脂、豆磷脂等等;增溶剂如吐温80、胆汁、甘油等等。此外,还可将活性成分与药学上可接受的缓控释载体,按照本领域所熟知的缓控释制剂的制备方法制成缓控释制剂。本发明所述组合物的制剂形式,可以是液体制剂、气体制剂、固体制剂和半固体制剂,优选芳香水剂、溶液剂、注射剂、合剂、洗剂、搽剂、气雾剂、喷雾剂、散剂、丸剂、片剂、膜剂、软膏剂、栓剂、糊剂等常用剂型。本发明还提供了一种硫酸坦度螺酮晶型I,采用CuKα辐射源进行X射线粉末衍射时,其X射线粉末衍射图中,2θ衍射角在15.3±0.2、21.3±0.2、22.2±0.2、23.0±0.2、28.4±0.2度有特征吸收峰。进一步地,2θ衍射角还在19.5±0.2、26.3±0.2、26.6±0.2度有特征吸收峰。进一步地,硫酸坦度螺酮晶型I具有基本如图4所示的X射线粉末衍射图特征。本发明硫酸坦度螺酮晶型I的结构式为:本发明还提供了上述硫酸坦度螺酮晶型I的制备方法,它包括如下操作工序:A、取坦度螺酮,加入丙酮,加热溶解后,再加硫酸乙醚溶液,待反应完全,反应液备用;B、反应液浓缩干燥,即得硫酸坦度螺酮晶型I;或者,C、反应液自然冷却至室温,取沉淀,干燥,即得硫酸坦度螺酮晶型I。进一步地,步骤A中,坦度螺酮与硫酸的摩尔比小于等于1∶1。进一步地,步骤A中,加热溶解温度为30-45℃。进一步地,步骤A中,坦度螺酮与丙酮的质量体积比为1∶1-30g/mL。进一步地,步骤A中,硫酸乙醚溶液的质量分数为3%-25%。进一步地,步骤A中,坦度螺酮与硫酸的摩尔比为1:1-2。进一步地,步骤A中,坦度螺酮与丙酮的质量体积比为1∶3-20g/mL。进一步地,步骤A中,硫酸乙醚溶液的质量分数为5%-15%。本发明还提供了另一种制备上述硫酸坦度螺酮晶型I的方法,它包括如下操作工序:A、用硫酸和坦度螺酮成盐,制备得到硫酸坦度螺酮;B、取硫酸坦度螺酮,加入有机溶剂,加热溶解后,制得硫酸坦度螺酮溶液;C、自然冷却至室温,静置,取沉淀,干燥,即得硫酸坦度螺酮晶型Ⅰ;或者,D、自然冷却至室温下放置,再置于-5±5℃下静置,取沉淀,干燥,即得硫酸坦度螺酮晶型Ⅰ。进一步地,步骤B中,加热溶解温度为30-100℃,硫酸坦度螺酮与有机溶剂的质量体积比为1:1-30g/mL,所述有机溶剂为醇类溶剂或者酮类溶剂。其中,步骤B中,加热溶解温度优选为50-80℃。其中,硫酸坦度螺酮与有机溶剂的质量体积比优选为1:1-25g/mL,更优选为1:3-20g/mL。其中,所述有机溶剂优选为丙醇、异丙醇或者甲乙酮;更优选异丙醇或者甲乙酮。进一步地,步骤C中,静置时间为1-16小时,优选为2-12小时;步骤D中,室温下放置1-16小时,优选为2-12小时,-5±5℃下静置12小时以内,优选为8小时以内。上述静置时间的长短,决定该化合物析晶是否完全,对其收率有影响,但不会影响晶型的结构。本发明还提供了上述硫酸坦度螺酮晶型Ⅰ在制备治疗5-羟色胺或/和去甲肾上腺素再摄取相关疾病的药物中的用途。其中,所述的药物为治疗中枢神经系统疾病和眼部疾病的药物,优选为治疗焦虑症、抑郁症、恐慌症、孤独症、自闭症、失眠症、精神分裂症、增龄性记忆障碍、神经衰弱、老年痴呆、青光眼、糖尿病性视网膜病、年龄相关性黄斑变性、视网膜水肿等疾病的药物。进一步地,上述硫酸坦度螺酮晶型Ⅰ在制备5-羟色胺调节剂中的用途。其中,所述5-羟色胺调节剂为治疗焦虑症、抑郁症或失眠症的药物。本发明还提供了一种药物组合物,它是以上述硫酸坦度螺酮晶型Ⅰ为活性成分,加上药学上可接受的辅料或辅助性成分制备而成的制剂。本发明所述药学上可接受的辅料或辅助性成分,为本领域熟知的用于制备上述制剂的常用赋形剂或辅料。口服制剂或外用制剂常用的赋形剂或辅料包括但不仅限于填充剂(稀释剂)、润滑剂(助流剂或抗粘着剂)、分散剂、润湿剂、粘合剂、调节剂、增溶剂、抗氧剂、抑菌剂、乳化剂、崩解剂等。粘合剂如糖浆、阿拉伯胶、明胶、淀粉浆、聚维酮、纤维素类衍生物等等;填充剂如乳糖、糊精、淀粉及其衍生物、纤维素类衍生物、无机钙盐、甘露醇、琼脂粉等等;润滑剂如微粉硅胶、硬脂酸及其盐类、滑石粉、氢化植物油、聚乙二醇类等等;崩解剂如淀粉及其衍生物、交联聚维酮、纤维素类衍生物等等;润湿剂如水、醇类或其他有机溶剂等等。所述注射剂常用的赋形剂或辅料包括但不仅限于:抗氧剂如亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、硫代硫酸钠等等;抑菌剂如苯酚、苯甲醇、羟丙甲酯、三氯叔丁醇等等;调节剂如盐酸、枸橼酸、氢氧化钾(钠)、缓冲剂等等;乳化剂如聚山梨酯80、卵磷脂、豆磷脂等等;增溶剂如吐温80、胆汁、甘油等等。此外,还可将活性成分与药学上可接受的缓控释载体,按照本领域所熟知的缓控释制剂的制备方法制成缓控释制剂。本发明所述组合物的制剂形式,可以是液体制剂、气体制剂、固体制剂和半固体制剂,优选芳香水剂、溶液剂、注射剂、合剂、洗剂、搽剂、气雾剂、喷雾剂、散剂、丸剂、片剂、膜剂、软膏剂、栓剂、糊剂等常用剂型。本发明提供的硫酸坦度螺酮化合物,即无定型硫酸坦度螺酮和硫酸坦度螺酮晶型I,填补了现有技术的空白;与现有产品枸橼酸坦度螺酮相比,本发明提供的硫酸坦度螺酮化合物,其性质稳定,水溶性良好,生物利用度高,为提高药物的安全性和有效性提供了一种有效的解决途径;另外,本发明硫酸坦度螺酮化合物的制备工艺简单,收率高,适用于工业化生产。以下通过具体实施例对本发明做进一步描述,然而,本发明并不限于下面的实施例,这些实施例不以任何方式限制本发明的范围。本领域技术人员在权利要求的范围内所作出的某些改变和调整也应认为属于本发明的范围。附图说明图1是本发明实施例1提供的无定型硫酸坦度螺酮的X射线粉末衍射图谱。图2是本发明实施例3提供的无定型硫酸坦度螺酮的X射线粉末衍射图谱。图3是本发明实施例5提供的无定型硫酸坦度螺酮的X射线粉末衍射图谱。图4是本发明实施例7提供的硫酸坦度螺酮晶型I的X射线粉末衍射图谱。具体实施方式本发明所用原料坦度螺酮是参照现有的制备工艺合成得到,例如CN101362751A、US5521313等文献中报道的方法。当然,除了通过现有方法合成以外,本发明所用坦度螺酮也可以通过购买市售商品得到。实施例1无定型硫酸坦度螺酮的制备称取500g坦度螺酮,溶于3.5L异丙醇,加热升温至80℃,待溶解完全,加入427g30%的硫酸水溶液,继续搅拌至反应完全后停止加热。反应液浓缩脱除溶剂,再加入2.0L丙酮溶解,浓缩至干得到620g固体,即为无定型硫酸坦度螺酮,收率为98.7%,质谱显示其ESIm/z:383(M+)。采用DX-2700型X-射线粉末衍射仪对样品晶相进行分析,CuKα辐射,测得无定型硫酸坦度螺酮的X射线粉末衍射图谱见图1,其X射线粉末衍射中无特征峰。实施例2无定型硫酸坦度螺酮的制备按照实施例1的方法制备无定型硫酸坦度螺酮,具体条件参见表1,坦度螺酮的投料量均为500g。各条件下所得产品的结构分析结果与实施例1的结构分析结果无明显差异,且X射线粉末衍射图谱与实施例1无明显差异。表1无定型硫酸坦度螺酮的制备注:表中混合溶剂比例均为体积比。实施例3无定型硫酸坦度螺酮的制备坦度螺酮与硫酸反应,制备硫酸坦度螺酮。称取200g硫酸坦度螺酮,加入1000mL乙醇,加热升温至80℃,待溶解完全,继续搅拌30min后停止加热,自然冷至室温放置2小时,再于-5±5℃放置4小时,弃去上清液,得到类白色沉淀物,干燥,即得195g类白色粉末状无定型硫酸坦度螺酮,收率为97.5%,质谱显示其ESIm/z:383(M+)。采用DX-2700型X-射线粉末衍射仪对样品晶相进行分析,CuKα辐射,测得无定型硫酸坦度螺酮的X射线粉末衍射图谱见图2,其X射线粉末衍射中无特征峰,且图2与图1无明显差异。实施例4无定型硫酸坦度螺酮的制备按照实施例3中所述方法制备无定型硫酸坦度螺酮,具体条件参见表2,硫酸坦度螺酮的投料量均为200g。各条件下所得产品的X射线粉末衍射图谱与实施例3无明显差异,确定其为无定型硫酸坦度螺酮。表2无定型硫酸坦度螺酮化合物的制备注:表中混合溶剂比例均为体积比。实施例5无定型硫酸坦度螺酮的制备坦度螺酮与硫酸反应,制备硫酸坦度螺酮。称取200g硫酸坦度螺酮,加入600mL甲醇,加热升温至70℃,待溶解完全,继续搅拌30min后停止加热,自然冷却至25℃以下,浓缩脱除溶剂,干燥,即得199g类白色粉末状无定型硫酸坦度螺酮,收率为99.5%,质谱显示其ESIm/z:383(M+)。采用DX-2700型X-射线粉末衍射仪对样品晶相进行分析,CuKα辐射,测得无定型硫酸坦度螺酮的X射线粉末衍射图谱见图3,其X射线粉末衍射中无特征峰,且图3与图1无明显差异。实施例6无定型硫酸坦度螺酮的制备按照实施例5中所述方法制备无定型硫酸坦度螺酮,具体条件参见表3,硫酸坦度螺酮的投料量均为200g。各条件下所得产品的X射线粉末衍射图谱与实施例5无明显差异,确定其为无定型硫酸坦度螺酮。表3无定型硫酸坦度螺酮化合物的制备注:表中混合溶剂比例均为体积比。实施例7硫酸坦度螺酮晶型I的制备称取5g坦度螺酮,加入25mL的丙酮,加热至35℃,待完全溶解后,加入13g的10%的硫酸乙醚溶液,搅拌至反应完全,反应液浓缩干燥,得到类白色的坦度螺酮晶型I6.24g,收率为99.4%,质谱显示其ESIm/z:383(M+)。采用DX-2700型X-射线粉末衍射仪对样品晶相进行分析,CuKα辐射,测得硫酸坦度螺酮晶型Ⅰ的X射线粉末衍射图谱如图4所示,其主要相关衍射数据见表4(2θ测量误差为±0.2)。表4硫酸坦度螺酮晶型Ⅰ的X射线粉末衍射数据实施例8硫酸坦度螺酮晶型I的制备按照实施例7的方法制备硫酸坦度螺酮晶型I,具体条件参见表5,坦度螺酮的投料量均为5g。各条件下所得产品的结构分析结果与实施例7的结构分析结果无明显差异,且X射线粉末衍射图谱与实施例7无明显差异。表5硫酸坦度螺酮晶型I的制备注:表中混合溶剂比例均为体积比。实施例9硫酸坦度螺酮晶型Ⅰ的制备坦度螺酮与硫酸反应,制备硫酸坦度螺酮。称取200g硫酸坦度螺酮,加入600mL异丙醇,加热升温至80℃,待溶解完全,继续搅拌30min后停止加热,自然冷至室温放置12小时,取沉淀,干燥,即得191g类白色的硫酸坦度螺酮晶型I,收率为95.5%,质谱显示其ESIm/z:383(M+),所得产品的X射线粉末衍射图谱与实施例7无明显差异。实施例10硫酸坦度螺酮晶型Ⅰ的制备坦度螺酮与硫酸反应,制备硫酸坦度螺酮。称取200g硫酸坦度螺酮,加入1000mL异丙醇,加热升温至70℃,待溶解完全,继续搅拌30min后停止加热,自然冷至室温放置2小时,再于-5±5℃放置8小时,取沉淀,干燥,即得190g类白色的硫酸坦度螺酮晶型I,收率为95.0%。所得产品的X射线粉末衍射图谱与实施例7无明显差异。实施例11硫酸坦度螺酮晶型Ⅰ的制备坦度螺酮与硫酸反应,制备硫酸坦度螺酮。称取200g硫酸坦度螺酮,加入4000mL甲乙酮,加热升温至50℃,待溶解完全,继续搅拌30min后停止加热,自然冷至室温放置6小时,再于-5±5℃放置4小时,取沉淀,干燥,即得192g类白色的硫酸坦度螺酮晶型I,收率为96.0%。所得产品的X射线粉末衍射图谱与实施例7无明显差异。实施例12本发明的缓释片将待制备量的硫酸坦度螺酮晶型I、羟丙基甲基纤维素和乳糖混合均匀,过筛,加入75%乙醇溶液制软材,过20目筛制湿颗粒,于50℃左右烘干,20目筛整粒,加入硬脂酸镁和滑石粉,混合均匀后压片。实施例13本发明的胶囊剂将待制备量的硫酸坦度螺酮晶型I与淀粉通过等量递增法混匀后,再与微晶纤维素混匀,制粒,装胶囊即得。实施例14本发明的胶囊剂将待制备量的无定型硫酸坦度螺酮与淀粉通过等量递增法混匀后,再与微晶纤维素混匀,制粒,装胶囊即得。实施例15本发明的舌下片将原辅料分别过100目筛。将待制备量的无定型硫酸坦度螺酮与低取代羟丙甲基纤维素通过等量递增法混匀,再依次加入甘露醇、乳糖淀粉,最后加入甜橙香精和硬脂酸镁,混合均匀后压片。实施例16本发明的局部眼用制剂将待制备量的无定型硫酸坦度螺酮、乙酸钠、氯化钠和依地酸二钠混合,加入注射用水,充分溶解后,将pH调至约5.0,然后加入苯扎氯铵,并适当调节溶液的pH至约5.0。以下通过试验例说明本发明的有益效果。试验例1:溶解度试验试验组1:本发明实施例1制备得到的无定型硫酸坦度螺酮;试验组2:本发明实施例7制备得到的硫酸坦度螺酮晶型I;对照组:参照现有文献(CN101880274A实施例7)公开方法制备得到的枸橼酸坦度螺酮。称取供试品2g,置于25±2℃的注射用水10mL中,振摇。1分钟后,如若还有目视可见的溶质颗粒,再补加供试品重量的5倍体积的水(即10mL水),重复前述操作,直至完全溶解。记录总用水量,结果见表6。表6溶解性比较研究无定型硫酸坦度螺酮硫酸坦度螺酮晶型Ⅰ枸橼酸坦度螺酮总用水量(倍)总用水量(倍)总用水量(倍)51060表6中的溶解性试验结果表明,本发明制备得到的无定型硫酸坦度螺酮和晶型I溶解所需要水量明显比枸橼酸坦度螺酮少,溶解性更优。通常情况下,好的水溶性不仅为药物疗效和安全性提供了有力的保证,而且还可以减少临床用药时产生的刺激,提高病人的依从性,这种优势在注射剂和眼部制剂的应用中尤为突出。试验例2:稳定性效果试验试验组1:本发明实施例1制备得到的无定型硫酸坦度螺酮;试验组2:本发明实施例7制备得到的硫酸坦度螺酮晶型I;对照组:参照现有文献(CN101880274A实施例7)公开方法制备得到的枸橼酸坦度螺酮。稳定性考察条件包括:(1)热降解:取供试品约200mg,置于60℃干燥箱中放置;(2)光降解:取供试品约200mg,置于光照度为4500±500lx的环境中放置;(3)高湿降解:取供试品约200mg,置于放有KNO3饱和溶液的干燥器中室温放置。稳定性试验结果见表7。表7稳定性试验结果由表7中的试验结果表明,本发明制备的硫酸坦度螺酮无定型和晶型I,在高温、高湿、光照的条件下,纯度均无明显变化。由此可见,本发明提供的硫酸坦度螺酮无定型和晶型I不仅纯度高,而且质量稳定可控,适合药物制剂的制造和长期储存。试验例3:生物利用度试验试验组1:本发明实施例1制备得到的无定型硫酸坦度螺酮;试验组2:本发明实施例7制备得到的硫酸坦度螺酮晶型I;对照组:参照现有文献(CN101880274A实施例7)公开方法制备得到的枸橼酸坦度螺酮。将18只健康雄性SD大鼠随机分为3组,每组6只,每组分别口服给予相当于10mg/kg(按坦度螺酮碱计)剂量的硫酸坦度螺酮晶型I、无定型硫酸坦度螺酮、对照组枸橼酸坦度螺酮。将受试样品在给药前配置成1mg/mL浓度的水溶液。大鼠在给药前禁食12小时,并于给药4小时后恢复进食。给药前取空白血,并于给药后的0.25、0.5、1、1.5、2、4、6、8、10和24小时预设时间间隔眼缘取血0.5mL置于含肝素的离心管中,以4000转/min离心10min分离血浆,取上清液,测定血浆中坦度螺酮的浓度,计算出药代动力学参数,结果见表8。表8药动学参数比较结果受试对象AUC(ng·h/mL)T1/2(h)Tmax(h)Cmax(ng/mL)无定型硫酸坦度螺酮148.7±35.61.2±0.10.9±0.132.9±19.3硫酸坦度螺酮晶型I136.8±33.21.2±0.10.9±0.127.2±18.5枸橼酸坦度螺酮45.1±12.21.4±0.11.3±0.15.6±1.4由表8中的试验结果显示:与现有产品枸橼酸坦度螺酮相比较,无定型硫酸坦度螺酮的达峰时间(Tmax)缩短了30%,峰浓度(Cmax)提高了近6倍,平均血药浓度-时间曲线下面积(AUC)值提高了约3.3倍;硫酸坦度螺酮晶型I的达峰时间(Tmax)缩短了30%,峰浓度(Cmax)增加了约5倍,平均血药浓度-时间曲线下面积(AUC)值提高了超过3倍。可见,本发明的硫酸坦度螺酮无定型和晶型I的Tmax值明显缩短,Cmax和AUC值显著增加,说明本发明硫酸坦度螺酮无定型和晶型I比枸橼酸坦度螺酮起效时间更快,能更迅速的发挥作用;而且具有更高的生物利用度,能更好的发挥药用效果。综上所述,与现有产品枸橼酸坦度螺酮相比,本发明提供的硫酸坦度螺酮化合物,即无定型硫酸坦度螺酮和硫酸坦度螺酮晶型I,其性质稳定,水溶性良好,生物利用度显著提高,为提高药物的有效性和安全性提供了一种有效的解决途径;另外,本发明化合物的制备工艺简单,收率高,适用于工业化生产。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 含氮的稠环化合物以及使用其的有机发光器件的制造方法与工艺
- (杂)芳基1,3‑偶极化合物与(杂)环炔的环加成方法与制造工艺
- 一种具抗肿瘤活性的岩白菜素氮杂肉桂酸酯类化合物及其合成方法与制造工艺
- 一种含有氮杂环的化合物及其有机电致发光器件的制造方法与工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺
- 氮杂环类化合物及其应用的制造方法与工艺
- 含唑杂环的嘧啶类化合物,组合物及其用途的制造方法与工艺
- 一种具有抗肿瘤活性的高乌甲素氮杂肉桂酸杂合体及其合成方法与制造工艺
- 一种氮杂芳烃苄位与缺电子芳环偶联的方法与制造工艺
- 一种含氮杂环衍生物及使用该含氮杂环衍生物的有机发光器件的制造方法与工艺