一种基于RNAi后雄性不育对褐飞虱种群控制效果的饲养和评价方法与流程
本发明涉及我国水稻重要害虫褐飞虱的室内RNAi人工饲养技术和定量评价其控制效果的方法。
背景技术:
褐飞虱Nilaparvata lugens属半翅目,飞虱科,是一种季节性、迁飞性、r-对策、暴发性害虫,在亚洲分布广泛,南亚、东南亚、东亚、南太平洋岛屿及澳大利亚均有分布,西起巴基斯坦东至日本和东南亚的一些群岛、密克罗尼西亚和巴布亚新几内亚也均有分布。褐飞虱为单食性害虫,只能在水稻上和普通的野生稻上取食和繁殖后代。自20世纪60年代以来,由于水稻矮秆品种的推广、大量使用N肥及其它栽培措施的改变、化学杀虫剂的密集使用等因素,促使褐飞虱频频暴发成灾,严重威胁着粮食生产安全。在水稻种植区,农民普遍用各种杀虫剂(有机磷类,氨基甲酸酯,新烟碱类化合物)防治褐飞虱种群,化学防治也是一直作为防治褐飞虱最有效途径。长时间以来,为防治各种水稻害虫多种杀虫剂交替使用,导致靶标害虫产生抗药性和非靶标害虫刺激生殖。褐飞虱是一种典型的杀虫剂诱导型再猖獗型害虫。因此,防治褐飞虱再猖獗的新方法和新途径是目前十分迫切需要解的问题。
RNAi技术是通过降解靶基因的mRNA或mRNA的3’末端的非转录片段结合而阻止基因的表达使特异性基因发生沉默的一种高度保守基因调控机制。由于RNAi具有靶标特异性、高效性、持久性、快捷性等优点,现已广泛用于多种生物的基因功能的研究中。在害虫防治领域,RNAi技术作来一种新型的害虫防治策略近几年已被人们逐渐接受,并在实验室条件下成功应用于鳞翅目、鞘翅目、半翅目等害虫。在RNAi研究中,合适的靶基因和适当的导入方法是其成功的关键。在昆虫学研究中,现主要采用微量注射法(广泛用于一些鳞翅目昆虫)、饲喂法(体型较小的刺吸式口器昆虫)和转基因植物法。基于这些原因,只要找到合适的PHF靶基因,然后利用RNAi技术就能够很好的控制害虫种群的增长。利用RNAi技术既不会使害虫产生抗药性,也不会刺激害虫再猖獗,又能减少农药的使用和维护生态平衡,提高农作物产品安全。此外,我们研究的主要区别在于从雄性不育角度研究对害虫种群长的控制效果进行评价,并且通过这些重要的生殖参数指标可以作为评价控制褐飞虱种群增长的定量指标。
技术实现要素:
本发明的目的是提供褐飞虱室内RNAi人工饲养技术和定量评价控制效果的方法。
为达到上述目的,本发明提供的技术方案是:
一种基于RNAi后雄性不育对褐飞虱种群控制效果的饲养和评价方法,利用RNAi技术控制雄虫不育,然后再利用不育的雄虫与雌虫交配后检测其雄虫或雌虫的生殖参数来定量评估褐飞虱种群增长的控制效果,饲养方法包括如下步骤:
(1)dsRNA引物设计:根据已知的NlPHF7基因(NLU00303)序列设计引物,采用引物设计软件设计特异性物;对每条引物进行评价和修改,以避免在引物内或引物间二聚体以及引物错配位点的出现等,最终设计出dsPHF7双链引物;
(2)褐飞虱雄虫RNA的提取和cDNA合成:采用试剂盒提取褐飞虱雄虫总RNA,然后合成cDNA;
(3)dsPHF7合成:采用试剂盒合成dsPHF7后,通过紫外吸收光谱法定量测定纯化的dsPHF7浓度,并用琼脂糖凝胶电泳检测以确保其完整性;
(4)褐飞虱种群室内RNAi的饲养:褐飞虱3龄若虫用人工饲料进行饲养,用玻璃双通管作为饲养室,两侧开口用Parafilm膜封住,加40μL含有浓度为0.05μg/mL的dsPHF7的液态人工饲料,再用Parafilm膜将饲料封住。
饲养方法步骤(4)中,每个玻璃双通管释放30头褐飞虱若虫;每两天换一次新鲜的人工饲料。
饲养方法步骤(4)中,玻璃双通管放置于生物培养箱,用黑色棉布包裹,利用昆虫的趋光性使其到玻璃双通管两端,取食两侧封口膜间的饲料。
所述的基于RNAi后雄性不育对褐飞虱种群控制效果的饲养和评价方法:评价方法包括如下步骤:
(1)褐飞虱3龄若虫RNAi饲养至5龄末期后,将其吸出放置于放有同样分蘖期水稻茎杆的玻璃杯中,进行饲养至刚羽化成成虫,然后将刚羽化的成虫进行一雌一雄进行配对,放置新鲜分蘖期的水稻稻茎干进行产卵实验;
(2)每隔2天换一次水稻茎干,然后在显微镜下解剖计算其每次的产卵量,在整个过程记录雌虫产卵前期、产卵期、寿命和产卵总数及雄虫的寿命指标;每个处理组指标和对照组指标至少20个生物学重复;
(3)对羽化后1天、3天和5天的雄虫进行生殖参数指标的测定,对交配后2天和3天的雌虫进行生殖参数指标的测定,然后解剖雌、雄虫内生殖器系统,观察其内生殖系统是否畸形;
(4)处理组的雌雄虫的生殖参数及雌虫的产卵量与对照组相比,能够准确的评价雄性不育对控制对褐飞虱种群的控制效果。
其中,羽化后1天、3天和5天的雄虫的行生殖参数指标包括精氨酸和附腺蛋白含量;交配后2天和3天的雌虫的生殖参数指标包括产卵量、脂肪体和卵巢内蛋白质及Nlvg表达水平。
有益效果:
本发明提供了一种褐飞虱室内RNAi人工饲养技术和褐飞虱种群定量评价控制效果的方法。在褐飞虱室内RNAi人工饲养方面,主要目的是利用RNAi技术沉默雄虫生殖基因NlPHF7,根据NlPHF7基因(NLU00303)设计特异性dsRNA双链引物(引物如表1所示),再利用T7 RiboMax RNAi System(Progema,Madism,WI,USA)合成纯化的dsRNA双链(图1),纯化的dsPHF7双链(终浓度为0.05μg/mL)后加入人工饲料中,然后将褐飞虱3龄若虫进行RNAi室内饲养。
褐飞虱种群定量评价其控制效果的方法,主要在于RNAi技术沉默褐飞虱雄虫目标基因后,待褐飞虱刚羽化成虫后,雌、雄成虫分别交配或单独饲养,然后测定雌、雄虫生殖参数,通过处理组与对照组雄虫的附腺蛋白含量和精氨酸含量、雌虫的产卵量和Nlvg基因的表达倍数等生殖参数比较,能够很好的评价雄性不育对褐飞虱的控制效果,并且这些重要生殖参数可以作为褐飞虱种群增长与否的衡量指标,为褐飞虱的防治提供了新途径和新方法。
附图说明
图1:发明利用NlPHF7基因设计特异性引物合成dsPHF7电泳检测图谱。(图中:1.正义ssRNA;2.反义ssRNA;3.双链dsPHF7)。
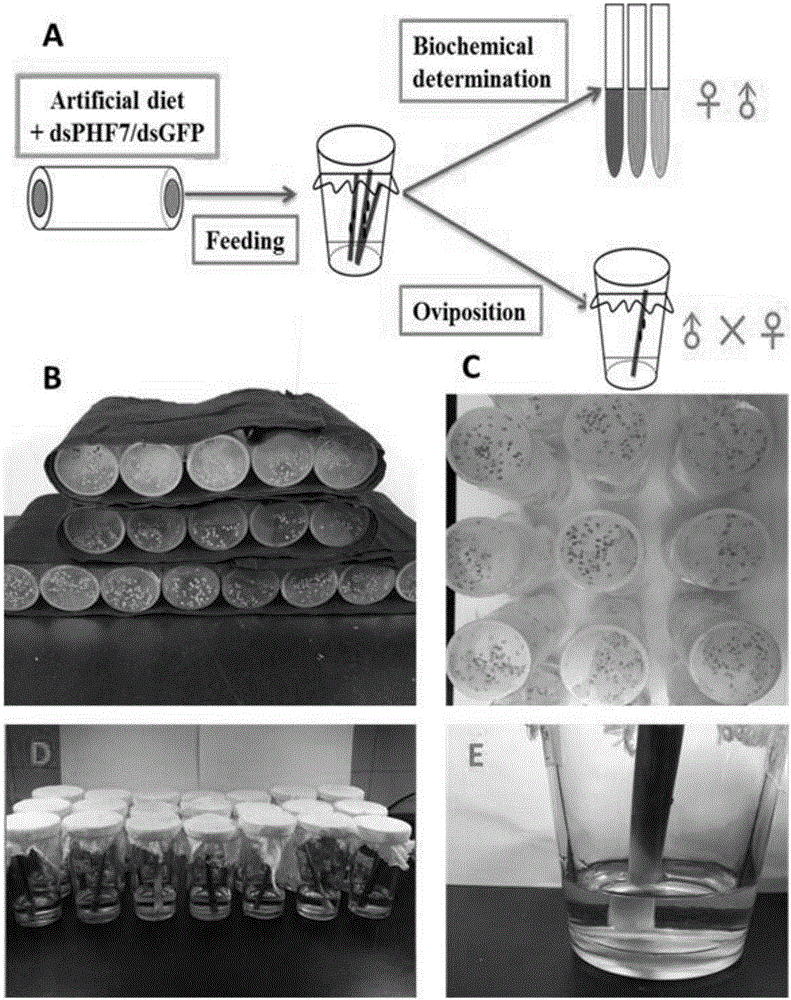
图2:利用本发明合成纯化的褐飞虱dsPHF7室内RNAi饲养及雌雄虫交配流程图。(图中:A.褐飞虱RNAi室内饲养及种群控制效果示意图;B.褐飞虱RNAi室内饲养;C.褐飞虱取食dsRAN+人工饲料;D.刚羽化的雌雄虫交配;E.单雄单雌交配)。
图3:利用本发RNAi饲喂的雄虫与雌虫交配后的雌雄虫内生殖器比较图。(图中:A.雌虫卵巢(对照);B.dsGFP处理的雌虫卵巢(阴性对照);C.dsNlPHF7处理的雌虫卵巢;D.雄虫内生殖器(对照);E.dsGFP处理雄虫内生殖器(阴性对照);F.dsNlPHF7处理的雄虫内生殖器)。
具体实施方式
下面结合具体实施例对本发明作进一步说明。
1.dsRNA引物设计
根据已知的NlPHF7基因(NlU00303)序列设计引物。根据引物设计原则及注意事项,尽量在特异区域进行引物的设计,使用Primer primer 5.0、Oligo 6.71和Primer 3.0online引物设计软件设计特异性物,再用Oligo 6.71引物设计软件对每条引物进行评价和修改,以避免在引物内或引物间二聚体以及引物错配位点的出现等,最终设计出dsPHF7双链引物(表1)
2.褐飞虱雄虫RNA的提取和cDNA合成
本实验采用美国Progega公司SV total isolation system Kit(Promega,Corporation,Madison,WI,USA)试剂盒提取褐飞虱雄虫总RNA。该方法操作简单、快速、高效且无毒,提取的RNA符合本研究要求,具体步骤如下:
1)将5头羽化后2天的褐飞虱雄虫置于1.5mL离心管中,加入175μL RNA Lysis到离心管中研磨匀浆,加入350μL的RNA Dilution Buffer(蓝色),颠倒3-4次混合。70℃水浴3min;
2)12,000×g离心10min,上清液移至新的1.5mL离心管中;
3)加入95%乙醇200μL,用移液枪混匀3-4次,转移至离心柱装配体中,12,000×g离心1min;
4)弃去收集管中的液体,回收收集管,加入600μL RNA Wash Solution,12,000×g离心1min;
5)弃去收集管中的液体,向离心柱内膜加入40μL Yellow Core Buffer和5μL 0.09M Mncl2及5μL DNase I的孵育混合物(现配);
6)室温(25℃)环境下孵育15min,然后加入200μL DNAase Stop Solution,12,000×g离心1min;
7)然后直接加入600μL RNA Wash Solution,12,000×g离心1min;
8)弃去液体,向离心柱内加250μL RNA Wash Solution,12,000×g离心2min;
9)将离心柱移至到洗脱管上进行洗脱,向柱中央加入40μL Nuclease-free water,覆于膜表面,静置1min后,12,000×g离心1min,使用前放置-80℃保存。
根据第一链cDNA试剂盒PrimeScriptTM 1st stand cDNA synthesis Kit(TaKaRa Biotechnology(Dalian)Co.,Ltd)合成cDNA。
3.dsPHF7合成
双链dsPHF7合成是根据T7 RiboMAXTM Express RNAi System(Progema Corporation,Madison,WI,USA)试剂盒。具体步骤如下:
1)正义ssRNA(单链)合成,反应体系如下:
2)反义ssRNA(单链)合成,反应体系如下
PCR反应条件为:94℃预变性5min,94℃变性40S,55℃(Tm)退火40S,72℃延伸1min,共30个循环,最后72℃延伸10min。
根据PCR反应条件合成的ssRNA进一步合成dsRNA
上述试剂混匀后37℃水浴4h。然后分别将上述合成的正义链ssRNA和反义ssRNA各20μL混合后进行退火反应,70℃孵育10min,然后冷却至室温约20min,总反应体积为40μL。再加放2μL didution RNAase A solution(1:200)和2μL RNase-free DNase加入到转录反应混合液的离心管中,37℃水浴30min,再加放110μL 95%乙醇和4.4μL 3M醋酸钠(pH5.2),12,000×g离心1min,再用用0.5mL 70%乙醇洗涤沉淀,然后室温干燥,用50μL Nuclear-free water溶解。紫外吸收光谱法定量测定纯化的dsPHF7(260nm)浓度,并用琼脂糖凝胶电泳检测以确保其完整性。
4.褐飞虱种群室内RNAi的饲养
褐飞虱3龄若虫用人工饲料进行饲养,用玻璃双通管(15×2.5cm)作为饲养室,两侧开口用Parafilm膜封住加含有dsPHF7(设计dsRNA,最终浓度为0.05ng/mL)的液态人工饲料(40μL),再用一层Parafilm膜将饲料封住。每个玻璃双通管释放30头褐飞虱若虫。玻璃管放置于生物培养箱(浙江宁波江南仪器有限公司)(温度:26±2℃;湿度为75-80%;光照为16L:8D),用黑色棉布包裹(图2),利用昆虫的趋光性使其到玻璃管两端,取食两侧封口膜间的饲料。每两天换一次新鲜的人工饲料。
5.褐飞虱种群增长控制效果的定量评价方法
褐飞虱3龄若虫RNAi饲养至5龄末期(大约8~10天)后,将其吸出放置于放有同样分蘖期水稻茎杆的玻璃杯(高12cm,口径10cm)中进行饲养至刚羽化成成虫,然后将刚羽化的成虫进行一雌一雄进行配对放置新鲜分蘖期的水稻稻茎干进行产卵实验。每隔2天换一次水稻茎干,然后在显微镜下解剖计算其每次的产卵量,整个过程可以记录雌虫产卵前期、产卵期、寿命和产卵总数及雄虫的寿命等指标。每个处理和对照至少20个生物学重复。对羽化后1天、3天和5天的雄虫进行生殖参数指标(精氨酸和附腺蛋白含量)的测定,交配后2天和3天的雌虫进行生殖参数指标(产卵量、脂肪体和卵巢内蛋白质及Nlvg表达水平)的测定,然后解剖雌、雄虫内生殖器系统,观察其内生殖系统是否畸形(图3)。处理组的雌雄虫的生殖参数及雌虫的产卵量与对照相比,能够准确的评价雄性不育对控制对褐飞虱种群的控制效果。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!