一种对氯甲苯连续氧化制备对氯苯甲醛的方法与流程
本发明属于有机合成工艺技术领域,涉及一种在液相反应条件下由对氯甲苯连续氧化制备对氯苯甲醛的方法,更具体说是以对氯甲苯为底物,双氧水为氧化剂,钴、钼、溴的一种或几种金属离子络合物为催化剂,一元羧酸为溶剂,在具有不同微结构的管式反应器中连续制备对氯苯甲醛产品。
背景技术:
对氯苯甲醛是一种重要的化工中间体,在医药、农药、染料等方面都有着非常重要的应用价值,广泛应用于合成除草剂、植物生长调节剂等农药产品以及芬那露、氯苯氨络酸等药物。此外对氯苯甲醛还被应用于合成酸性蓝7BF、酸性艳蓝6B等燃料和合成感光材料的中间体。
传统的对氯苯甲醛的工业生产方法主要包括以下三种:对氯甲苯的甲基双氯化水解法、对氯甲苯的氯化氧化法和对氯甲苯直接氧化法,其中对氯甲苯的氯化氧化法就是利用对氯甲苯氯化得到的对氯氯化苄水解制备。传统的方法存在着氯化深度难以控制、严重的环境污染以及工艺繁琐复杂等问题,并且随着人们对环境污染的重视,科研工作者逐渐将视点转向绿色化学方面。以双氧水、氧气、空气为氧化剂实现对氯甲苯的氧化得到对氯苯甲醛。
A.P.Singh等(Applied Catalysis A:General 143,1996,111-124)以双氧水为氧化剂,乙腈为溶剂,V-Si分子筛为催化剂,在高压条件下实现了对氯甲苯的氧化,得到了对氯苯甲醛。该方法对氯甲苯的转化率只有13.4%,对氯苯甲醛的选择性为64.0%,对氯苯甲醛的收率仅为8.6%,其反应时间长达12小时;同时还产生其它的副产物。该方法的缺点是转化率低,反应条件苛刻以及反应时间长。
中国专利CN1724500,王家强等以双氧水为氧化剂,乙酸为溶剂,采用介孔材料为非均相催化剂,在常压低温的条件下实现对氯甲苯的氧化,得到了对氯苯甲醛。对氯甲苯的转化率为50%,对氯苯甲醛的选择性为99%。该方法的优点是转化率和选择性都很高;缺点是催化剂制备难度大,氧化剂为双氧水,反应时间长,一般需要10小时,使得成本很高。
户安军(An-Jun Hu)(Catalysis Communications 8,2007,1279-1283)等以氧气为氧化剂,以乙酸-水混合物为溶剂,以钴盐、锰盐为催化剂,常压、低温条件下反应10h得到了对氯苯甲醛。对氯甲苯的转化率为33.7%,对氯苯甲醛的选择性为66.6%,对氯苯甲醛的收率为22.4%。该方法的优点是成本低、工艺简单;缺点是反应时间长、催化剂不能重复利用、转化率较低。综上所述,现有的技术存在高成本、高能耗、工艺复杂、对氯苯甲醛选择性低等诸多缺点。
以上所述方法从不同的角度对对氯甲苯氧化制备对氯苯甲醛进行优化和改进,但仍存在一些问题需要解决:首先在规模化生产上仍主要采用间歇釜批次生产;其次在上述方法中仍存在传质传热效果差,氧化剂利用率低等缺点,这也是造成在上述过程中氧化剂的使用量较大,副反应增多,目标产物选择性、产率低的主要原因;另外在上述间歇生产方法中,双氧水的分解速率较快,容易引发安全事故,这也是双氧水氧化没有大规模应用的受限制原因。而利用特定结构的连续流管式反应器进行对氯甲苯的连续氧化合成对氯苯甲醛,可多方面解决现有工艺技术的诸多不足。
管式反应器是具有微结构的小型反应器的统称,与常规反应器相比,管式反应器具有体积小,比表面积大,易放大,过程连续,快速混合效果好,传热效果好,耐高温高压等特点,采用特定结构的连续流管式反应器可对反应物料的混合以及传质、传热过程进行有效控制。通过对管道结构和尺寸的设计可有效增加反应物间的接触面积增强其传质传热效果,提高了氧化剂的利用率,降低了氧化剂的使用量并避免了助催化剂的使用,同时解决了反应过程中因局部过热而产生的“飞温”现象。通过对管式反应器的长度及反应停留时间的控制,可进一步使原料和产物的分布更加优化可控;通过调节原料泵的流速可实现底物对氯对氯甲苯与氧化剂按比例进入管式反应器进行反应大大减少了返混,进一步减少了副反应的发生,氧化剂的稳定性及目标产物的选择性也大幅提高;通过在管式反应器中设置压力安全阀,可以及时排放出反应器中的过量氧化剂,保证反应的安全进行,将危险率降至最低。本发明采用特定结构的管式反应器进行对氯甲苯连续氧化制备对氯苯甲醛的方法相对于传统间歇式生产方法具有无可比拟的优势,而且可为其工业化连续生产的改进提供一条重要的途径。
技术实现要素:
本发明针对以上存在的不足,提供了一种在管式反应器中将对氯甲苯连续氧化制备对氯苯甲醛的方法。本方法反应时间短,生产效率高,传质、传热得到大大优化,反应过程更加稳定可控。本发明更进一步的目的在于,通过本发明的工艺方法,实现对氯甲苯连续氧化的稳定可控,降低副产物的生成。通过传质传热过程的强化和工艺优化提高反应物料的有效利用率,进一步降低氧化剂及催化剂的使用量而且在反应过程中避免了助催化剂的使用,从而有效节约生产成本进而改进现有的工业化生产方法。
为实现上述目的,本发明采用的技术方案为:
一种采用特殊结构的管式反应器将对氯甲苯连续氧化制备对氯苯甲醛的方法,按照下述步骤进行:
(1)首先在室温下,将底物对氯甲苯和部分羧酸溶剂以体积比1:1搅拌混合均匀,将氧化剂和部分羧酸溶剂以体积比1:1混合均匀,然后将金属络合物混合倒入对氯甲苯-羧酸溶液,将钠盐倒入双氧水-羧酸溶液中;通过所需的反应时间,计算得出两种物料的不同流速,分别经计量泵连续打入管式反应器中经预热混合后进入反应区进行反应,反应温度由外部循环换热系统进行控制;
(2)通过调节流速及计重的方法控制反应物料的摩尔比,通过改变管式反应器的管道内径0.5~15mm,体积25~750ml来控制物料混合反应的停留时间60~1800s;在反应完成后,产物从反应器末端流出进入收集罐,产物精馏分离,未反应的对氯甲苯循环反应,产物对氯苯甲醛精馏纯化后收集,其中目标产物对氯苯甲醛的收率可达30%~50%。
其中所述的催化剂为钴、钼、溴一种或几种金属络合物催化剂,其主要包括:乙酸钴、草酸钴、碳酸钴、环烷酸钴、钼酸钠、钼酸铵、溴化钠、溴化铵等,其中以油溶性催化剂为主,能在对氯甲苯中充分溶解,其用量与底物对氯甲苯的摩尔比在(0.008~0.08)∶1,其中优选摩尔比为(0.01~0.05)∶1。
其中所述的氧化剂为双氧水,其溶液浓度以质量浓度计为5%~50%,优选浓度为15%~30%。双氧水与底物对氯甲苯的优选摩尔比为(1.0~5.0)∶1。
其中所述的双氧水,在管式反应器中,当双氧水通过反应器体积50ml时,双氧水的开始迅速分解,释放大量分子氧,当其通过100ml时,几乎为分子氧形式,此时应在100ml反应体积处额外补充等浓度的双氧水进入,再次参与反应。
其中所述的羧酸溶剂包括:甲酸、乙酸、丙酸、丁酸、己酸、辛酸等。其中溶剂与对氯甲苯的体积比在(1~10)∶1。
其中所述的反应温度为60~110℃,优选反应温度为90~105℃,反应停留时间为60s~1800s。
进一步的技术方案中,在反应完成后先用二氯甲烷钠淬灭未参与反应的氧化剂,然后通过有机溶剂萃取,蒸馏分离纯化后得目标产物。
上述技术方案中,所述的反应系统包括原料储罐、反应区、产物收集区等不同功能区域。反应器通道结构包括:圆管直流型通道结构、圆饼式脉冲变径型矩形扁管道结构、斜方饼式脉冲变径型矩形扁管道结构、增强混合型圆饼式矩形扁管道结构以及Corning的Heart Cell通道结构。
本发明具有以下优点:
1、本发明采用一种连续化的生产方式,反应时间短,反应条件温和,过程安全可控,生产效率高。
2、本发明通过采用不同结构造的管式反应器,可实现对反应过程的有效控制,使反应产物停留在醛醇一步。
3、通过对反应过程中传质、传热的强化大幅提高了其反应速率及原料的利用率,并有效降低了氧化剂及催化剂的使用量,而且避免了助催化剂的使用,使生产成本得到有效节约。
4、本发明操作简便,适用范围广,生产灵活,可通过反应装置的并联扩大生产规模。
附图说明
图1为本发明对氯甲苯连续氧化制备对氯苯甲醛的工艺流程图。
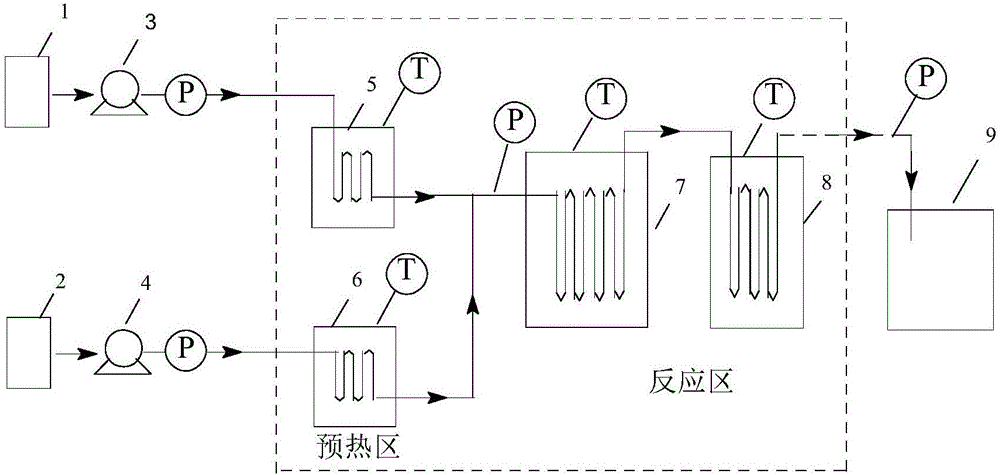
图2 为本发明所使用的连续流管式反应器装置图:1、2-原料罐,3、4-原料计量泵,5-预热区,6、7-反应区,8-产物淬灭收集区。
图3 为本发明所使用的管式反应器通道结构示意图,其中a-直流型通道结构,b-圆饼式脉冲变径型矩形扁管道,c-斜方饼式脉冲变径型矩形扁管道,d-增强混合型圆饼式扁管道,e-Corning的Heart Cell结构微通道。
具体实施方式
将乙酸钴和钼酸钠溶于装有对氯甲苯和乙酸的1#罐中,通过3#泵送入5#预热反应器中,预热反应器加热到50℃;将溴化钠溶于装有双氧水和乙酸的2#罐中,通过4#泵送入6#预热反应器中,预热反应器加热到50℃,接着将两股预热物料,输送至7#、8#反应器中,反应器温度设定在反应所需温度,产物通过8#反应器中流出,采用0℃冷却,收集所得产物。
下面结合实施例详细说明本发明,但下面的实施例仅为本发明较佳的实施方式,本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替代或改变,都应涵盖在本发明的保护范围之内。
实施例1
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3b)直流型通道+圆饼式脉冲变径型矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将3.03g乙酸钴和3.03g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.0075:1,将3.03g溴化钠溶解于15%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.0075:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以8.33ml/min和16.67ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度60℃,停留时间60s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为50.3%,对氯苯甲醛收率为32.1%。
实施例2
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3c)直流型通道+斜方饼式脉冲变径型矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于15%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以8.33ml/min和16.67ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度95℃,停留时间200s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为75.8%,对氯苯甲醛收率为41.7%。
实施例3
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3d)直流型通道+增强混合型圆饼式矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于15%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以8.33ml/min和16.67ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度105℃,停留时间600s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为66.8%,对氯苯甲醛收率为30.2%。
实施例4
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3b)直流型通道+圆饼式脉冲变径型矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于25%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以8.33ml/min和16.67ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度105℃,停留时间600s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为74.5%,对氯苯甲醛收率为45.1%。
实施例5
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3c)直流型通道+斜方饼式脉冲变径型矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于25%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以8.33ml/min和16.67ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度105℃,停留时间600s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为42.7%,对氯苯甲醛收率为35.1%。
实施例6
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3d)直流型通道+增强混合型圆饼式矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于25%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以5.56ml/min和11.11ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度105℃,停留时间900s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为43.7%,对氯苯甲醛收率为38.0%。
实施例7
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3e)直流型通道+Corningde Heart Cell结构,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于25%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以5.56ml/min和11.11ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度90℃,停留时间1200s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为56.8%,对氯苯甲醛收率为35.0%。
实施例8
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3d)直流型通道+增强混合型圆饼式矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于25%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以5.56ml/min和11.11ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度100℃,停留时间1500s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为47.9%,对氯苯甲醛收率为36.1%。
实施例9
(1)装置:参照图2确定管式反应器的连接方式,管道类型为:(3a+3c)直流型通道+斜方饼式脉冲变径型矩形扁管道,管道内径与体积根据流速与反应停留时间确定,换热介质为导热油。
(2)分别将6.06g乙酸钴和6.06g钼酸钠溶解于200ml对氯甲苯及200ml乙酸形成混合溶液,此时n(乙酸钴):n(对氯甲苯)=0.015:1,将6.06g溴化钠溶解于25%H2O2形成H2O2-乙酸溶液,此时n(溴化钠):n(对氯甲苯)=0.015:1,对氯甲苯-乙酸溶液与和H2O2-乙酸溶液分别以5.56ml/min和11.11ml/min的流速通过恒流泵注入持续换热的管式反应器中,此时n(H2O2):n(对氯甲苯)=2:1,采用图2微通道反应器,控制反应温度110℃,停留时间1800s。出口物料0℃冷却,反应液用二氯甲烷淬灭。经过GC分析,对氯甲苯转化率为78.1%,对氯苯甲醛收率为48.2%。
- 还没有人留言评论。精彩留言会获得点赞!