一种新型芘基查尔酮类衍生物及其合成方法与流程
本发明属于有机合成技术领域,具体涉及一种新型芘基查尔酮类衍生物及其合成方法。
背景技术:
据报道,查尔酮是一类交叉共轭非线性光学发色体,表现出良好的SHG效率和透明度且很容易结晶。芘具有较大的π共轭体系,其衍生物表现出良好的三阶非线性光学效应。Anthoni Praveen Menezes等人报道,取代的吡啶查尔酮衍生物非线性光学行为的电荷转移具有指向性作用,表现出良好的分子超极化率。C. S. Chidan Kumar等人报道了一种中心对称的有机晶体1-(3,4-二甲氧基苯基)-3-(2-氟苯基)丙烯酮,采用开孔Z-扫描技术测定了它的三阶非线性光学吸收和光限幅实验,发现处于苯环上对位与间位的二个甲氧基作为给体(D)起作用而处于另一苯环上邻位的氟原子作为受体(A)起作用,电荷转移发生从给体端到受体端,并且来自苯环对位的给体基团电荷转移效应比间位的更有效。Chen Jingwei等人报道,一种新颖查尔酮衍生物(2E)-1-(2, 4-二氯-5-氟苯基)-3-(4-二甲氨基苯基)丙烯酮分别以1, 2-二氯乙烷溶液和掺杂聚甲基丙烯酸甲酯薄膜方式测定了它的三阶非线性光学性质呈自聚焦效应,掺杂薄膜的非线性折射率随着掺杂样品浓度的增加而增加,三阶非线性折射率n2和三阶非线性极化率c(3)分别为10-15 m2/w量级和10-9esu量级,并且比溶液状态下的值更大。A. N. Prabhu等人报道,一种新的潜在有用的非线性光学有机材料1-(5-氯噻吩-2-基)-3-(2,3-二甲氧基苯基)-2-丙烯-1-酮是一个π共轭有机非线性光学查尔酮衍生物;在波长为532nm时,采用Z-扫描技术纳秒激光脉冲测定了该化合物的实部和虚部的c(3)、非线性吸收系数和非线性折射率;结果显示,非线性折射率为10-11 m2 /W量级,三阶非线性极化率为10-13esu量级;在532nm该化合物显示出良好的光限幅行为,并且发现最好的光限幅行为是基于它的强电子给予体作用。K. Mani Rahulan等人报道了3-(4-(二甲氨基)苯基)-1-(4-(4-羟甲基-1H-1, 2, 3-三唑-1-基)苯基)-2-丙烯-1-酮的合成,研究了该有机物的三阶非线性光学性质,发现在氯仿中的非线性吸收行为随激光强度的不同呈现出明显的差异;一个有趣的现象是随着激光强度的增加,该化合物的非线性吸收从饱和吸收(SA)转换成反饱和吸收(RSA);研究表明,该化合物作为光学器件具有潜在的应用价值。孙金鱼等人报道了终端带有共轭作用基团的芘基查尔酮衍生物,采用开孔Z-扫描技术测定了该化合物的三阶非线性光学性质,发现该有机物有良好的三阶非线性光学性质,表现出有较大的极化率,三阶非线性极化率(c(3))可达10-11esu量级。石玉芳等人新近报道了1-(芘-1-基)-3-(4-甲氧基苯基)丙烯酮的合成,采用4f相位相干成像技术测定了它的三阶非线性光学性质,研究发现该化合物有较强的非线性吸收(β = 2.53×10-9 m/W),端基甲氧基的推电子作用使之三阶非线性极化率(c(3))可达10-10esu量级。
甲基芳基酮与芳香醛一般在碱性条件下能够发生缩合反应,生成查尔酮:
结果是两个芳香体系通过碳碳双键的建立而联在一起,形成更大的共轭体系;这种大共轭体系的化合物易于受到光的作用,在强激光作用下产生非线性光学效应。但是,3-吡啶甲醛和4-吡啶甲醛分别与1-乙酰基芘在上述条件下作用并不能得到预期的缩合产物查尔酮,即使在酸性条件下也未能获得预期产物;而2-吡啶甲醛则可以顺利获得相应产物。
技术实现要素:
本发明为了解决现有技术中3-吡啶甲醛和4-吡啶甲醛分别与1-乙酰基芘在碱性或酸性条件下都无法反应得到含有芘基与吡啶基的查尔酮的问题,提供一种新型芘基查尔酮类衍生物及其合成方法。
本发明采用如下技术方案:
一种新型芘基查尔酮类衍生物,其名称分别为:1-(芘-1-基)-3-(吡啶-3-基)丙烯酮和1-(芘-1-基)-3-(吡啶-4-基)丙烯酮,为芳香大π共轭体系分子,其结构式分别为式Ⅰ和式Ⅱ:
式Ⅰ,式Ⅱ。
所述新型芘基查尔酮类衍生物的合成方法,包括如下步骤:
(1)1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g 1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL3-吡啶甲醛和催化剂,40~60°C搅拌反应4~6h,有黄色固体析出,期间TLC跟踪反应,至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.27-0.29g,经柱层析分离得纯品0.25-0.27g,产率79-81%,熔点132-133℃;
(2)1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g 1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL 4-吡啶甲醛和醋酸钠,40~60°C搅拌反应4~6h,有黄色固体析出,期间TLC跟踪反应,至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.25-0.27g,经柱层析分离得纯品0.24-0.26g,产率77-79%,熔点108-109℃。
所述催化剂为醋酸钠,添加量为其余反应物摩尔质量的5~10%。
所述TLC用的展开剂为V乙酸乙酯:V石油醚=1:7。
所述柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7。
为说明本发明的新型芘基查尔酮类衍生物的结构,对两种化合物分别采用IR、1H NMR、13C NMR、LCMS进行了结构表征;并测定了紫外光谱、荧光光谱和光学非线性吸收性能。
分别将本发明的两种化合物配制成浓度为1×10-5mol/L的二氯甲烷溶液,测定它们的紫外吸收光谱;
分别将本发明的两种化合物配制成浓度为1×10-6mol/L的二氯甲烷溶液,测定它们的荧光发射光谱;
测样条件:(1)色谱条件:两通进样,流 动 相:A相-水溶液;B相-甲醇,A:B=30:70,流速:0.4 mL/min,进样体积:5 μL;(2)质谱条件:离子源: ESI,负离子扫描,雾化气: 氮气 3.0 L/min,干燥气:氮气 15 L/min,碰撞气:氩气,脱溶剂管温度:400℃,加热模块温度250℃,扫描模式:Q3Scan,驻留时间:100 ms。在上述条件下测定本发明两种化合物的质谱;
非线性光学吸收测定:采用Z-扫描技术测定,激光器:Nd: YAG (激光脉冲21 ps,波长532 nm,实验重复频率10 Hz),数值拟合分别获得非线性光学吸收系数为β1= 1.4×10-13m/W和β2= 1.6×10-13 m/W。
1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的结构表征:
I.R.νmax/cm-1(KBr ):3129,1655(C=O),1616(C=C) ,1595(芳环);
1H NMR (600MHz, DMSO-d) δ/ppm:8.996(s, 1H),8.691~8.675(d, 1H, J=9.6Hz),8.637~8.629(d, 1H, J=4.8Hz), 8.544~8.531(d, 1H, J=7.8Hz),8.454~8.406(m, 3H),8.373~8.303(m, 4H), 8.188~8.163(t, 1H, J=7.5Hz), 7.953~7.926(d, 1H, J=16.2Hz), 7.744~7.717(d, 1H, J=16.2Hz), 7.513~7.492 (m, 1H);
13C NMR (150MHz, DMSO-d) δ/ppm:194.62, 151.65, 150.89, 142.14, 135.61, 133.55, 133.29, 131.16, 130.87, 130.55, 129.87, 129.74, 129.26, 129.17, 127.75, 127.54, 127.31, 126.98, 126.63, 124.94, 124.83, 124.50, 124.45, 124.01;
LCMS(ESI)m/z:found ([M+H]+):334.10;calcd. for C24H16NO([M+H]+): 334.1232。
红外光谱显示了1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的各官能团特征吸收峰;核磁共振氢谱显示氢原子的种类与个数与1-(芘-1-基)-3-(吡啶-3-基)丙烯酮所含相吻合,碳谱显示碳原子种类与分子中所含相一致;LCMS(ESI)显示实测值与计算值相差极小,相对误差0.069‰;综合各谱分析认为,合成的1-(芘-1-基)-3-(吡啶-3-基)丙烯酮结构正确。
1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的结构表征:
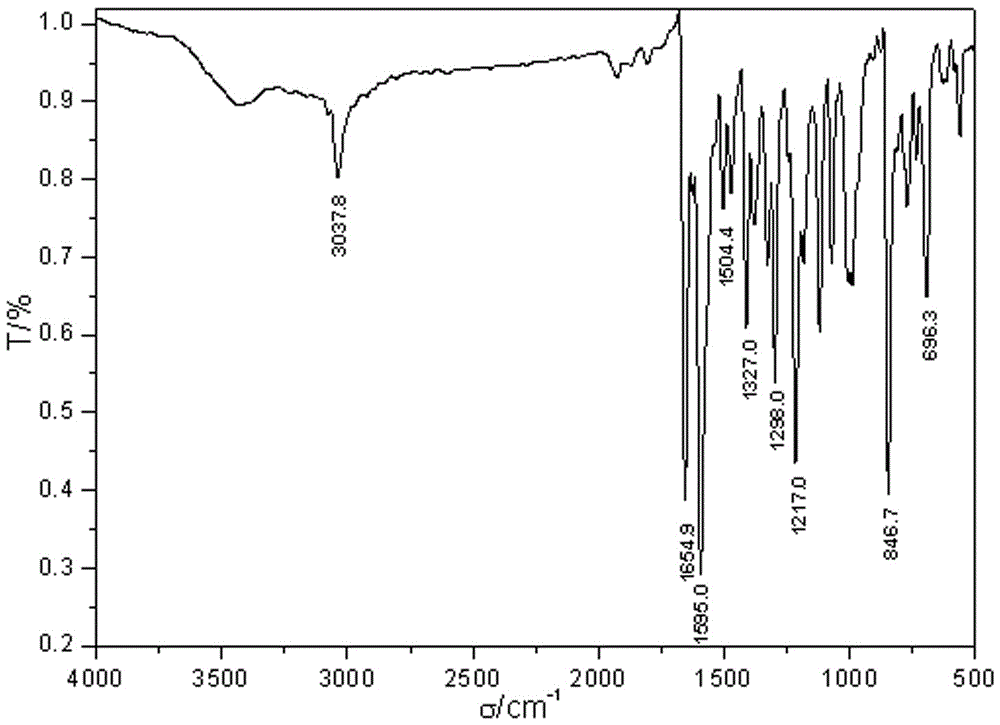
I.R.νmax/cm-1(KBr ):3036,657(C=O),1589(C=C),1501(芳环);
1HNMR(600MHz,DMSO-6)δ/ppm:7.663~7.636(d,1H,J=16.2Hz,环外稀氢),7.891~7.812(d,2H,J=4.2Hz),8.036~8.009(d,1H,J=16.2Hz,环外稀氢),8.182~8.156(t,1H,J=7.8Hz),8.308~8.293(d,1H,J=9.0Hz),8.367~8.353(d,2H,J=8.4Hz),8.445~8.402(m.3H),8.556~8.543(d,1H,J=7.8Hz),8.678~8.670(d,2H,J=8.4Hz),8.713~8.697(d,1H,J=9.6Hz);
13CNMR(150MHz,DMSO-d)δ/ppm:194.53,150.87,142.43,142.17,133.74,132.84,131.37,131.13,130.51,130.01,129.88,129.37,127.75,127.73,127.33,127.07,126.70,124.92,124.78,124.49,123.96,122.98;
LCMS(ESI)m/z :found([M+H]+):334.05;calcd.ForC24H16NO([M+H]+):334.1232。
红外光谱显示了1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的各官能团特征吸收峰;核磁共振氢谱显示氢原子的种类与个数与1-(芘-1-基)-3-(吡啶-4-基)丙烯酮所含相吻合,碳谱显示碳原子种类与分子中所含相一致;LCMS(ESI)显示实测值与计算值相差极小,相对误差0.22‰;综合各谱分析认为,合成的1-(芘-1-基)-3-(吡啶-4-基)丙烯酮结构正确。
本发明的有益效果如下:
1.通过使用复合催化剂体系,实现了3-吡啶甲醛和4-吡啶甲醛分别与1-乙酰基芘在碱性或酸性条件下反应得到含有芘基与吡啶基的查尔酮;
2.本发明的两个化合物具有较大的分子极化率,可用作非线性光学材料。
附图说明
图1为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的合成原理图;
图2为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的红外光谱图;
图3为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的1H NMR图;
图4为图3的局部放大的1H NMR图;
图5为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的13C NMR图;
图6 为 图5的局部放大的13C NMR图;
图7为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的LCMS图;
图8为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的UV谱图;
图9为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的荧光发射谱图;
图10为1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的光学非线性吸收图;(激光波长532nm在3.95uj能量下(样品/DMSO)的开孔Z扫描数据,点表示实验数据,线是理论拟合结果。)
图11为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的合成原理图;
图12为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的红外光谱图;
图13为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的1H NMR图;
图14为 图13的局部放大的1H NMR图;
图15为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的13C NMR图;
图16为图13的局部放大的13C NMR图;
图17为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的LCMS图;
图18为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的UV谱图;
图19为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的荧光发射谱图;
图20为1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的光学非线性吸收图。(激光波长532nm在3.95uj能量下(样品/DMSO)的开孔Z扫描数据。点表示实验数据,线是理论拟合结果。)。
具体实施方式
一种新型芘基查尔酮类衍生物,其名称分别为:1-(芘-1-基)-3-(吡啶-3-基)丙烯酮和1-(芘-1-基)-3-(吡啶-4-基)丙烯酮,为芳香大π共轭体系分子,其结构式分别为式Ⅰ和式Ⅱ:
式Ⅰ,式Ⅱ。
实施例1,所述新型芘基查尔酮类衍生物的合成方法,包括如下步骤:
(1)1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g 1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL3-吡啶甲醛和催化剂醋酸钠,催化剂添加量为其余反应物摩尔质量的5%,40°C搅拌反应4h,有黄色固体析出,期间TLC跟踪反应(展开剂为V乙酸乙酯:V石油醚=1:7),至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.29g,经柱层析分离得纯品0.27g(柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7),产率为81%,熔点:132°C;
(2)1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL4-吡啶甲醛和催化剂醋酸钠,催化剂添加量为其余反应物摩尔质量的5%,40°C搅拌反应4h,有黄色固体析出,期间TLC跟踪反应(展开剂为V乙酸乙酯:V石油醚=1:7),至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.28g,经柱层析分离得纯品0.26g(柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7),产率79%,熔点108°C。
实施例2,所述新型芘基查尔酮类衍生物的合成方法,包括如下步骤:
(1)1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g 1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL3-吡啶甲醛和催化剂醋酸钠,催化剂添加量为其余反应物摩尔质量的7%,50°C搅拌反应5h,有黄色固体析出,期间TLC跟踪反应(展开剂为V乙酸乙酯:V石油醚=1:7),至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.28g,经柱层析分离得纯品0.26g(柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7),产率为80%,熔点:132.5°C;
(2)1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL4-吡啶甲醛和催化剂醋酸钠,催化剂添加量为其余反应物摩尔质量的7%,50°C搅拌反应5h,有黄色固体析出,期间TLC跟踪反应(展开剂为V乙酸乙酯:V石油醚=1:7),至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.27g,经柱层析分离得纯品0.25g(柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7),产率78%,熔点108.5°C。
实施例3,所述新型芘基查尔酮类衍生物的合成方法,包括如下步骤:
(1)1-(芘-1-基)-3-(吡啶-3-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g 1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL3-吡啶甲醛和催化剂醋酸钠,催化剂添加量为其余反应物摩尔质量的10%,60°C搅拌反应6h,有黄色固体析出,期间TLC跟踪反应(展开剂为V乙酸乙酯:V石油醚=1:7),至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.27g,经柱层析分离得纯品0.25g(柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7),产率为79%,熔点:133°C;
(2)1-(芘-1-基)-3-(吡啶-4-基)丙烯酮的合成:
在配有磁力搅拌的250 mL圆底烧瓶中,依次加入0.24g1-乙酰基芘和35mL无水乙醇,加热搅拌使其溶解;然后加入0.25mL4-吡啶甲醛和催化剂醋酸钠,催化剂添加量为其余反应物摩尔质量的10%,60°C搅拌反应6h,有黄色固体析出,期间TLC跟踪反应(展开剂为V乙酸乙酯:V石油醚=1:7),至1-乙酰基芘完全反应为止,停止搅拌,冷却,抽滤,将滤饼先后用水、乙醇洗涤,抽滤,真空干燥,得产品0.26g,经柱层析分离得纯品0.24g(柱层析用的淋洗液为V乙酸乙酯:V石油醚=1:7),产率77%,熔点109°C。
- 还没有人留言评论。精彩留言会获得点赞!
- 一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用的制作方法与工艺
- 一种丹参酮类化合物17位酯化衍生物及其制备工艺和应用的制作方法与工艺
- 用于治疗癌症的异喹啉酮衍生物的制作方法与工艺
- 二氢碟啶酮衍生物及其用途的制作方法与工艺
- 一种酞嗪酮衍生物、该衍生物的制备方法及其制备用催化剂与流程
- 环烃基取代的甲磺酰基苯甲酰胺衍生物、其制法与医药上的用途的制作方法与工艺
- 一种以喹唑啉酮衍生物为核心的化合物及其在OLED上的应用的制作方法与工艺
- 一种母核为喹唑啉酮衍生物的化合物及其在OLED上的应用的制作方法与工艺
- 一种母核为喹唑啉酮衍生物的化合物及其应用的制作方法与工艺
- 蝶啶酮衍生物作为EGFR抑制剂的应用的制作方法与工艺