N‑(取代苯)基吡唑基梣酮类衍生物、其制备方法及应用与流程
本发明属有机化学领域,涉及梣酮类衍生物,尤其涉及系列具有杀虫和抑菌活性的N-(取代苯)基吡唑基梣酮类衍生物及其制备方法和该系列衍生物在制备天然产物杀虫和抑菌剂中的应用。
背景技术:
梣酮(fraxinellone)是一种天然的降解型柠檬苦素类化合物,含有一个α取代呋喃环的结构。在1965年,Pailer等初步测定了其结构,随后在1969年,Coggon等首次从D.albus.L.中分离出梣酮,并首次通过X单晶衍射证明了其绝对构型(Coggon P,et al.1969.J Chem Soc D,Chem Commun,828)。目前,梣酮主要可以从许多芸香科植物或楝科植物中提取、分离而得,这些植物如:新疆白鲜(D.angustifolius)、帕拉芸香(Fagaropsis glabra)、榆橘(Raulinoa echinata)、白鲜皮(D.dasycarpus)、和苦楝树(Melia azadarach)中分离而得(Liu Z L,et al.2002.J Agric Food Chem,50:1447;D’Ambrosio M,Guerriero A.2002.Phytochemistry,60:419-424.Boustie J,et al.Phytochemistry,1990,29:1699-1701;Biavatti M W,et al.Z.Naturforsch,56C:570-574;Nakatani M,et al.Phytochemistry,49:1773;Fukuyama Y,et al.Tetrahedron Lett,13(33):3401)。
早在1972年日本学者Fukuyama等(Fukuyama Y,et al.Tetrahedron Lett,13(33):3401)首次报道了梣酮的全合成。Tokoroyama等应用Diels-Alder反应顺利合成了外消旋体梣酮(Tokoroyama T,et al.J Chem Soc,Perkin I:1557)。在1997和2005年,Okamura等和Trudeau等以不同的方法又合成了梣酮及其相关化合物(Okamura H,et al.1997.Tetrahedron Lett,38:263.Trudeau S,et al.2005.Org Lett,7:5465)。
在生物活性方面,梣酮具有抗炎、抑菌、抑制生育,杀虫,令血管松弛作用,并在治疗T细胞介导的肝脏疾病等方面有一定作用。2009年,Sun等(Sun Y,et al.2009.Biochem Pharmacol,77:1717)报道了梣酮能明显改善小鼠细胞免疫性肝损伤,有望在治疗各种急、慢性病毒性肝炎中得到应用。Zhao和王麦玲等又报道了中药材白鲜皮中的活性成分梣酮对真菌具有一定的抑制生长活性(Zhao W,et al.1998.Phytochemistry,47:7;王麦玲等.2006.农药学学报,45(11),739)。Woo(Woo W S,et al.Planta Med,53:399)等人对梣酮研究发现,其还具有一定的抑制生育活性,如降低小鼠生育能力。此外,Wu等研究证明梣酮还具有令血管松弛以及治疗T细胞介导的肝脏疾病等活性(Wu T S,et al.1994.Chin Pharm J,46:447)。相比梣酮的其它活性,其在杀虫活性方面的研究报道相对最多,在1997年,Okamura等合成了外消旋的梣酮及其类似化合物并初步对Spodoptera exiguo H.和青鱂分别测定了其拒食活性与毒杀活性(Okamura H,et al.1997.Tetrahedron Lett,38:263)。2002年,Liu等报道了白鲜皮中梣酮对玉米象Sitophilus zeamais、赤拟谷盗Tribolium castaneum具有拒食和毒杀活性。原春兰等测定了梣酮的乳油对三龄粘虫Mythimna separate 3天后的拒食率和致死率,结果显著,分别达到90.4和95.2%(原春兰,李宗孝.2005.植物保护,31(5):86),卫粉艳等又对梣酮以小叶碟添加法对其生物活性进行了检测,结果表明其对三龄粘虫72h的拒食率和致死率分别为80.4%和96.6%(卫粉艳等.2006.西北农业学报,15(4):93)。吕敏对梣酮的杀虫及作用机理做了详细的研究,表明梣酮具有缓效杀虫活性,能延缓幼虫的发育,延长化蛹、羽化。对许多试虫具有很强的拒食活性,如梣酮对5龄粘虫幼虫、2龄小菜蛾Plutella xylostella幼虫以及2龄小地老虎Agrotis ypsilon幼虫都表现出很好的拒食率,其24h时的拒食中浓度(AFC50)值分别为11.47、7.78及13.40mg/mL。特别是对粘虫,在2h内,5.0、10.0及20.0mg/mL的梣酮溶液对5龄粘虫幼虫的拒食率均高于60%。此外,梣酮对试虫还具有较强的胃毒毒杀活性,但触杀活性相对较差(LüM,et al.2010.Pestic Biochem Physiol,98:263)。
然而,对梣酮类衍生物的合成及杀虫活性报道较少,主要来自本课题前期合成了系列梣酮腙/酯类衍生物,发现部分化合物对三龄前期粘虫具有很好的生长发育抑制和毒杀作用(Guo Y,et al.2012.J.Agric Food Chem.,60:7016;Guo Y,et al.2012.Bioorg Med Chem Lett,22:5384;Guo Y,et al.2013,J.Agric Food Chem.,2013,61,11937)。为此,本发明制备了系列N-(取代苯)基吡唑基梣酮类衍生物,并对其杀虫活性和抑菌活性进行了测定,有望制备成新型天然产物杀虫剂和抑菌剂。
技术实现要素:
本发明的目的在于,提供系列高效、低毒具有杀虫和抑菌活性的N-(取代苯)基吡唑基梣酮类衍生物;另一目的在于提供该类衍生物的制备方法和应用。
为实现上述目的,本发明是通过下列技术措施得以实现:
所述系列新的N-(取代苯)基吡唑基梣酮类衍生物,其特征在于,其化学通式为:
其中R分别为:
上述的N-(取代苯)基吡唑基梣酮类衍生物的制备方法,其特征在于,以梣酮为原料通过烯丙位氧化反应,得到梣酮酮,再与N,N-二甲基甲酰胺二甲基缩醛反应,得到4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c),最后分别与不同取代的苯肼盐酸盐反应,得到系列N-(取代苯)基吡唑基梣酮类衍生物,具体按下列步骤制备:
将4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)分别与不同的取代苯肼盐酸盐用无水乙醇溶解,加热至回流,TLC跟踪检测,反应结束后,减压浓缩将乙醇旋干后,用少量二氯甲烷溶解,然后薄层色谱分离得到目标化合物1-20。
所用的取代苯肼盐酸盐分别为:
苯肼盐酸盐、2-氟苯肼盐酸盐、2-氯苯肼盐酸盐、3-氯苯肼盐酸盐、3-硝基苯肼盐酸盐、4-氟苯肼盐酸盐、4-氯苯肼盐酸盐、4-溴苯肼盐酸盐、4-甲基苯肼盐酸盐、4-异丙基苯肼盐酸盐、4-氰基苯肼盐酸盐、3、4-二氟苯肼盐酸盐、3、4-二氯苯肼盐酸盐、2-氯-4-氟苯肼盐酸盐、2、4-二氯苯肼盐酸盐、2、4-二甲基苯肼盐酸盐、2-氯-5-氟苯肼盐酸盐、3、5-二氟苯肼盐酸盐、2、4、6-三氯苯肼盐酸盐、2、3、5、6-四氟苯肼盐酸盐。
4-羰基-5-(N,N-二甲基乙烯胺)基梣酮与取代的苯肼盐酸盐的摩尔比为:1:1.2。
4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)的制备方法:
将三氧化铬和吡啶用无水二氯甲烷溶解,然后加入叔丁基过氧化氢搅拌,然后加入梣酮,室温条件下反应,TLC检测,反应完全后,减压浓缩柱层析分离得化合物梣酮酮;将化合物梣酮酮用甲苯溶解,后加入N,N-二甲基甲酰胺二甲基缩醛加热回流反应,TLC检测,反应完全后,减压浓缩后柱层析分离,得化合物4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)。
经实验证明,本发明制得的N-(取代苯)基吡唑基梣酮类衍生物对三龄粘虫具有较好的生长抑制和毒杀活性,且部分化合物的活性高于已商品化的天然产物农药川楝素,故有望用于制备优良的天然产物杀虫剂。此外,本发明化合物对部分细菌表现较好的抑菌活性,有望开发成潜在的天然产物抑菌剂。合成路线简单可行,收率高,达83%以上。
附图说明
图1为本发明化合物11红外谱图;
图2为本发明化合物11核磁1H谱图;
具体实施方式
以下通过实施例对本发明做进一步详细阐述。
实施例1 4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)的合成
将200mg的三氧化铬和316.4mg的吡啶用无水二氯甲烷溶解,后加入1.8g的叔丁基过氧化氢搅拌3分钟,最后加入464mg的梣酮,室温下反应,TLC检测,反应完全后,减压浓缩柱层析分离得化合物梣酮酮;将246mg化合物梣酮酮用适量的甲苯溶解,后加入143mg的N,N-二甲基甲酰胺二甲基缩醛于110℃条件下反应,TLC检测,反应完全后,减压浓缩后柱层析分离,得化合物4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)。
4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)的理化性质:
1)、橙黄色固体,熔点66-68℃。
2)、4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)的红外光谱图(IR)特征:
采用溴化钾压片法:2963,2919cm-1为饱和碳氢伸缩振动吸收,1757cm-1为内酯羰基伸缩振动吸收,1717cm-1为羰基伸缩振动吸收,1025cm-1为C-O-C伸缩振动吸收。
3)、4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:7.68(s,1H,H-2′),7.49(s,1H,-CHN(CH3)),7.46(t,J=1.6Hz,1H,H-5′),6.35(d,J=1.2Hz,1H,H-4′),5.11(s,1H,H-8),3.12(s,6H,-CHN(CH3)),2.97(d,J=13.2Hz,1H,H-6),2.79(d,J=13.6Hz,1H,H-6),2.25(s,3H,H-10),0.93(s,3H,H-11)。
实施例2 N-苯基吡唑基梣酮类衍生物(化合物1)
将72.3mg 4-羰基-5-(N,N-二甲基乙烯胺)基梣酮(c)与31.1mg苯肼盐酸盐用无水乙醇溶解,加热至回流,TLC跟踪检测,反应结束后,减压浓缩将乙醇旋干后,加入适量二氯甲烷溶解,然后薄层色谱分离得到化合物1纯品,收率83%。
化合物1的理化性质如下:
1)、橙黄色固体,熔点85-88℃。
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:2961,2923cm-1为饱和碳氢伸缩振动吸收,1736cm-1为内酯羰基伸缩振动吸收,1024cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.56(s,1H,-CH=N-),7.52(s,1H,H-2′),7.47-7.50(m,4H,-Ph and H-5′),7.39-7.41(m,2H,-Ph),6.39(d,J=1.2Hz,1H,H-4′),5.19(s,1H,H-8),2.80-2.89(m,2H,H-6),2.05(s,3H,H-10),0.91(s,3H,H-11)。
实施例3 N-(2-氟-苯)基吡唑基梣酮类衍生物(化合物2)
采用实施例2所述方法合成化合物2,化合物2的理化性质如下:
1)、浅黄色固体,熔点204-206℃。
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3132cm-1为不饱和碳氢伸缩振动吸收,2962,2925cm-1为饱和碳氢伸缩振动吸收,1741cm-1为内酯羰基伸缩振动吸收,1041cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.60-7.67(m,2H,-Ph and-CH=N-),7.53(s,1H,H-2′),7.45-7.52(m,2H,-Ph and H-5′),7.31-7.35(m,1H,-Ph),7.18-7.22(m,1H,-Ph),6.39(d,J=0.8Hz,1H,H-4′),5.19(s,1H,H-8),2.79-2.92(m,2H,H-6),2.07(s,3H,H-10),0.90(s,3H,H-11)。
实施例4 N-(2-氯-苯)基吡唑基梣酮类衍生物(化合物3)
采用实施例2所述方法合成化合物3,化合物3的理化性质如下:
1)、黄色固体,熔点160-162℃。
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:2967,2926cm-1为饱和碳氢伸缩振动吸收,1741cm-1为内酯羰基伸缩振动吸收,1041cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.59-7.64(m,2H,-Ph and-CH=N-),7.52(s,1H,H-2′),7.45-7.50(m,4H,-Ph and H-5′),6.39(s,1H,H-4′),5.19(s,1H,H-8),2.79-2.91(m,2H,H-6),1.98(s,3H,H-10),0.90(s,3H,H-11)。
实施例5 N-(3-氯-苯)基吡唑基梣酮类衍生物(化合物4)
采用实施例2所述方法合成化合物4,化合物4的理化性质如下:
1)、黄色固体,熔点167-169℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3114cm-1为不饱和碳氢伸缩振动吸收,2970,2926cm-1为饱和碳氢伸缩振动吸收,1741cm-1为内酯羰基伸缩振动吸收,1025cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.56(s,1H,-CH=N-),7.53(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.42-7.47(m,3H,-Ph),7.28(d,J=7.6Hz,1H,-Ph),6.39(d,J=0.8Hz,1H,H-4′),5.19(s,1H,H-8),2.80-2.88(m,2H,H-6),2.10(s,3H,H-10),0.92(s,3H,H-11)。
实施例6 N-(3-硝基苯)基吡唑基梣酮类衍生物(化合物5)
采用实施例2所述方法合成化合物5,化合物5的理化性质如下:
1)、黄色固体,熔点201-203℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3089cm-1为不饱和碳氢伸缩振动吸收,2974,2921cm-1为饱和碳氢伸缩振动吸收,1740cm-1为内酯羰基伸缩振动吸收,1025cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:8.33(d,J=9.2Hz,2H,-Ph),7.68-7.76(m,2H,-Ph),7.62(s,1H,-CH=N-),7.54(s,1H,H-2′),7.49(t,J=1.6Hz,1H,H-5′),6.40(d,J=0.8Hz,1H,H-4′),5.21(s,1H,H-8),2.83-2.91(m,2H,H-6),2.10(s,3H,H-10),0.95(s,3H,H-11)。
实施例7 N-(4-氟苯)基吡唑基梣酮类衍生物(化合物6)
采用实施例2所述方法合成化合物6,化合物6的理化性质如下:
1)、浅黄色固体,熔点224-225℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3134cm-1为不饱和碳氢伸缩振动吸收,2974,2929cm-1为饱和碳氢伸缩振动吸收,1740cm-1为内酯羰基伸缩振动吸收,1033cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.55(s,1H,-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.37-7.40(m,1H,-Ph),7.16-7.20(m,2H,-Ph),6.39(d,J=0.8Hz,1H,H-4′),5.19(s,1H,H-8),2.80-2.88(m,2H,H-6),2.05(s,3H,H-10),0.90(s,3H,H-11)。
实施例8 N-(4-氯苯)基吡唑基梣酮类衍生物(化合物7)
采用实施例2所述方法合成化合物7,化合物7的理化性质如下:
1)、黄色固体,熔点119-120℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:2967,2925,2893cm-1为饱和碳氢伸缩振动吸收,1737cm-1为内酯羰基伸缩振动吸收,1032cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.56(s,1H,-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.46(d,J=9.6Hz,2H,-Ph),7.34(d,J=8.8Hz,2H,-Ph),6.39(d,J=1.2Hz,1H,H-4′),5.19(s,1H,H-8),2.79-2.88(m,2H,H-6),2.08(s,3H,H-10),0.91(s,3H,H-11)。
实施例9 N-(4-溴苯)基吡唑基梣酮类衍生物(化合物8)
采用实施例2所述方法合成化合物8,化合物8的理化性质如下:
1)、棕色固体,熔点188-190℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3070cm-1为不饱和碳氢伸缩振动吸收,2967,2923,2891cm-1为饱和碳氢伸缩振动吸收,1739cm-1为内酯羰基伸缩振动吸收,1033cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.61(d,J=8.8Hz,2H,-Ph),7.56(s,1H,-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.28(d,J=8.4Hz,2H,-Ph),6.39(d,J=0.8Hz,1H,H-4′),5.19(s,1H,H-8),2.79-2.88(m,2H,H-6),2.08(s,3H,H-10),0.91(s,3H,H-11)。
实施例10 N-(4-甲基苯)基吡唑基梣酮类衍生物(化合物9)
采用实施例2所述方法合成化合物9,化合物9的理化性质如下:
1)、白色固体,熔点202-204℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3134cm-1为不饱和碳氢伸缩振动吸收,2974,2929cm-1为饱和碳氢伸缩振动吸收,1740cm-1为内酯羰基伸缩振动吸收,1033cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.54(s,1H,-CH=N-),7.52(s,1H,H-2′),7.48(d,J=2.0Hz,1H,H-5′),7.26-7.27(m,4H,-Ph),6.39(d,J=1.2,1H,H-4′),5.18(s,1H,H-8),2.79-2.88(m,2H,H-6),2.43(s,3H,-CH3),2.05(s,3H,H-10),0.90(s,3H,H-11)。
实施例11 N-(4-异丙基苯)基吡唑基梣酮类衍生物(化合物10)
采用实施例2所述方法合成化合物10,化合物10的理化性质如下:
1)、浅黄色固体,熔点206-208℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3124cm-1为不饱和碳氢伸缩振动吸收,2959,2927cm-1为饱和碳氢伸缩振动吸收,1745cm-1为内酯羰基伸缩振动吸收,1024cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.53(s,1H,-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.28-7.33(m,4H,-Ph),6.39(d,J=0.8Hz,1H,H-4′),5.18(d,J=2.8Hz,1H,H-8),2.95-3.02(m,1H,-CH(CH3)2),2.79-2.88(m,2H,H-6),2.05(s,3H,H-10),1.30(s,3H,-CH3),1.28(s,3H,-CH3),0.91(s,3H,H-11)。
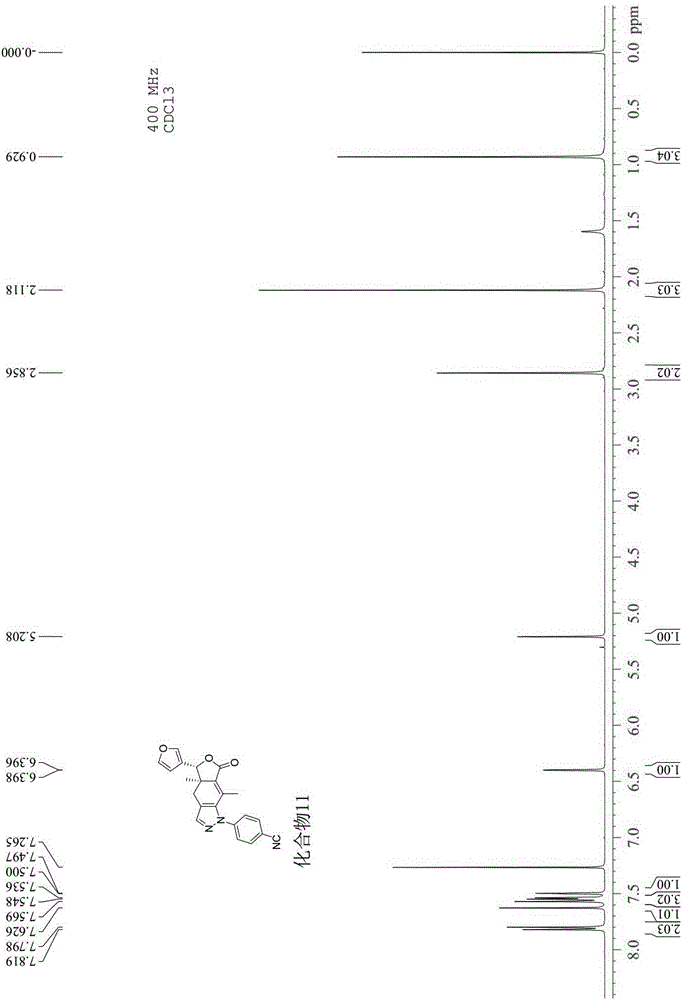
实施例12 N-(4-氰基苯)基吡唑基梣酮类衍生物(化合物11)
采用实施例2所述方法合成化合物11,化合物11的理化性质如下:
1)、黄色固体,熔点187-190℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3089cm-1为不饱和碳氢伸缩振动吸收,2956,2922cm-1为饱和碳氢伸缩振动吸收,2226cm-1为氰基伸缩振动吸收,1739cm-1为内酯羰基伸缩振动吸收,1033cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.79(d,J=8.4Hz,2H,-Ph),7.62(s,1H,-CH=N-),7.54(d,J=8.4Hz,2H,-Ph),7.53(s,1H,H-2′),7.49(t,J=1.6Hz,1H,H-5′),6.39(d,J=0.8Hz,1H,H-4′),5.20(s,1H,H-8),2.81-2.89(m,2H,H-6),2.11(s,3H,H-10),0.92(s,3H,H-11)。
实施例13 N-(3,4-二氟苯)基吡唑基梣酮类衍生物(化合物12)
采用实施例2所述方法合成化合物12,化合物12的理化性质如下:
1)、白色固体,熔点198-200℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3134cm-1为不饱和碳氢伸缩振动吸收,2968,2931cm-1为饱和碳氢伸缩振动吸收,1741cm-1为内酯羰基伸缩振动吸收,1033cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.55(s,1H,-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.27-7.34(m,2H,-Ph),7.13-7.16(m,1H,-Ph),6.39(d,J=1.2Hz,1H,H-4′),5.19(s,1H,H-8),2.79-2.88(m,2H,H-6),2.10(s,3H,H-10),0.91(s,3H,H-11)。
实施例14 N-(3,4-二氯苯)基吡唑基梣酮类衍生物(化合物13)
采用实施例2所述方法合成化合物13,化合物13的理化性质如下:
1)、黄色固体,熔点204-206℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3071cm-1为不饱和碳氢伸缩振动吸收,2966,2925cm-1为饱和碳氢伸缩振动吸收,1746cm-1为内酯羰基伸缩振动吸收,1032cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.55-7.58(m,3H,-Ph and-CH=N-),7.52(s,1H,H-2′),7.48(d,J=1.6Hz,1H,H-5′),7.25-7.27(m,1H,-Ph),6.39(d,J=1.2Hz,1H,H-4′),5.19(d,J=2.8Hz,1H,H-8),2.80-2.88(m,2H,H-6),2.12(s,3H,H-10),0.91(s,3H,H-11)。
实施例15 N-(2-氯-4-氟苯)基吡唑基梣酮类衍生物(化合物14)
采用实施例2所述方法合成化合物14,化合物14的理化性质如下:
1)、浅黄色固体,熔点176-178℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3118,3063cm-1为不饱和碳氢伸缩振动吸收,2965,2926cm-1为饱和碳氢伸缩振动吸收,1737cm-1为内酯羰基伸缩振动吸收,1022cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1HNMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.59-7.63(m,2H,-Ph and-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.08-7.36(m,2H,-Ph),6.38(s,1H,H-4′),5.19(s,1H,H-8),2.79-2.94(m,2H,H-6),2.00(s,3H,H-10),0.89(s,3H,H-11)。
实施例16 N-(2,4-二氯苯)基吡唑基梣酮类衍生物(化合物15)
采用实施例2所述方法合成化合物15,化合物15的理化性质如下:
1)、橙黄色固体,熔点202-204℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3143cm-1为不饱和碳氢伸缩振动吸收,2967cm-1为饱和碳氢伸缩振动吸收,1740cm-1为内酯羰基伸缩振动吸收,1028cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.56-7.61(m,2H,-Ph and-CH=N-),7.53-7.54(m,1H,-Ph),7.52(s,1H,H-2′),7.48(d,J=1.6Hz,1H,H-5′),6.38(s,1H,H-4′),5.19(d,J=2.8Hz,1H,H-8),2.79-2.90(m,2H,H-6),2.01(s,3H,H-10),0.89(s,3H,H-11)。
实施例17 N-(2,4-二甲基苯)基吡唑基梣酮类衍生物(化合物16)
采用实施例2所述方法合成化合物16,化合物16的理化性质如下:
1)、浅黄色固体,熔点173-175℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3117cm-1为不饱和碳氢伸缩振动吸收,2963,2923cm-1为饱和碳氢伸缩振动吸收,1741cm-1为内酯羰基伸缩振动吸收,1023cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:8.07(d,J=8.8Hz,2H,-Ar),7.01(d,J=8.8Hz,2H,-Ar),6.82(s,1H,H-6),6.11(s,2H,-OCH2O-),5.91-6.01(m,1H,H-2′),5.09-5.13(m,2H,H-3′),3.89(s,3H,-OCH3),3.79(s,3H,-OCH3),3.41(d,J=6.4Hz,2H,H-1′).13C NMR(100MHz,CDCl3)δ:164.58,162.38,159.06,150.11,145.97,144.40,136.74,128.83,126.64,116.46,116.41,114.52,112.00,102.39,102.19,62.57,55.48,33.58.。
实施例18 N-(2-氯-5-氟苯)基吡唑基梣酮类衍生物(化合物17)
采用实施例2所述方法合成化合物17,化合物17的理化性质如下:
1)、白色固体,熔点161-162℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:2972,2924cm-1为饱和碳氢伸缩振动吸收,1753cm-1为内酯羰基伸缩振动吸收,1021cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.55-7.62(m,1H,-Ph and-CH=N-),7.46-7.52(m,3H,-Ph and H-2′,5′),7.06-7.41(m,2H,-Ph),6.39(s,1H,H-4′),5.19(s,1H,H-8),2.79-2.94(m,2H,H-6),2.03(s,3H,H-10),0.89(s,3H,H-11)。
实施例19 N-(3,5-二氟苯)基吡唑基梣酮类衍生物(化合物18)
采用实施例2所述方法合成化合物18,化合物18的理化性质如下:
1)、淡黄色固体,熔点177-179℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3117cm-1为不饱和碳氢伸缩振动吸收,2974,2929cm-1为饱和碳氢伸缩振动吸收,1738cm-1为内酯羰基伸缩振动吸收,1026cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.58(s,1H,-CH=N-),7.53(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.27-7.34(m,2H,-Ph),6.91-7.00(m,3H,-Ph),6.39(d,J=0.8Hz,1H,H-4′),5.20(s,1H,H-8),2.80-2.88(m,2H,H-6),2.16(s,3H,H-10),0.92(s,3H,H-11)。
实施例20 N-(2,4,6-三氯苯)基吡唑基梣酮类衍生物(化合物19)
采用实施例2所述方法合成化合物19,化合物19的理化性质如下:
1)、浅黄色固体,熔点174-176℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3116cm-1为不饱和碳氢伸缩振动吸收,2962,2926cm-1为饱和碳氢伸缩振动吸收,1740cm-1为内酯羰基伸缩振动吸收,1022cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.67(m,1H,-CH=N-),7.55(d,J=2.0Hz,1H,-Ph),7.52(s,1H,H-2′),7.47(t,J=2.0Hz,1H,H-5′),6.38(d,J=1.2Hz,1H,H-4′),5.21(s,1H,H-8),2.79-2.94(m,2H,H-6),2.01(s,3H,H-10),0.87(s,3H,H-11)。
实施例21 N-(2,3,5,6-四氟苯)基吡唑基梣酮类衍生物(化合物20)
采用实施例2所述方法合成化合物20,化合物20的理化性质如下:
1)、白色固体,熔点71-73℃;
2)、该化合物的红外光谱图(IR)特征:
采用溴化钾压片法:3069cm-1为不饱和碳氢伸缩振动吸收,2965,2925cm-1为饱和碳氢伸缩振动吸收,1746cm-1为内酯羰基伸缩振动吸收,1024cm-1为C-O-C伸缩振动吸收。
3)、该化合物的核磁共振图谱(1H NMR,400MHz)特征:
以氘代氯仿为溶剂,TMS为内标,其中各峰归属为:δ:7.71(m,1H,-CH=N-),7.52(s,1H,H-2′),7.48(t,J=1.6Hz,1H,H-5′),7.32-7.34(m,1H,-Ph),6.39(d,J=1.2Hz,1H,H-4′),5.21(s,1H,H-8),2.81-2.92(m,2H,H-6),2.13(s,3H,H-10),0.89(s,3H,H-11)。
应用例1:杀虫活性实验:
1、供试昆虫:3龄前期粘虫幼虫,虫卵购于中国农业科学院植物保护研究所
2、样品及试剂:
样品为:梣酮、川楝素、4-羰基-5-(N,N-二甲基乙烯胺)基梣酮以及实施例制备的化合物1-20。溶剂为丙酮,市售分析纯。
3、生测方法:
采用小叶蝶添加法:在直径为9厘米的培养皿底部铺一层滤纸,并加水保湿。每皿挑取10头大小一致、较健壮的3龄前期粘虫幼虫。分别称取5mg梣酮、川楝素、4-羰基-5-(N,N-二甲基乙烯胺)基梣酮以及实施例制备的化合物1-20加入5ml丙酮,配成浓度为1mg/mL的药液。将玉米叶剪成1×1cm2的小叶碟,于待测药液中浸3秒,晾干后喂试虫。以丙酮液为空白对照组。每处理10头,重复3次。于室温(25℃左右)下、湿度65%~80%、光照时间为12小时光照/12小时黑暗的条件下饲养。48小时后喂以正常的叶蝶直至羽化。定期记录虫子的取食量、活口数、表现症状等,根据下列公式计算试虫的最终死亡率。测定结果见表1。
最终死亡率(%)=(试虫死亡个数)/(试虫总个数)×100
矫正死亡率(%)=(处理死亡率-对照死亡率)/(1-对照死亡率)×100
表1.本发明N-(取代苯)基吡唑基梣酮类衍生物1-20对3龄粘虫的生长抑制及毒杀活性
结果表明,本发明制备的N-(取代苯)基吡唑基梣酮类衍生物在10天期间,相比已商品化的植物源杀虫剂川楝素,化合物11-15,17-20对粘虫均表现出一定的生长抑制和毒杀作用。在20天时,化合物4-羰基-5-(N,N-二甲基乙烯胺)基梣酮,2,11-15,17,19,20的毒杀活性达到40%以上,说明该系列化合物对粘虫的在蛹期有强的生长抑制作用,使幼虫不能发育成正常的蛹,而最终死亡。在35天时,化合物4-羰基-5-(N,N-二甲基乙烯胺)基梣酮,12,14,15,17-20的毒杀活性均高于已商品化的天然产物农药川楝素,特别是化合物14高于川楝素24.2%。此外,化合物11和18的毒杀活性和阳性对照川楝素相同。故本发明制备的N-(取代苯)基吡唑基梣酮类衍生物有望用于制备新型的天然产物杀虫剂。
应用例2:抑菌活性实验:
1、供试细菌:
革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus ATCC29213);藤黄微球菌(Micrococcus luteus ATCC4698);枯草杆菌(Bacillus subtilis ATCC6633)。
革兰氏阴性菌:大肠杆菌(Escherichia coli ATCC 25922);嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia);铜绿假单胞菌(Pseudomonas aeruginosa ATCC 9027)。
2、样品及试剂:
样品为:梣酮、梣酮酮、万古霉素、4-羰基-5-(N,N-二甲基乙烯胺)基梣酮以及实施例制备的化合物1-20。
3、测试方法:
根据美国国家临床实验室标准,在96孔微型版板上釆用二倍稀释的方法对化合物梣酮酮、4-羰基-5-(N,N-二甲基乙烯胺)基梣酮及本发明目标化合物1~20和标准药物万古霉素的体外抗细菌活性进行测试,用肉眼观察结合酶标分析仪于600nm测各孔OD值。以肉眼观察完全澄清孔的药物浓度为MIC值。
表2.本发明N-(取代苯)基吡唑基梣酮类衍生物1-20的体外抑菌活性(ug/mL)
注:a-梣酮,b-梣酮酮,c-4-羰基-5-(N,N-二甲基乙烯胺)基梣酮,VA-万古霉素。
S.a:金黄色葡萄球菌(Staphylococcus aureus ATCC 29213);M.l:藤黄微球菌(Micrococcus luteus ATCC4698);B.s:枯草杆菌(Bacillus subtilis ATCC6633);E.c:大肠杆菌(Escherichia coli ATCC 25922);S.m:嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia);P.a:铜绿假单胞菌(Pseudomonas aeruginosa ATCC 9027)。
从表2得出,本发明制备的N-(4-氯苯)基吡唑基梣酮类衍生物7对革兰氏阳性菌枯草杆菌的MIC值为4ug/mL,有较好的抑菌活性。此外,N-(2,3,5,6-四氟苯)基吡唑基梣酮类衍生物20对革兰氏阳性菌金黄色葡萄球菌(Staphylococcus aureus ATCC 29213)、藤黄微球菌(Micrococcus luteus ATCC4698)、枯草杆菌(Bacillus subtilis ATCC6633)和革兰氏阴性菌铜绿假单胞菌(Pseudomonas aeruginosa ATCC 9027)都表现出一定的抑制作用,MIC值分别为128、128、64和128ug/mL,有一定的广谱抑菌活性。故本发明制备的N-(取代苯)基吡唑基梣酮类衍生物有望用于制备潜在的天然产物抑菌剂。
- 还没有人留言评论。精彩留言会获得点赞!
- 含有氟虫腈和吡虫啉的悬浮种衣剂及其制备方法与应用
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种含哌虫啶和吡唑茚满基甲酰胺的杀虫组合物的制作方法
- 一种含虫酰肼和吡唑茚满基甲酰胺的杀虫组合物的制作方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 含有色酮结构的吡唑类n‐对硝基苯基马来酰亚胺衍生物及其制备方法与应用
- 含有色酮结构的吡唑类n-苯基马来酰亚胺衍生物及其制备方法与应用
- 5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a] 嘧啶-3-羧酸乙酯的合成方法
- 5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a] 嘧啶-3-羧酸的合成方法
- 一种含虫酰肼和吡唑茚满基甲酰胺的杀虫组合物的制作方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 制备1-烷基-3-二氟甲基-5-氟-1h-吡唑-4-甲醛和1-烷基-3-二氟甲基-5-氟-1h-吡唑-4 ...的制作方法
- 含有色酮结构的吡唑类n‐对硝基苯基马来酰亚胺衍生物及其制备方法与应用
- 含有色酮结构的吡唑类n-苯基马来酰亚胺衍生物及其制备方法与应用
- 三氟甲基吡唑基胍F<sub>1</sub>F<sub>0</sub>-ATP酶抑制剂及其治疗用图
- 5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a] 嘧啶-3-羧酸乙酯的合成方法
- 5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a] 嘧啶-3-羧酸的合成方法
- 5-(4-氟苯基)-N–1-(3-羟基金刚烷基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种胺苯吡唑酮残留量的gc-ei-ms快速测定方法