一种高产褐藻胶裂解酶的海洋弧菌及其应用的制作方法
本发明属于有益微生物筛选技术领域,具体涉及一种高产褐藻胶裂解酶的海洋弧菌及其应用
背景技术:
褐藻胶是由α-L-古洛糖醛酸(G)和β-D-甘露糖醛酸(M)通过1,4-糖苷键,按照不同的组合方式构成的非均聚线性分子。褐藻胶裂解酶通过β-消除反应,催化单体间的1,4-糖苷键,在非还原端的C4、C5之间形成不饱和双键,该双键在235nm处有最大吸光值。在酶活测定中,主要通过OD235紫外吸收法检测不饱和双键的产生和薄层层析法(TLC)测定降解产物的均一性。
目前褐藻胶裂解酶,尤其是内切型褐藻胶裂解酶,已经被广泛应用于生产褐藻胶寡聚糖、研究褐藻胶的精细结构以及制备红藻和褐藻的原生质体。此外,褐藻胶裂解酶通过降解细菌生物膜上的多糖,在治疗囊性纤维化方面有巨大的潜在应用价值。褐藻胶裂解酶还可应用于褐藻胶发酵生产生物乙醇,但目前所使用的褐藻胶裂解酶存在着产物均一性差的问题。
技术实现要素:
本发明的目的在于提供一株高产褐藻胶裂解酶的菌株,其降解褐藻胶的产物均一性高,从而推动褐藻胶寡糖的制备及应用,以弥补现有技术的不足。
本发明的第一个目的在于提供一株高产褐藻胶裂解酶的海洋灿烂弧菌(Vibrio splendidus)OU02株,该微生物保存在位于北京市朝阳区北辰西路1号院3号的中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.13478,保藏日期为2016年12月22日。
本发明所筛选的灿烂弧菌(Vibiro splendidus)OU02株用于生产制备褐藻胶裂解酶;
本发明还提供了一种用于诱导上述海洋弧菌表达产生褐藻胶裂解酶的培养基,培养基的基本碳源为褐藻胶;
作为实施例的一种具体记载,一种培养基的具体配比如下:褐藻胶2g/L,酵母粉0.5g/L,蛋白胨2.5g/L,海水溶解并调节pH 7.6-7.8。
本发明再一个方面提供一种制备褐藻胶裂解酶的方法。
本发明所筛选的灿烂弧菌OU02株还用来发酵生产褐藻寡糖。
本发明所筛选的灿烂弧菌OU02株所产生的褐藻胶裂解酶可以降解褐藻胶产生具有潜在生物学活性的褐藻寡糖,该微生物发酵周期短,酶活性高,且多数活性为胞内酶活,有利于样品的收集及保存,为后续的工业化应用奠定了基础。
附图说明
图1:TLC检测细胞裂解物酶活测定图,其中1.未加胞内酶对照样品;2.加酶样品;3.未加膜上提取酶对照;4.加酶;
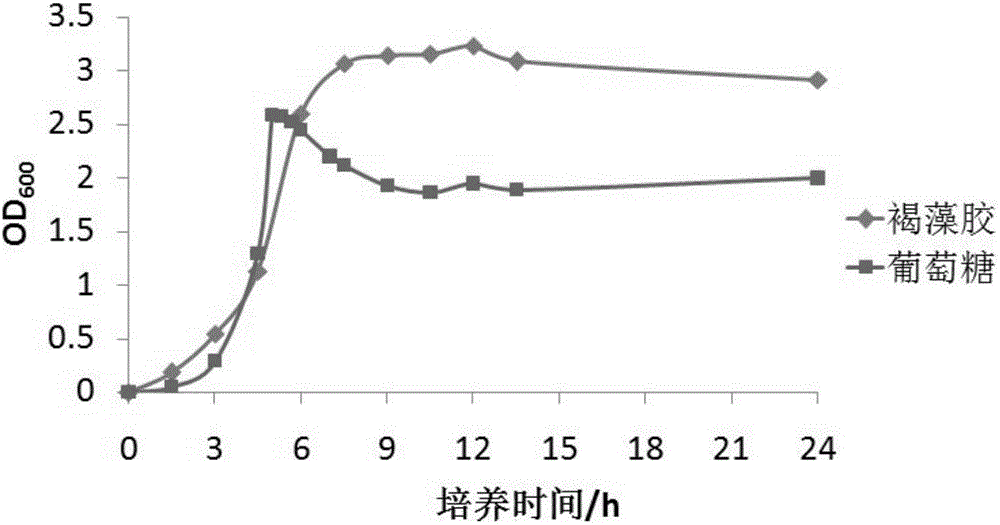
图2:本发明筛选的菌株的生长曲线图。
具体实施方式
本发明从具有产生高活性褐藻胶裂解酶的海洋无脊椎动物的消化腺来源的共生微生物中进行筛选,获得了一株能够产生专一性的褐藻胶裂解酶的微生物菌株,从而促成了本发明。
下面结合实施例对本发明进行详细的描述
实施例1:微生物的筛选及鉴定
1、微生物的筛选
在无菌条件下对新鲜活扇贝及鲍鱼进行解剖,分离出二者的消化腺。在提取的消化腺组织中加入无菌生理盐水,浸提后获得扇贝、鲍鱼消化腺组织的悬浊液。用无菌生理盐水将悬浊液按照,10-1,10-2,10-3,10-4,10-5,10-6的梯度进行稀释。分别取稀释后的液体100-200 μL涂布到2216E褐藻胶固体选择培养基上。将培养板置于25℃培养箱中进行培养。从平板上挑取生长状态良好的菌落接种于2216E褐藻胶液体选择培养基中,于摇床中振荡培养。24h后对各菌株的产褐藻胶裂解酶活性进行测定,选择活性高的菌株进行后续筛选。
所用到的培养基的配方如下:
2216E褐藻胶选择液体培养基:褐藻胶2g/L,酵母粉0.5g/L,蛋白胨2.5g/L,海水溶解并调节pH 7.6-7.8。
2216E褐藻胶选择固体培养基:在液体培养基的基础上,补加琼脂(15g/L)。
将待筛选的菌株用提取的胞内粗酶对褐藻胶进行降解,以加入同体积灭活酶作为对照,反应结束后采用TLC法对降解产物进行分析,来筛选产物均一性高的菌株。
最终筛选获得了高产褐藻胶裂解酶的海洋灿烂弧菌(Vibiro splendidus)OU02株,该微生物保存在位于北京市朝阳区北辰西路1号院3号的中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.13478,保藏日期为2016年12月22日。
灿烂弧菌(Vibiro splendidus)OU02株的16S rRNA基因的扩增、序列测定及分析
采用细菌基因组提取试剂盒(Tiangen)提取已筛选到的高活性菌株的基因组,以此为模板,扩增该菌株的16S rRNA基因。采用以下引物:
27F:5’-AGAGTTTGATCCTGGCTCAG-3’
1492R:5’-GGTTACCTTGTTACGACTT-3’
PCR反应按照以下条件进行:95℃预变性3min;95℃变性30s,50℃退火30s,68℃延伸90s共进行35个循环,之后68℃延伸10min。
获得的RCR产物经胶回收试剂盒(Omega)纯化后,与pMD19-T 载体(Takara)连接,转化E.coli Top 10感受态细胞,挑取阳性克隆进行DNA测序,进化树分析显示其与Vibrionales Bacterium SWAT-3的亲缘关系最近。
实施例2:灿烂弧菌(Vibiro splendidus)OU02株的发酵研究
1、菌株发酵培养
将筛选得到的高活性菌株进行发酵培养,获得该微生物在褐藻胶培养基中的生长曲线。
按1-3%的接种量,将种子液接入褐藻胶液体培养基中,25℃,150rpm摇床中培养,在不同时间收集发酵液,以未接菌的培养基作为空白对照,测定菌液600nm处吸光值,绘制该菌的生长曲线(图1)。结果发现该菌在褐藻胶培养基中,大约在6-10小时内达到生长的平台期,此时OD600=2.5左右。这作为将来菌体收集的最佳时间。
2、不同部位酶的提取及活性测定(以下操作均在4℃条件下进行)
①胞外酶:将发酵液在12,000rpm条件下离心15min。将离心后的上清透析到50mM Tris-HCl pH7.5,200mM NaCl缓冲液中。
②胞内酶:上一步中发酵液离心后的菌体用50mM
Tris-HClpH7.5,200mM NaCl缓冲液重悬,之后进行超声破碎(超声3s,间隔5s,总时间15min),超声破碎后的液体在20,000g条件下离心20min,收集离心后的上清即为提取的胞内酶。
③膜结合酶:第二步中细菌经超声破碎、离心后的沉淀被认为是包括难以溶解的膜结构。在50mM Tris-HClpH7.5,200mM NaCl缓冲液中按0.1%(v/v)的比例加入吐温20,配成膜结合蛋白浸提液。用该浸提液,重悬第二步中细菌经超声破碎、离心后的沉淀,之后过夜反应提取膜结合酶。最后,反应液经20000g,离心20min后的上清即为膜结合酶。
采用235nm处检测不饱和双键的吸光值的方法对提取的酶组份进行活性测定。结果表明该菌的褐藻胶裂解酶主要来源于细胞内和细胞膜上,其中胞内酶所占比例较高。
3、酶解产物的TLC分析
用提取的胞内粗酶对褐藻胶进行降解,以加入同体积灭活酶作为对照,反应结束后采用TLC法对降解产物进行分析。分别取2μL降解后的溶液和对照组溶液点样于硅胶板上(Silica gel 60F 254,Merck)。吹干后将硅胶板置于展开剂中开始层析,展开剂按以下比例配置:正丁醇/甲酸/水(v/v)=4:6:1。层析结束后,取出硅胶板并吹干,在硅胶板上喷洒显色剂(苯胺-二苯胺显色剂),吹干,再将硅胶板置于高温条件下显色,直至出现明显的斑点。
TLC结果见图2,TLC结果显示该微生物胞内酶的降解产物主要有三种组份,均一性较好,适应用于规模化制备均一性寡糖。
- 还没有人留言评论。精彩留言会获得点赞!